ATP对羊肉中糖酵解酶磷酸化和乙酰化的影响
2023-09-07侯成立张德权
董 宇 任 驰 侯成立 方 菲 李 欣 张德权
(中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室, 北京 100193)
糖酵解是影响肉品质最重要的生化途径之一。糖酵解酶活性影响糖酵解过程,进而调控肉品质[1]。宰后肌肉糖酵解过快导致乳酸堆积,pH 值快速下降,生成PSE(pale, soft, exudative)肉;而糖酵解不足则导致极限pH 值过高,产生DFD(dark, firm, dry)肉,造成肉品质劣变[2]。因此,宰后肌肉糖酵解一直是肉品质形成机制和调控技术的研究重点。
蛋白质磷酸化、乙酰化等翻译后修饰在肉品质调控中发挥重要作用。糖酵解酶翻译后修饰影响糖酵解酶活性,进而调控糖酵解进程。蛋白质磷酸化通过影响肌肉中糖酵解限速酶中糖原磷酸化酶、丙酮酸激酶和磷酸果糖激酶活性,进而调节糖酵解进程,最终影响肉的色泽、嫩度、保水性等品质[3-6]。大部分糖酵解酶都可通过乙酰化修饰发挥其对代谢过程的调控作用[7]。己糖激酶、磷酸果糖激酶和丙酮酸激酶的磷酸化、乙酰化通过不同的调节模式共同影响其酶活性,进而影响肉品质[8]。
宰后早期糖酵解酶活性及代谢物三磷酸腺苷(adenosine triphosphate, ATP)是影响肉品质的关键。一方面,ATP分解为二磷酸腺苷(adenosine diphosphate,ADP)和磷酸基团,为宰后早期肌肉僵直成熟中肌肉收缩、蛋白降解等过程提供能量[9];另一方面,ATP 在蛋白激酶存在的情况下为蛋白质磷酸化提供磷酸基团,是糖酵解酶发生翻译后修饰的关键物质[10-11]。研究表明,糖原磷酸化酶(glycogen phosphorylase, PYGM)、醛缩酶(fructose-1,6-bisphosphate aldolase, ALDOA)、磷酸丙糖异构酶(triosephosphate isomerase, TPI1)是影响肉品质的关键糖酵解酶[12-13]。ATP酶活性由磷酸化和乙酰化修饰调控。PYGM 酶活性由磷酸化和乙酰化修饰调控,ATP 通过促进PYGM 磷酸化提高其酶活性,乙酰化直接抑制其酶活性并促进去磷酸化负向调节酶活性[12-14]。ALDOA和TPI1可发生磷酸化和乙酰化修饰,进而影响其生理功能,宰前应激促进ALDOA 乙酰化,TPI1第58位Ser磷酸化抑制糖酵解和癌细胞生长[15-16]。但ATP如何影响宰后肉中糖酵解酶磷酸化、乙酰化目前尚不清楚。本研究采用体外孵育的方法,研究肌肉匀浆液中ATP含量对糖原磷酸化酶、醛缩酶和磷酸丙糖异构酶磷酸化、乙酰化水平和活性的影响,旨在揭示ATP对糖酵解酶磷酸化和乙酰化的潜在影响机制,为研发宰后早期肉品质精准调控新技术提供理论依据。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
Mettler-Toledo pH计,上海梅特勒-托利多有限公司;Ultra Turrax Disperser S25分散器,德国IKA公司;Neofuge 15R 高效冷冻离心机,上海力申科学仪器有限公司;MSC-100 恒温震荡金属浴,杭州奥盛仪器有限公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;Spectra Max 190 全波长酶标仪,美国Molecular Devices 公司;Mini-PROTEAN Tetra System 电泳设备、ChemiDocTM MP 凝胶成像系统,伯乐生命医学产品(上海)有限公司。
1.3 试验方法
1.3.1 试验设计 选取饲养管理相同、平均胴体重为(38.94±2.11) kg的6只6~7月龄小尾寒羊去势羊两侧背最长肌,在宰后1 h 内剔除表面筋膜和脂肪,切碎后分装至冻存管,经液氮速冻后保存于-80 ℃备用。称取1 g肉样,切碎后按照1∶6(g∶mL)的比例分别加入6倍体积预冷的缓冲液(PBS 缓冲液,蛋白酶抑制剂50 mL/片,pH 值7~7.2),1 200 r·min-1冰浴匀浆(15 s×3),得到肌肉匀浆液,用BCA 试剂盒测定蛋白浓度,使用PBS 缓冲液将浓度调至6 μg·μL-1。
将所得肌肉匀浆液设置成以下处理组:1)对照组:不添加ATP;2)低ATP含量组:ATP添加量为20 nmol·mg-1蛋白;3)中ATP 含量组:ATP 添加量为50 nmol·mg-1蛋白;4)高ATP含量组:ATP添加量为100 nmol·mg-1蛋白。用缓冲液调节各处理组最终体积为10 mL。4 ℃振荡孵育0、1、3、6、12、24 h。在每个孵育时间点留样,液氮速冻后保存至-80 ℃,用于ATP、乳酸、糖酵解酶磷酸化和乙酰化水平、糖酵解酶活性测定。再取未添加ATP、孵育时间为0 h 的肌肉匀浆液添加等体积上样缓冲液(100 mmol·L-1Tris-HCl,pH 值6.8,20%甘油,0.75%巯基乙醇,0.02%溴酚蓝)后制备成比照标准品,混合后煮沸5 min,液氮速冻并保存于-80 ℃。
1.3.2 ATP 含量 参考Bai 等[17]的方法,首先建立标准曲线:在检测孔内加入0.01、0.02、0.05、0.1、0.2、0.5、1、2 μmol·L-1的ATP 标准品20 μL,测定其荧光值;取100 μL样品加入100 μL裂解液,建立反应体系,充分振荡混匀后测定荧光值,重复测定3 次,根据建立的标准曲线计算ATP含量。
1.3.3 乳酸含量 参考Bai等[17]的方法,取100 μL制备完毕的样品,按照1∶9 的比例加入生理盐水,充分震荡混匀后,按照试剂盒的要求操作,分别向乳酸标准液和检测液中加入显色液,在37 ℃下反应10 min,加入2 mL终止液,读取530 nm波长处的吸光值,重复测定3次。
1.3.4 免疫沉淀 参考Zhang等[18]的方法,按照试剂盒说明书操作。取3 μL抗体添加至120 μL样品中,裂解液稀释至300 μL,4 ℃过夜反应。取25 μL的Protein A/G磁珠,用200 μL 裂解液冲洗(2 min×3),去除上清液。将过夜孵育的样本与磁珠混合,室温下震荡孵育2 h后去除上清液,200 μL 裂解液冲洗(2 min×3),200 μL 超纯水冲洗(2 min×2),磁力架吸附磁珠,去除上清液后与120 μL 上样缓冲液充分混合,室温下震荡孵育1 h后保留上清液,充分摇匀后煮沸5 min,液氮速冻并保存于-80 ℃冰箱。
1.3.5 糖原磷酸化酶、醛缩酶、磷酸丙糖异构酶磷酸化水平 参考Bai等[19]的方法,采用Zn2+-Phos-tagTM凝胶测定糖原磷酸化酶、醛缩酶、磷酸丙糖异构酶磷酸化水平。十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDSPAGE)电泳采用10%的浓缩胶(包含5.5 μmol·L-1PhostagTM AAL 和10 mmol·L-1ZnCl2溶液)和4%的浓缩胶,上样量为6 μL。电泳恒定电流120 mA。在恒压100 V条件下转膜100 min,用Tris 盐缓冲液(Tris buffered saline with Tween-20, TBST)溶液洗涤3次,封闭液封闭2 h,然后与一抗在4 ℃下过夜孵育,用TBST溶液洗涤膜3次后与辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶1 000稀释于封闭液)在室温下孵育2 h。TBST溶液洗涤膜3次后利用显色液显色,通过凝胶成像系统和Quantity One软件分析灰度值。糖酵解酶的磷酸化水平用糖原磷酸化酶的强度和标准品的强度之比表示。该灰度值为磷酸化(A)和非磷酸化糖酵解酶相对含量(B),A/(A+B)即为糖酵解酶的磷酸化水平。
1.3.6 糖原磷酸化酶、醛缩酶、磷酸丙糖异构酶乙酰化水平 参考Ren 等[8]的方法,采用Stain-free 凝胶测定糖原磷酸化酶、醛缩酶、磷酸丙糖异构酶乙酰化水平。SDS-PAGE采用10%的分离胶和4%的浓缩胶,上样量为6 μL。电泳恒定电流100 V。电泳结束后立即水洗,通过凝胶成像系统和Quantity One软件分析灰度值,改灰度值为全蛋白含量(C)。在恒压100 V 条件下转膜100 min,TBST 溶液洗涤3 次,封闭液封闭2 h,然后与一抗在4 ℃下过夜孵育,TBST 溶液洗涤3 次后与HRP 标记的二抗(1∶1 000 稀释于封闭液)在室温下孵育2 h。TBST溶液洗涤3次后利用显色液显色,通过凝胶成像系统和Quantity One软件分析灰度值,该灰度值为乙酰化的糖酵解酶相对含量(D)。C/D 即为糖酵解酶的乙酰化水平。
MKo Medinikara’s Nānārthaśabdakośa / Medinikośa: Hośhing 1968
1.3.7 糖原磷酸化酶、醛缩酶、磷酸丙糖异构酶活性 参考Bai 等[19]的方法,按照试剂盒要求操作,分别在对照管、标准管和测定管中加入检测液,充分混匀后在37 ℃下反应15 min,室温静置3 min,取200 μL 转移至96 孔板中,在450 nm 波长处以空白调零,读取吸光值,重复测定3次。
1.4 数据处理与分析
使用SPSS 21.0 软件对试验数据进行方差分析(ANOVA),采用Duncan 多重比较进行差异显著性分析(P<0.05),采用Origin 2021 软件对试验数据进行Person相关性分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同ATP含量处理组中ATP含量变化
不同孵育时间点ATP 含量变化如表1 所示。随着孵育时间延长,对照组和低、中ATP处理组的ATP含量分别在孵育0~1、0~3 和0~6 h 显著下降。高ATP 含量组的ATP 含量在孵育0~24 h 内显著高于对照组,在孵育0~6 h内显著高于中、低ATP含量组。中ATP含量组的ATP 含量在孵育0~3 h 显著高于对照组和低ATP 含量组。低ATP 含量组的ATP 含量在孵育0 h 显著高于对照组。上述结果表明,孵育体系构建成功。

表1 不同ATP含量处理组孵育过程中ATP含量变化Table 1 ATP content changes during incubation in different ATP content groups /(μmol·L-1)
2.2 不同ATP含量处理组中乳酸含量变化
由表2可知,随着孵育时间延长,低ATP 含量组的乳酸含量在孵育6 h显著升高,高ATP含量组的乳酸含量在孵育6 h显著升高,12 h显著下降。低ATP含量组的乳酸含量在孵育0~1 h显著低于其他处理组;高ATP含量组的乳酸含量在孵育0~6 h显著高于低ATP含量组。
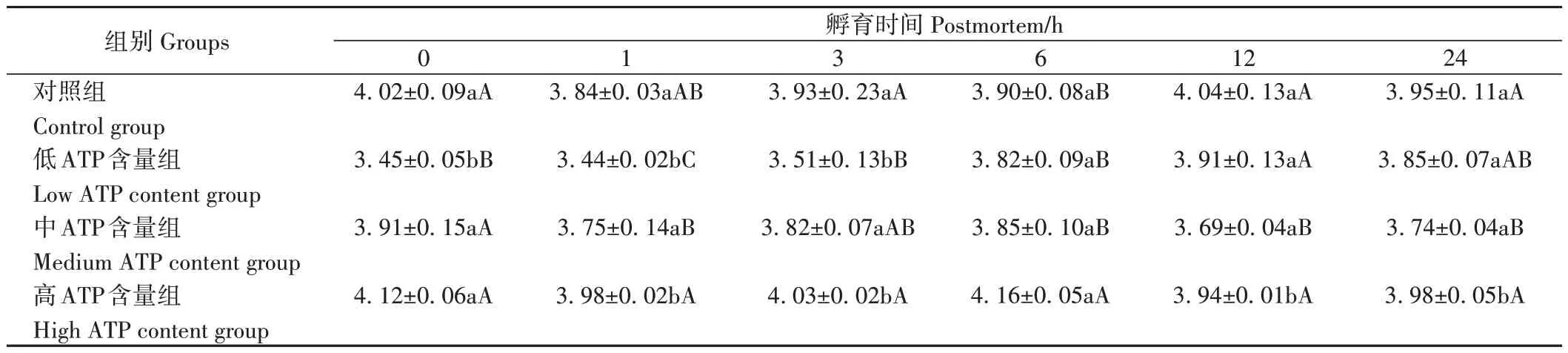
表2 不同ATP含量处理组孵育过程中乳酸含量变化Table 2 Changes of lactate content during incubation in different ATP content groups/(mmol·g-1·protein-1)
2.3 不同ATP 含量处理组中PYGM、ALDOA、TPI1磷酸化水平变化
由图1-A可知,低ATP含量组的PYGM磷酸化水平在孵育0~1 h显著高于对照组,中ATP含量组的PYGM磷酸化水平在孵育3、24 h 时显著低于其他处理组,高ATP含量组的PYGM磷酸化水平在孵育过程中与对照组无显著差异。同时,对照组和高ATP含量组的PYGM磷酸化水平随着孵育时间延长整体呈上升趋势,低ATP含量组的PYGM磷酸化水平在孵育24 h显著下降。

图1 不同ATP含量处理组孵育过程中糖酵解酶磷酸化水平Fig.1 Phosphorylation level of glycolytic enzyme during incubation in different ATP content groups
由图1-B可知,不同ATP含量组的ALDOA磷酸化水平在孵育3 h显著高于对照组,低ATP含量组的ALDOA磷酸化水平在孵育6~24 h 整体显著高于其他处理组。同时,对照组的ALDOA磷酸化水平在孵育1 h较0 h显著下降;低ATP含量组ALDOA 磷酸化水平在孵育0~24 h随着孵育时间延长呈上升趋势;中ATP含量组ALDOA磷酸化水平在孵育期间整体呈下降趋势。
由图1-C可知,不同ATP含量组的TPI1磷酸化水平在孵育0~1 h显著高于对照组,6~12 h显著低于对照组。低ATP含量组的TPI1磷酸化水平在孵育0、6 h显著高于高ATP含量组;高ATP含量组的TPI1磷酸化水平在0~1 h显著低于中ATP含量组,12~24 h显著高于中ATP含量组。
2.4 不同ATP 含量处理组中PYGM、ALDOA、TPI1乙酰化水平变化
由图2-A 可知,对照组PYGM 乙酰化水平在孵育0~3 h显著高于其他处理组;高ATP含量组的PYGM 乙酰化水平在孵育6 h 显著高于其他处理组,在孵育12~24 h整体显著低于对照组。同时,对照组和低、中ATP含量组的PYGM 乙酰化水平在孵育3 h显著升高,高ATP含量组的PYGM乙酰化水平在孵育6 h显著升高。
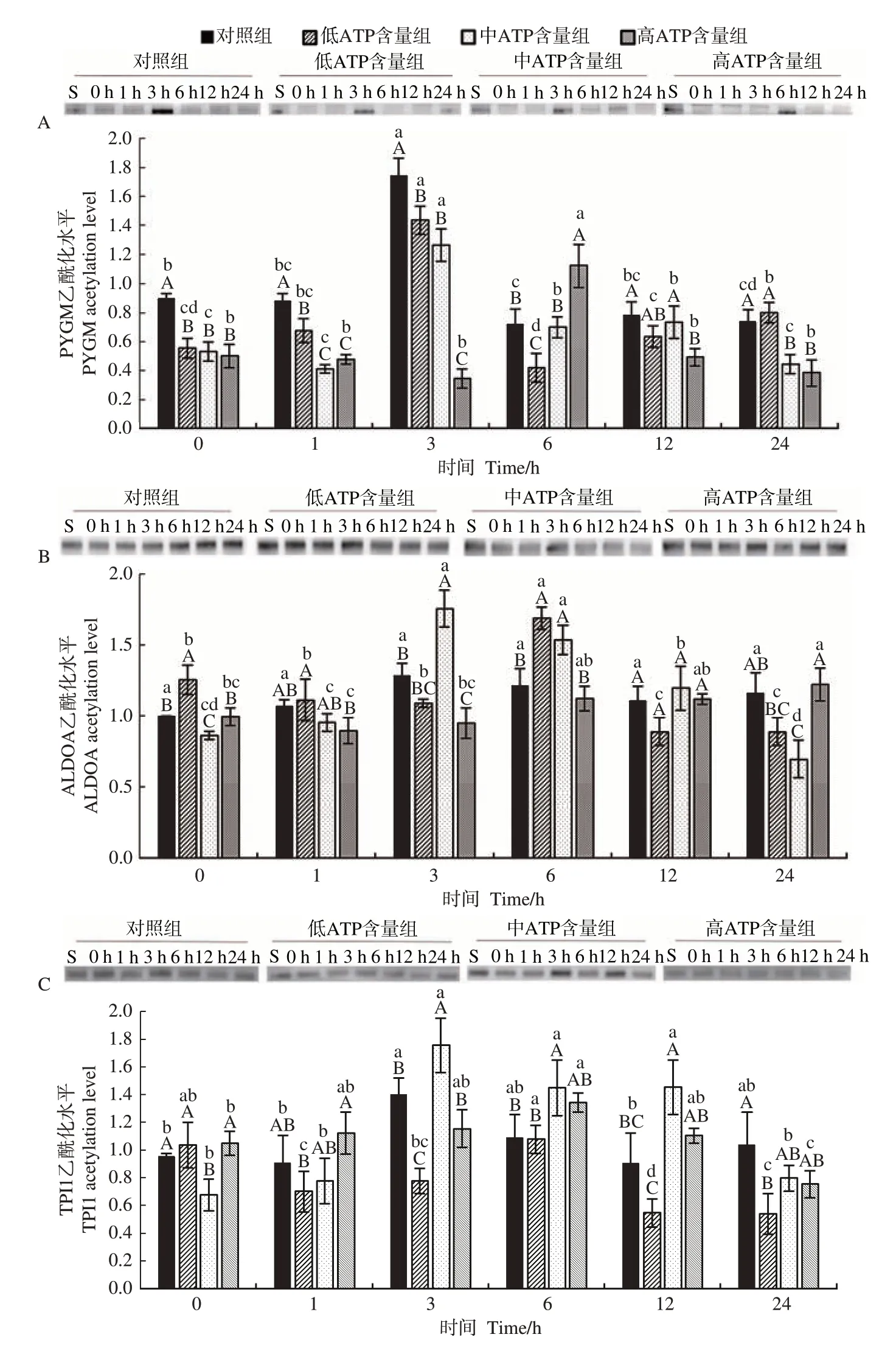
图2 不同ATP含量处理组孵育过程中糖酵解酶乙酰化水平Fig.2 Acetylation level of glycolytic enzyme during incubation in different ATP content groups
由图2-B可知,低ATP处理组的ALDOA 乙酰化水平在孵育0、6 h 时显著高于对照组,中ATP 处理的组ALDOA 乙酰化水平在孵育3~6 h 时显著高于对照组,高ATP 处理组的ALDOA 乙酰化水平在孵育24 h 显著高于低ATP 含量和中ATP 含量组。同时,低ATP 含量组的ALDOA乙酰化水平在孵育6 h显著上升。
由图2-C 可知,低ATP 含量组的TPI1 乙酰化水平在孵育3 和24 h 时显著低于对照组,中ATP 处理组的TPI1 乙酰化水平在孵育3~12 h 时整体显著高于其他处理组。此外,低ATP 含量组的TPI1 乙酰化水平在孵育12 h显著下降。
2.5 不同ATP 含量处理组中PYGM、ALDOA、TPI1活性变化
由图3-A 可知,ATP 处理组PYGM 活性在孵育0~1 h 显著高于对照组。低ATP 含量组PYGM 活性在孵育0 h显著高于其他处理组;中ATP含量组PYGM 活性在孵育0~3 h内显著高于对照组;高ATP含量组PYGM活性在孵育6 h显著高于其他处理组。
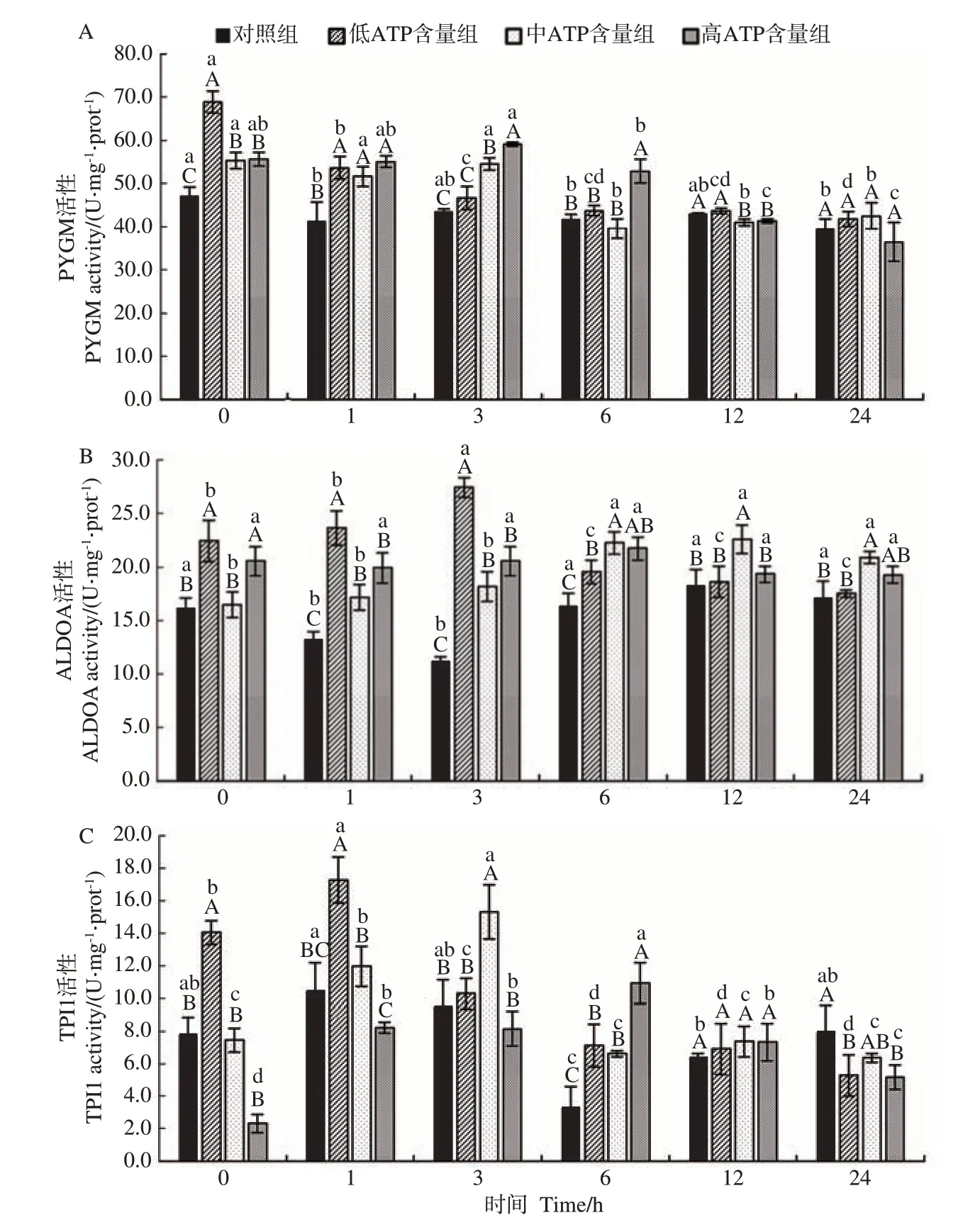
图3 不同ATP含量处理组孵育过程中糖酵解酶活性变化Fig.3 Changes of glycolytic enzyme activity during incubation in different ATP content groups
由图3-B可知,低ATP含量组ALDOA 活性在孵育1~3 h显著高于其他处理组;中ATP含量组ALDOA活性在孵育1~24 h显著高于对照组;高ATP含量组ALDOA活性在孵育1~6 h显著高于对照组。
由图3-C可知,低ATP含量组TPI1活性在孵育0~1 h显著高于其他处理组,中、高ATP含量组TPI1活性分别在孵育3、6 h显著高于其他处理组。此外,低、中、高ATP含量组TPI1活性随孵育时间延长均呈先升后降的趋势。
2.6 不同ATP 含量处理组中ATP 与乳酸含量、糖酵解酶磷酸化水平、乙酰化水平及其活性相关性分析
由图4 可知,不同孵育时间的ATP 含量与乳酸含量、PYGM 活性呈显著正相关,表明ATP 正向调控乳酸含量。乳酸含量与ALDOA 和TPI1 活性呈显著负相关,TPI1的磷酸化水平和其乙酰化水平呈显著负相关,和ALDOA乙酰化水平呈显著正相关。

图4 ATP与乳酸含量、糖酵解酶磷酸化水平、乙酰化水平及其活性相关性分析Fig.4 Correlation analysis of ATP content and lactate content, phosphorylation level, acetylation level and activity of glycolytic enzymes
3 讨论
3.1 ATP 在能量代谢和蛋白质翻译后修饰进程中的重要性
能量代谢在宰后肌肉向肉品的转化过程中起着重要作用[20]。畜禽宰后血液循环中断,氧气供应终止,线粒体ATP合成不足,导致糖酵解产生少量ATP;随着肌肉收缩、离子运输、蛋白降解等生化途径消耗大量ATP,导致ATP含量降低[21-22]。这与本研究结果一致,而ATP随着孵育时间延长被大量消耗。同时,ATP在蛋白质翻译后修饰过程中发挥重要作用,ATP为蛋白质磷酸化供应底物,通过提高μ-钙蛋白酶磷酸化水平抑制其降解和活性,从而影响肉品质[23]。Zhang等[24]研究发现ATP升高诱导线粒体蛋白发生磷酸化和乙酰化,抑制线粒体功能。ATP促进组蛋白乙酰化,影响干细胞多功能性[25]。本研究结果表明,添加不同含量ATP在孵育0~1 h促进PYGM、TPI1 磷酸化,中ATP 含量组在孵育6 h 促进ALDOA、TPI1乙酰化水平,与上述研究结果一致。
3.2 PYGM、ALDOA、TPI1 在能量代谢进程中的重要性
大部分糖酵解酶都是可发生磷酸化修饰的蛋白质,经磷酸化修饰调节糖酵解进程,进而影响肉品质[26]。宰后肌肉中鉴定出的最大的两个乙酰化蛋白质簇来源于糖酵解和肌肉收缩[27]。其中,PYGM 作为无氧糖酵解第一步反应的关键酶,在肌肉中催化糖原分解为葡萄糖-1-磷酸和葡萄糖6-磷酸,为糖酵解提供必要底物[28]。Bai 等[14]研究发现外源添加ATP 提高了PYGM 磷酸化水平与其酶活性,与本研究结果相同。本研究表明,ATP提高了PYGM 活性,低、中、高ATP 含量组PYGM 活性分别在孵育1、3、6 h 达到最高。ALDOA 是糖酵解过程中的主要代谢酶,参与糖酵解及糖异生过程,将六碳糖分成2个三碳糖,催化1,6-二磷酸果糖生成磷酸二羟丙酮和3-磷酸甘油醛[29-30]。ALDOA 通过影响细胞代谢和蛋白质磷酸化促进肿瘤细胞增殖[31]。本研究发现ATP 提高了ALDOA 活性,其中ATP 处理组在孵育0~6 h 促进ALDOA 活性提升效果较好,且低ATP 含量组的促进效果最好。磷酸二羟丙酮和3-磷酸甘油醛是糖酵解途径、磷酸戊糖途径、糖异生的共同中间代谢物[32]。TPI1 通过调节二者之间的相互转化进而调节能量代谢[33-34]。本研究发现低、中、高ATP 含量对TPI1 活性的促进作用分别在孵育1、3、6 h 达到最高,说明ATP 通过磷酸化和乙酰化的共价修饰促进TPI1 活性,随着ATP 含量的增加,其对TPI1活性的促进作用延后。
3.3 ATP 对PYGM、ALDOA 和TPI1 磷酸化和乙酰化的影响
ATP 是蛋白质磷酸化的关键底物,在蛋白激酶催化下将自身磷酸基团转移到蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上[3]。酶活性主要受磷酸化、乙酰化等修饰和别构效应的影响[35]。前人研究表明,ATP处理可提高宰后肌肉肌原纤维蛋白的磷酸化水平[22]。Li 等[26]鉴定到高嫩度组的PYGM 磷酸化水平较高。Chen 等[13]通过分析不同糖酵解速率肉并进行磷酸化蛋白组学发现,ALDOA 的磷酸化与宰后早期糖酵解速率相关,糖酵解速率较快组的第124、第127 位丝氨酸磷酸化程度较高。本研究发现不同ATP 含量催化糖酵解酶磷酸化水平的效果不同,低ATP 含量组在孵育0~1 h 对PYGM 磷酸化的促进效果最大,在孵育3~24 h对ALDOA磷酸化的促进效果最大;中ATP含量组在孵育0~1 h 对TPI1 磷酸化的促进效果最大,随着孵育时间延长,ATP 被大量消耗,TPI1 磷酸化效果减弱,ATP的促进作用降低。
蛋白质乙酰化是指在乙酰基转移酶的作用下,在蛋白质赖氨酸残基上添加乙酰基的过程[36]。蛋白质乙酰化是另一种重要的蛋白质翻译后修饰,调节蛋白质功能,如酶活性、蛋白相互作用等[37]。已有研究表明,ATP 促进ATP 柠檬酸裂解酶产生乙酰辅酶A,进而促进乙酰化,ATP升高可诱导多种线粒体蛋白乙酰化,抑制线粒体功能[24]。本研究表明,ATP处理组在孵育0~3 h抑制PYGM 乙酰化,低、中ATP 含量组在孵育6 h 促进ALDOA乙酰化。中ATP处理组在孵育3~6 h促进TPI1乙酰化。一方面是ATP 被不断消耗,柠檬酸裂解酶催化作用降低;另一方面是ATP 处理后,优先用于TPI1磷酸化修饰,随着孵育时间延长,ATP促进ATP柠檬酸裂解酶产生乙酰辅酶A,进而促进乙酰化水平[38]。
4 结论
本研究初步阐明了ATP 对宰后早期肌肉中糖酵解酶磷酸化、乙酰化的影响。ATP 通过影响糖酵解酶磷酸化和乙酰化修饰而调控其活性,糖酵解酶磷酸化和乙酰化水平对不同含量ATP 的响应效果不同。添加ATP处理在孵育0~1 h促进PYGM磷酸化并抑制其乙酰化,进而促进其活性;在孵育3~6 h内促进ALDOA磷酸化和乙酰化,进而促进其活性;在孵育0~1 h 促进TPI1磷酸化,孵育3~6 h促进其乙酰化,进而促进其活性。
