高效液相色谱三重四极杆质谱联用法测定茶叶中百草枯残留量
2023-09-05汪文俊徐小雷余晓峰
◎ 吴 琼,汪文俊,朱 林,徐小雷,宗 凯,韩 芳,叶 菁,余晓峰
(1.合肥海关技术中心,食品安全分析与检测安徽省重点实验室,安徽 合肥 230022;2.黄山市茶产业促进中心,安徽 黄山 245000)
百草枯是一种快速灭生性除草剂,能够迅速被植物绿色组织吸收,可有效杀死一年或多年生杂草,在土壤中迅速与土壤结合而使其钝化[1-3]。因此,它们曾长期被认为是对环境无害类农药而在全球推广使用,但百草枯对人和动物毒性极大,一旦误服无药可解,口服中毒死亡率在90%以上,我国是百草枯生产使用大国,也是中毒者数量最多的国家[4]。《食品安全国家标准 食品中百草枯等43 种农药最大残留限量》(GB 2763.1 2018)发布后,食品安全国家标准增加了百草枯在谷物和茶叶中的最大残留限量要求,目前现行的《食品安全国家标准 食品中农药最大残留限量》(GB 2763 2021)延续了百草枯在茶叶中的最大残留限量要求(0.2 mg·kg-1)。国外标准中,欧盟对输欧茶叶中百草枯残留量作了规定,不得大于0.05mg·kg-1。
目前现行的百草枯检测标准有《出口植物源性食品中百草枯和敌草快残留量的测定 液相色谱-质谱/质谱法》(SN/T 0293 2014)、《出口果蔬中百草枯检测拉曼光谱法》(SN/T 4698 2016)和《稻米中百草枯残留量的测定 液相色谱-质谱/质谱法》(DB22/T 1622 2012),检测方法主要包含液相色谱串联质谱法和拉曼光谱法等,检测对象涉及水果蔬菜、玉米、稻米等植物源性食品。SN/T 0293 2014作为GB 2763 2021 指定的百草枯检测方法,其适用范围仅为大米、大豆、玉米、小麦、棉籽、干木耳、甘蓝、苹果、香蕉和草莓,未包含茶叶。直接使用该方法对茶叶中百草枯残留量进行检测时存在溶剂用量大且回收率偏低的情况。覃重阳等[5]利用表面增强拉曼光谱法对茶叶中百草枯农药残留进行快速检测,但该方法在分析不同茶叶中农药含量时存在基质影响大的问题,普适性较差。目前主流的百草枯残留量检测方法仍为高效液相色谱质谱联用法[6-15]。色谱质谱联用技术具有选择性好、定性能力强、灵敏度高的优点,近年来较少有该方法对茶叶中百草枯残留量的检测研究报道。
本研究以茶叶为检测对象,在《出口植物源性食品中百草枯和敌草快残留量的测定 液相色谱-质谱/质谱法》(SN/T 0293 2014)方法基础上,采用固相萃取结合高效液相色谱三重四极杆质谱联用技术,通过优化前处理过程及仪器条件等,建立了一种准确、高效测定茶叶中百草枯残留量的方法。本方法定量限为5 μg·kg-1,可满足国标和欧盟对茶叶的限量要求,为完善百草枯检测标准、监控茶叶质量安全和国家食品安全抽检提供了技术支撑。
1 材料与方法
1.1 材料与试剂
本实验中所用绿茶、红茶、黑茶等茶叶样品均购自黄山茶城。
甲醇、乙腈(色谱纯,西陇科学);甲酸(色谱纯,阿拉丁);氨水(分析纯,阿拉丁);超纯水由纯水仪制得(Milli-Q,美国Millipore);WCX 固相萃取柱(60 mg,3 mL,美国Waters);百草枯二氯酸盐(CAS:1910-42-5,100 mg·L-1,天津阿尔塔)。
1.2 仪器与设备
样品磨(KN295,丹麦FOSS);涡旋振荡仪(Vortex-Genie 2,美国Scientific Industries);分析天平(万分之一,上海梅特勒);固相萃取装置(美国Waters);液相色谱-质谱联用仪(1290II-6470,美国安捷伦)。
1.3 实验方法
1.3.1 标准溶液配制
标准储备液:移取1 mL 质量浓度为100 mg·L-1的百草枯二氯盐有证标准储备液于100 mL 容量瓶中,用乙腈定容至刻度,得到1 mg·L-1百草枯二氯盐标准储备液。
标准工作溶液:移取相应体积的标准储备液(1 mg·L-1)用空白样品基质溶液稀释,分别配制成质量浓度为5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1、50.0 μg·L-1、100.0 μg·L-1和200.0 μg·L-1的系列标准工作溶液。
1.3.2 样品前处理
取代表性的茶叶样品500 g 经样品磨粉碎后充分混匀。称取2.0 g 样品于50 mL 具塞离心管中,加入20 mL 含5% FA 的甲醇水溶液,涡旋混匀3 min 后均质提取2 min,4 000 r·min-1离心5 min,取上层提取液10 mL 到15 mL 聚乙烯离心管中,用5% NH4OH 水溶液调节pH 值至7.0 0.5,将上清液转移至已经过活化的固相萃取柱内,控制流速,弃去流出液。依次用2 mL 水和2 mL 甲醇淋洗萃取柱,最后用4 mL 含10% FA 的乙腈溶液洗脱,控制流速,收集洗脱液于刻度离心管中,洗脱液经45 ℃氮吹至干,取1 mL 乙腈-0.1% FA 水溶液溶解残渣,过0.22 μm 滤膜后,供液相色谱三重四极杆质谱联用仪测定。
1.3.3 色谱条件
色谱柱:Thermo Syncronis HILIC(长度为100 mm,直径为2.1 mm, 粒径为1.7 μm); 流动相A:0.1% FA 水溶液;流动相B:乙腈;梯度洗脱程序:0 ~3.0 min,5% A,3.0 ~5.0 min,5% ~90%A;5.0 ~8.0 min,90% A;8.0 ~8.1 min,90%~5%A;柱温:40 ℃;进样量:2 μL;流速:0.3 mL·min-1。
1.3.4 质谱条件
离子化模式:电喷雾电离正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);干燥气:氮气;鞘气流速:10 L·min-1;辅助气流速:3 L·min-1;离子传输管温度:350 ℃;喷雾气电压:4 000 V;碰撞气:氩气,1.0 mTorr,质谱参数见表1。

表1 百草枯的质谱条件表
1.4 数据处理
采用高效液相色谱质谱联用仪自带软件工作站[Agilent Mass Hunter Quantitative Analysis(for QQQ)]进行标准曲线绘制和样液质量浓度计算。采用Microsoft Office Excel 2013 软件进行数据统计及统计图表绘制,采用Win 10 自带画图软件进行图像辅助处理。
2 结果与分析
2.1 色谱与质谱条件的优化
接双通注入质量浓度为1 mg·L-1的百草枯标准溶液以优化质谱条件,通过全扫描模式(Q3 SCAN)优化喷雾气电压、源内碎裂电压、干燥气流速和离子传输管温度等参数,得到对应母离子186;再通过产物离子扫描模式(Product ion SCAN)找到对应子离子;分别选择响应较优的两个产物离子作为定量和定性离子,分别为171 和155;最后在多反应监测(Multiple Reaction Monitoring,MRM)模式下根据响应优化碰撞能等参数[4],具体参数见表1。
百草枯为亲水强极性化合物,参考SN/T 0293 2014 方法采用亲水性Syncronis HILIC 色谱柱进行分离。流动相采用0.1% FA 水—乙腈流动相体系优化峰形减少拖尾,同时提高离子化效率,利用优化好的质谱参数和色谱条件进行MRM 分析,百草枯(0.2 mg·L-1)的总离子流图与MRM 质谱图见图1。

图1 百草枯(0.2 mg·L-1)总离子流图与MRM 质谱图
2.2 提取溶剂的优化
百草枯呈碱性,易溶于水,在中性和酸性条件下稳定。调研文献[6-7,11]发现,大部分采用有机溶剂与稀酸混合溶液进行提取,分别选择相同体积甲醇/0.1 mol·L-1盐酸溶液(1 ∶9)、乙腈/0.1 mol·L-1盐酸溶液(1 ∶9)、含5% FA 的甲醇/水(1 ∶1)、含5% FA 的乙腈/水(1 ∶1)进行溶剂萃取,考察实际茶叶样品加标的萃取效率。实验发现,选择含5%FA 的甲醇/水(1 ∶1)溶液萃取效率最佳,百草枯归一化萃取效率见图2。
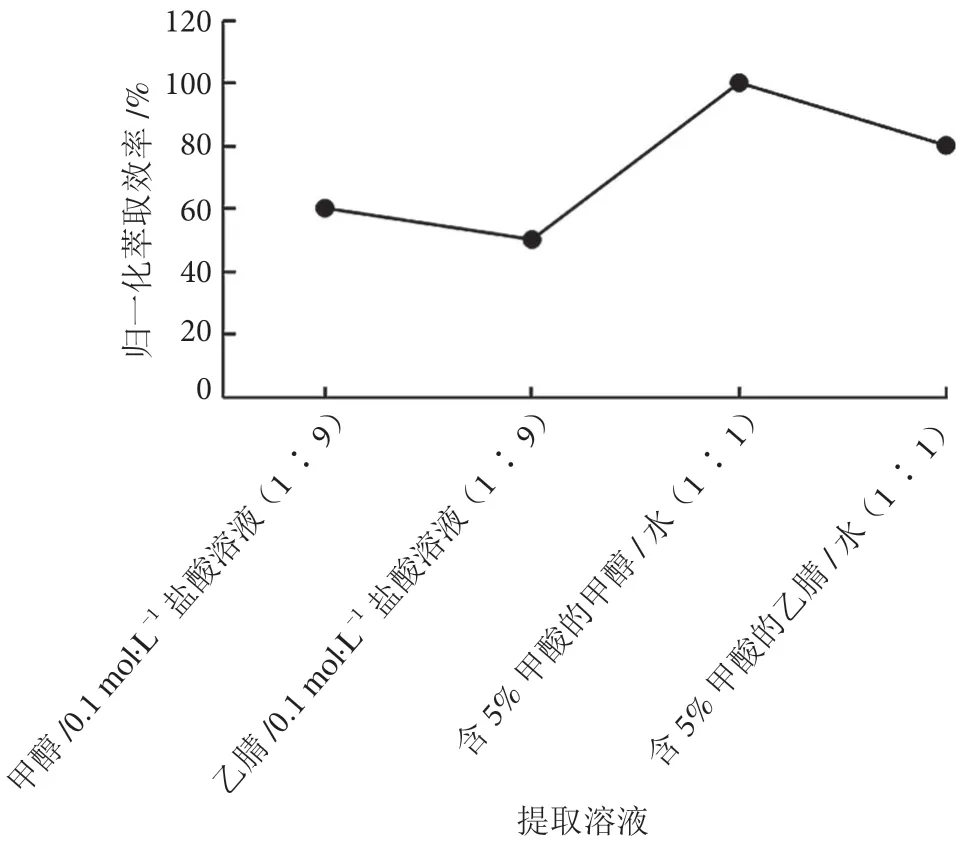
图2 不同提取溶剂归一化萃取效率图
2.3 固相萃取柱洗脱条件的优化
茶叶样品基质较蔬菜水果复杂,提取液色素含量高,基质效应强,无法直接上机分析。为了获得更好的净化效果,采用固相萃取法净化。百草枯为亲水性强极性化合物,参考SN/T 0293 2014 方法,选用阳离子交换、混合型WCX 固相萃取柱进行净化。洗脱条件是决定回收率的关键因素,在0.2 mg·kg-1加标浓度下,分别用含5%、10%、15% FA 的乙腈溶液作为洗脱液,进行回收率实验。实验发现,含10%、15%FA 的乙腈溶液的洗脱效率明显优于5%,而用10%和15% FA-乙腈时的洗脱效率相差不大,考虑到相同洗脱效率下优先选择含酸浓度低的乙腈溶液作为洗脱液,最终采用含10% FA 的乙腈进行洗脱。不同洗脱溶剂归一化洗脱效率结果见图3。同时,实验考察了不同体积(2 mL、3 mL、4 mL 和5 mL)洗脱液的洗脱效率。在0.2 mg·kg-1的加标浓度下,根据回收率结果最终选用4 mL 洗脱液洗脱。不同洗脱体积下的回收率结果见图4。
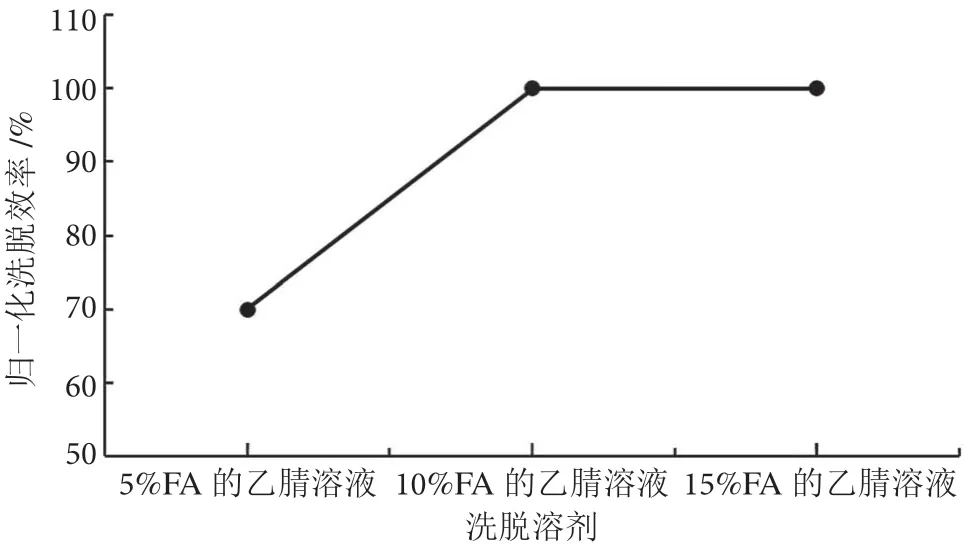
图3 不同洗脱溶剂归一化洗脱效率图
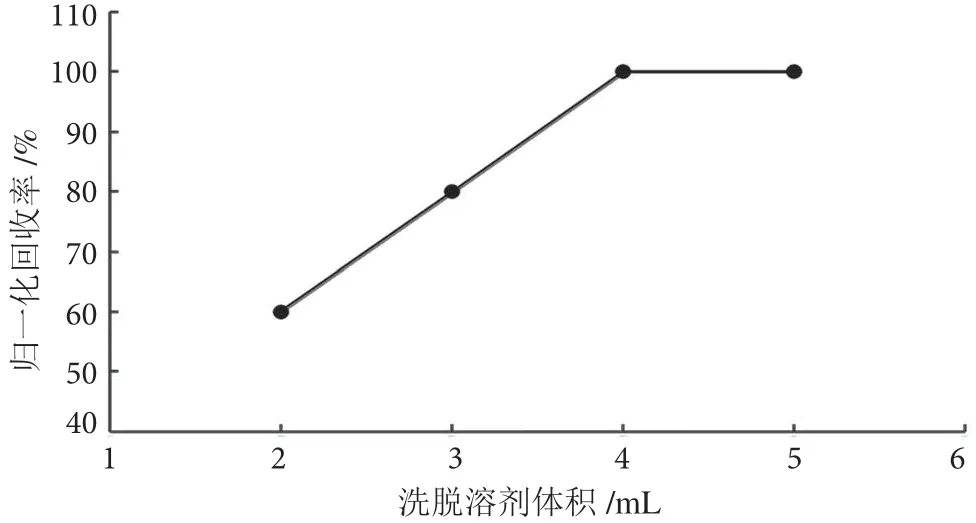
图4 不同体积洗脱液洗脱归一化回收率图
2.4 线性关系、方法定量限、回收率和精密度实验
用空白基质溶液配制质量浓度为5.0 ~200.0 μg·L-1的百草枯系列标准工作溶液,1.3 色谱和质谱条件下进样,以百草枯定量离子171 色谱峰面积为y轴,质量浓度为x轴绘制标准曲线。结果表明,在相应质量浓度范围内线性良好,线性方程为y=307.51x-480.63,r2=0.999 86。
以3 倍信噪比确定检出限,该方法百草枯检出限为1 μg·kg-1,以10 倍信噪比确定定量限,该方法百草枯定量限为5 μg·kg-1。
为了考察该方法在不同茶叶中的适用性,分别选择绿茶、红茶、黑茶阴性样品,在方法定量限(0.005 mg·kg-1)、欧盟茶叶限量(0.050 mg·kg-1)、标曲最高点/国标茶叶限量(0.200 mg·kg-1)3 个不同浓度水平下加标,按照本研究方法进行处理和测定,每个加标水平做6 次平行实验,加标回收率和精密度实验数据如表2 所示。结果表示,百草枯平均回收率为92.5%~103.2%,相对标准偏差为3.2%~5.6%,准确度和精密度满足方法学要求。
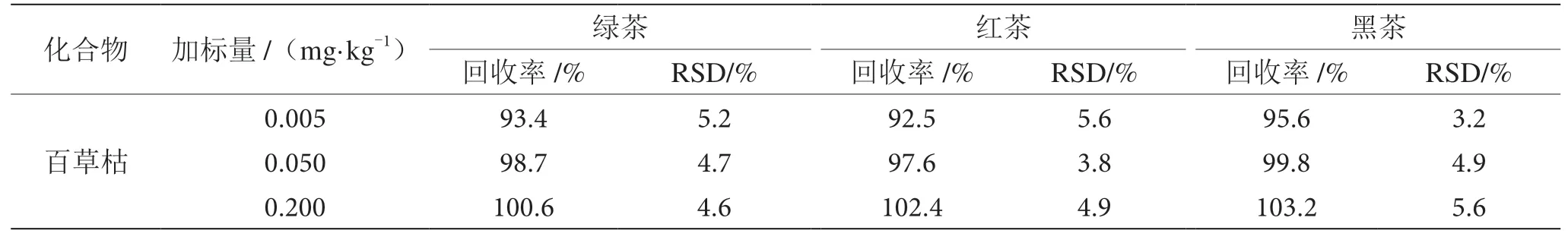
表2 阴性样品中百草枯加标回收率和精密度表(n=6)
2.5 方法应用
用本文建立的方法对市售20 份茶叶样品进行百草枯残留量检测,20 份样品均无百草枯残留检出,市售样品和阴性加标样品MRM 图见图5 和图6。
图5 市售样品MRM 图
图6 茶叶加标样品MRM 图
3 结论与讨论
本文建立了一种茶叶中百草枯残留量的固相萃取/高效液相色谱三重四极杆质谱检测法,茶叶样品经甲醇-甲酸水溶液提取后,采用WCX 固相萃取柱净化,样液在含0.1% FA 水-乙腈流动相体系经亲水性HILIC 色谱柱分离,采用电喷雾离子源正离子模式采集,多反应监测模式下检测,外标法定量。由于百草枯易产生柱残留,在分析标准工作溶液与样液之间可插入数针试剂空白,避免柱残留产生的假阳性。该方法结果准确,适用于各种茶类中百草枯残留量的测定,方法定量限可满足各国对茶叶中百草枯的限量要求,为完善百草枯检测标准、监控茶叶质量安全、国家食品安全抽检提供了技术支撑。
