3例高血糖相关性急性脑损伤患者的临床与影像分析
2023-09-03陈迪梁
陈迪梁 黄 骥 金 银 殷 鹏
天门市第一人民医院,湖北 天门 431700
高血糖相关性脑损伤是以血糖升高继而导致急性脑损伤为表现的一种临床综合征,其包括有非酮症性高血糖偏侧舞蹈症、非酮症高血糖性癫痫等。本文结合相关文献总结了天门市第一人民医院2019-07—2022-08诊治的高血糖相关性急性脑损伤患者3例,并对其临床特点及影像学特征进行了总结。
1 临床资料
总结天门市第一人民医院2019-07—2022-08因高血糖继发急性脑损伤的病例并进行详细评估,包括临床症状、病史和血检、影像学检查,结合临床表现、影像学、实验室检查、鉴别诊断及相关治疗,对符合糖尿病性急性脑损伤的3例患者进行分析。
例1,女性,66岁,入院7 d前无明显诱因突发出现右侧肢体无力,走路跛行,同时伴右侧肢体不自主活动,无眩晕、复视。既往有2 型糖尿病5 a,长期服用盐酸二甲双胍片(0.5 g/次,2 次/d)、格列齐特缓释片(1 片/次,1 次/d)降糖治疗,但血糖控制差;否认冠心病、高血压、脑卒中病史。入院当天体格检查,BP:130/80 mmHg神志清楚,头颅无畸形,右侧肢体可见不自主运动,肌力及肌张力无法检查(肌力4+级以上),左侧肢体肌力正常,四肢腱反射正常,深浅感觉正常,病理征阴性,Kernig征阴性,Brudzinski征阴性。
2019-07-28入院,查头部CT提示左侧豆状核可疑密度高(图1A)。入院随机血糖:22.1 mmol/L。第2天血检:血常规、甲状腺功能、风湿三项、凝血功能、D-二聚体、心肌酶谱、ENA谱、肝功能、粪常规基本正常;肾功:Na(钠)141 mmol/L(参考范围137~147 mmol/L),K(钾)3.35 mmol/L(参考范围3.5~5.3 mmol/L),Urea(尿素)5.51 mmol/L,HbAlc(糖化血红蛋白)12.60%(参考范围4.27%~6.07%);尿常规:尿糖3+,尿酮体阴性。2019-07-29 行头颅MRI+DWI检查显示如图1B-E所示。

图1 例1 头部CT 平扫,左侧豆状核稍高密度灶,无占位效应,周围组织无水肿(A);头部MRI平扫,T1WI示左侧豆状核高信号灶(B),T2WI示双侧豆状核低信号,左侧更明显(C),DWI及ADC 序列未见明显弥散受限及高灌注表现(D、E),复查头部CT平扫可见双侧豆状核高密度灶,左侧更明显(F),2 a后复查头部CT双侧基底节区高密度灶消失(G)Figure 1 Case 1 head CT non-contrast scan:left legume nucleus slightly dense,no mass effect,no edema of surrounding tissues(A);Head MRI scanning:T1WI showed left legume nucleus high signal focus(B),T2WI showed bilateral legume nucleus low signal,left side more obvious(C),DWI and ADC sequences did not show obvious diffusion restriction and hyperperfusion manifestations(D,E),repeat head CT non-translation:bilateral legume nucleus high-density foci,left side more obvious(F),2 years later,review of head CT bilateral basal ganglia high-density foci disappeared(G)
入院第2天予胰岛素(优泌乐+甘精胰岛素)降糖治疗,同时予氯硝西泮抗不自主运动治疗,治疗第6天,患者右侧肢体不自主运动明显改善,监测血糖控制良好,于2019-08-06 好转出院,但院外患者未规律饮食及降糖治疗,于2019-08-22 再次出现右侧肢体不自主运动就诊我院,2019-08-22 复查头部CT示:双侧豆状核、尾状核密度增高,符合非酮症糖尿病偏身舞蹈症表现(图1F)。再次予胰岛素积极降糖治疗,但未予氯硝西泮等药物对症处理,经严格降糖治疗后7 d,患者症状好转出院。此后患者严格糖尿病饮食及药物控制血糖,后未在出现舞蹈样症状发作,且2022-01-29 再次复查头部CT 双侧豆状核、尾状核高密度信号灶消失(图1G)。
例2,女性,53 岁,2021-03-12 入院,入院前7 d患者左侧肢体不自主运动,呈舞蹈样动作,下肢重于上肢,伴左侧肢体乏力不适,无眩晕、复视等其他神经系统症状。既往有10 余年2 型糖尿病史,目前服用格列美脲,但未控制饮食及监测血糖;有3 a 高血压史,口服药物不详,未监测血压,但自我感觉血压控制良好。入院当天检查:T 36.6 ℃,BP 160/100 mmHg,神志清楚,左侧肢体可见不自主运动,左侧肢体肌力5-级,右侧肢体肌力正常,四肢腱反射正常,四肢肌张力正常,深浅感觉正常,余神经系统检查未见明显异常。入院查随机血糖33.36 mmol/L,糖化血红蛋白15.90%,肾功能(电):钠135.0 mmol/L,氯94.6 mmol/L,钾3.82 mmol/L,尿常规:尿糖4+,尿酮体阴性,ENA谱、血常规、肝功能、甲状腺功能三项均未见明显异常。2021-03-12 头部CT 提示右侧尾状核头区脑梗死,周围基底节区密度增高(图2A)。2021-03-15行头部MRI+DWI示,右侧基底节区病灶见片状短T1信号影,周围高密度影,T2序列可见右侧基底节高信号灶(脑梗死所致),周围低密度灶(高血糖所致),T2FLAIR、DWI 及ADC 序列上可见右侧基底节区混合信号灶(图2B~F)。入院考虑糖尿病急性脑损伤合并脑梗死,当天即予胰岛素+米格列醇降糖,同时予阿司匹林抗栓、他汀调脂及磷酸川穹嗪改善循环等治疗,并联合康复功能训练,血糖控制良好,第6天患者左侧不自主运动明显好转,且经过康复功能锻炼,左侧肢体肌力恢复正常,好转出院后嘱继续脑卒中二级预防及严格控制血糖治疗,后期电话随访,患者血糖控制良好,且未再出现肢体不自主运动。

图2 例2 头部CT 平扫:右侧尾状核区见片状低密度灶,周围密度增高,无占位效应,周围组织无水肿(A)头部MRI平扫:T1WI示右侧尾状核低信号灶,周围信号增高(B),T2WI及T2 FLAIR示右侧尾状核高低混合信号灶(C、D),DWI、ADC示混合信号灶(E、F)Figure 2 Case 2 head CT plain scan:flaky low-density foci in the right caudate nucleus area,increased peripheral density,no mass effect,no edema of surrounding tissues(A)Head MRI plain scan:T1WI showed low signal foci of right caudate nucleus,increased peripheral signal(B),T2WI and T2 FLAIR showed high and low mixed signal foci(C,D)of the right caudate nucleus,and DWI and ADC showed mixed signal foci(E,F)
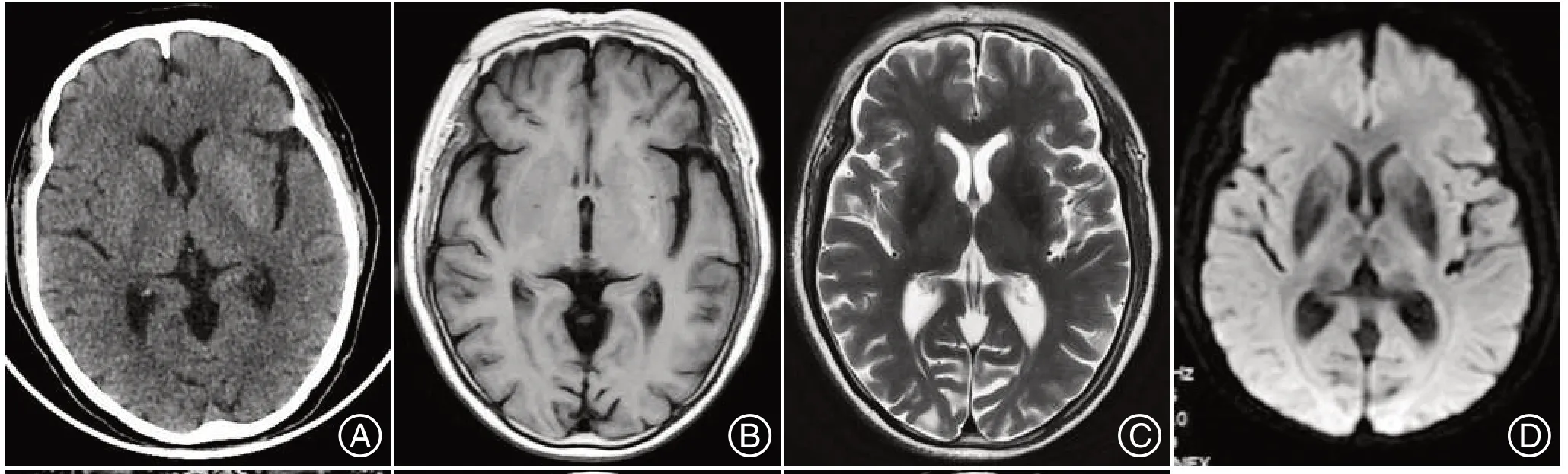
例3,男性,39岁,2022-08-23入院,7 d前开始出现头晕,伴头痛、视物模糊,头部闷痛不适,呈持续性,位于枕部,双眼视物模糊,偶有双眼右侧视野闪光,亮度炫目、不敢睁眼,时间数秒至1分钟不等,无肢体抽搐,意识清楚。既往无“高血压、糖尿病、癫痫”病史。入院当天检查:T 36.5 ℃,BP 127/87 mmHg,神志清楚,颈软,双侧瞳孔等大等圆(D=2.5 mm),光反射存在,双眼右侧视物模糊,未见明显视野缺损,眼球活动正常,无眼震,四肢肌力及肌张力正常,深浅感觉正常,余神经系统检查均正常。入院测随机血糖:high>35 mmol/L,糖化血红蛋白(HbA1c):13.20%,空腹血糖15.53 mmol/L,尿液分析:葡萄糖3+、酮体阴性,肾功能:钾3.53 mmol/L、钠125 mmol/L、氯92.4 mmol/L,血常规、粪常规、肝功能、凝血五项、甲状腺功能、Hcy、ENA谱均正常,梅毒试验阴性,眼底荧光血管造影未见视网膜病变,HIV 阴性。入院急查头部CT未见明显异常(图3A)。脑电图可见左侧顶枕部慢波活动稍增加(图H),头部MR:左侧枕顶叶见皮层下稍短T2信号影,皮层可见细小高信号影,T1等信号,T2FLAIR 低信号(图3B~D),DWI、ADC、SWI 稍低信号(图3E~F)。入院后予胰岛素积极降糖治疗,经治疗第3天后,患者未再出现视野闪光,1 周后患者视物模糊明显好转出院,院外嘱严格控制血糖,后电话随访,未再出现视野闪光,且视物模糊症状完全缓解。
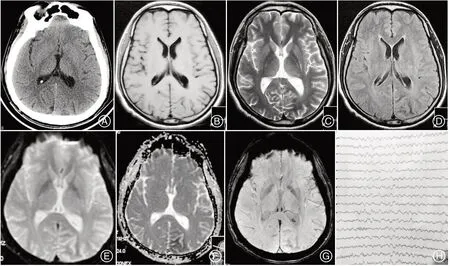
图3 例3头部CT 平扫未见明显病灶(A);T1WI示等信号灶(B),T2、T2 FLAIR低信号、DWI、ADC、SWI左侧枕顶叶稍低信号灶(C-G),脑电图左侧顶枕部慢波活动活动稍增加Figure 3 Case3 head CT non-contrast scan showed no obvious lesions(A);T1WI Showed equal signal foci(B),T2,T2 FLAIR low signal,DWI,ADC,SWI left occipital parietal lobe slightly lower signal foci(C-G),and left parietal occipital slow wave activity increased on EEG
2 讨论
本文3 例患者,例1、例2 为中老年女性,既往有明确糖尿病病史,但血糖均控制较差,诊断为非酮症性高血糖偏侧舞蹈症;例3 为中年男性,首次确诊糖尿病,诊断非酮症高血糖相关性局灶性癫痫发作。3例患者血糖均明显升高且HbAlc 升高显著,提示为既往糖尿病病史。例1 例2 患者均表现为单侧肢体不自主抖动,单侧肢体不自主运动与高血糖所致脑功能障碍有关,随着高血糖的纠正,症状可消失,例2左侧肢体轻瘫,考虑与同时合并右侧基底节区脑梗死所致;例3 患者表现为双眼视物模糊且伴有视野闪光,但头颅影像学检查左侧枕叶病灶与脑梗死病灶影像学不符,不支持脑梗死,考虑为高血糖所致癫痫症状,而枕叶癫痫是高血糖的少见症状之一。
非酮症性高血糖偏侧舞蹈症(hemichorea of nonketotic hyperglycemia,HC-NH),是糖尿病神经系统急性并发症,临床相对少见,指血糖控制不良的糖尿病患者,影像学上NECT 表现为基底节区高信号,MR 显示T1WI 呈高信号,临床上出现对侧肢体不自主运动,类似舞蹈样动作的临床综合征[1],也有被命名为糖尿病纹状体病[2]。该病最早在1960年被首次报道[3],目前文献中尚无该病的统一命名及诊断标准,且发病机制具体不明。总结相关报道及以前文献,具有如下特点:(1)患者多起病急,少部分为亚急性起病,而慢性起病者偏少,但均有糖尿病,且血糖控制差,部分患者尿酮体阳性[2,4];(2)其临床特征是患肢无意识的不平衡的舞蹈样动作,多单侧,部分患者双侧表现,若早期不予治疗,病情可进行性加重,出现频繁、幅度大的动作表现,部分患者伴或不伴噘嘴、口角抽动或(及)挤眉弄眼等异常动作,一般下肢症状较上肢表现明显,但在入睡后症状可消失[5];(3)影像学上病灶多发生在基底节区,且多累及豆状核、苍白球、尾状核、壳核,可单侧或双侧病变[1,4];(4)影像学特征性表现为其诊断有重大价值,大部分病人的头颅CT为相应基底节区密度增高,MR 检查时基底节区T1WI 高信号,T2WI、DWI、FLAIR 序列低信号或等信号,且均无占位效应,但合并脑梗死患者,DWI、FLAIR序列可出现高、低信号混合,而增强扫描没有增强[6-7],若血糖控制良好,基底节区病变在短时间(半年)内可消失;(5)多数患者在积极控制血糖后1周左右,或同时应用抗震颤相关药物(如氟哌啶醇、氯硝西泮)治疗后,舞蹈样症状可大幅度好转,甚至消失,预后良好[8]。综合目前相关文献及研究,认为有以下机制可能:(1)γ-氨基丁酸(GABA)减少:长期处于高血糖状态下的糖尿病病人,脑组织局部血流量下降,造成以三羧酸循环获取能量的途径被抑制,继而使脑细胞主要以无氧糖酵解获取能量,在此背景下,脑细胞代偿机制启动,使GABA 成为脑细胞的主要供能物质,继而脑组织的GABA 被快速消耗,但又无法快速再次合成,但GABA是一种抑制性的神经递质,它起到了调节机体平衡的作用,GABA含量下降对基底节的抑制作用会减弱,进而出现锥体外系统的症状,临床上表现为舞蹈样运动[9-10]。(2)离子沉积学说:高血糖可导致微循环障碍和血脑屏障破坏,使Mn2+通过血脑屏障,形成锰-超氧化物歧化酶(Mn-SOD),并聚集在星形胶质细胞线粒体内,其滞留时间很长,因此MR的T1WI上显示高信号的时间较长[11-12]。(3)免疫性学说:研究发现[13-14],抗谷氨酸脱羧酶在HC-NH 患者基底节区滴度明显升高,而基底节区GABA 能神经元以谷氨酸脱羧酶(glutamate decar-boxylase,GAD)为标记物,糖尿病患者体内抗谷氨酸脱羧酶65(GAD65)抗体比例普遍升高,同时,高血糖可以提高血-脑屏障的通透性,使外周血液中抗GAD65抗体通过血-脑屏障进入基底节,与GAD发生抗原交叉作用,使GABA水平降低,引起基底节功能异常,产生舞蹈样动作。(4)雌激素减少:HC-NH 通常发生在老年人,特别是亚洲的2型糖尿病妇女,表明女性及高龄是一个诱发因素,在黑质纹状体通路中,多巴胺可以控制机体运动和肌张力等作用,而研究发现,雌激素通过抑制黑质纹状体的多巴胺传递功能,使大脑中的多巴胺受体浓度增高,进而引起超敏现象[27];而绝经妇女体内的雌激素含量明显降低,对多巴胺的抑制能力降低,但多巴胺受体浓度升高,且其敏感程度提高,从而引起舞蹈症的发生[15]。因该病无统一诊断标准,且临床少见,若不注意,早期极易被漏诊、误治,导致症状加重及延误病情。该病需与以下疾病鉴别:(1)出血:部分基底节区出血临床可表现为类似症状,但多急性起病,运动中发病多见,且伴头痛、头昏等不适,多伴高血压;CT上出血灶表现为更高密度,MRI依据血红蛋白的演变各期表现不一,亚急性期T1WI为高信号,周围可见水肿带,占位效应明显。(2)获得性肝性脑部病变:是由慢性肝脏疾病引起的锥体外系症状的临床综合征,多见于肝硬化、活动性慢性肝炎、肝移植术后等慢性肝病的患者;MRI显示T1WI高信号,呈对称片状分布,多位于双侧基底节区,T2WI 信号正常;CT 上基底节区常无异常密度;无占位效应,无水肿带,无强化。HC-NH治疗的重中之重是血糖控制,一般血糖控制良好后24 h~1 周症状可缓解,且后期颅内病灶可消失。本文中例1患者为老年女性,入院急查头部CT 可见左侧豆状核高信号灶,头部MR 示T1WI 示左侧豆状核高信号灶,T2WI 示双侧豆状核低信号、左侧更明显,DWI 及ADC 等信号,周围无水肿及占位改变;患者经严格控制血糖后,院外第1、3、12月后电话随诊,患者右侧肢体舞蹈样症状未再发作,2 a 后再次复查头部CT,双侧基底节区高密度灶消失,预后良好,嘱继续控制血糖。
癫痫是神经内科常见的一种临床综合征,它是由于各种原因造成的大脑神经元高度同步异常放电,从而导致一系列的症状。脑血管病、脑肿瘤、脑外伤、颅内感染是其主要病因。但单纯由高血糖导致癫痫发作却相对罕见,被MACCARIOM 等[15]学者首次报道,该疾病的特征是高血糖,无意识障碍,无酮症酸中毒和癫痫发作[16],控制血糖治疗有效,后被命名为非酮症高血糖(non-ketotic hyperglycemia,NKH)性癫痫[17],症状复杂多变,可表现为癫痫全面性发作,也可表现为局灶性发作,临床以局灶性运动性癫痫多见[18],杨明辉等[19]报道过1例患者表现为肢体不自主性扭转痉挛,GABALLA 等[22]报道过1 例表现为短暂性单侧同向偏盲的枕叶癫痫的患者,崔韬等[20]报道2例枕叶癫痫,其临床表现为发作性视野闪光和视幻觉,而本文中例3枕叶癫痫患者表现为视物模糊并有发作性视野闪光。结合相关文献及病例,总结有以下特点:(1)中老年患者多见,但也有部分青中年患者,杨明辉等[19]和余年等[21]曾报道过在青中年时期发病的糖尿病性痫性发作患者。(2)患者可既往或初次诊断糖尿病,但血糖均控制差。(3)临床痫性发作症状复杂多变,局灶性发作多见,亦可全身发作。(4)影像学上表现为发作区皮层下会出现T2WI低信号,伴皮层受限(T2细小高信号),ADC 低信号,DWI 序列显示正常或稍低信号灶;而这种在DWI 图像上呈低信号,我们称之为“T2暗化效应”;这种T2暗化效应是发生在皮层下白质,而不是皮质,但并不是所有的该类患者均出现这种“T2暗化效应”。GABALLA 等[22]报道1 例枕叶癫痫的患者,其MR 显示病灶区T2WI、FLAIR 和SWAN 图像显示皮质高信号,而相邻皮质下白质低信号。(5)脑电图一般无明显异常,部分可显示弥漫性慢波,少数可见癫痫样波,发作期间脑电图呈棘波表现有明显诊断价值。GABALLA 等[22]报道痫性发作脑电图显示左枕多棘波,扩散至右枕区,随后弥漫性双侧受累,而崔韬等[20]报道痫性发作脑电图为θ或α节律的演变。本文中例3 为1 例39 岁男性患者,初次诊断为糖尿病,入科随机手指血糖显示High(>35 mmol/L)、糖化血红蛋白(HbA1c):13.20%,均明显升高,临床表现为视物模糊,且伴发作性视野闪光,头部MR 可见T2WI、FLAIR 、DWI和ADC序列左侧枕叶皮层下低信号,符合上述文献报道。但目前该病发病机制具体不明,综合各种文献,可能的发病机制大致分为以下4 类:(1)神经递质改变:BRICK 等[23]认为高血糖患者,脑组织主要通过无氧糖酵解来获取能量,并通过抑制三羧酸的循环,使GABA 代谢加快,从而GABA 水平下降,而GABA是神经系统的一种抑制性神经递质,故而降低癫痫的发作阈值,从而导致痫性发作。(2)离子通道的改变:糖尿病可导致离子通道结构和功能改变,造成钾离子外流,加速细胞超极化,从而降低神经细胞的兴奋性[24];同时,亦可以激活酸敏感离子通道,可导致海马神经元和皮质的兴奋性增加,从而导致其持续去极化和癫痫样放电[25-26]。(3)神经血管单元失衡:高血糖可导致微循环障碍,引起神经血管单元平衡紊乱,继而破坏血脑屏障的完整性,使其通透性增高,引起星形胶质细胞增生和激活,最终导致癫痫的发生[24]。(4)免疫异常:高血糖患者胰岛细胞受损,导致谷氨酸脱羧酶抗体产生[24,27],而脑内的GABA是由葡萄糖经谷氨酸脱羧酶脱羧生成的,所以糖尿病患者可继发导致GABA 生成减少,继而导致癫痫发作,表明糖尿病性癫痫的发病与免疫功能的变化密切相关。NKH性癫痫与其他原因导致的癫痫不一样,本病可以通过积极控制高血糖及液体疗法后,可使患者症状得到迅速改善,赵媛等[29]报道过多例非酮症高血糖性癫痫患者经积极控制血糖后症状可迅速缓解,因此,早期识别这一临床综合征,尤其是与引起癫痫发作的其他原因相鉴别时,对预后至关重要。
本文3 例患者均为高血糖所致急性脑损伤,例1、例2为非酮症高血糖偏侧舞蹈症,例3为非酮症高血糖性局灶性癫痫发作,目前文献及研究表明,糖尿病所致偏侧舞蹈症和癫痫发作,两者病因及发病机制类似,且其最主要的治疗方法均为积极控制血糖,早期给予降糖及对症治疗,一般预后良好,后期随诊头部病灶大部分可逆转,故笔者认为这两种疾病只是病灶部位不同,所致症状不一样,且命名尚未统一而已。因临床高血糖所致急性脑损伤漏诊、误诊病例较多,希望本文能对临床工作给予重要提示。
