宝根续筋药贴经皮给予的急性毒性、刺激性和过敏性研究
2023-09-03梁艳伍春梅陈婉月张宪哲张敬文宋映莲赵美玲王张何浚治
梁艳 伍春梅 陈婉月 张宪哲 张敬文 宋映莲 赵美玲 王张 何浚治

【摘 要】 目的:评价宝根续筋药贴经皮肤给药后的急性毒性、刺激性以及过敏性。方法:在急性毒性实验研究中将兔按性别和体重随机分为空白对照组和宝根续筋药贴浸膏45.76倍临床剂量组,选择最大给药量[即405.151 mg·(cm2·d) -1],观察和记录动物一般状况,死亡情况、体重和饲料消耗量,测试血常规和血生化指标。在刺激性实验研究中给予宝根续筋药贴浸膏0.5 mL[剂量为67.525 mg·(cm2·d)-1],按评分标准对皮肤红斑和水肿进行评分,并进行统计学处理。在豚鼠主动皮肤过敏性实验研究中将宝根续筋药贴浸膏0.2 mL[即27.0101 mg·(cm2·d)-1],观察动物是否有严重的全身性过敏反应出现。结果:观察期内未见动物死亡、中毒症状和肉眼可见的脏器异常,体重和饲料消耗量无明显变化,但急性毒性实验中部分血细胞指标(红细胞数、血红蛋白、红细胞压积数、白细胞数和中性粒细胞数)和血液生化指标(总胆固醇含量)出现异常,皮肤未见刺激性及过敏性。结论:宝根续筋药贴浸膏经皮肤给药后未见明显的急性毒性、刺激性和过敏性,安全性良好,但在临床使用时仍需监测血常规和血液生化学指标。
【关键词】 宝根续筋药贴;皮肤给药;急性毒性;刺激性;过敏性
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2023)15-0015-08
DOI:10.3969/j.issn.1007-8517.2023.13.zgmzmjyyzz202315005
Abstract:Objective To evaluate the safety of acute toxicity, pungency and irritability of Baogenxujin Paste after skin administration.Method Rabbits were randomly divided into blank control group and Baogenxujin paste 45.76 times clinical dose group according to gender and body weight. The maximum dose [405.151 mg·(cm2·d) -1] was selected. The general condition, death, body weight and feed consumption of the animals were observed and recorded.Blood routine and biochemical parameters were tested In the experimental study of pungency, Baogenxujin paste was given 0.5 mL [67.525 mg·(cm2·d)-1)]. Skin erythema and edema were scored according to the scoring standard, and statistically processed. In the active skin allergy experimental study of guinea pigs, Baogenxujinpaste 0.2 mL [27.0101 mg·(cm2·d)-1] was used to observe whether the animals had severe systemic allergic reactions.Result During the observation period, there were no animal death, poisoning symptoms and organ abnormalities visible to the naked eye, and there were no significant changes in body weight and feed consumption;but part of the blood cells in acute toxicity experiment indicators (red blood cell count, hemoglobin, red blood cell pressure accumulation of, leukocyte count and neutrophil) and blood biochemical indicators (total cholesterol) is abnormal, the skin is not allergic and irritating.Conclusion After skin administration of Baogenxujin Paste,the safety is good, but we still need to pay attention to the monitoring of blood routine and blood biochemical indexes.
Keywords:Baogenxujin Paste; Skin Administration; Acute Toxicity; Pungency;Irritability
蒙醫制剂宝根续筋药贴(曾用名:舒筋续断药贴)为外用的贴膏剂,以接骨木、当归和续断为君药,臣以防风和白芷,佐以红花和红毛五加皮,并以醋乳香和醋没药为使,共同发挥活血通络、续筋接骨、通“白脉”的功效,主治骨关节及软组织损伤中后期。根据《中国药典》(2020年版)记载当归、续断等均可用于“风湿痹痛,跌扑损伤”[1]。接骨木总黄酮、花青素、木质素及续断皂苷Ⅵ可抗骨质疏松[2-5];当归多糖APF2可促进分泌造血生长因子[6];红花黄色素及红毛五加皮中的多糖、皂苷和萜类物质可以镇痛[7-11];没药甾酮可抗炎[12-13];乳香可缓解关节炎患者疼痛僵硬[14]。
根据《医疗机构制剂注册管理办法》(征求意见稿, 2015年)[15],药物研究技术指导原则(2005年)[16-18]、《四川省医疗机构制剂研究技术指南(试行版)》(2014年)[19],宝根续筋药贴拟申请四川省医疗机构中药制剂批文,需开展急性毒性、刺激性和过敏性实验研究并提供资料。因此参考相关专著[20]开展系统安全性评价,为宝根续筋药贴申请四川省医疗机构制剂批文提供技术支撑,为其后续有效性研究及临床安全合理应用奠定基础。其作为外用制剂,十分有必要开展皮肤刺激性和过敏性等基本的安全性评价实验。
1 材料与方法
1.1 实验药物 宝根续筋药贴为外用的贴膏剂,其临床成人日用剂量为0.0088542 g浸膏/cm2,亦即0.02083 g藥材/cm2,临床最长用药周期为21d。本实验直接使用浸膏(稠膏),含量为2.3529 g药材/g浸膏,密度为1215.4530 mg浸膏/mL浸膏(与药贴仅为有无压敏胶的区别,因此本实验直接采用浸膏作为受试物),生产批号为210101。外用,每日贴1张药贴。药贴面积为12 cm×16 cm,每张药贴含1.7 g浸膏,相当于4 g药材。宝根续筋药贴的临床给药途径为外用于非破损皮肤,故本次实验采用与临床给药途径相似的皮肤外用途径。2,4-二硝基氯代苯(C6H3ClN2O4,过敏性实验用阳性对照药):由Xiya Chemical Industry Co., Ltd Shangdong出品,规格:100g/瓶,AR级,纯度99%,批号为W5656。用70%乙醇配成浓度为1%和0.1%的溶液备用。
1.2 动物 新西兰大白兔,普通级,12只,雌雄各半,体重为2.0~2.5 kg,《四川省实验动物质量合格证》号:No.0043044;8只,雌雄各半,体重为1.8~2.2 kg,《四川省实验动物质量合格证》号:No.0042956。均由成都达硕实验动物有限公司提供,实验动物生产许可证号:SCXK(川)2019-031。英国种豚鼠,白色,普通级,30只,雌雄各半,体重250~300 g,由四川省实验动物专委会养殖场提供,实验动物生产许可证号:SCXK(川)2018-14,《四川省实验动物质量合格证》号:No.0020374。
1.3 试剂 血常规测试用试剂:溶血剂(批号V-28CFL)、稀释剂(批号M-3D)、清洗剂(批号V-28R)。血液生化指标测试用试剂盒:总蛋白(TP)(批号140819004)、白蛋白(ALB)(批号148320006)、总胆固醇(TC)(批号141620009)、甘油三脂(TG)(批号141720008)、总胆红素(T-bil)(批号144420002)、葡萄糖(GLU)(批号141520016)、丙氨酸氨基转移酶(ALT)(批号140119009)、天门冬氨酸氨基转移酶(AST)(批号140219006)均来自深圳迈瑞生物医疗电子股份有限公司。
1.4 仪器 兽用全自动血液细胞分析仪(型号BC-2800Vet,深圳迈瑞生物医疗电子股份有限公司生产);兽用生化分析仪(型号BS-240VET,由深圳迈瑞生物医疗电子股份有限公司生产)。
1.5 实验方法 急性毒性实验:将兔按性别、体重分层[18]后再随机分为空白对照组和宝根续筋药贴浸膏45.76倍临床剂量组,即405.1510 mg·(cm2·d) -1,亦即953.296 mg药材/cm2/d,每组 6只兔,雌雄各3只。仅在第一天内给药3次(8点、14点、20点,每次间隔6 h),每次1.0 mL,给药面积为9 cm2。药物敷贴4 h后将贴敷处简单洗净,自然风干。其后连续观察14 d,期间观察和记录动物一般状况、死亡情况、体重和饲料消耗量,最后一天处死动物后测试血常规和血生化指标。
刺激性实验:采用同体对照法,共8只兔,雌雄各4只[18]。兔的背部右侧剃毛区给予纯净水0.5 mL,作为对照;背部左侧剃毛区给予宝根续筋药贴浸膏0.5 mL[剂量为67.5252 mg·(cm2·d) -1],相当于临床成人日用剂量的7.63倍,每侧给药面积为9 cm2;每天给予一次,连续10 d;每天观察并记录给药前、给药后1 h及末次给药后30 min、60 min、24 h、48 h、72 h和96 h皮肤的红斑及水肿、涂敷部位是否有皮肤异常情况。
皮肤过敏性实验:豚鼠30只,按性别、体重分层[18]后再随机分为3个组,即空白对照组、阳性对照药组和宝根续筋药贴浸膏组;每组10只动物,雌雄各5只。致敏接触阶段,在实验第0天、第7天和第14天时,将宝根续筋药贴浸膏0.2 mL(即27.0101 mg/cm2/次,亦即67.5252 mg药材/cm2/d,相当于成人临床日用剂量为8.8542 mg浸膏/cm2的3.05倍)均匀涂布于豚鼠背部已去毛背部左侧皮肤上,阳性对照药组使用1%的2,4-二硝基氯代苯溶液,给药体积为0.2 mL/次,给药面积为9 cm2,故给药剂量为0.2222 mg/cm2/次,空白对照组给予纯净水。激发接触阶段,第28天时将宝根续筋药贴浸膏0.2 mL分别均匀涂布于豚鼠背部已去毛右侧皮肤上一次,阳性对照药组使用0.1%的2,4-二硝基氯代苯的溶液,给药体积为0.2 mL/次,给药面积为9 cm2,故给药剂量为0.02222 mg/cm2/次,空白对照组给予纯净水。连续观察四天,记录各时间点时动物皮肤过敏反应程度,同时密切观察动物是否有全身性过敏反应出现。
1.6 统计学方法 计量资料的数据一般以平均值加减标准差(x±s)表示。组间差异的显著性检验运用SPSS 20.0 for windows软件提供的非参数检验或单因素方差分析方法。计数数据一般采用非参数检验进行组间的差异性比较。P<0.05为均数间的差异有统计学意义,P<0.01为均数间的差异有高度统计学意义。
2 结果
2.1 急性毒性
2.1.1 死亡情况、一般状况和尸检结果 空白对照组和宝根续筋药贴浸膏45.76倍临床剂量组共12只兔,死亡0只,给药时动物无异常;在给药后当天、第2天、第7天和第14天时,对各组兔进行一般观察,在给药后14 d的观察期内,两个组的外观体征和尸解情况均无异常。
2.1.2 体重及饲料消耗量 空白对照组和宝根续筋药贴浸膏45.76倍临床剂量组的雌、雄兔14d内体重均自然增加。宝根续筋药贴浸膏45.76倍临床剂量对兔体重及饲料消耗量没有明显的影响。详见表1、表2。
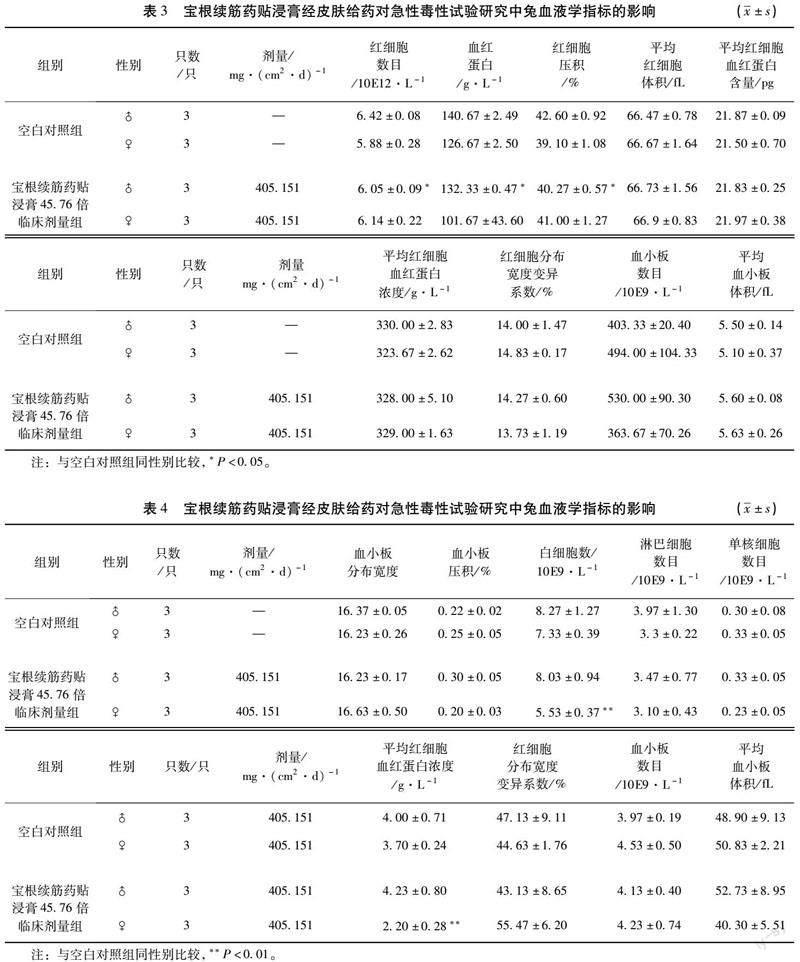
2.1.4 血液学指标 宝根续筋药贴浸膏使雄性兔给药后第14天的红细胞数目、血红蛋白和红细胞压积数量减少,雌性兔在给药后第14天的白细胞数和中性粒细胞数减少,其余各项血液学指标均无明显的变化。见表3和4。
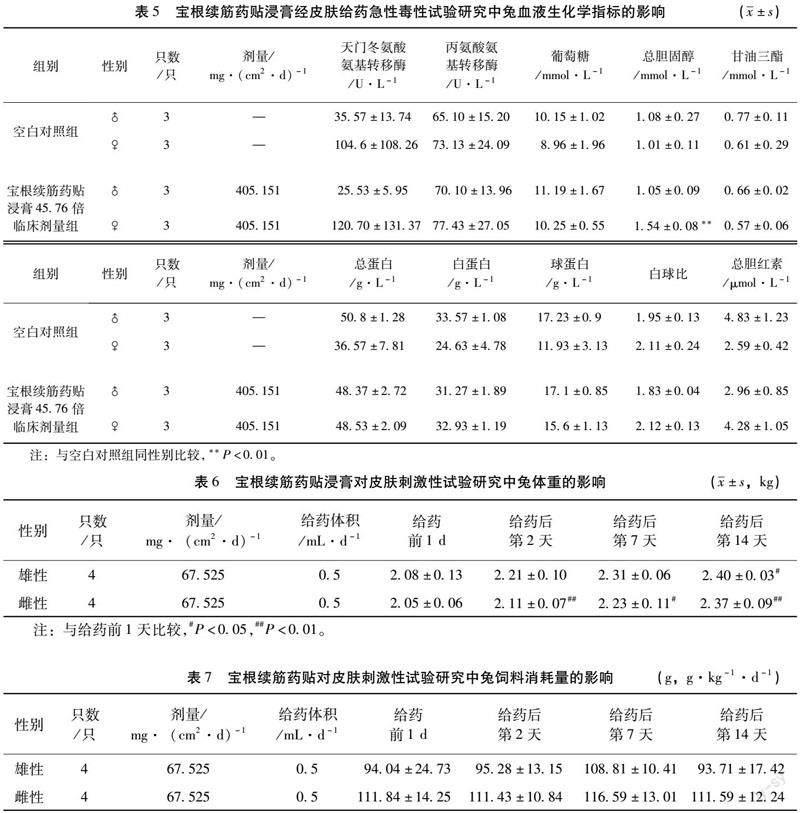
2.1.5 血液生化学指标 宝根续筋药贴浸膏使雌性兔在给药后第14天的总胆固醇含量升高,其余各项血液生化学指标均无明显的变化;此外,雄性兔的血液生化学指标均无明显的变化。见表5。
2.2 皮肤刺激性
2.2.1 死亡情况、一般状况和尸检结果 在给药前及首次给药后14 d期间,对每只动物进行一般状况观察,兔的外观体征均无异常及各种活动亦无异常。宝根续筋药贴浸膏皮肤刺激性研究中8只兔在给药前及首次给药后14 d期间均未见动物死亡;麻醉处死后解剖动物的各个脏器亦未见肉眼可见异常。
2.2.2 体重及饲料消耗量 雄8只兔在给药前及首次给药后14 d期间的体重均自然增加。见表6。雌雄8只兔在给药前及首次给药后14天期间的饲料消耗量大体上呈现先增加后减少的趋势,但均无明显的差异(P>0.05)。见表7。
2.2.3 皮肤刺激性结果 宝根续筋药贴浸膏连续给予兔背部皮肤10 d,8只动物均未见任何红斑、水肿等皮肤刺激性反应,涂敷部位皮肤异常,停药后观察4 d期间亦未见任何延迟性皮肤刺激性反应。
2.3 皮肤过敏性
2.3.1 体重及饲料消耗量 空白对照组、阳性对照组和宝根续筋药贴浸膏组的豚鼠32 d内体重均自然增加。见表8。宝根续筋药贴浸膏45.76倍临床剂量对豚鼠饲料消耗量没有明显的影响。见表9。
2.3.2 皮肤过敏性反应 空白对照组豚鼠的皮肤在“致敏接触阶段”和“激发接触阶段”时,没有红斑、水肿或全身过敏等过敏反应,故纯净水对豚鼠皮肤无致敏性。
阳性对照组(2,4-二硝基氯苯)豚鼠的皮肤实验前均正常。在“致敏接触阶段”, 实验第18~23天出现“可见红斑,轻度水肿,勉强可见”等中度致敏性;实验第24~27天出现“重度红斑;中度水肿,明显可见(边缘高出周围皮肤)”“紫红色红斑到轻度焦痂形成;严重水肿,皮肤隆起1 mm以上或有水泡、破溃”等中度致敏性。在“激发接触阶段”,激发性给药后第0.5小时出现“豚鼠呼吸加快,竖毛,活动增加”等中度致敏性,6 h及24 h后豚鼠给药部位皮肤出现“勉强可见的轻度红斑”等中度致敏性,48 h后豚鼠给药部位皮肤出现“明显可见的中度红斑和水肿”等中度致敏性,72 h后豚鼠给药部位皮肤的“红斑与水肿逐渐消失”等,96 h后豚鼠给药部位皮肤的“红斑与水肿基本消失,破溃处结痂”等。故2,4-二硝基氯苯对豚鼠皮肤有中度致敏性,主要表现为皮肤红斑、水肿和呼吸加快、竖毛、活动增加,呈现“致敏接触阶段由轻到重,随后激发接触阶段再逐步缓解”的“时-毒关系”。
宝根续筋药贴浸膏组豚鼠的皮肤在“致敏接觸阶段(28 d)”和“激发接触阶段(4 d)”时,没有红斑、水肿或全身过敏等过敏反应,故宝根续筋药贴浸膏对豚鼠皮肤无致敏性。
3 讨论
有研究者[21]认为,在外用实验中由于受给药部位的限制,不少中药外用制剂的量效关系并不明显;原则上动物实验外用剂量有一个与临床外用是等效剂量。针对皮肤用药的特点,经多次试验和分析认为,动物与人等面积用药量一致就是等效剂量,成人的给药剂量为“1.7 g浸膏除以192 cm2(12 cm×16 cm)”,即为0.0088542 g浸膏/cm2,亦即0.02083 g药材/cm2;参考上述文献中提出的“动物与人等面积用药量一致就是等效剂量”的理论,兔的等效剂量亦为8.8542 mg浸膏/cm2,亦即20.83 mg药材/cm2。在急性毒性中,对于给药面积没有选择文献中动物体表面积的10%(约为0.0150 m2)原因是面积过大可能引起动物着凉,进而导致动物死亡,且给药剂量以单位面积的载药量来计算,与剃毛面积大小无关,因此背部给药区域面积采用为9 cm2;对于兔皮肤的最大给药体积问题,由于一定面积的皮肤对药物吸收有限,超过一定限值后增加药物也无法明显增加吸收。根据前期预实验,1.0 mL的给药体积刚好能覆盖面积为9 cm2的兔背部皮肤,同时为满足急毒实验最大给药剂量的要求,一日给药三次,因此一日内的最大给药体积为3.0 mL·d-1。
宝根续筋药贴组方以接骨木、当归、续断、防风、白芷、红花、红毛五加皮、醋乳香和醋没药组成。《现代中药毒理学》[22]记载接骨木的药性为有小毒。但现代研究对于其外用的毒性研究较少,并未有研究证明接骨木外用有毒性,且在安全性评价实验中并没有发现接骨木急性毒性、刺激性以及过敏性。在兔急性毒性实验中,与空白对照组比较,虽然宝根续筋药贴浸膏45.76倍临床剂量组雄性兔的红细胞数目(6.05±0.09)、血红蛋白数目(132.33±0.47)以及红细胞压积(40.27±0.57)显著降低(P<0.05),雌性兔的白细胞数(5.53±0.37)及中性粒细胞数(2.20±0.28)十分显著降低(P<0.01),雌性兔的总胆固醇含量(1.54±0.08)十分显著的升高(P<0.01),但是均在临床参考的正常范围内(红细胞数5.00~7.60,血红蛋白数目105~170,红细胞压积31.0~46.0,白细胞数5.2~13.5,中性粒细胞数2.0~7.5),即上述变化虽有统计学意义,但不具有临床意义。因此,宝根续筋药贴临床上外用安全,但仍应当根据具体情况考虑进行血常规和血液生化学指标的监测。
新西兰大白兔背部完整皮肤在24 h内分3次接触宝根续筋药贴浸膏45.76倍临床剂量后,在14 d内未见明显的不良反应;该剂量为临床成人日用剂量的45.76倍,从而提示宝根续筋药贴浸膏的毒性低,经皮用药安全;对兔正常皮肤无刺激性,且未见任何延迟性反应,属于“无刺激性”范畴。外用于豚鼠后无皮肤致敏性,不导致皮肤红斑、水肿或全身过敏等过敏反应。总之,宝根续筋药贴外用安全。
参考文献
[1]国家药典委员会.中华人民共和国药典:一部[S].2020年版.北京:中国医药科技出版社,2020.
[2]李安林,熊双丽. 接骨木茎总黄酮的提取及DPPH自由基清除活性[J]. 中国食品添加剂,2010(5):113-116
[3]冯文娟,崔玮琪,徐泽平,等. 接骨木花青素的纯化工艺及清除DPPH自由基活性的研究[J]. 中国酿造,2017,36(11):134-137.
[4]XIAO H,SHAM T,CHAN C, et al. A Metabolomics Study on the Bone Protective Effects of a Lignan-Rich Fraction From Sambucus Williamsii Ramulus in Aged Rats[J].Frontiers in Pharmacology, 2018(9): 932.
[5]KE K,LI Q,YANG X, et al. Asperosaponin VI promotes bone marrow stromal cell osteogenic differentiation through the PI3K/AKT signaling pathway in an osteoporosis model[J].Scientific Reports, 2016(6): 35233.
[6]LEE J,HSIEH W,CHEN S, et al. Hematopoietic and myeloprotective activities of an acidic Angelica sinensis polysaccharide on human CD34+ stem cells[J].Journal of Ethnopharmacology, 2012(139):739-45.
[7]YUE S,XIN L,FAN Y, et al. Herb pair Danggui-Honghua: mechanisms underlying blood stasis syndrome by system pharmacology approach[J].Scientific Reports, 2017(7): 40318.
[8]陈永,李強,谭晓晶, 等. 红毛五加多糖的基本性质研究[J]. 天然产物研究与开发,2004(6):507-510.
[9]孔德云,金惠芳. 红毛五加化学成分研究[J]. 中国医药工业杂志,1990,23(6):235-237.
[10]赵余庆,袁昌鲁,杨志强. 红毛五加挥发性成分的研究[J]. 中药材,1992(4):28-31.
[11]颜鸣,刘玉兰,赵余庆. 红毛五加不同提取物的药理研究[J]. 沈阳药学院学报,1991(2):138-139.
[12]LEE Y,LEE J,NOH E, et al. Guggulsterone blocks IL-1beta-mediated inflammatory responses by suppressing NF-kappaB activation in fibroblast-like synoviocytes[J].Life Sciences, 2008(82): 1203-9.
[13]SONG J,KWON S,CHO C, et al. Guggulsterone suppresses LPS induced inflammation of human middle ear epithelial cells (HMEEC)[J].International Journal of Pediatric Otorhinolaryngology, 2010(74): 1384-1387.
[14]MAJEED M,MAJEED S,NARAYANAN N, et al. A pilot, randomized, double-blind, placebo-controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the management of osteoarthritis of the knee[J].Phytotherapy Research, 2019(33): 1457-1468.
[15]国家食品药品监督管理局.《医疗机构制剂注册管理办法》(征求意见稿, 2015年)[EB/OL]. [2015-01-26] https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjylqx/20150126123501296.html.
[16]国家食品药品监督管理局.药物研究技术指导原则(2005年)[M]. 中药、天然药物急性毒性研究技术指导原则.北京:中国医药科技出版社,2006:209-216.
[17]国家食品药品监督管理局.药物研究技术指导原则(2005年)[M].《中药、天然药物刺激性和溶血性研究技术指导原则》.北京:中国医药科技出版社,2006:227-242.
[18]国家食品药品监督管理局.药物研究技术指导原则(2005年)[M].《中药、天然药物免疫毒性(过敏性、光过敏反应)研究技术指导原则》.北京:中国医药科技出版社,2005:243-254.
[19]四川省食品药品监督管理局:《四川省医疗机构制剂研究技术指南(试行版)》(2014年)[EB/OL].[2014-05-26]http://yjj.sc.gov.cn/scyjj/gztz/2015/4/23/6119b3e87a214a3d939f1dad22a24db8.shtml.
[20]袁伯俊,廖明阳,李波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007: 200-211,236-238,238-241.
[21]苗明三,尹俊涛,缪君娴,等.中药外用药理实验存在问题及解决思路[J].时珍国医国药,2008,19(12):2945-2946.
[22]夏丽英.现代中药毒理学[M].天津:天津科技翻译出版公司,2005:299-300.
(收稿日期:2022-11-15 编辑:刘 斌)
基金项目:四川省应用基础研究计划项目(2019YJ0286):归芪健骨药贴治疗骨质疏松症的作用机制研究。
作者简介:梁艳(1998—),女,汉族,硕士研究生在读,研究方向为中药理论与应用研究。E-mail: 709489716@qq.com
通信作者:王张(1980—),男,汉族,博士,教授,研究方向为民族药药理学研究。 E-mail:wzcqcd@163.com
