暖地杓兰种子繁育与栽培研究*
2023-09-02华梅蒋宏周彬孔继君
华梅,蒋宏,周彬,孔继君
(1.云南省林业和草原科学院,云南 昆明 650201;2.国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室/云南省森林植物培育与开发利用重点实验室,云南 昆明 650201)
暖地杓兰[1-2](Cypripediumsubtropicum)是《野生动植物濒危物种国际贸易公约》附录I物种,被世界自然保护联盟(物种红色名录)列为极危(CR)物种,被《国家重点保护野生植物名录(2021版)》列为一级保护植物,被《云南省生物物种红色名录(2017版)》列为极危物种,被《中国生物多样性红色名录:高等植物版(2018版)》列为易危(VU)物种,在《全国极小种群野生植物拯救保护工程规划(2011—2015年)》中,暖地杓兰作为120种极小种群植物之一优先纳入了规划,实施保护。
暖地杓兰是杓兰属(Cypripedium)在亚洲唯一的亚热带种,国内目前有少量分布,活植株仅存不足300株。暖地杓兰为仅有的常绿叶多花杓兰,唇瓣独特,花色艳丽,具有非常高的观赏价值。遭受过度的商业化采集,加之原生境遭破坏和种群退化等原因,野外活体数量逐年锐减濒临灭绝,对暖地杓兰的保育工作迫在眉睫。人工繁育、引种回归、种群复壮、重建是兰科植物保育的有效措施[3-5]。
杓兰的繁殖主要以种子无菌(非共生)萌发为主[6-12],繁殖的关键在于种子的质量及成熟度。暖地杓兰的传粉昆虫为食蚜蝇(Scaevapyrastri),因原生环境因素传粉昆虫较少,自然结实率非常低,野外获取种子比较困难[3]。暖地杓兰种子像其他兰科植物一样,细小如尘,无胚乳,无法提供种子萌发所必需的养分。同时暖地杓兰种子内层种皮被压缩成薄薄的一层,紧紧地包裹着胚,而外层种皮逐渐拉长,成熟种子看起来像头发一样。木质化的内层和外层种皮导致种子休眠,种子萌发极其困难。采用非共生的萌发方法,以暖地杓兰成熟未开裂的果荚为试验材料,筛选适合的萌发、继代培养基及培养方法,筛选适合暖地杓兰幼苗栽培的基质及栽培方法,有望解决暖地杓兰繁殖中的种子萌发率低、继代褐化及死苗、无菌苗出瓶成活率低、环境适应性差、幼苗生长缓慢等问题,获得的大量种苗,为暖地杓兰的回归、保育及产业化开发利用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 暖地杓兰种子繁育材料
暖地杓兰种子繁育材料采用野外居群人工授粉后所结的成熟未裂开的果荚。
1.1.2 暖地杓兰种子非共生萌发培养基
暖地杓兰种子非共生萌发基础培养基 MS、1/2 MS、1/4MS、B5、VW、花宝1号、改良Norstog培养基。
改良Norstog培养基为在原Norstog1993培养[13]的基础上,大量元素:KH2PO4、KCl、MgSO4·7H2O、CaCl2·2H2O浓度减半,其他元素改用1 mg/L苹果酸、20 g/L蔗糖和7 g/L琼脂构成,具体的配方见表1。
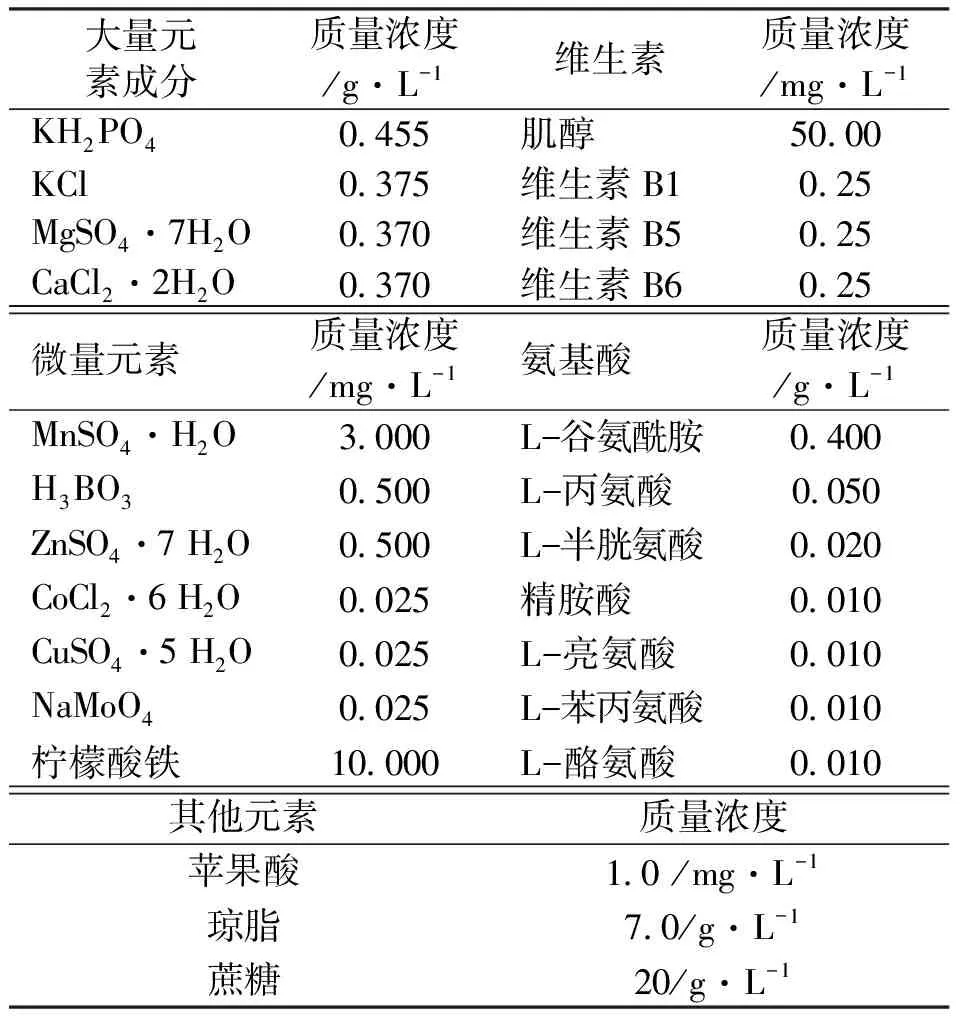
表1 改良Norstog培养基
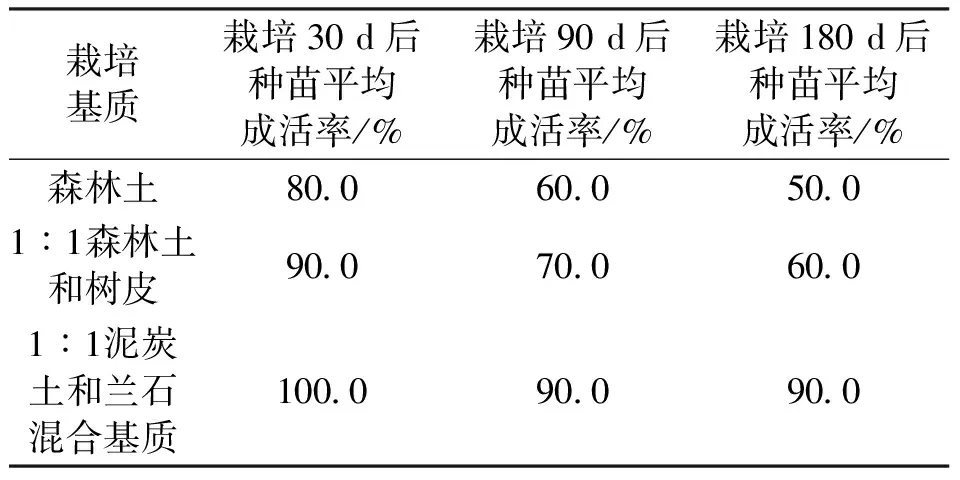
表2 3种栽培基质对暖地杓兰移栽成活率的影响
继代培养培养基 改良Norstog培养基的基础上,再添加20 g/L马铃薯匀浆构成。萌发培养基和继代培养基pH 值调节至5.7,然后经过高温高压灭菌。
1.2 实验方法
1.2.1 暖地杓兰人工授粉
选取云南马关野生居群暖地杓兰开花植株(七月初盛开)进行套袋并人工异花授粉,记录授粉时间。
授粉时间 授粉最佳时间为母本开花后3~4 d。父本取已充分成熟的花粉块,以提高坐果率。花粉块以松软膨胀、帽盖被稍顶起、边缘微显花粉为佳。一般选择在晴天1000—1600时进行,雨天或露水未干时不宜授粉。
授粉方法 授粉工具一般用尖嘴镊子,无镊子可用针或竹针。授粉时先用镊子自下往上挑开父本药帽,将花粉块移到干净纸片上,随手将选定的母本的柱蕊和唇瓣撑开,夹取花粉块放到柱头上让粘液粘住,然后把柱蕊和唇瓣恢复原状。
1.2.2 暖地杓兰果荚及种子采收
采集暖地杓兰人工异花授粉后105 d的果荚作为种子繁育的材料。
1.2.3 暖地杓兰果荚无菌处理
采集成熟未裂开的暖地杓兰果荚,将果荚进行清洗,在无菌环境下用大量无菌水冲洗,果荚表面用75%无水乙醇擦拭,后用10%的次氯酸钠溶液(内加一滴Tween 20)消毒10 min,再用1%升汞消毒5 min。表面灭菌后,将果荚切开,在无菌培养皿中用镊子取出种子[14]。
1.2.4 暖地杓兰种子繁育及培养基筛选
配制MS、1/2MS、1/4MS、B5、VW、花宝1号、改良Norstog培养基,用5 mol/L NaOH溶液来调节培养基的pH至5.7,在121 ℃高压灭菌20 min。将已消毒的暖地杓兰种子均匀的播撒到培养基表面,每瓶约100粒种子,将培养瓶在(25±1)℃和恒定黑暗的生长室中进行培养,种子膨胀胚突破种皮确认为种子萌发,萌发率的计算方法是将萌发的种子数除以种子总数并乘以100。根据种子的萌发情况及萌发率筛选出适合暖地杓兰种子萌发的培养基。
1.2.5 暖地杓兰继代培养
将已萌发并长到一定大小的暖地杓兰根茎苗转接到继代培养基中进行继代培养。
1.2.6 暖地杓兰种苗移植前处理
将可以出瓶的暖地杓兰无菌苗进行炼苗处理[15](将待出瓶无菌苗组培瓶放置于大棚中的阴凉位置处一周;后将瓶盖拧松,再放置一周;再将瓶盖拧开一半,再放置一周;最后将瓶盖全部拿开,放置一周;炼苗时将大棚温度控制在15~25 ℃,相对湿度70%~80%,光照强度为800~1 000 Lx),然后洗净根部培养基,将幼苗放在自封袋中(保湿)放入4 ℃冰箱进行春化,春化期间注意观察湿度及芽的情况,春天转暖时即可移栽。
1.2.7 暖地杓兰种苗移栽及不同栽培基质对移栽的影响
栽培基质分别选用森林土、1︰1森林土和树皮、1︰1泥炭土和兰石混合基质,基质用2 000倍的高锰酸钾溶液进行杀菌,筛选最适宜暖地杓兰栽培的基质。将经过春化的暖地杓兰小苗用2 000倍的农用硫酸链霉素浸泡30 min,然后晾干,进行栽培。将经过杀菌处理的暖地杓兰种苗种植于装有混合基质的陶盆中,每种基质种植5盆,每盆种10棵,将根埋住,芽点裸露在外面。栽培条件为棚内温度控制在15~25 ℃,相对湿度70%~80%,光照强度为800~1 000 Lx。
2 结果与分析
2.1 暖地杓兰人工授粉及果荚
采用异株异花授粉方式,对10株暖地杓兰进行人工授粉,每株异株异花授粉5个花朵,共授粉50朵花,授粉105 d后共采集到45个果荚,其中有5个果荚发育不完全枯死。暖地杓兰异株异花坐果率达90%,授粉前进行套袋处理,能显著提高果荚质量,果荚在野外被虫咬食的情况得到控制。

ab
2.2 暖地杓兰果荚消毒与播种处理
在无菌工作台中,用10%的次氯酸钠溶液消毒15 min,播种5 d后污染率为8%;采用1%升汞消毒15 min,播种5 d后污染率为5%;分别用10%的次氯酸钠溶液(内加一滴Tween 20)消毒10 min和1%升汞消毒5 min后,播种5 d后污染率为1%,见图2。

图2 暖地杓兰果荚无菌处理
2.3 暖地杓兰种子非共生萌发培养基确定
暖地杓兰种子在MS、1/2MS、1/4MS、B5、VW、花宝1号、改良 Norstog培养基中暗培养180~210 d,除了在改良 Norstog培养基中种子有萌发外,其余培养基中种子均没有萌发,最终确定暖地杓兰种子无菌萌发培养基为改良Norstog 培养基。暖地杓兰播种在改良Norstog培养基中4 个月后,种子开始陆续萌发,种子的萌发率为31.21%。在萌发培养基中添加8 μmol/L 6-(γ,γ-二甲基烯丙基氨基)嘌呤(2iP),能提高暖地杓兰种子的萌发率(38.74%)且原球茎未褐化,见图3。

ab
2.4 暖地杓兰继代培养次数
从播种后第6个月开始将发育中的幼苗转移到继代培养基中,培养 3个月后,幼苗体积增大,根系形成明显。之后再培养3个月,再进行2次继代培养,当根长到10 cm 左右,长出芽点时,即可出瓶移栽。继代培养过程中,暖地杓兰幼苗能根长大长粗并长出芽点,见图4。从图中可以看出,随着继代培养时间及次数的增加,暖地杓兰幼苗体积增大,根长长、长粗,长出芽点,两次继代培养后根长到10 cm左右,有2~3条根。

abc
2.5 不同栽培基质对暖地杓兰移栽成活率的影响
将根长10 cm左右,具2~3条根,并具芽点的暖地杓兰根茎苗进行炼苗,然后从培养瓶中拿出,洗净培养基后晾半干,放入塑料密封袋中放4 ℃冰箱中避光进行春化处理3~4个月(图5),春化后的根状苗拿出进行种植。在3种基质中,暖地杓兰幼苗都能成活。在森林土中栽培180 d后种苗平均成活率为50%;在1︰1森林土和树皮栽培180 d后种苗平均成活率为60%;最适宜暖地杓兰栽培的基质为1︰1泥炭土和兰石混合基质,在该基质中移栽180 d后暖地杓兰小苗平均成活率达90%。

图5 暖地杓兰根茎苗春化处理
2.6 暖地杓兰幼苗栽培
暖地杓兰幼苗移栽成活后,进行栽培管理。施肥:每盆施撒15 g缓释肥,每年春季、秋季各施撒一次。
(1)浇水 基质发白喷洒水,浇湿即可。
(2)病虫害 暖地杓兰幼苗常见的病害有蜗牛和地老虎,用四聚乙醛和氯氰菊酯进行杀虫。暖地杓兰移栽后的生长情况见图6。由图6可知,暖地杓兰幼苗移栽栽培120 d后,芽点进一步长大,并舒展长出叶片。
3 讨论与结论
3.1 讨论
杓兰的繁殖主要以种子无菌(非共生)萌发繁殖为主[6-12],影响兰科植物种子非共生萌发培养的主要因素包括种子成熟度,温度,光照,基本培养基的种类,植物激素(生长素类、细胞分裂素及其浓度配比),氮源,碳源(蔗糖、果糖、葡萄糖、海藻糖等),活性炭是否添加及其浓度,天然有机物提取物(土豆汁、香蕉汁、椰汁等)等。通过控制这些影响因素可以调节兰科植物种子的非共生萌发,使得兰科种子的萌发可能性更大、萌发速度更快、萌发率更高。同属不同种兰花,因生态分布不同、海拔、气候及土壤环境不同,会导致兰花的生存模式、植株及种子营养利用模式的不同,进而导致对营养贫富利用的各异。蒋宏等[8]在改良1/4MS培养基中对长瓣杓兰(Cypripediumlentiginosum)进行体外萌发繁育,最佳萌发率为54.1%。黄家林等[12]以授粉15周后的黄花杓兰(C.flavum)种子经0.5%NaClO溶液处理后在改良型Harvais培养基中培养20周后种子最高萌发率达到90%。同时以Harvais(Ha)为基本培养基对紫点杓兰(C.guttatum)成熟蒴果中的种子进行离体繁殖,成功地繁育出紫点杓兰植株[16]。邓莲等[17]以大花杓兰(C.macranthum)蒴果为研究材料,对大花杓兰种子进行非共生萌发研究,在VWD改良培养基上种子萌发最好,萌发率可达68.06%。培养基中加入1.2 mg/L的KT可以促进种子萌发并维持低褐化率。
暖地杓兰种子木质化的内层和外层种皮导致种子休眠,种子萌发极其困难,暖地杓兰的繁育研究鲜有报道。本研究采用非共生的萌发方法,以暖地杓兰成熟未开裂的果荚为试验材料,分别在MS、1/2MS、1/4MS、B5、VW、花宝1号、改良 Norstog培养基中进行非共生萌发暗培养180~210 d,结果显示:除了在改良Norstog培养基中种子有萌发外,其余培养基中种子均没有萌发,最终确定暖地杓兰种子无菌萌发培养基为改良Norstog培养基。虽然研究中暖地杓兰种子在筛选出的改良Norstog培养基中可以萌发成苗,但种子萌发率仅有30%,今后深入研究以提高改善暖地杓兰的种子萌发率,以期获得更多的种苗。
3.2 结论
暖地杓兰播种在改良Norstog 培养基中4 个月后,种子开始陆续萌发,种子的萌发率为31.21%。在萌发培养基中添加8 μmol/L 6-(γ,γ-二甲基烯丙基氨基)嘌呤(2iP),能提高暖地杓兰种子的萌发率(38.74%)且原球茎未褐化,最终能分化出根及芽。根茎苗出瓶春化栽培后能顺利舒展出叶片,长大的植株最终能否回归到原生境中,实现回归保育,缓解濒危状况仍需长期观察评估。
