拔节期不同程度渍水对小麦根系生长和籽粒产量的影响
2023-09-02王美玲蒋文月葛雨洋朱新开李春燕郭文善丁锦峰
王美玲,蒋文月,葛雨洋,朱新开,李春燕,朱 敏,郭文善,丁锦峰
(扬州大学,江苏省作物遗传生理国家重点实验室培育点,粮食作物现代产业技术协同创新中心,扬州大学 小麦研究中心,江苏 扬州 225009)
渍水胁迫是全球性的自然灾害,严重影响着小麦产量和品质形成。据统计,全球每年有100万~1 500万hm2小麦受到涝渍灾害影响,占种植面积的15%~20%,造成20%~50%的产量损失[1]。长江中下游平原是我国小麦主产区之一,每年播种面积约400万hm2,总产约占全国的22%[2]。该区多采用水稻-小麦两熟种植制度,因稻田浸水时间长,土壤黏重、通透性差,再加上小麦季局部时段降水偏多,常超过小麦正常需水量,是小麦渍害频发区域[3]。因此,系统深入地研究小麦渍害发生特点及其影响产量形成机制,可为长江中下游地区小麦产量潜力提升和产业稳定发展提供重要支撑。
前人研究表明,小麦在生殖生长时期对生长环境的水分敏感,土壤水分过多,会限制小麦根系对水分及矿物质的吸收,加速小麦的衰老和死亡[4]。根系对渍水胁迫的响应早于地上部,表现为种子根死亡,次生根长度、根体积和根干质量减少[5-6],严重渍水还会导致根尖失活[7]。渍水胁迫同样抑制了地上部生长,表现为叶面积减小、叶绿素含量降低、干物质量减少,籽粒产量下降[8]。渍水对小麦生长生理和产量形成的影响因发生时期、持续时长、严重程度等存在较大差异。Ding等[9]报道,拔节期是长江中下游麦区渍水胁迫影响产量形成的关键时期。刘杨等[10]研究发现,在孕穗期和灌浆期渍害胁迫5~15 d,小麦减产分别可达6%~77%,7%~56%。Araki等[5]研究表明,拔节期和开花期渍水胁迫均会导致产量大幅降低,且开花期的影响更大。然而,de San Celedonio等[6]通过对小麦出苗—开花连续4个时期渍水长期处理,研究认为,苗期渍水导致地上部生物量减少最多。在渍水持续时间对小麦影响方面,马尚宇等[11]研究表明,花后渍水3 d对小麦根冠生长和产量无显著影响,渍水6,9 d会造成显著减产。丁富功等[12]研究表明,短期渍害胁迫,有效穗数、穗粒数和千粒质量等指标均有小幅度升高现象。Malik等[13]研究表明,随着渍水深度的增加,根系的生长受抑制加剧。
综上所述,渍水胁迫的发生特点可能在不同生态和生产条件下存在差异。本研究采用长江中下游麦区大面积种植的小麦品种扬麦25和宁麦13为试验材料,在该区渍害频发的拔节期设置渍水持续时间和不同水层处理,研究不同土层根系干质量、地上部生长、产量构成因素改变及其与籽粒产量关系,以期为小麦抗逆高产栽培提供支撑。
1 材料和方法
1.1 供试材料和生长环境
试验于2020—2021年在扬州大学农学院玻璃温室进行,以小麦品种扬麦25(YM25)和宁麦13(NM13)为试验材料。盆栽土壤取自试验大田表土,土质为沙壤土,含有机质22.3 g/kg、碱解氮118.65 mg/kg、速效磷63.72 mg/kg、速效钾123.75 mg/kg,pH值7.26。
采用自制的长1.2 m、直径16 cm聚氯乙烯柱形盆钵进行种植。盆钵底部装有4个5 mm直径排水孔的底座,以便摆放和控水。土壤自然风干后过8 mm筛网。盆钵内底部先铺一层3 kg石子,便于排水,再套入底部开孔的长筒塑料袋。于袋内装预先过筛细土20.8 kg,再装入5.2 kg拌入肥料的土壤。肥料根据大田生产,按照土壤质量折算用量,具体为尿素(含46% N)0.36 g和复合肥(含15%N、15%P2O5、15%K2O)3.24 g。为使土壤沉实,每盆等量浇水,采用称质量法每日监测土壤相对含水量,待土壤水分降至75%左右时播种。2020年11月12日,将精选的4粒种子均匀放置于土壤表面,覆土0.52 kg。于三叶期,留取生长一致的幼苗2株。拔节期每盆追施溶于水的0.18 g尿素。杂草通过人工拔除,如遇病虫及时进行药剂控制。
1.2 试验处理
试验采用两因素裂区设计,以品种为主区,水分处理为裂区。拔节期追肥后第7天开始水分处理,包括:保持3 d土表以下10 cm水层的短期轻度渍水(SL)、保持3 d土表以上2 cm水层的短期重度渍水(SS)、保持12 d土表以下10 cm水层的长期轻度渍水(LL)和保持12 d土表以上2 cm水层的长期重度渍水(LS),以保持土壤相对含水量70%~75%为对照处理(CK),每组处理15盆。
所有盆钵全生育期放置于高透光玻璃温室内,以便精准控水。水分处理开始时,将盆钵搬入2个长2 m、宽1.2 m、深1.2 m的水池,一个水池放置轻度渍水处理的盆钵,另一个水池放置重度渍水处理的盆钵。用水管往水池中注水,使轻度渍水的水池水面保持在土表以下10 cm,重度渍水的水池水面保持在土表以上2 cm水层,处理期间每隔12 h检查水位,及时加水。对照处理采用称质量法每日监测土壤相对含水量,及时浇水。水分处理结束后,将渍水处理的盆钵及时从水池中取出,自然排水落干。除渍水处理期间,所有盆钵通过称质量法进行全生育期控水,保持土壤相对含水量在70%~75%。
1.3 测定项目及方法
1.3.1 根系干质量和根质量密度 于开花期和成熟期,取各个处理植株3盆。将盆钵内塑料袋抽出,由土表开始每20 cm切层,形成0~20 cm,20~40 cm,40~60 cm,60~80 cm,80~100 cm土柱。将每层土柱置于孔径0.4 mm筛网中,先用流水清洗,然后用农用压缩喷雾器将根冲洗干净。根系于105 ℃杀青30 min后70 ℃烘干至恒质量后测定干质量,每层根系干质量之和即为根系总质量,根质量密度按每层根质量(g)与土柱体积(cm3)之比计算。
1.3.2 地上部干质量 同步于根系取样,于开花期和成熟期,取各个处理植株3盆。首先记录每株有效分蘖数,再将植株分为有效分蘖的绿叶、黄叶、茎、穗(成熟期进一步分为籽粒、颖壳和穗轴)。样品105 ℃杀青30 min后70 ℃烘干至恒质量进行称量。根冠比为根系总干质量与地上部总干质量之比。
1.3.3 根系活力 于开花期和乳熟期,取各个处理植株3盆。将盆钵内塑料袋抽出,由土表每20 cm切层,形成0~20 cm,20~40 cm,40~60 cm土柱(60~100 cm根系生物量少,不满足测定要求)。将每层土柱置于孔径0.4 mm筛网中,先用流水清洗,然后用农用压缩喷雾器将根冲洗干净,最后用吸水纸擦干。取鲜样用ɑ-萘胺氧化法进行测定[14]。
α-萘胺的生物氧化量计算公式为:Y=(A-B-C)×D/(t×W),其中A为酶促反应前α-萘胺的起始浓度;B为酶促反应后α-萘胺的浓度,C为空白试验时α-萘胺减少的浓度,D为稀释倍数,t为酶促反应时间,W为样品鲜质量。
1.3.4 地上部绿叶面积和叶绿素含量 于渍水处理开始,标记各个处理下的植株各3盆中的有效分蘖6个,于乳熟期破坏性取样时,分别使用便携式叶面积测定仪和SPAD叶绿素仪测定单茎倒三叶、倒二叶和剑叶的绿叶面积和SPAD值。
1.3.5 籽粒产量及其构成 于成熟期,取每处理植株4盆,记录盆穗数后分别脱粒,计数总结实粒数,算出穗粒数。采用近红外分析仪(Infratec 1241,Foss,Denmark)测定籽粒含水率,折算为13%含水率的粒质量和籽粒产量。
1.4 数据分析
用IBMSPSSStatistics 25.0进行方差分析,各渍水处理之间用LSD法(P<0.05)进行两因素差异显著性检验,采用Microsoft Excel 2016软件整理试验数据、制表和绘图。
2 结果与分析
2.1 拔节期不同程度渍水对籽粒产量及其构成的影响
由表1可知,扬麦25籽粒产量显著高于宁麦13,渍水胁迫后两品种产量降幅分别为13.44%~35.47%,17.67%~37.26%。品种间盆穗数和穗粒数差异不显著,千粒质量以扬麦25显著较高。水分处理极显著影响盆穗数、穗粒数、千粒质量和籽粒产量,影响程度因渍水程度而异。扬麦25籽粒产量表现为:CK>SL、SS>LL、LS,其中CK显著最高,SL与SS间差异不显著(减产13.44%和20.08%),均显著高于LL和LS(减产30.43%和35.47%),LL与LS间差异不显著;宁麦13籽粒产量表现为:CK显著最高,SL和SS(17.67%和22.45%)高于LL和LS(减产28.76%和37.26%)。LL和LS盆穗数少于SL和SS,较CK差异均不显著;但单穗产量均显著下降,表现为SL与SS间差异不显著,均显著高于LS;扬麦25穗粒数均显著减少,表现为SL与SS间差异不显著,显著高于LL和LS;宁麦13穗粒数表现为LS显著最低,SS和LL少于CK和SL。综上所述,拔节期渍水导致单穗产量尤其穗粒数下降是减产的主因;渍水12 d较3 d会加剧减产幅度,但土面10 cm下渍水较土表渍水仅轻微减轻产量损失。

表1 拔节期不同程度渍水对籽粒产量及其构成的影响
2.2 拔节期不同程度渍水对根冠干质量的影响
由表2可知,扬麦25开花期和成熟期根系和地上部干质量均显著高于宁麦13(其中开花期LL处理下低于宁麦13,LS处理下两品种差异不显著),两品种间开花期根冠比差异未达显著水平,但成熟期扬麦25显著较高。渍水处理影响了开花期和成熟期根系和地上部干物质积累量和根冠比,影响程度因品种和渍水程度而异。扬麦25开花期根和地上部干质量表现为:CK>SS>SL>LL>LS,其中根干质量在处理间差异显著,地上部干质量在SL与SS间差异不显著,其他处理间差异显著;宁麦13表现为:CK>SL、LL、SS>LS,其中CK显著最高,LS显著最低。扬麦25根冠比在CK、SL和SS间差异不显著,均显著高于LL和LS,而宁麦13以CK显著最高,LS显著最低,其他处理间差异不显著。成熟期两品种根干质量均表现为CK>SL>SS、LL>LS,其中SS与LL间差异不显著,其他处理间差异均达显著水平;扬麦25地上部干质量表现为CK>SL>SS、LL、LS,其中SS、LL与LS间差异不显著;宁麦13地上部干质量表现为CK>SL>SS>LL、LS,其中LL与LS间差异不显著;两品种根冠比均以CK显著最高,LS显著最低。综上所述,渍水胁迫会显著抑制根冠生长,短期渍水胁迫轻于长期渍水;土表渍水较土面下渍水会加剧抑制根系生长,导致根冠生长失衡。
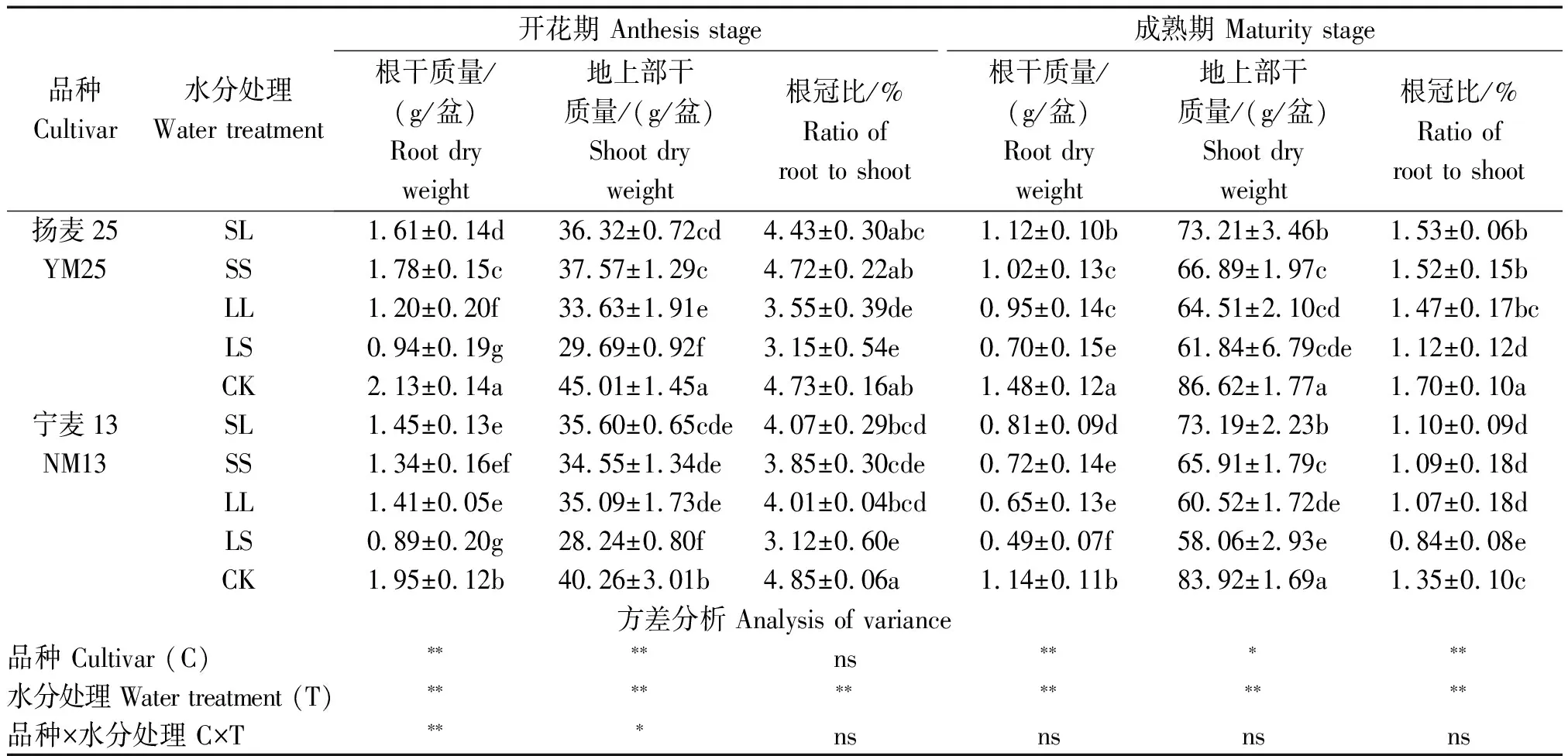
表2 拔节期不同程度渍水对根冠干质量的影响
2.3 拔节期不同程度渍水对不同土层根质量密度的影响
由图1可知,扬麦25在0~20 cm,20~40 cm,40~60 cm,60~80 cm土层(除开花期20~40 cm土层外)开花期和成熟期根质量密度均显著高于宁麦13,其中开花期LL处理下显著低于宁麦13,LS处理下两品种差异不显著,两品种间80~100 cm根质量密度差异不显著。两品种开花期和成熟期根质量密度在不同土层下受水分处理影响显著。开花期0~20 cm根质量密度在品种与水分处理间存在显著的互作效应,扬麦25表现为CK、SS、SL间差异不显著,均显著高于LL,LS显著最低;宁麦13表现为CK>SL、LL、SS>LS,CK显著最高,LS显著最低。20~40 cm土层中,扬麦25开花期根质量密度表现为CK、SS和SL高于LL和LS,LL和LS间差异不显著;宁麦13开花期根质量密度表现为CK最高,LS最低,其余处理间差异不显著。40~80 cm土层中,两品种开花期根质量密度表现为CK显著最高,其他处理间差异较小;80~100 cm土层以CK显著最高,其他水分处理间差异不显著。扬麦25的40~60 cm,80~100 cm土层和宁麦13的0~20 cm土层成熟期根质量密度表现为CK>SL、SS、LL>LS,CK显著最高,LS显著最低;扬麦25的0~20 cm土层表现为CK和SL高于SS和LL,LS显著最低;扬麦25的20~40 cm土层表现为CK>SL>SS、LL、LS,其中CK显著最高,SS、LL、LS间差异较小;扬麦25的60~80 cm土层和宁麦13的20~80 cm土层表现为CK显著最高,其他处理间差异较小;宁麦13的80~100 cm土层成熟期根质量密度表现为CK>SL>SS、LL>LS,SS与LL间差异不显著。综上所述,扬麦25表层根系对短期轻度渍水有较好的耐受性;渍水对根系生长的抑制随胁迫时间和程度加剧。
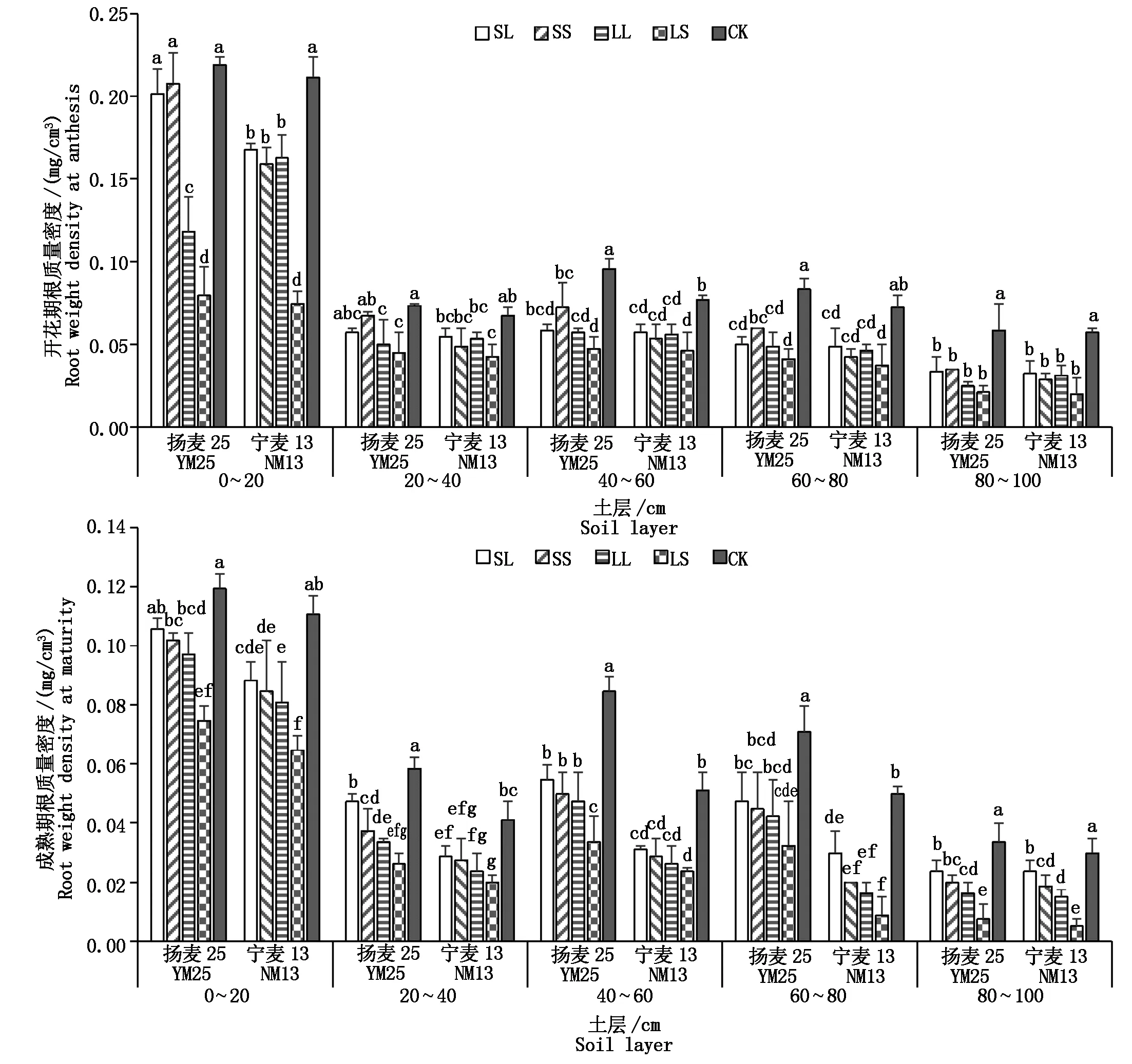
不同小写字母表示处理间差异显著(P<0.05)。图2同。
2.4 拔节期不同程度渍水对根系活力的影响
由图2可知,扬麦25开花期0~20 cm土层根系活力显著高于宁麦13;两品种间开花期20~40 cm,40~60 cm土层和乳熟期各土层根系活力差异均不显著。水分处理可显著影响开花期和乳熟期根系活力。两品种0~20 cm土层开花期根系活力均以CK最高,显著高于LL和LS,其中LS显著最低;20~40 cm和40~60 cm土层中,扬麦25表现为CK显著最高,SL和SS间差异较小;宁麦13表现为CK和SL高于SS和LL,LS显著最低。0~20 cm土层乳熟期根系活力在CK、SL、SS与LL间差异较小,LS低于其他处理;20~40 cm土层表现为CK与SL间差异不显著,均显著高于SS、LL和LS;40~60 cm土层表现为CK与SL间差异不显著,其他处理间差异较小。表明,短期轻度渍水胁迫后表层根系仍可维持较高的活力,且深层根系活力可恢复,但长期和/或重度渍水根系活力难以恢复。

图2 拔节期不同程度渍水下小麦分层根系活力的变化
2.5 拔节期不同程度渍水对绿叶面积和SPAD值的影响
由表3可知,乳熟期旗叶、倒二叶和倒三叶绿叶面积和SPAD值在扬麦25与宁麦13间差异均不显著,受水分处理影响极显著,在品种与水分处理间互作效应不显著。相比CK处理,两品种各水分处理下旗叶和倒二叶绿叶面积分别平均下降5.5%和5.4%,7.8%和11.2%,旗叶SPAD值下降3.0%和1.5%,各水分处理间差异较小;两品种SL和SS处理下倒三叶绿叶面积分别平均下降12.2%和15.2%,SPAD值下降3.7%和4.8%,两处理间差异较小,而LL和LS处理下分别平均下降27.8%和8.6%,25.1%和8.5%;两品种SL、SS和LL处理下倒二叶绿叶面积和SPAD值分别平均下降1.7%和1.1%,8.0%和0.8%,处理间差异较小,而LS处理下分别平均下降16.5%和5.6%,20.8%和5.1%。表明,短期渍水仅轻微降低花后光合面积和光合能力,长期渍水会导致上三叶早衰。

表3 拔节期不同程度渍水对上三叶绿叶面积和SPAD值的影响
3 结论与讨论
黄宁等[15]认为,长江中下游地区小麦高产的主要原因是高的收获指数和千粒质量。周袁慧等[16]认为,高产品种地上部干物质积累量要显著高于低产品种,且花后干物质对产量的贡献率更高。另有前人研究认为,高根冠比和根系活力是植株衰老慢、光合物质生产量多的重要保证,也是增加粒质量的重要原因[17];金立桥等[18]认为,高产小麦能够保持更高的叶绿素含量及最大光合速率,延缓后期叶片衰老速率,从而提高籽粒灌浆能力,最终提高了千粒质量和穗粒数。本研究结果显示,扬麦25籽粒产量显著高于宁麦13,主要依赖于显著高的千粒质量。扬麦25具有较高的花后根系和地上部干质量以及成熟期根冠比,其较大的根系主要表现在上层根系干质量高,且浅层根系活力高。
Marti等[19]研究认为,渍水导致籽粒产量损失与胁迫时间呈正比,渍水胁迫期间和之后的植株生长取决于土壤中水的深度。本研究表明,拔节期渍水3~12 d导致籽粒产量显著下降13.44%~37.26%,渍水12 d较3 d会加剧减产幅度,但土面10 cm下渍水较土表渍水仅轻微减轻产量损失。前人研究表明,分蘖期、拔节期等生育前期的渍水胁迫处理对小麦穗数影响较为显著[9];孕穗期是小麦渍害临界期,该时期渍水可使小麦的小穗数和小花数锐减,单穗的结实籽粒数目和粒质量降低,使小麦籽粒产量严重下降[20]。本研究结果表明,拔节期渍水显著降低穗粒数和单穗产量,但长期且重度渍水胁迫亦减少了穗数。前人研究表明,渍水胁迫减少地上部和根系生物量,对根系的影响重于地上部,导致根冠生长失调,且渍水时间越长,根冠比下降越严重[6,21-22]。可能的解释是渍水胁迫下根系的生长速率慢于地上部[13]。马尚宇等[23]研究认为,花后渍水3 d对根系平均直径、总根体积、总根长和根干质量等无显著影响,渍水6,9 d后,灌浆中后期各指标均显著下降,导致最终千粒质量和产量显著降低。与前人研究结果相似,本研究显示,拔节期渍水会显著降低开花期和成熟期根系和地上部干质量以及根冠比。短期渍水仅轻度抑制根冠生长量,而长期尤其重度渍水才会严重抑制根系生长,导致根冠生长失衡。进一步分析表明,不同土层根系生长受渍水抑制程度有所差异,浅层根质量密度轻度减少,而60~100 cm土层根质量密度无论胁迫程度均显著下降。Malik等[13]发现,渍水会刺激新的不定根形成,但主要在浅土层中。前人研究结果指示,渍水胁迫时间延长会加剧根系活力下降程度[7]。本研究还表明,拔节期短期轻度渍水对0~60 cm土层根系活力影响较轻,且渍水处理后能够恢复,但重度渍水后根系活力难以恢复。
马富举等[24]研究结果显示,拔节期水分亏缺会减小小麦开花期的净光合速率和叶面积指数。丁富功等[12]研究表明,孕穗期渍害胁迫会导致叶绿素含量的降低,且随着渍害胁迫时长和叶位的降低,SPAD值降幅增大。本研究结果表明,长期渍水会显著降低花后上三叶的绿叶面积和SPAD值,短期渍水则表现轻微,此外倒三叶对渍水胁迫时长和程度响应更为敏感。暗示了下位叶绿色面积和深浅作为渍水胁迫伤害程度的可能指示作用。综上所述,拔节期渍水胁迫会抑制根系尤其是土壤下层根系生长,引起冠层下层叶片早衰和光合能力降低,进而造成光合产物供应不足,减少结实粒数、粒质量和籽粒产量,且随着渍水程度的增加,根系受害愈加严重,导致根冠生长失调、产量损失扩大。因此,渍水发生后应尽快排水并降低水位,有助于表层根系维持生长生理活性,降低叶片早衰风险。本盆钵试验一定程度上限制了小麦根系的生长空间,且仅设置了2个渍水时长和水层深度,未来需深化研究缓解渍害的水分管理技术与机制。
