非定向激活沉默基因簇挖掘链霉菌活性次级代谢产物研究进展
2023-09-02宋国栋廖宏娟张志斌
宋国栋,廖宏娟,张志斌,朱 笃,2*
1江西师范大学生命科学学院 江西省亚热带植物资源保护与利用重点实验室,南昌 330022;2江西科技师范大学生命科学学院 江西省生物加工过程重点实验室,南昌 330013
微生物次级代谢产物是一类结构多样、功能复杂且具备特殊生物活性的物质,在药物研究与开发领域占据着重要的地位。截至目前,从微生物中鉴定出大约30万种化合物,有超过60 %的抗生素来源于链霉菌。然而,随着大量次级代谢产物的分离,从链霉菌中发现具有显著生物活性且结构新颖抗生素的概率越来越低[1-3]。近些年,随着基因组测序技术在微生物测序方面的广泛应用,大量的链霉菌基因组信息被公开[4]。通过对链霉菌基因组数据进行生物信息学分析,发现其中仍有一大部分的基因处于沉默状态,这表明还有大量潜在的次级代谢产物尚未被发现[5]。受限于常规培养条件,链霉菌生物合成基因簇未能有效激活,因而其独特的代谢产物途径往往表达较少或不表达。因此,通过激活链霉菌沉默基因簇以挖掘新型活性次级代谢产物具有重要意义。
为了激活链霉菌沉默基因表达,以发现更多活性次级代谢产物,迄今已有多种激活沉默基因簇的方法得到开发和应用[6,7]。常用的策略可分为两大类:一类是非定向激活策略,即通过改变培养基的组成(碳源、氮源、微量元素、化学激发子)[8,9]、菌株的生长环境(温度、pH、曝气、容器类型)[6]或微生物共培养[10]等方式,诱导链霉菌产生不同的代谢产物;另一类是定向激活策略,即通过基因编辑技术(CRISPR-Cas9)[11]、靶向激活特定基因簇(启动子工程、途径特异性调控因子激活、异源表达)等手段[12,13],使链霉菌沉默基因得以表达。相较于定向激活策略,非定向激活策略不需要建立目标菌株的遗传操作体系,因此具有操作简单、可同时激活多个生物合成基因簇(而不是某一特定的生物合成基因簇)等优点,其应用更为广泛。本文简要综述了改变培养基组成或培养条件激活策略、共培养策略、添加化学激发子及全局性调控等非定向激活链霉菌沉默基因的策略(见图1),并描述了这一领域所面临的问题和未来的发展前景。

图1 非定向策略激活沉默基因Fig.1 No-target strategies for activating silent genes clusters
1 改变培养基组成或培养条件的激活策略
1.1 改变培养基的组成
培养基组成(即碳源、氮源、无机盐等)对次级代谢产物的影响非常复杂,且对不同微生物产生相当明显的差异[14]。大量的研究表明,营养组成的变化可激发链霉菌产生各种新型化合物[15](见图2、表1)。

表1 改变培养基组成、培养条件发现新的活性代谢产物Table 1 Change of medium composition,culture conditions to discover new active metabolites
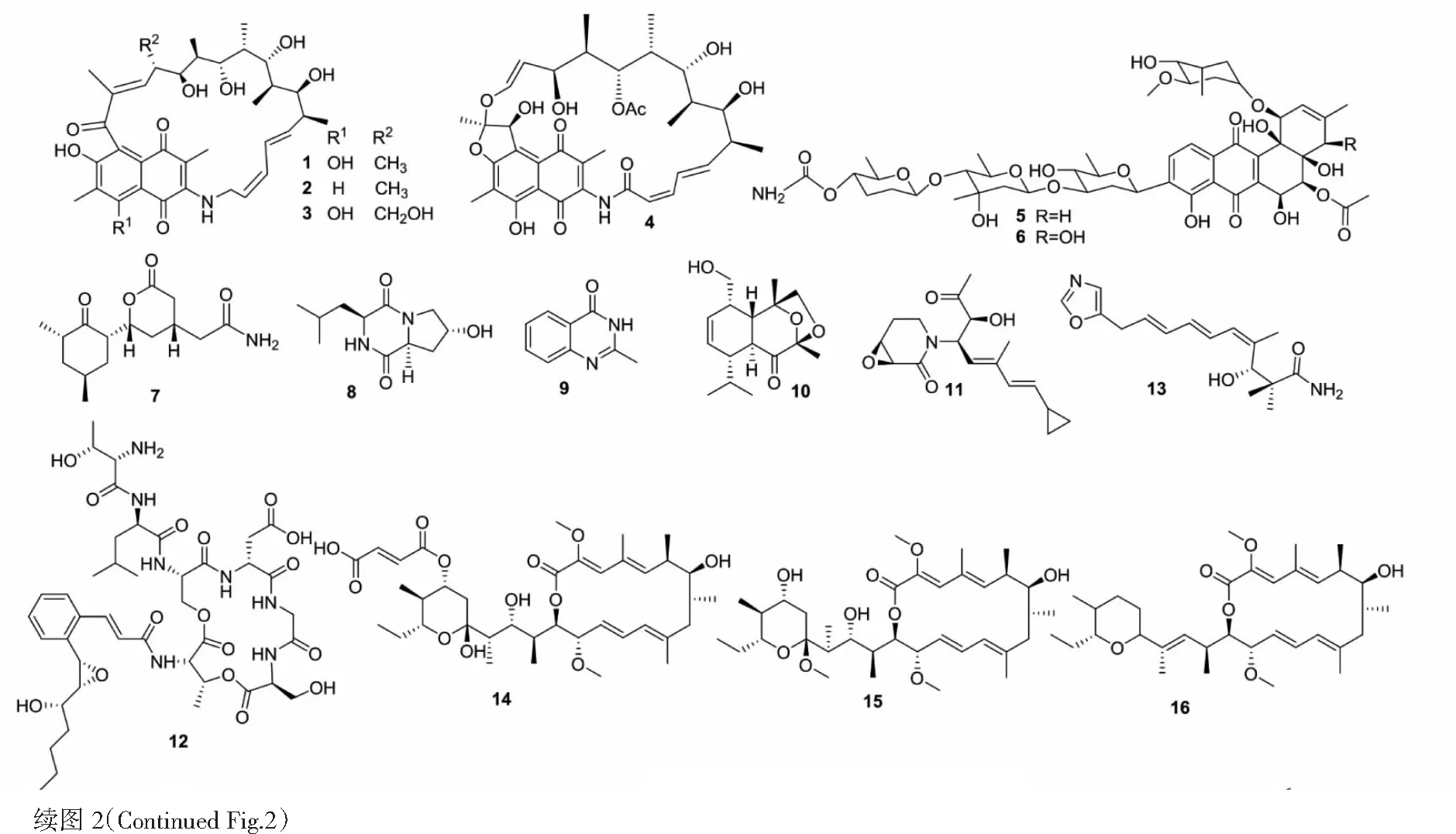
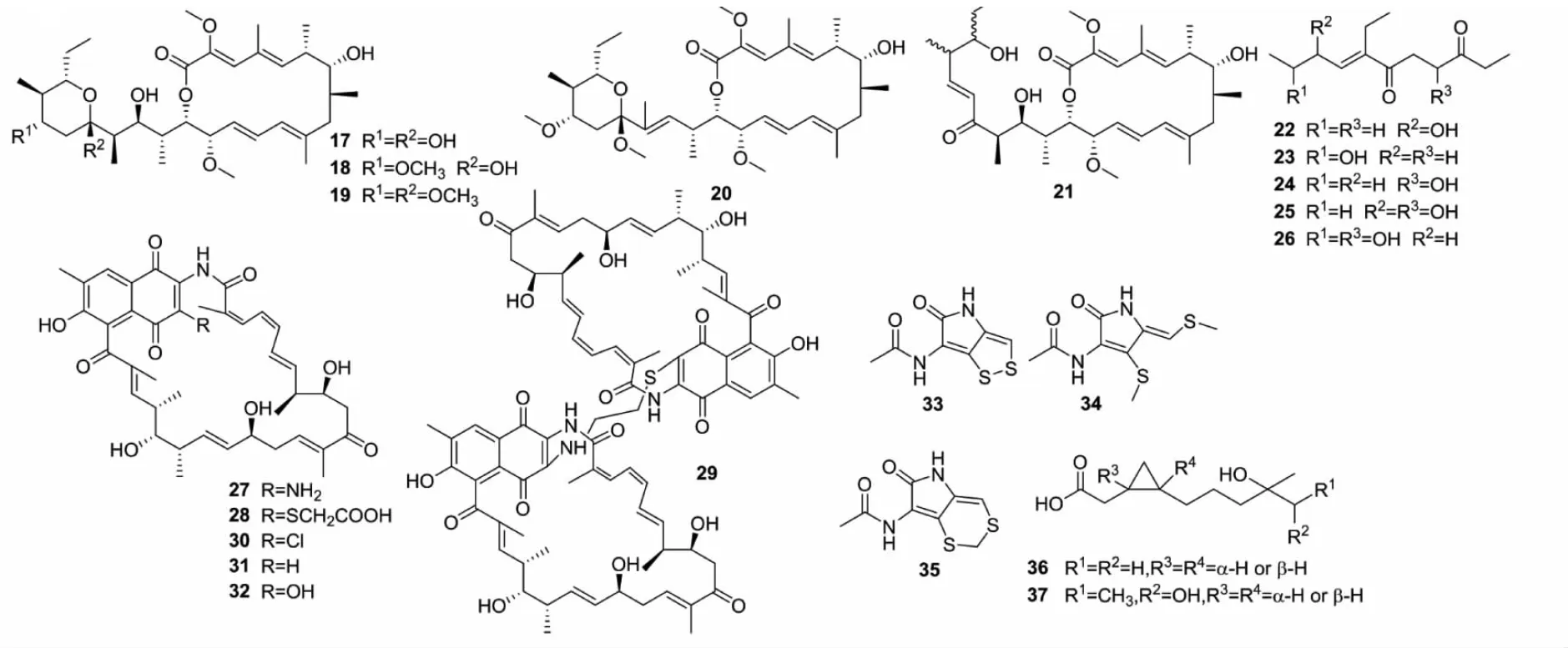
图2 化合物1~37结构Fig.2 Structures of compounds 1-37
1.1.1 碳氮源
Martin等[16]描述了碳氮源种类及碳氮比对次级代谢产物的影响。葡萄糖是一种优质的生长碳源,但是浓度过高时会干扰次级代谢产物的形成,这已经被Romero-Rodriguez等[17]所验证。Gullon等[18]观察到当葡萄糖作为碳源,可以通过抑制S.lividans中afsMRNA(编码一个参与刺激次级代谢产物生物合成的全局性调控基因)的表达,从而抑制放线菌紫红素(actinorhodin)的产生;当葡萄糖用甘油替代时,则没有观察到这种抑制作用。同样地,Rateb等[19]将ISP2培养基中的葡萄糖换成甘油用于培养Streptomycessp.C34,并从该菌分离到4个新的聚酮类化合物chaxamycins A~D(1~4)。Sujatha等[20]比较了葡萄糖、乳糖、果糖、甘油等14种碳源对海洋链霉菌Streptomycessp.BT-408生产聚酮类抗生素产量的影响,结果发现该菌以葡萄糖为碳源时产量最高,其次是果糖。
氮是蛋白质和核酸的重要组成之一,不同的氮源会对细菌生长和次级代谢产物的合成有一定的影响[21]。链霉菌中低浓度的氮源有利于次级代谢产物的合成已被广泛证明[14]。Sujatha等[20]比较了6种无机氮源和13种氨基酸(作为唯一氮源)对Streptomycessp.BT-408生产聚酮类抗生素的影响,结果表明硝酸铵为氮源时抗生素产量最高。N-乙酰葡糖胺(N-acetylglucosamine,GlcNAc)是细菌肽聚糖的一部分,它是一种优质的碳氮源。Rigali等[22]研究了GlcNAc对S.griseus(链霉素的生产者)形态分化与次级代谢产物产生的影响。结果表明,添加较多的GlcNAc,S.griseus的形态分化和抗生素的生产都被抑制,而添加较少的GlcNAc则得到相反的效果。同时,Wezel等[23]发现,较少的GlcNAc有利于S.cescoloniesA3中抗生素的生成,而较多的GlcNAc则呈现抑制作用。此后证明,这种现象在链霉菌中普遍存在,称为氮抑制。这种机制不仅会影响初级氮代谢,还会影响到次级代谢产物的生物合成。
总之,碳氮源种类和浓度对链霉菌的生长发育以及次级代谢产物的合成都有重要影响,且这一过程要受到严格的基因调控。碳源选择的这一过程被称为碳分解代谢物阻遏效应(carbon catabolite repression,CCR),与其它革兰氏阳性菌不同,链霉菌中的CCR不受磷酸烯醇丙酮-磷酸转移酶系统(phosphoenolpyruvate-phosphotransferase system,PTS)的控制,而是通过质子转运体运输葡萄糖[24],同时被葡萄糖激酶(glucokinase,Glk)磷酸化,目前已证明了Glk在CCR这一过程中的关键作用[25],被称为Glk依赖机制,此外葡萄糖依赖机制也被认为在CCR中发挥着重要作用[25]。与Glk相似,在氮代谢中,GlnR(一种全局性调控因子)在双组分系统(two-component system,TCS)中发挥着重要的作用[26]。
1.1.2 微量元素
营养元素尤其是微量元素对微生物次级代谢产物的合成和积累有重要作用。微量元素可作为次级代谢产物的组成元素,也可对次级代谢产物合成酶的活性有激活或抑制作用。
磷是细胞生长过程中的中重要元素,参与遗传物质合成、能量代谢、信号转导、维持膜完整性等多个至关重要的过程,并通过磷酸化发挥重要的信号传导作用[27]。近些年,磷酸盐对次级代谢产物的分子机制已被阐明,即PhoR-PhoP(又称Pho规则)双分子系统[27]。已有无机磷酸盐对链霉菌生理和抗生素产量影响的报道,高浓度磷酸盐(≥10 mmol/L)培养基会导致次级代谢产物产量骤减或消失;相反,低磷酸盐水平(< 0.1 nmol/L)可导致次级代谢产物的增加[28]。一些研究表明,PhoR-PhoP系统通过间接的方式影响其他转录因子(AtrA[29]、AveR[30])表达,从而引起次级代谢产物的变化。
微量金属被证明既能刺激次级代谢产物的增加,又能激活微生物中沉默的生物合成基因簇[31]。金属离子与微生物之间通常存在三种相互作用:在细胞中发生反应、同化反应和异化反应。Akhter等[32]采用不同类型(NiCl2、CoCl2、ZnSO4、CrCl3、MnCl2)、不同浓度(100、200、400、800 μmol/L)金属离子对从海洋沉积物中分离出的S.pratensisNA-ZhouS1进行发酵培养,确定Ni离子效果最佳,并成功分离出2个新的芳香族聚酮stremycin A、B(5、6)以及4个已知的化合物(7~10)。Shi等[33]同样用含镍培养基从Streptomycessp.WU20中分离到1个新型的环唑嗪类似物(11)。Liu等[34]将Streptomycessp.FXJ1.172放在添加了铁离子的葡萄糖-酵母提取物-麦芽提取物(Glucose-yeast extract-malt extract,GYM)培养基中培养,产生了1个新型的环肽类化合物cyclic depsipeptide NC-1(12)。
1.1.3 更换培养基
除了改变培养基中的碳源、氮源、添加微量元素等方式,更换培养基也可以获得更丰富的代谢产物。Wu等[35]使用不同的培养基(ISP2、ISP4、ACM和TSB),对一株海洋来源的链霉菌发酵培养,最终在ACM培养基中分离出1个新型聚酮类化合物inthomycin B(13)。Lu等[36-40]对Streptomycessp.CS进行培养,在YMG琼脂培养基产生3个新的大环内酯类化合物(14~16),在ISP2培养基中产生5个新的巴弗洛霉素衍生物(17~21),在Waksman合成培养基中产生5个新的聚酮类化合物(22~26),在燕麦培养基中产生3个新的安莎霉素类化合物naphthomycins L、M、N(27~29)以及3个已知的naphthomycins(30~32)。Ding等[41]将一株海洋来源的链霉菌Streptomycessp.DT-A37放在Gause′s液体培养基中培养,分离得到2个主产物:全霉素(holomycin)(33)及其开环衍生物(34)。随后Ding等[41]又将这株链霉菌放在大米固体中培养发酵,从其培养提取物中分离出新的全霉素衍生物(35)和2个新的环丙烷乙酸衍生物(36、37)。
1.2 培养条件的改变
微生物在培养过程中的外界环境如温度、pH、曝气、容器类型等因素都会影响微生物基因表达,因而对次级代谢产物的合成有着显著的影响。最早在2002年,Bode等[6]通过改变外界培养参数(如曝气、温度、pH、培养容器),从6种不同的微生物中分离出100多种化合物,分属于25种以上不同的结构类型。
1.2.1 温度
次级代谢产物的产生直接受微生物酶活性的影响,温度过高导致酶失活,温度过低则会影响酶促反应速率。链霉菌S.peucetiusDM07以生产重要的蒽环类药物而闻名,在同一培养基中,Pham等[42]将菌株在不同温度下(18、23、28和37 ℃)培养72 h,发现在18 ℃培养条件下的产物于17.5 min出现新峰,而在其他的温度下该峰不存在,通过进一步的分离与纯化得到1个新型大环内酯类化合物peucemycin(38)(见图3和表1)。

图3 化合物38~71结构Fig.3 Structures of compounds 38-71
1.2.2 曝气或溶氧量
含氧量的变化可以影响生化反应,进而调控代谢途径,激活不同的基因簇。链霉菌Streptomycessp.Go40/14所有的代谢产物都可以通过改变发酵罐体积、培养基组成或曝气程度分离获得,化合物39~43几乎在所有的条件下都能获得;而化合物44和45只能在特殊的发酵罐得到;化合物46~49可通过高曝气获得;化合物50只能在体积超过90L、高曝气的发酵罐中得到[6]。Gallagher等[43,44]用海洋来源的链霉菌Streptomycessp.CNQ-525来探究氧气浓度对次级代谢产物生成的影响,当在低氧环境下生长时,观察到萜类化合物napyradiomycin(51)的产量减少,而另外1个萜类化合物的中间体8-amino-flaviolin(52)大量增加。S.parvulusTu64在常规培养条件下的主要代谢产物为聚酮类化合物manumycin A(53),同时伴有manumycins B~D(54~56)的产生,但随着压力以及溶氧量的增加,导致该菌产生了20个新的聚酮类化合物manumycin或manumycin类似物,这里仅列出来2种(57、58)[6]。
1.2.3 盐度、pH
盐度、pH与温度一样都是微生物生理生化保持稳定的一个重要因素。微生物暴露在添加不同卤素的培养基中,可能会激活隐秘的生物合成基因簇,产生不同的次级代谢产物。Streptomycessp.DSM 14386在含1.5% NaCl的培养基中产生5个新型的环肽类化合物Svetamycins A~E(59~63),在含1.5% NaBr的培养基中产生2个溴化同源物Svetamycins F、G(64、65),这些物质均在常规培养基中未被发现[45,46]。培养环境pH通过影响酶的活性及膜表面的带电性质,改变底物的进出速率与进出方式,进而影响基因簇的表达。Streptomycessp.A1在pH为微酸的情况下产生双苯并螺环缩酮类化合物Rubromycins(66~69),当环境pH为7.3时,则会产生化合物70和71[6]。Sakar等[47]从靠海附近的湿润环境中分离到一株Streptomycessp.MS1/7,并报道了pH对该菌次级代谢产物产量的影响,发现其在酸性(pH 4.0)培养基中没有抗菌活性,pH大于7.0表现出一定的活性,pH=10.0时仍表现出抗菌活性,但是在pH为9.0时抗菌活性最高。
1.3 培养条件的优化策略
在改变培养基组成或培养条件的激活策略中,培养条件的优化可以通过一次次地修改某个单一因素来实现,也可以基于更复杂的数学和统计方法来帮助实现,即人工神经网络(artificial neural network,ANN)、遗传算法(genetic algorithm,GA)、响应面法(response surface methodology,RSM)等[48]。RSM方法是Box等[49]开发的一种使用因子设计来优化所需代谢物的生产过程,常用于优化配方变量和优化发酵过程。Managamuri等[50]对S.sparsusVSM-30培养基组成进行优化,包括孵育时间、温度、pH、碳氮源等,实现抗真菌、抗细菌和抗氧化等活性物质的增加。在另一项研究中,Singh等[51]应用ANN与GA结合的方法优化了S.triostinicus的培养基组分,并从该菌种分离到放线菌素V,该菌株在先前并没有检测此类抗生素的产生,且应用ANN/GA获得的抗生素产量比RSM获得的产量高36.7%。
2 共培养策略
传统微生物天然产物的生产通常是在一个营养丰富的单一培养基中完成的,这些培养基虽然有效,但是与细菌原始、复杂且贫瘠的环境相比有着明显的区别[52]。共培养体系是激活沉默生物合成基因簇、刺激新型次级代谢产物产生的有效策略之一,其主要通过模拟种间争夺养分、空间等条件时所遇的生存压力来分析微生物形态变化、监测细胞密度等,进而发现共培养体系中微生物次级代谢产物的变化[53]。根据培养基状态的不同可以分为液体共培养(混合发酵)和固体共培养[10]。根据共培养微生物的类型,我们可以分为:链霉菌与链霉菌共培养、链霉菌与非链霉菌共培养两大类[54]。
2.1 链霉菌与链霉菌共培养
Yamanaka等[55]对76株链霉菌的交叉共培养证明,20%以上的链霉菌在共培养条件下表现为菌株长势迅速且次级代谢产物产量增加。铁色素类化合物去铁胺(desferrioxamine E)(72)(见图4)是从S.griseus培养液上清中分离纯化的一种铁载体,它与链霉菌生长及相关生物产品的产生有关。将该菌与不同链霉菌菌株共培养,使链霉菌出现不同程度的次级代谢产物增加或形态分化。当S.griseus与S.coelicolorA3(破坏了铁载体合成基因簇,单独不可培养)共培养时,S.coelicolorA3恢复正常生长,表明了desferrioxamine E在链霉菌的生存发育中起到一定的作用[55]。S.colicolorM145与其他链霉菌(Streptomycessp.E14、Streptomycessp.SPB74等)相互作用时,至少产生了12个不同的去铁胺[56]。
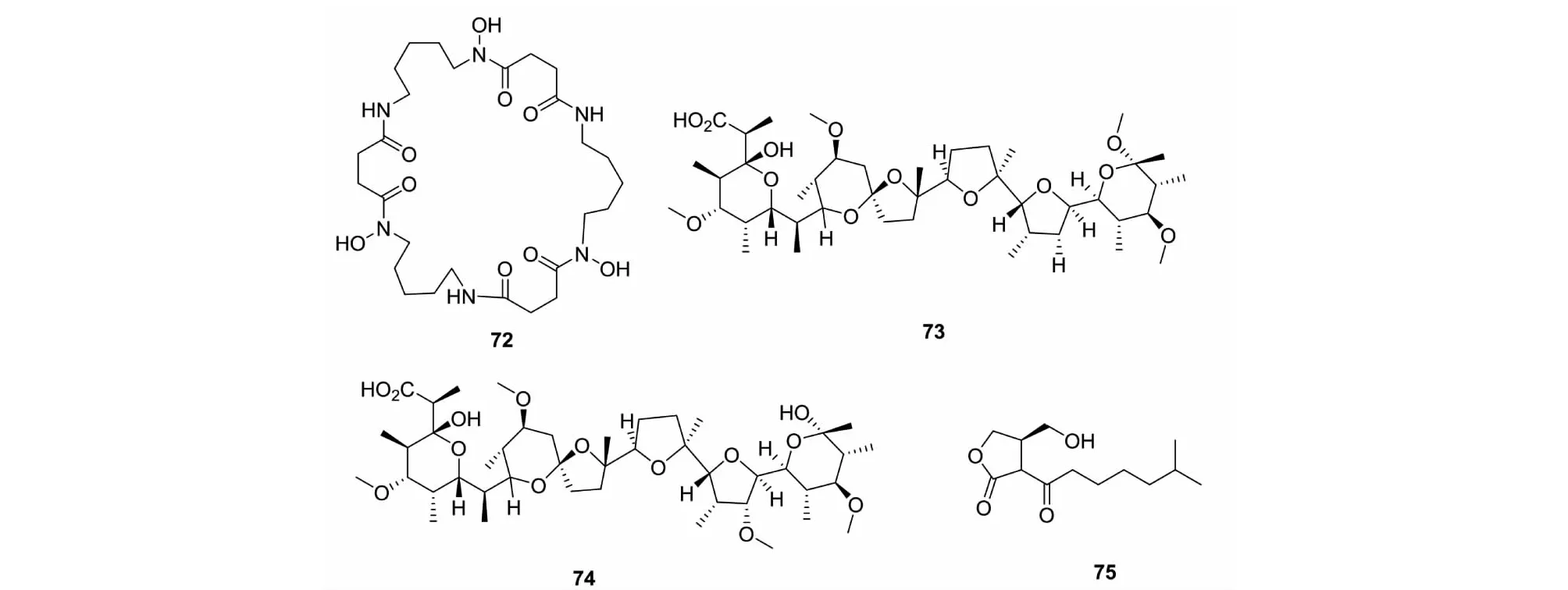
图4 化合物72~75结构Fig.4 Structures of compounds 72-75
Promomycin(73)是在链霉菌中发现的可以促进抗生素生产的聚醚类化合物,结构上与lonomycin(74)相关,本身具有抗菌活性。将产生这种物质的链霉菌与不同的链霉菌(常规培养未有抗生素类物质产生)共培养,均有抗生素物质产生[57]。S.lividans是两种红色素的生产者,但这些色素的产生需要具备一定的条件,在实验室正常培养条件下,并不会产生这些色素,需要在一种激素类似物(75)的刺激下才可以产生[58]。Onaka等[58]将从土壤中分离出的400个放线菌用于刺激S.lividans的生长,将Streptomycessp.TP-A0584与目标菌种共培养后发现S.lividans产生红色素,后经分离得到1个新的多肽类抗生素goadsporin,低浓度的goadsporin具有促进孢子形成的作用,高浓度则会抑制菌体的生长。
2.2 链霉菌与非链霉菌共培养
2.2.1 链霉菌与细菌
金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)等人类致病菌一直是实验室筛选具有生物活性次级代谢产物的指示菌株。最近几十年发现,这些致病菌在通过共培养方式来激活沉默基因簇方面具有优势,因而一直尝试将它们与放线菌共培养,尤其是链霉菌属[59]。
Bing等[60]发现Streptomycessp.FXJ2.014单一培养主要产生的生物活性代谢产物是醌霉素(quinomycin A),将其与枯草芽孢杆菌在液体培养基中共培养可产生1个新的醌霉素结构类似物quinomycin FXJ2.014-HB,并通过实验验证,这种新产生的醌霉素具有成为低细胞毒性抗生素的潜力。Daniel等[61]将一株海洋来源的链霉菌与枯草芽孢杆菌共培养,发现了1个新的环肽类化合物dentigerumycin E,检测了dentigerumycin E(76)及其化学衍生物(77、78)生物活性,发现dentigerumycin E具有抗人类癌细胞增殖活性(见图5、表2)。

表2 共培养挖掘新的活性代谢产物Table 2 Co-culture mining for new active metabolites

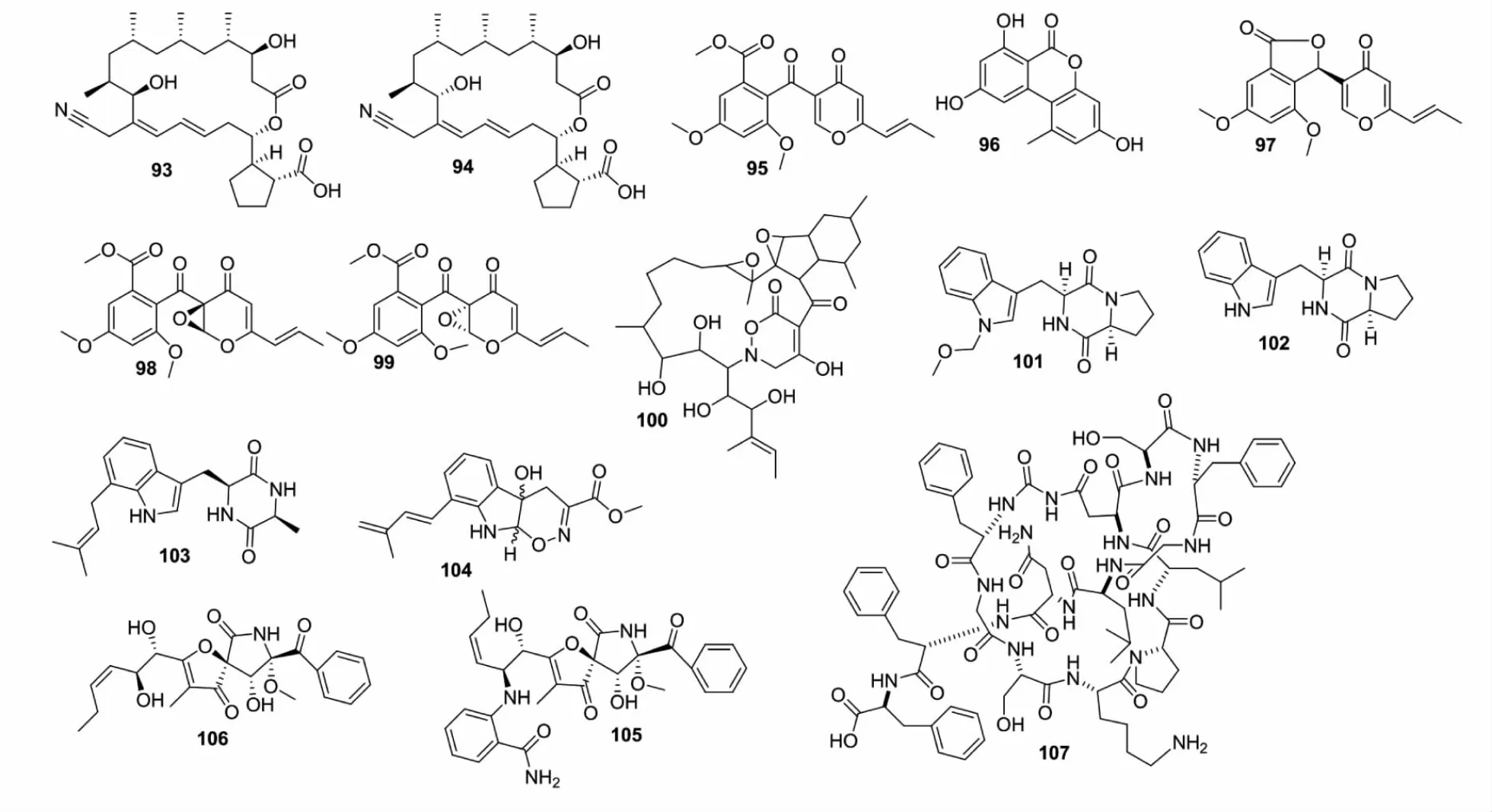
图5 化合物76~107结构Fig.5 Structures of compounds 76-107
Sung等[62]从红树林根部分离到一株链霉菌Streptomycessp.PTY08712,通过分析其基因组发现该菌株具有产生多种次级代谢产物的强大潜力。使用多种培养基单独培养时,在其提取物中发现的次级代谢产物,与基因组数据显示的潜在的次级代谢产物的种类相比存在巨大的偏差。后将其与枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌(P.aeruginosa)共培养,该菌株中的沉默生物合成基因簇被激活,granaticin、granatonmycin D 和 dihydrogranaticin 等3种抗生素产量增加。单一培养S.coelicolorA3时会产生少量三吡咯色素类化合物undecylprodigiosin,Mavituna等[63]将该链霉菌与大肠杆菌共培养,最终undecylprodigiosin的产量有显著增加。
Burkholderiavietnamiensis(ATCC BAA-248)、Brucellaneotomae(ATCC 23459),Yersiniapestis(A1122)和Xanthomonasaxonopodis(ATCC 8718)均为变形杆菌,与链霉菌(Streptomycessp.Bo33)共培养时产生1个新型的醌类天然抗生素resistomycin,对菌株单独培养时均未检测到该物质的产生[64]。
2.2.2 链霉菌与真菌
真菌是一类庞大的群体,人们已经从真菌发现了大量的次级代谢产物[65],并且许多次级代谢产物表现出生物活性,因而具有重大的药物开发潜力[66]。目前,最成功的共培养方法可能涉及到与各种真菌的共培养,由于许多真菌与放线菌在不同的生态环境中共存,这意味着他们之间存在着普遍的相互作用[67](见图5和表2)。
Rateb等[68]报道将S.bullii与AspergillusfumigatusMBC-F1-10分别接种在麦芽提取物培养基,在LC-MS色谱图中几乎看不到任何占主导地位的峰,用相同的培养基将两者共同培养,其LC-MS谱图非常复杂,最后经过分离鉴定,得到7个新型的生物碱类化合物(79~85)。Schroeckh等[69]将印尼曲霉A.nidulans与S.hygroscopicus共培养时会产生4个新型的聚酮类化合物(86~89),这是在单独培养时未曾发现的。
在Yu等[70]的研究中,以S.rocheiMB037和Rhinocladiellasimilis35进行共培养,并以两株菌的单独培养作为对照。从培养液中成功分离出2个新型的大环内酯类化合物borrelidins J、K(90、91),以及三种已知的大环内酯类化合物(92~94),且化合物90、91仅在共培养中被检测到。Wang等[71]将Penicilliumsp.WC-29-5与S.fradiae007共培养,从培养液中共分离出5个新型的聚酮类化合物(95~99),其中化合物deoxyfunicone(95)、交链孢酚 alternariol (96)、(9R,14S)-epoxy-11-deoxyfunicone(98)、(9S,14R)-epoxy-11-deoxyfunicone(99),仅在共培养中发现,且化合物98和99表现出一定的细胞毒性活性。
TsukamurellapulmonisTP-B0596是一种含霉菌酸的真菌,与S.lividans共培养能诱导红色素的产生。Onaka等[72]将112株链霉菌与TsukamurellapulmonisTP-B0596共培养,经HPLC分析发现其中41个菌株诱导了新的次级代谢产物产生,如新型聚酮类抗生素alchivemycin A(100)。
链霉菌与非链霉菌共培养时,两者的关系并不是一成不变的。链霉菌既可以是生产者也可以是诱导者。如Wakefield等[73]将一株源自海洋的真菌AspergillusfumigatusMR2012与高干旱沙漠分离的S.leeuwenhoekiiC34共培养来研究两者的相互作用。真菌MR2012与链霉菌C34共培养导致许多新化合物产生,其中包括真菌来源的6个新型的生物碱类化合物brevianamide X(101)、brevianamide F(102)、terezine D(103)、luteoride D(104)、pseurotin G(105)、11-O-methy pseurotin A(106),这是该真菌在单独培养时从未检测到的;除了在链霉菌C34检测到的代谢物外,共培养条件下分离出1个新型的环肽类化合物chaxapeptin(107),这也是单独培养未检测到的。
3 添加化学激发子
化学激发子是小分子物质,当添加到培养基中时可诱导微生物生物合成基因簇的表达并产生次级代谢产物[74]。在自然界中,链霉菌生活在比较复杂的环境之中,周围常存在细菌、真菌、动物和植物,为了解决本身生存问题,其会产生大量化学信号分子来调节自己与四周环境的适应性,从而满足特定合成基因的调控表达机制,以便其更好地生存[75](见图6、表3)。

表3 添加化学激发子发现新的活性代谢产物Table 3 Addition of chemical excitons to discover new active metabolites

图6 化合物108~118结构Fig.6 Structures of compounds 108-118
有报道称,大多数激发子是抗生素,它们能在较低的浓度下诱导次级代谢产物的产生[76]。如前面提到的从一株链霉菌中分离得到的抗生素goadsporin,低浓度(<1 μmol/L)的goadsporin能刺激链霉菌次级代谢产物的增加;高浓度的goadsporin则会抑制细胞的增殖[58]。Etoposide(108)和ivermectin(109)是已知的抗生素,在低浓度下均可以诱导次级代谢产物的增加[41]。S.coelicolor能生产undecylprodignine(110)、streptorubin B(111)等色素型次级代谢产物[77,78]。为了确定干扰次级代谢的小分子,Craney等[79]筛选了30569种小分子,以链霉菌在固体培养基培养期间色素的沉着能力作为检测标准。
结果观察到有112种小分子有色素沉着能力,其中19种小分子表现出较好的效果。19个小分子中有4个具有相似的结构:ARC2、ARC3、ARC4和ARC5,称为ARC2系列。在实验中,将购买的ARC2(112)及其ARC2衍生物Cl-ARC2用于多种链霉菌中,成功诱导出1个苯并异色烷醌类化合物(113)、1个三吡咯色素类化合物(114)以及3个不饱和内脂类化合物(115~117)[14,74,79,80]。
组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类重要的酶,负责从组蛋白的N端尾部去除乙酰基团[81]。组蛋白的N端通过添加/去除小基团如甲基、乙酰基或磷酸基团来修饰,这些修饰可以影响基因的转录[82]。链霉菌属于原核生物,没有组蛋白可以供DNA附着,HDAC抑制剂对细菌的研究较少。在一项初步研究中,Moore等[81]研究了HDAC抑制剂对S.coelicolorA3次级代谢产物产生的影响。实验在两种固体培养基中进行,正常情况下R5培养基会产生两种色素且产量正常,MM培养基则会降低两种色素的产量。当加入一定体积的丁酸钠(sodium butyrate,一种典型的HDAC抑制剂)会使MM培养基上色素的产量增加,而R5培养基上的色素产量降低。随后使用不同的HDAC抑制剂,得出了相似的结果。在液体培养基中,加入丁酸钠,通过定量PCR进行检测发现S.coelicolorA3中5个公认的沉默基因被表达[81]。
稀土金属也是一类激发因子,最近的研究证明,其在刺激沉默基因簇产生次级代谢产物方面也相当有效果[83]。如Xu等[84]在正常培养基中添加LaCl3用于培养来自于深海的50株放线菌,其中有15株由于添加了LaCl3导致抗病原菌活性物质的产量增加,并检测到新的环肽类化合物如uranchimycin D(118)。此外,糖、金属离子等也可以作为激发子触发沉默基因簇表达[23,32,85]。
总之,无论选择哪种激发子进行诱导,其优势都是明显可见的。同时添加激发子是最简单、最具有成本效益的方式,当然缺点也是明显的,激发子过多过少都会造成一定的影响,过多会造成微生物的直接死亡,过少则表现为没有影响,因此使用时需要选择合适的激发子的浓度[74]。
4 全局性调控
链霉菌的次级代谢产物可以通过多种复杂的代谢途径合成,且相关基因的表达往往要受到极为严格的调控[86]。其中,全局性调控是指在全局性调控因子的作用下发挥的调控作用,该因子不属于任何一个基因簇,在特定的环境条件下,可同时诱导多个基因的表达,还可以影响形态结构以及生长发育[87]。
天蓝色链霉菌bld基因是全局性调控中第一个被描述的,该基因的突变会导致抗生素合成的中断以及生长发育停止。早在2000年,天蓝色链霉菌中就有超过10个bld基因被鉴定,这些基因调控着不同的产物[88],其中bld A基因是bld基因中研究最多的,其通过调控mRNA的转录,从而控制次级代谢产物的合成[89]。同时研究者在其他链霉菌的基因组中也发现了bld基因的同源基因,逐渐被用于链霉菌沉默基因簇的激活[90]。除了bld基因外,目前还有nsdA[91]、farR1[92]、abrC1/C2/C3[93]、SCB1,2,3[94]、adpA[95]、crp[96]等全局性调控因子用于链霉菌沉默基因簇的激活。
5 总结
抗生素的发现是医学发展史上的重大里程碑,极大地降低了病菌感染的发生率和死亡率。目前已经发现的抗生素类约60%的是由链霉菌产生,然而,随着抗生素的大量使用,耐药性及超级细菌问题同样日益突出[1]。为了应对耐药性以及超级细菌的这一问题,我们急需挖掘新的抗生素。通过对链霉菌基因组数据进行生物信息学分析,发现存在着很大一部分的基因处于沉默状态[5]。因而,链霉菌中沉默基因簇的激活是当下重要的问题之一。越来越多的学者注意到了链霉菌发现新化合物的潜力,开始研究如何刺激沉默基因簇的激活。
根据激活的目标基因是否明确,我们将目前的激活策略分为定向激活策略和非定向激活策略。非定向激活策略包括改变培养基组成或培养条件的激活策略、共培养策略、添加化学激发子和全局性调控等,与一些基于基因的手段如核糖体工程、启动子工程、转录因子调控等相比,非定向激活策略有着自身的优势及局限性(见表4)。近些年,一些新的、前沿的手段被研发,如微流体平台[14]、微发酵与基因组尺度的代谢模型结合[97]、生物发生管与组学相结合[98]、HiTEs[99]等,在激发沉默基因簇中起着巨大的作用。将非定向激活策略与代谢物指纹图谱分析结合已证明在挖掘次级代谢产物中取得重大成果[100]。

表4 非定向沉默基因簇激活策略的优缺点Table 4 Advantages and disadvantages of non-directed strategies for activating silent gene clusters
本文仅仅是对改变培养基组成或培养条件的激活策略、共培养策略以及添加化学激发子策略进行简单的概括,未涉及或仅涉及到很少一部分基因层面的技术。目前,无论是非定向激活策略还是定向激活都有各自的优势及局限性,单独使用某一种策略很难全面激活沉默基因簇。因此,在基因组测序技术的不断进步的前提下,将基础微生物学方法、计算方法和技术创新等更彻底地结合起来,将更有助于发现链霉菌巨大的次级代谢产物合成潜力。
