南海海绵Dactylospongia elegans的二倍半萜类化学成分及抗炎活性研究
2023-09-02康永锋武改芳甘建红
康永锋,武改芳,李 立,甘建红*
1上海海洋大学食品学院;2上海水产品加工及贮藏工程技术研究中心;3食品科学与工程国家级实验教学示范中心,上海 201306
海洋的高压、高盐、缺氧和少光等特殊的生态环境,使得海洋生物能够拥有独特的代谢机制,从而产生结构新颖的次级代谢产物。海绵是海洋的第二大生物,被认为是海洋天然产物最丰富的来源[1,2]。Dactylospongia属海绵拥有丰富的具有生物活性的次生代谢产物,文献报道的该属海绵的化学成分主要有倍半萜醌/氢醌、倍半萜酸类、二萜、类固醇、二倍半萜类以及其他类型的化合物[3],其中大部分为倍半萜醌/氢醌。这些代谢产物显示出一系列的生物活性,如抗肿瘤、抗血管生成、抗菌[4]、抗炎[5]、抗锥虫、抗疟原虫[6]和抗氧化[7]等活性。目前,从D.elegans海绵中分离得到的二倍半萜类化合物相对较少,仅有少量的文献进行了报道,如Yu等[8]从D.elegans海绵中分离得到了5个新的二倍半萜类化合物。
本文对胄甲海绵D.elegans的化学成分进行了一系列的研究,致力于发现结构新颖、具有生物活性的化合物,丰富海洋来源的天然产物,同时发现具有潜在药用价值的先导化合物。
1 材料与方法
1.1 主要仪器与试剂
Waters 1525/2996高效液相色谱仪(美国Waters公司);Bruker AV-600型核磁共振仪、Bruker AVANCE NEO 400兆核磁共振波谱仪(美国Bruker公司);TLC高效薄层层析板(烟台江友硅胶开发有限公司);甲醇、乙腈(色谱纯,美国Promptar公司);二氯甲烷、甲烷、石油醚、乙酸乙酯、正丁醇(分析纯,上海化学试剂公司);氘代试剂(上海思域化工科技有限公司);显色剂用10%硫酸香兰素溶液;小鼠巨噬细胞RAW 264.7(中国科学院上海生命科学研究院细胞资源中心);胎牛血清(美国Hyclone 公司,批号:SH30406.05);DMEM培养基(美国Gibco公司,批号:812557);饮用纯净水(杭州娃哈哈集团有限公司);地塞米松(北京索莱宝科技有限公司,纯度:≥98%,批号:D8040)。
1.2 样品来源
胄甲海绵D.elegans样品于2020年3月采自中国南海永兴岛,种属由上海交通大学仁济医院林厚文教授鉴定。样本(编号D20-3)存放于上海海洋大学食品学院。
1.3 实验方法
1.3.1 提取分离
将海绵(D.elegans)切碎后,用乙醇反复浸泡、超声提取,直到薄层色谱法检验完全提取为止,合并提取液,减压浓缩得到粗浸膏;将粗浸膏混悬于1.5 L水中,用等体积二氯甲烷萃取4次;减压浓缩得到总浸膏;将其混悬分散于90%的甲醇溶液中,用等体积的石油醚萃取3次,浓缩萃取液得到石油醚部位浸膏;再加水将混悬液的甲醇浓度调整至60%,用等体积的二氯甲烷萃取3次,浓缩萃取液得到二氯甲烷部位浸膏。
将二氯甲烷部位浸膏进行减压硅胶柱色谱,用石油醚-乙酸乙酯(100∶1 → 1∶1,MeOH)进行梯度洗脱,根据TLC显色合并相似流份得到7个组分A~G。对组分C进行反相ODS色谱柱色谱,甲醇-水(40∶60 →100∶0)梯度洗脱,根据TLC显色合并相似流分得到8个组分D1~D8,对组分D3进行正相硅胶柱色谱,石油醚-乙酸乙酯(100∶1 → 1∶1)梯度洗脱,根据TLC显色合并相似流分得到5个组分(D3a~D3e)。从D3c组分以甲醇-水(90∶10)为洗脱体系经高效液相色谱纯化得到化合物2(2.1 mg,tR=39 min)。对组分D4进行正相硅胶柱色谱,石油醚-乙酸乙酯(100∶1 → 1∶1)梯度洗脱,根据TLC显色合并相似流分得到4个组分(D4a~D4d);从D4b组分以乙腈-水(75∶25,0.1%甲酸)为洗脱体系经高效液相色谱纯化得到化合物1(2.0 mg,tR= 25 min),从D4c组分以甲醇-水(90∶10,0.1%甲酸)为洗脱体系经高效液相色谱纯化得到化合物3(2.3 mg,tR= 40 min)和4(1.7 mg,tR= 46 min)。对组分E进行正相硅胶柱色谱,二氯甲烷-甲醇(100∶1 → 1∶1)梯度洗脱,根据TLC显色合并相似流分得到7个组分(E1~E7)。从E4组分以甲醇-水(87∶13,0.1%甲酸)为洗脱体系经高效液相色谱纯化得到化合物5(2.2 mg,tR= 31 min)和7(1.8 mg,tR= 49 min)以及组分E4a;组分E4a以乙腈-水(75∶25,0.1%甲酸)体系经过HPLC二次纯化得到化合物6(2.1 mg,tR= 47 min)组分E5以甲醇-水(85∶15,0.1%甲酸)为洗脱体系经高效液相色谱得到化合物8(3.2 mg,tR= 52 min)。
1.3.2 生物活性测定
1.3.2.1 细胞培养
将小鼠巨噬细胞RAW 264.7细胞用含10%新生胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM完全培养基培养,37 ℃,5% CO2培养箱培养至细胞覆盖率达85%以上时传代,生长状态良好的细胞用于实验研究。
1.3.2.2 NO生成抑制率测定
采用Griess法[9]检测化合物对脂多糖LPS诱导小鼠巨噬细胞RAW 264.7细胞NO释放的抑制作用。对数生长期的RAW 264.7细胞以5×104个/孔的密度接种到96孔板中,每孔100 μL,并设LPS组、空白对照组和给药组。待细胞贴壁后,LPS组加入LPS(1 μg/mL),空白对照组每孔加入0.1 μL的DMSO,给药组加入10 μmol/L单体化合物,37 ℃孵育1 h后,加入LPS(1 μg/mL),继续培养24 h;收取100 μL细胞上清液,与100 μL Griess试剂等体积混合,室温孵育10 min,记录各孔在540 nm处的吸光度值(OD值)。按照公式:抑制率=(OD样品-OD空白)/(ODLPS-OD空白)×100%,计算NO生成抑制率。
1.3.2.3 细胞活力的检测
采用CCK-8法[9]测定化合物对细胞增殖的影响。收取100 μL细胞上清液用于测定NO的释放后,将10 μL的CCK8溶液加入每个孔,37 ℃孵育1 h后,使用酶标仪在450 nm波长处记录每个孔的吸光度。
2 实验结果
2.1 化合物的结构鉴定

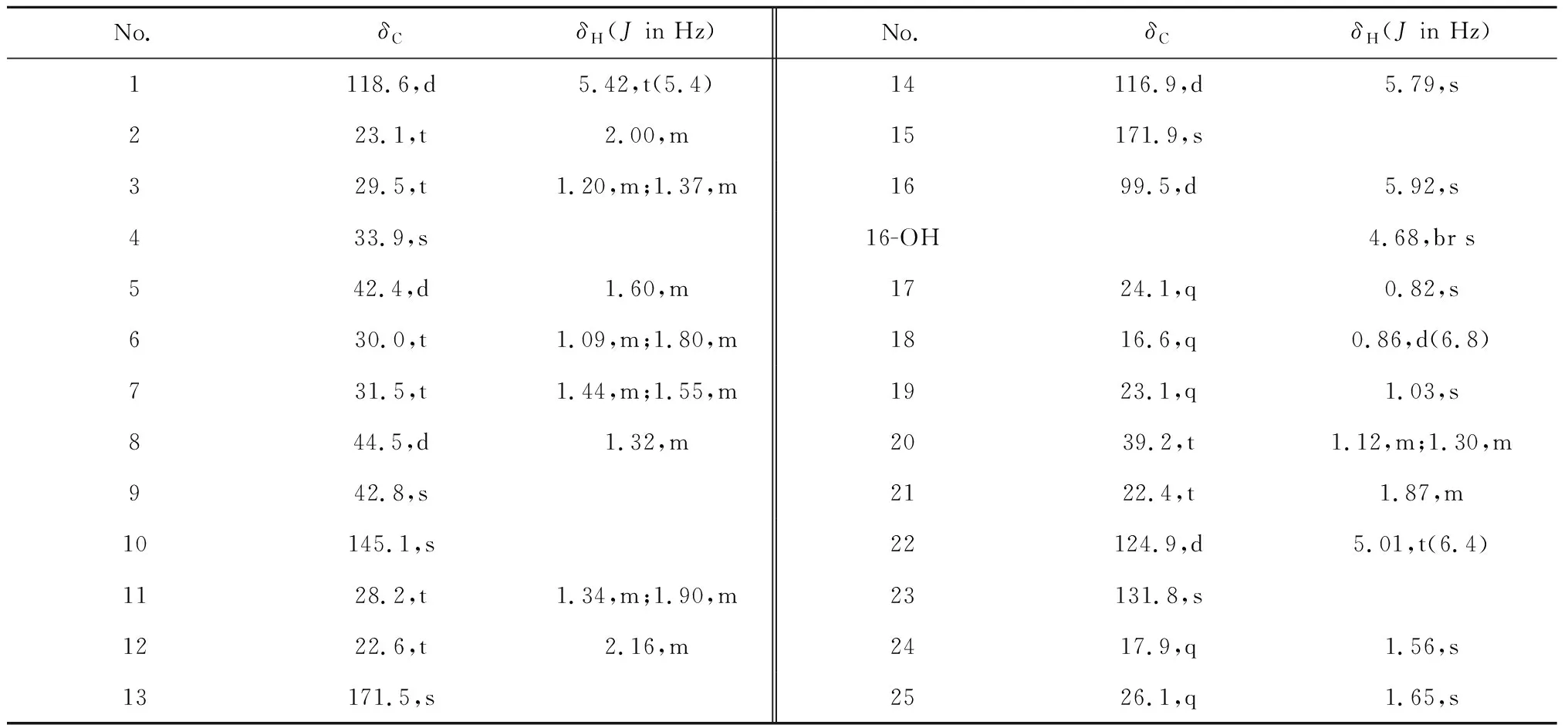
表1 化合物1的1H NMR和13C NMR数据(400和100 MHz,CDCl3)Table 1 1H NMR和13C NMR data for compound 1 (400 and 100 MHz,CDCl3)
1H NMR谱高场区域显示了分子中4个甲基单峰[δH0.82(3H,s,H-17),1.03(3H,s,H-19),1.56(3H,s,H-24),1.65(3H,s,H-25)]、1个甲基双峰[δH0.86(3H,d,J= 6.8 Hz,H-18)]以及1个活泼氢[δH4.68(1H,br s,16-OH)]信号的存在;低场区域显示3个烯烃质子[δH5.42(1H,t,J= 5.4 Hz,H-1),5.79(1H,s,H-14),5.01(1H,t,J= 6.4 Hz,H-22)]信号。13C NMR和DEPT谱中共显示有25个碳信号,包括6个季碳,6个次甲基碳,8个亚甲基碳以及5个甲基碳,其中包括1个羰基碳(δC171.9),3个烯烃季碳(δC171.5,145.1,131.8),3个烯烃次甲基碳(δC124.9,118.6,116.9),1个连氧次甲基碳(δC99.5)。1个羰基和3个双键占据了4个不饱和度,提示分子中三环结构的存在。
查阅文献[8]发现,化合物1与已知化合物dactylospene C的核磁数据基本一致,不同的是与化合物dactylospene C相比,化合物1缺少了一个碳信号(δC56.5)和一个氢信号[δH3.50(3H,s,16-OCH3)],同时C-16的碳谱化学位移值由化合物dactylospene C中的δC104.4向高场位移至化合物1中的δC99.5,C-16的氢谱化学位移值由化合物dactylospene C中的δH5.61(1H,s,H-16)向低场位移至化合物1中的δH5.92(1H,s,H-16),推测可能是由于C-16位的取代基不同导致的。结合化合物1的HR-EI-MS、1H NMR和13C NMR,确定化合物1的C-16位的取代基是羟基而不是化合物dactylospene C中的甲氧基。同时,一组碳信号δC171.9(C-15),171.5(C-13),116.9(C-14)以及99.5(C-16),以及H-16与C-13/C-14/C-15,H-14与C-13/C-15/C-16的HMBC相关可以进一步证实α,β-不饱和-γ-羟基-γ-内酯结构单元的存在。由上述信息,最终确定了化合物1的平面结构,如图1所示。
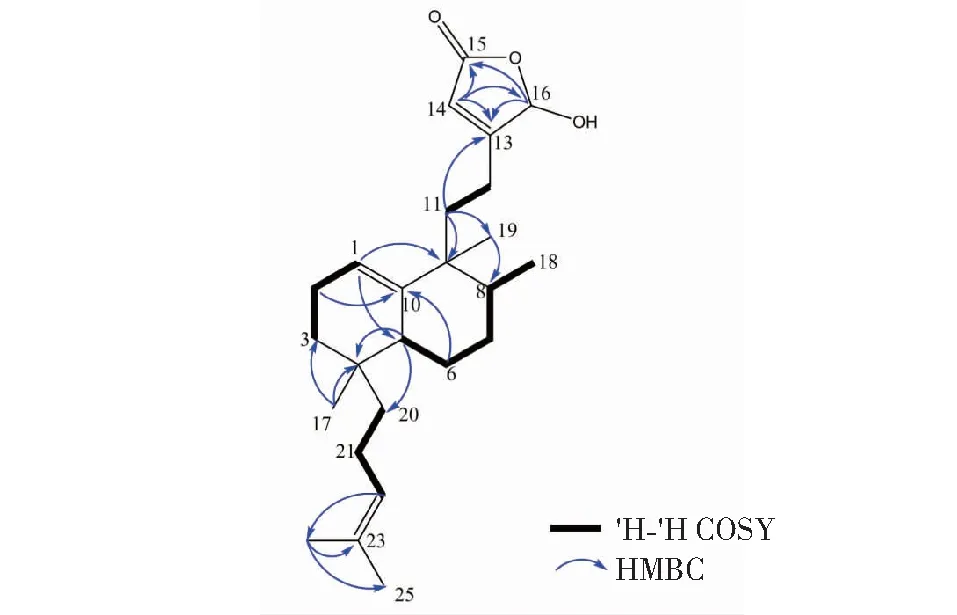
图1 化合物1的1H-1H COSY和关键HMBC相关Fig.1 1H-1H COSY and HMBC correlations of compound 1
化合物1的相对构型是通过NOSEY谱确定的(见图2)。在NOESY谱中,H-5与H3-18、H-20a有NOESY相关,可知这些氢是处于同一平面。H-8与H3-19有NOESY相关,表明这些氢是处于另一平面的。化合物1的绝对构型是通过CD谱确定的。化合物1在205 nm左右处正Cotton效应,在250 nm左右处正Cotton效应(如图3所示),与已知化合物dactylospene C一致,因此确定化合物1的绝对构型为4R,5S,8R,9R,16S。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。

图2 化合物1的关键NOESY相关Fig.2 Key NOESY correlations of compound 1
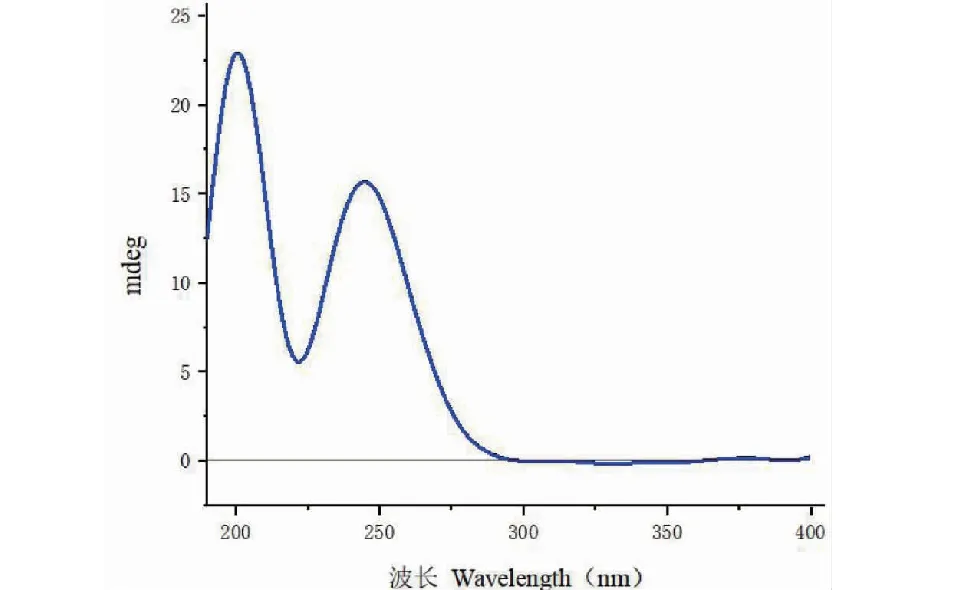
图3 化合物1的CD谱图Fig.3 The CD spectrum of compound 1
化合物2白色粉末,易溶于二氯甲烷;ESI-MS:m/z445.29 [M + H]+,分子式为C27H40O5。1H NMR(600 MHz,CDCl3)δ:6.80(1H,d,J= 2.8 Hz,H-16),5.67(d,J= 5.0 Hz,H-25),4.90(1H,br s,H-12),2.09(3H,s,CH3CO),0.93(3H,s,H-21),0.85(3H,s,H-22),0.84(3H,s,H-19),0.81(3H,s,H-20),0.80(3H,s,H-23);13C NMR(150 MHz,CDCl3)δ:39.6(C-1),18.0(C-2),41.4(C-3),33.2(C-4),56.4(C-5),18.5(C-6),41.9(C-7),37.9(C-8),52.5(C-9),37.3(C-10),22.3(C-11),74.6(C-12),36.9(C-13),49.9(C-14),24.1(C-15),135.3(C-16),128.1(C-17),50.8(C-18),33.3(C-19),21.4(C-20),16.3(C-21),16.0(C-22),15.1(C-23),167.9(C-24),98.9(C-25),171.1(CH3CO),21.4(CH3CO)。以上数据与文献[10]报道一致,鉴定化合物2为scalarin。
化合物3白色粉末,易溶于二氯甲烷;ESI-MS:m/z521.34 [M + Na]+,分子式为C31H46O5。1H NMR(600 MHz,CDCl3)δ:5.60(1H,br t,J= 2.4 Hz,H-12),4.77(1H,dd,J= 13.0,6.6 Hz,H-24),4.09(1H,m,H-3′),1.35(3H,d,J= 7.0 Hz,H-26),1.18(3H,d,J= 7.0 Hz,H-4′),1.17(3H,s,H-23),1.09(3H,d,J= 6.4 Hz,H-27),0.87(3H,s,H-21),0.79(3H,s,H-22),0.58(1H,dd,J= 8.6,4.5 Hz,H-19b),0.47(1H,t,J= 5.0 Hz,H-19a);13C NMR(150 MHz,CDCl3)δ:39.9(C-1),21.6(C-2),33.5(C-3),22.9(C-4),50.5(C-5),17.9(C-6),40.5(C-7),37.9(C-8),51.6(C-9),37.7(C-10),21.6(C-11),74.9(C-12),38.6(C-13),51.4(C-14),17.0(C-15),24.4(C-16),164.4(C-17),132.9(C-18),13.8(C-19),13.6(C-20),17.1(C-21),13.8(C-22),21.3(C-23),77.9(C-24),171.1(C-25),18.6(C-26),13.2(C-27),171.7(C-1′),41.7(C-2′),64.9(C-3′),22.5(C-4′)。以上数据与文献[11]报道一致,鉴定化合物3为 honulactone A。
化合物4白色粉末,易溶于二氯甲烷;ESI-MS:m/z521.34 [M + Na]+,分子式为C31H46O5。1H NMR(600 MHz,CDCl3)δ:5.59(1H,br t,J= 2.4 Hz,H-12),4.77(1H,d,J= 7.6 Hz,H-24),4.10(1H,m,H-3′),1.35(3H,d,J= 7.2 Hz,H-26),1.18(3H,d,J=7.0 Hz,H-4′),1.17(3H,s,H-23),1.10(3H,d,J= 6.4 Hz,H-27),0.87(3H,s,H-21),0.79(3H,s,H-22),0.58(1H,dd,J= 8.6,4.5 Hz,H-19b),0.48(1H,t,J= 5.0 Hz,H-19a);13C NMR(150 MHz,CDCl3)δ:39.8(C-1),21.2(C-2),33.4(C-3),22.6(C-4),50.2(C-5),17.5(C-6),40.3(C-7),37.8(C-8),51.4(C-9),37.5(C-10),21.3(C-11),74.7(C-12),38.5(C-13),51.5(C-14),16.6(C-15),24.3(C-16),164.1(C-17),132.8(C-18),13.7(C-19),13.4(C-20),17.0(C-21),13.9(C-22),21.4(C-23),78.1(C-24),171.3(C-25),18.6(C-26),13.0(C-27),171.1(C-1′),43.4(C-2′),64.2(C-3′),22.5(C-4′)。以上数据与文献[12]报道一致,鉴定化合物4为 honulactone B。
化合物5白色粉末,易溶于二氯甲烷;ESI-MS:m/z535.32 [M + Na]+,分子式为C32H48O5。1H NMR(600MHz,CDCl3)δ:5.59(1H,br t,J= 2.6 Hz,H-12),4.78(1H,dd,J=13.2,6.4 Hz,H-24),4.10(1H,m,H-3′),3.06(1H,br s,HO-3′),1.37(3H,d,J= 7.0 Hz,H-26),1.17(3H,s,H-23),1.08(3H,d,J= 6.4 Hz,H-27),0.93(3H,t,J= 7.5 Hz,H-5′),0.88(3H,s,H-21),0.79(3H,s,H-22),0.58(1H,dd,J= 8.8,4.5,Hz,H-19b),-0.47(1H,dd,J= 4.5,5.6 Hz,H-19a);13C NMR(150 MHz,CDCl3)δ:39.8(C-1),21.1(C-2),32.9(C-3),22.7(C-4),49.9(C-5),17.5(C-6),40.2(C-7),37.7(C-8),51.4(C-9),37.2(C-10),21.1(C-11),74.6(C-12),38.5(C-13),51.2(C-14),16.8(C-15),24.1(C-16),164.2(C-17),132.8(C-18),13.6(C-19),13.4(C-20),16.9(C-21),13.8(C-22),21.5(C-23),77.9(C-24),171.8(C-25),18.8(C-26),13.2(C-27),172.1(C-1′),41.7(C-2′),64.5(C-3′),22.3(C-4′),10.1(C-5′)。以上数据与文献[12]报道一致,鉴定化合物5为honulactone E。
化合物6白色粉末,易溶于二氯甲烷;ESI-MS:m/z535.32 [M + Na]+,分子式为C32H48O5。1H NMR (600 MHz,CDCl3)δ:5.59(1H,br t,J= 2.6 Hz,H-12),4.77(1H,q,J= 7.4 Hz,H-24),3.98(1H,m,H-3′),2.99(1H,s,HO-3′),1.36(3H,d,J= 7.0 Hz,H-26),1.18(3H,s,H-23),1.08(3H,d,J= 6.4 Hz,H-27),0.93(3H,t,J= 7.5 Hz,H-5′),0.88(3H,s,H-21),0.79(3H,s,H-22),0.57(1H,dd,J= 8.8,4.1 Hz,H-19),-0.49(1H,t,J= 5.2 Hz,H-19);13C NMR(150 MHz,CDCl3)δ:39.8(C-1),21.1(C-2),33.1(C-3),22.6(C-4),50.2(C-5),17.4(C-6),39.9(C-7),37.9(C-8),51.4(C-9),37.2(C-10),21.0(C-11),74.7(C-12),38.5(C-13),51.4(C-14),16.5(C-15),24.3(C-16),164.2(C-17),132.8(C-18),13.7(C-19),13.5(C-20),16.8(C-21),13.9(C-22),21.4(C-23),78.1(C-24),171.7(C-25),18.7(C-26),13.2(C-27),172.3(C-1′),41.7(C-2′),64.4(C-3′),22.3(C-4′),10.1(C-5′)。以上数据与文献[12]报道一致,鉴定化合物6为honulactone F。
化合物7白色粉末,易溶于二氯甲烷;ESI-MS:m/z573.38 [M + H]+,分子式为C34H53O7。1H NMR(600 MHz,CDCl3)δ:5.61(1H,br t,J= 3.2 Hz,H-12),5.35(1H,q,J= 7.2 Hz,H-20),4.76(1H,q,J= 7.0 Hz,H-24),3.79(1H,m,H-3′),2.95(1H,s,HO-3′),2.04(3H,s,CH3CO),1.36(3H,d,J= 8.6 Hz,H-26),1.18(3H,s,H-23),1.07(3H,d,J= 8.4 Hz,H-27),0.95(3H,s,H-19),0.93(3H,t,J=8.4 Hz,H-5′),0.87(3H,s,H-21),0.86(3H,s,H-22);13C NMR(150 MHz,CDCl3)δ:40.2(C-1),17.7(C-2),38.9(C-3),39.1(C-4),59.0(C-5),20.1(C-6),42.2(C-7),37.5(C-8),53.6(C-9),37.3(C-10),21.0(C-11),74.4(C-12),38.4(C-13),50.9(C-14),16.9(C-15),24.0(C-16),163.8(C-17),132.5(C-18),23.0(C-19),73.0(C-20),16.7(C-21),16.4(C-22),21.2(C-23),77.8(C-24),171.5(C-25),18.4(C-26),15.9(C-27),170.1(CH3CO),21.9(CH3CO),172.1(C-1′),41.7(C-2′),69.3(C-3′),29.2(C-4′),10.0(C-5′)。以上数据与文献[12]报道一致,鉴定化合物7为honulactone I。
化合物8白色粉末,易溶于二氯甲烷;ESI-MS:m/z573.38 [M + H]+,分子式为C34H53O7。1H NMR (600 MHz,CDCl3)δ:5.58(1H,br t,J= 3.4 Hz,H-12),5.36(1H,q,J= 7.4 Hz,H-20),4.77(1H,q,J= 8.0 Hz,H-24),3.79(1H,m,H-3′),2.95(1H,s,HO-3′),2.03(3H,s,CH3CO),1.37(3H,d,J= 6.6 Hz,H-26),1.19(3H,s,H-23),1.08(3H,d,J= 6.4 Hz,H-27),0.95(3H,s,H-19),0.92(3H,t,J= 11.4 Hz,H-5′),0.86(3H,s,H-21),0.85(3H,s,H-22);13C NMR(150 MHz,CDCl3)δ:40.3(C-1),17.7(C-2),39.0(C-3),39.1(C-4),59.0(C-5),20.0(C-6),42.3(C-7),37.5(C-8),53.6(C-9),37.3(C-10),21.0(C-11),74.4(C-12),38.4(C-13),50.9(C-14),16.8(C-15),24.0(C-16),163.8(C-17),132.5(C-18),23.1(C-19),73.0(C-20),16.7(C-21),16.4(C-22),21.3(C-23),78.1(C-24),171.4(C-25),18.5(C-26),15.9(C-27),170.2(CH3CO),21.9(CH3CO),171.9(C-1′),41.6(C-2′),69.4(C-3′),29.1(C-4′),10.0(C-5′)。以上数据与文献[12]报道一致,鉴定化合物8为honulactone J。
化合物1~8的结构式见图4。
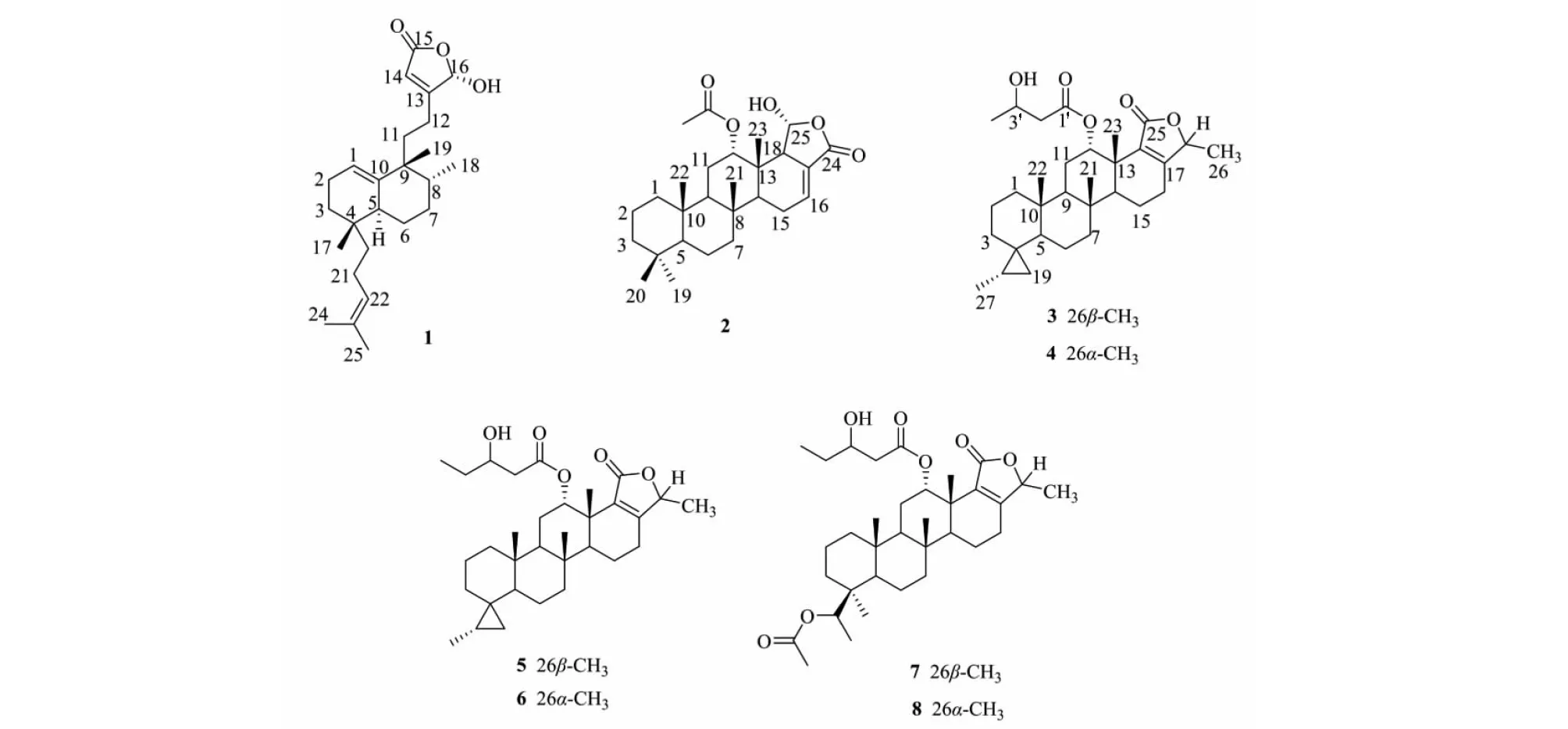
图4 化合物1~8的结构式Fig.4 Structures of compounds 1-8
2.2 生物活性测试
测定了化合物对脂多糖LPS诱导小鼠巨噬细胞RAW 264.7细胞NO释放的抑制作用,结果显示,在10 μmol/L时,化合物1具有显著的抗炎活性,抑制率为65.5%,化合物3和4具有较好的抗炎活性,抑制率为48.5% 和46.0%,且化合物1、3和4对小鼠巨噬细胞RAW 264.7无细胞毒性,抑制率分别为0.8%、4.0%和1.8%。其他化合物均为无活性。
3 结论
本文对中国南海永兴岛的海绵D.elegans的化学成分进行了研究,分离得到8个该属海绵罕见的二倍半萜类化合物,化合物1为新化合物,化合物2~8为首次从该海绵中分离得到。化合物2~8为Scalarane型二倍半萜类化合物,文献报道该类化合物主要从Hyatellasp、Phyllospongiasp.、Dysideasp.、Lendenfeldiasp.等海绵中分离得到[13],首次从D.elegans海绵分离得到的Scalarane型二倍半萜可能与这几种海绵的食物链或者共附生微生物有关。测定了8种化合物对脂多糖LPS诱导小鼠巨噬细胞RAW 264.7释放NO的抑制率,为了避免在抗炎评价过程中使用被试验化合物的对RAW 264.7细胞的细胞毒性,同时进行了CCK-8检测,结果显示,化合物1、3、4在10 μmol/L时具有较好的NO抑制作用,抑制率分别为65.5%,48.5%和46.0%,且对RAW 264.7细胞无细胞毒性。这些化合物可能在抗炎治疗中具有潜在的价值,但参与抗炎作用的具体机制有待进一步研究。
