基于TLR4/NF-κB通路研究诃子多糖对CIA模型大鼠及其肠黏膜屏障的影响*
2023-09-01董秋梅
刘 君,董秋梅
(内蒙古医科大学中医学院 呼和浩特 010100)
类风湿性关节炎(Rheumatoid arthritis,RA)是一种常见的慢性免疫介导疾病,在过去几十年的研究中,RA 的发病机制仍然没有被完全理解,世界人口的大约1%患有RA[1-2]。发病机制尚未明确,目前认为多与环境,遗传,肠道菌群等相关。有研究表明,肠道黏膜免疫在RA 病程中起着重要作用[3-4]。并且肠黏膜屏障功能障碍与关节炎的发病息息相关[5-6]。肠道作为机体消化、吸收的重要器官,肠黏膜是其重要保护屏障,也是人体的第一道防护体系,当肠黏膜结构被损伤,引起肠道细菌、内毒素等穿过肠黏膜屏障入侵机体,引起机体的炎症反应,使肠黏膜的通透性增加,肠内抗原受刺激活化,激活致病性系统性免疫反应,导致滑膜、软骨等损害[7-8]。同时,受损的肠组织会出现ZO-1、claudin-1、occludin-1 等蛋白减少,进而影响肠黏膜形态[9-10]。Toll 样受体4(Toll-like receptor 4,TLR4)是一种I 型跨膜蛋白,并表达于多种组织细胞中,可通过NF-κB 途径启动细胞内的信号转导[11]。TLR4 被激活会介导下游NF-κB 信号通路活化,在“肠黏膜屏障-关节轴”发病机制中起重要作用,并抑制相关炎性因子表达[12-13]。
诃子有良好的抗RA 效果,且治疗RA 的蒙医药复方大多含有诃子[14]。诃子含有多酚类活性成分,如诃子宁可抑制炎症因子的表达,从而延缓关节炎症的发生发展[15-16]。前期研究发现诃子提取物可有效调节CIA 模型大鼠肠道菌群构成,增加益生菌菌属,降低大肠杆菌数量,且通过药物分析法发现诃子多糖在诃子水提物中占比14.36%,含量较多[17]。推断诃子多糖可能具有调节CIA模型大鼠肠道免疫的功能。现代药理研究表明诃子多糖具有抗氧化,提高免疫等功效,且关于其提取纯化、提取工艺及含量测定的研究较多,尚未发现诃子多糖对CIA模型大鼠肠道免疫方面的影响[18-19]。本研究旨在探讨诃子多糖是否通过抑制TLR4/NF-κB 通路,调节CIA 模型大鼠肠黏膜屏障,进而缓解类风湿关节炎症状。
1 材料
1.1 动物
雄性SD大鼠,80只,SPF级;体重(170±10)g,鼠龄4-5 周,由北京科宇动物养殖中心提供,许可证编号:SCXK(京)2018-0010。饲养于内蒙古医科大学实验动物中心实验室。
1.2 主要试剂及仪器
诃子多糖(购自德思特生物公司提取的诃子多糖标准品,DST191023-196,经紫外分光光度仪检测纯度≥98%);甲氨蝶呤片(上海信宜药厂有限公司,H31020644)牛Ⅱ型胶原(Chondrex 公司,190306);不完全弗氏佐剂(Chondrex 公司,190425);NF-κBp50(Affinity 公司,AF6217);NF-κBp65(Affinity 公司,AF5006);TLR4(Affinity 公司,AF7017);IFN- γ(Affinity 公司,DF6045);ZO-1(Affinity 公司,AF5145);Claudin-1(Affinity公司,AF0127);Occludin-1(Affinity 公司,DF7504);SDS-PAGE 凝胶制备试剂盒(武汉百仟度生物科技有限公司,Ba1012);BCA 蛋白质浓度测定试剂盒(武汉百仟度生物科技有限公司,Ba1086);ECL 化学发光检测试剂盒(武汉百仟度生物科技有限公司,Ba1059);酶标仪(Thermo 公司,muLISKANMK3);4℃离心机(德国Eppendorf 公司,Centrifuge 5415R);扫描仪(EPSON公司,L4158)。
2 方法
2.1 实验动物分组
SD雄性大鼠80只,经1周饲养后将大鼠随机分为6组,并进行造模。筛选造模成功的大鼠60只,分成正常组、模型组、甲氨蝶呤组、诃子多糖高剂量组、诃子多糖中剂量组、诃子多糖低剂量组(经前期急性毒性实验测出诃子多糖高、中、低剂量组范围),每组10只。
2.2 造模及分组给药
从4℃冰箱中取出液体型牛Ⅱ型胶原和不完全弗氏佐剂,以1∶1的比例混合相同的量后,在离大鼠尾根部约1 cm 处各注射0.2 mL,除正常对照组外。7天后,再次进行强化免疫,剂量为每只0.1 mL[20]。免疫诱导21天后,将大鼠随机分为6组:正常组、模型组、甲氨蝶呤组、高、中、低诃子多糖组。大鼠分别给予6 g·kg-1、3 g·kg-1和1.5 g·kg-1浓度的诃子多糖,每天一次,以及0.3 mg·kg-1的甲氨蝶呤,每周2次[21],灌胃28天。
2.3 观察测量大鼠一般情况
每7 天观察一次大鼠皮毛、体色、食欲、活动和体重等一般情况,及爪关节有无红肿等变化。造模前使用游标卡尺测量大鼠后足足爪厚度,开始灌胃后每周测量1 次。使用关节炎指数(Arhtritic index,AI)评分记录关节炎的发生和严重程度,在此基础上分为5 个级别(0-4 级):0 级:未出现关节肿胀(0 分);1 级:小脚趾关节肿胀(1 分);2 级:趾关节和足底有肿胀(2 分);3 级:踝关节以下肿胀(3 分);4 级:整个踝关节肿胀(4 分)。上述采用肢体评分系统测定,累计得分AI 的最高分是16 分。RA 动物模型成功建立至少1 只踝关节出现肿胀,AI分数达4分或以上[22]。
2.4 标本采集
乙醚麻醉后开始取血,血液标本静置30 min 后置于(3000 r·min-1)离心机内离心10 min,取血清,-80℃保存待测。取血后,取下小肠组织和踝关节组织,清洗干净后,将其置于装有4%、10%的多聚甲醛采样杯中分别固定24 h和48 h。
2.5 ELISA 法检测CIA 大鼠血清IFN-γ、TLR-4 因子含量
按照试剂盒说明书及参照文献[23]操作方法,采用双抗体夹心法测定大鼠血清中IFN-γ、TLR4含量。主要操作步骤如下:将所用抗原用包被稀释液稀释到适当浓度(1∶200),每孔抗原加入100 µL,置37℃ 4,h,弃去孔中液体,封闭酶标反应孔,5%小牛血清置37℃封闭40 min,封闭时将封闭液加满各反应孔,并去除各孔中的气泡,封闭结束后用洗涤液满孔洗涤3 遍,每遍3 min。加入待检测样品,采用1∶200 的稀释度,将稀释好的样品加入酶标反应孔中,每样品至少加双孔,每孔100 µL,置于37℃,40-60 min。用洗涤液满孔洗涤3遍,每遍3 min。加入酶标抗体,每孔加100 µL,洗涤同前。加入底物液(现用现配):首选TMB-过氧化氢尿素溶液,OPD-过氧化氢底物液系统次之。底物加入量:每孔100 µL,置37℃避光放置3-5 min,加入终止液显色,OPD 显色后采用492 nm 波长,TMB 反应产物检测需要450 nm 波长。检测时一定要首先进行空白孔系统调零,用测定标本孔的吸收值与一组阴性标本测定孔平均值的比值。
2.6 CIA大鼠踝关节和小肠组织HE染色
将多聚甲醛固定好的组织常规梯度脱水、石蜡包埋,切片,进行HE 染色,做连续切片(4 µm)→将片子置于水浴锅(37℃)内展片→用标记好的防脱载玻片捞片→将载玻片置于恒温烤片机烤3 h(60℃)→二甲苯Ⅰ脱蜡10 min→二甲苯脱蜡Ⅱ10 min→无水乙醇5 min→95%乙醇5 min→90%乙醇5 min→80%乙醇3 min→蒸馏水3 min→苏木精染色10 min→流水冲洗→1%盐酸乙醇分化15 s→流水冲洗→伊红染色40 s→80%乙醇30 s→90%乙醇30 s→95%乙醇1 min×2次→无水乙醇3 min×2 次→二甲苯3 min×2 次→封片,光学显微镜下观察大鼠踝关节和小肠组织病理变化情况。
2.7 免疫组织化学法检测小肠组织中IFN-γ,TLR4及踝关节组织NF-κBp50,NF-κBp65的表达情况
参照文献[24],将包埋好的蜡块切片至4-5 mm 厚度,经脱蜡、水化、抗原修复后,PBS 冲洗3-5 次,分别滴加一抗IFN-γ,TLR4,NF-κBp50,NF-κBp65 抗体,4℃过夜。滴加二抗,37℃孵育60 min,DAB 显色,自来水反复冲洗,HE复染,脱水、封片,于100倍镜下照相,固定面积值,求各因子平均蛋白表达结果。
2.8 Western Blot 法检测小肠组织上ZO-1、claudin-1、occludin-1蛋白的表达
按照试剂盒说明提取蛋白质,根据文献[25]记录方法,测定蛋白浓度后,对蛋白进行变性处理。每孔采集总蛋白100 µg,每块胶水恒流电源15 mA进行电泳。转膜后用含5%脱脂奶粉的TBST 室温封膜2 h。一抗ZO-1、claudin-1、occludin-1 和GAPDH 分别稀释为1∶250、1∶250、1∶250和1∶1000。将冰箱置于4℃下过夜。用TBST 冲洗PVDF 膜3 次,5 min。将PVDF 膜置于酶标二抗(稀释:1∶1000)中,室温孵育2 h。用TBST 冲洗膜3 次,5 min。反应5 分钟后,荧光带明显,用滤纸吸收多余的衬底液,在天能自动化学发光分析仪中曝光并拍照。将各组ZO-1、claudin-1、occludin-1 的相对蛋白表达水平与GAPDH(靶蛋白ID/内参ID)进行综合灰度值比较。
2.9 统计方法
实验数据均属于计量资料,首先进行正态分布检验,符合用均值±标准差()表示。其次进行方差齐性检验,若方差齐,使用单因素方差分析;方差不齐,用Games-Howell 检验进行统计分析。实验数据使用SPSS21.0 软件统计分析,P<0.05 或P<0.01,提示差异具有统计学意义。
3 结果
3.1 诃子多糖对各组大鼠足掌厚度变化影响
造模前,各组大鼠足掌厚度无差异。造模成功后,各组大鼠足掌相继开始增厚,变红肿。与正常组比较,差异有统计学意义(P<0.01);随用药时间增加,模型组大鼠足掌增厚程度严重,各用药组足掌变厚厚度与模型组比较(P<0.01),其中诃子多糖高剂量组和甲氨蝶呤组下降最快,诃子多糖高剂量组与甲氨蝶呤组相比,两者无明显差异(P>0.01),见表1。

表1 诃子多糖对CIA大鼠足掌厚度的影响(n=10)
3.2 诃子多糖对各组大鼠关节炎指数变化影响
正常组大鼠踝关节及脚趾无红肿,关节炎指数为0。模型组及用药组大鼠AI 指数均高于正常组(P<0.01)。实验灌胃前,各组大鼠关节炎指数与正常组相比,有明显差异(P<0.01);随着灌胃时间增加,用药组大鼠关节红肿程度明显下降,甲氨蝶呤组与诃子多糖中、低剂量组相比有显著性差异(P<0.01),和高剂量组相比,无明显差异(P>0.01),见表2。

表2 诃子多糖对CIA大鼠关节炎指数的影响(n=10)
3.3 诃子多糖对CIA大鼠血清IFN-γ、TLR4含量水平的影响
ELISA 结果示,模型组大鼠血清IFN-γ、TLR4 因子含量较正常组及各用药组显著增多(P<0.01);与模型组相比,甲氨蝶呤组及诃子多糖各组治疗后因子水平明显下降(P<0.01),IFN-γ、TLR4 在甲氨蝶呤组、诃子多糖高剂量组间无明显差异(P>0.01);诃子多糖中、低剂量组的IFN-γ、TLR4 表达无明显差异(P>0.01),见表3。
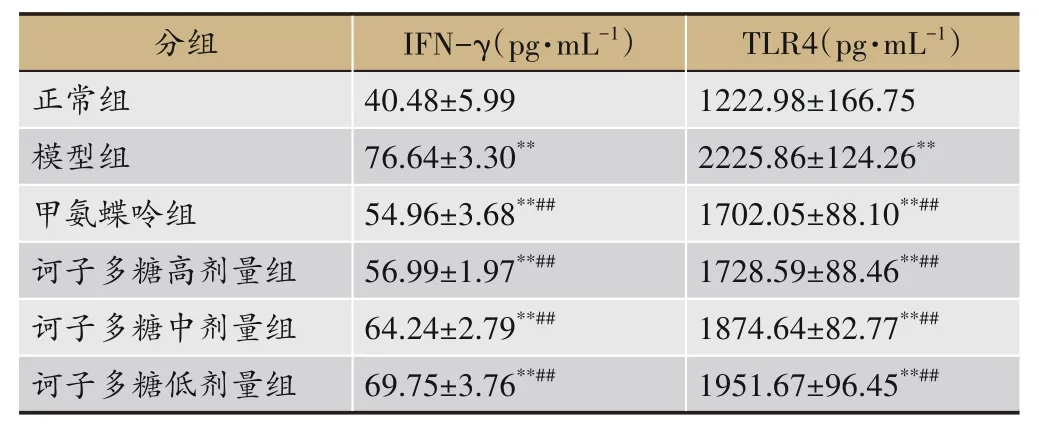
表3 诃子多糖对CIA大鼠血清IFN-γ、TLR4水平的影响(n=10)
3.4 诃子多糖对CIA大鼠关节组织病理学观察
HE 结果显示,正常组踝关节结构正常,滑膜细胞排列整齐,未见异常滑膜增生,未见炎性细胞的浸润,没有软骨破坏和新生血管等病理改变;模型组关节结构严重受损,伴有软骨细胞严重变性坏死,滑膜纤维组织异常增生,炎性细胞浸润;诃子多糖高剂量组和甲氨蝶呤组关节腔内有少量炎性细胞浸润和少量滑膜增生,诃子多糖中、低剂量组治疗效果不明显,较其它治疗组改善情况较弱(图1)。

图1 诃子多糖对CIA大鼠踝关节组织病理的影响(100×)
3.5 诃子多糖对CIA大鼠肠道组织病理学观察
HE 结果显示:正常组肠道组织结构正常,粘膜上皮细胞排列整齐,未见减少或脱落;粘膜未见炎性细胞;模型组肠道组织结构损坏严重,大量炎性细胞浸润,肠粘膜水肿、溃疡严重,腺体杯状细胞减少;甲氨蝶呤组和诃子多糖高组肠绒毛排列整齐,部分脱落,肠粘膜见轻微水肿,部分有少量炎性细胞;诃子多糖中组肠绒毛排列尚可,肠粘膜中度水肿,有中性粒细胞、淋巴细胞浸润,腺体杯状细胞减少;诃子低组肠绒毛排列较乱,肠粘膜重度水肿,出现大量炎性细胞浸润;诃子多糖组高剂量组和甲氨蝶呤组出现轻度肠组织结构异常,诃子多糖中、低剂量组治疗效果较弱(图2)。

图2 诃子多糖对CIA大鼠小肠组织病理的影响(100×)
3.6 诃子多糖对CIA 大鼠肠道IFN-γ,TLR4 表达的影响
免疫组化结果显示:与正常组相比,各组IFN-γ因子表达均升高(P<0.05),TLR4 表达显著增高(P<0.01);与模型组相比,各组IFN-γ、TLR4 阳性表达明显降低(P<0.05);与甲氨蝶呤组相比,诃子多糖高、中、低剂量组有显著性差异(P<0.01),见表4。
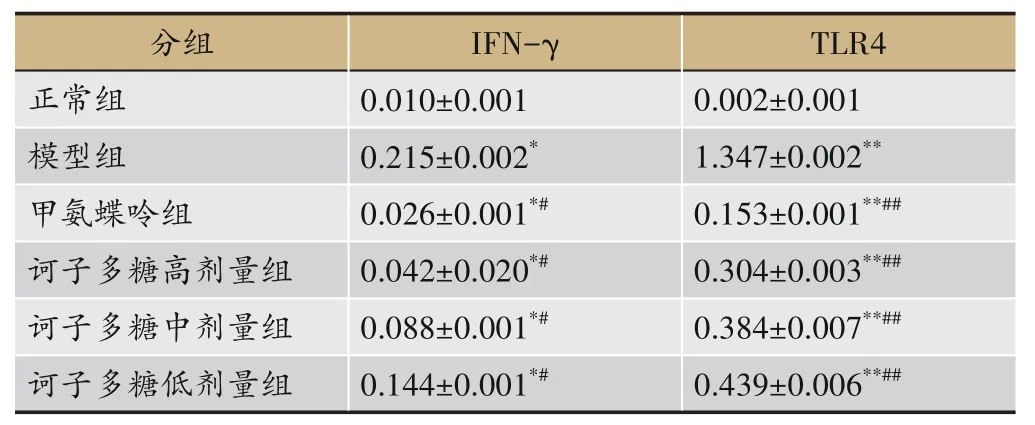
表4 诃子多糖对CIA大鼠小肠组织IFN-γ,TLR4表达的影响(n=10)
3.7 诃子多糖对CIA 大鼠关节NF-κBp50、NF-κBp65表达的影响
免疫组化结果显示:与正常组相比,各组NFκBp50、NF-κBp65 因子表达差异显著(P<0.01);与模型组相比,各组因子表达显著降低(P<0.01);与甲氨蝶呤组相比,各组有显著性差异(P<0.01),见表5。
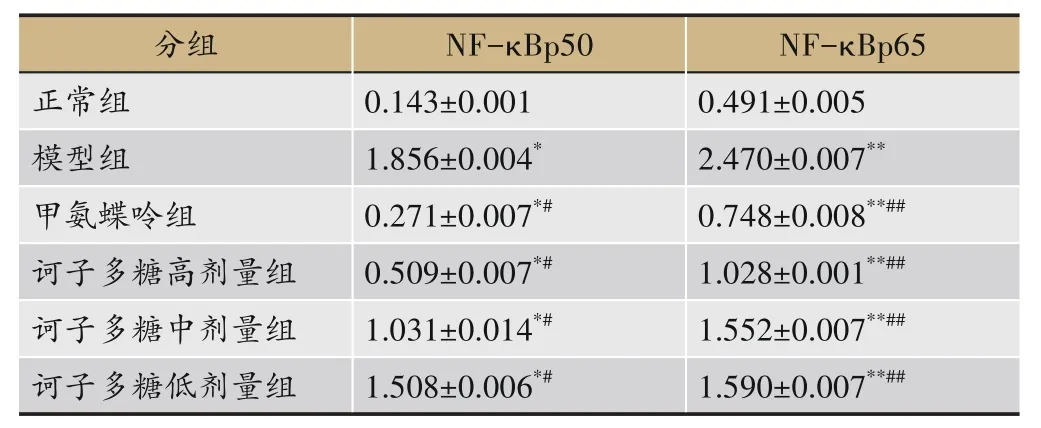
表5 诃子多糖对CIA大鼠踝关节组织NF-κBp50、NF-κBp65表达的影响(n=10)
3.8 诃子多糖对CIA 模型大鼠小肠组织上ZO-1、claudin-1、occludin-1蛋白的影响
Western blot 结果显示:甲氨蝶呤组的ZO-1、claudin-1、occludin-1 蛋白与正常组相比,无统计学意义(P>0.05);诃子多糖高、中、低剂量组的ZO-1、claudin-1 与正常组比,差异有统计学意义(P<0.05),诃子多糖高、中剂量组与模型组相比,差异有统计学意义(P<0.05),而诃子多糖低剂量组的occludin-1 与模型组相比,无显著性差异(P>0.05),见图3-4。

图3 诃子多糖对CIA大鼠小肠组织中ZO-1、claudin-1及occludin-1蛋白表达的影响

图4 诃子多糖对CIA大鼠小肠组织中ZO-1、claudin-1及occludin-1蛋白表达的影响
4 讨论
NF-κB 在RA 中扮演着至关重要的角色,p50 和p65是NF-κB通路在细胞中最常见、最主要的形式,且经过二聚活化后可调控众多细胞因子的表达,导致大量炎症细胞浸润,引起或加重机体炎症反应[26-27]。NFκB 的激活可提高TNF-α、IL-1β、IL-6、IL-8 等因子的转录水平[28-30]。INF-γ 的表达与RA 及肠道炎症反应相关,并影响NF-κB 的激活[31-32],而TLR4 通过活化NF-κB 通路使其转入核内,启动炎症反应,导致IL-6、IL-17、IL-1β 等炎症因子释放,加剧滑膜炎产生[33-34]。本研究观察发现诃子多糖有效降低CIA大鼠血清和小肠组织IFN-γ、TLR4 的表达,降低滑膜组织NFκBp50、NF-κBp65炎症因子。诃子多糖可以有效治疗CIA 大鼠关节炎症状,并缓解其肠道炎症反应,进一步证实多糖是抗RA 和调节肠道免疫的重要活性成分,且诃子多糖可通过抑制TLR4/NF-κB 通路,作为类风湿关节炎及其肠黏膜屏障之间的阻断剂。
相关研究指出肠道微生物群引起的肠黏膜屏障失衡,激活TLR4/NF-κB 通路,加重肠黏膜炎症反应,反之,TLR4/NF-κB 信号通路因子的激活,引起肠上皮炎症[35-36]。“肠黏膜-关节”轴与TLR4/NF-κB 的发生密切相关,大量炎症因子浸润,包括TLR4、NF-κBp50、NF-κBp65的异常表达激活TLR4/NF-κB通路,导致肠黏膜屏障损坏,大量有害物质入侵,经血液循环引起全身免疫反应,诱发关节炎症,这也证实肠黏膜与类风湿关节炎间的相关性[37]。肠黏膜屏障完整性依赖于Occludin、ZO-1、Claudin-1 等紧密连接蛋白的表达情况,该蛋白是肠黏膜上皮细胞间的连接蛋白,可封闭细胞间隙,保护肠黏膜避免有害物质穿过细胞间隙引起肠道炎性改变,具有保护肠道屏障的作用[38-40]。本实验发现CIA 大鼠模型组的小肠组织上ZO-1、claudin-1、occludin-1 蛋白表达异常,明显高于正常组和用药组,表明肠黏膜屏障结构的完整性与紧密连接蛋白含量相关,与文献报道一致。
诃子及其提取物或有效成分作用显著,具有抗炎、抗癌、调节免疫、抗氧化活性、抑菌、降血糖等多种药理作用[41-42],并且可以有效缓解类风湿关节炎症状,对肠黏膜有一定的保护作用,但具体是哪种活性成分可以调节这两种免疫性疾病,还缺乏系统的机制研究。本研究以诃子中的多糖为干预药物,通过建立CIA 大鼠模型,发现诃子多糖可能介导TLR4/NF-κB通路上相关炎性因子表达,增加肠道紧密连接蛋白,降低肠道通透性,保护肠黏膜屏障,从而缓解类风湿关节炎症状。明确了诃子多糖具有调节RA 与肠黏膜屏障的双重作用,为中医药治疗RA提供新思路。
