基于网络药理学及实验验证探讨甘草苷治疗帕金森病的作用机制*
2023-09-01曲欣妮李文标沈隽吉殷宇晴徐缘博何建成许言午
曲欣妮,李文标,王 利,沈隽吉,殷宇晴,徐缘博,何建成,许言午
(上海中医药大学基础医学院生物化学教研室,上海中医药大学基础医学院中医诊断教研室,上海市健康辨识与评估重点实验室 上海 201203)
帕金森病(Parkinson's disease,PD)是一种常见于中老年人的神经退行性疾病。近年来,其年龄标准化患病率、伤残调整寿命年率和死亡率均呈上升趋势。其病理特征是人体中脑黑质致密部多巴胺能神经元的进行性变性,导致纹状体多巴胺缺失和细胞内α-突触核蛋白聚集。临床主要表现为运动迟缓、震颤、肌肉强直、姿势不稳。帕金森病发病机制复杂,多数学者认为可能与氧化应激、线粒体功能障碍、病毒性感染、钙平衡失调、免疫和凋亡等有关[1-2]。其中,通过抗凋亡途径保护受损的神经元一直是改善帕金森病重要的研究方向,相关药物的研究也不断引起科学家的兴趣和关注[3-4]。
中医治疗帕金森病常见处方组合繁多,围绕中医关于帕金森病的认识,以补元、活血、解毒、祛风为主要治则,多用当归、人参等补药,配合甘草等调和,辩证应用祛风、祛瘀药。其中,甘草具有补中益气、清热解毒、缓急止痛、调和诸药等诸多功效,是中医临床用于治疗帕金森病的常用中药,为帕金森病经典方剂芍药甘草汤(《伤寒论·太阳篇》)及其他临床帕金森病常用中药方剂的重要组成药物,为中医各家普遍接受和认可,并被现代实验研究所证实[5-7]。越来越多的研究显示,甘草在诸多方剂对帕金森病等神经退行性疾病的治疗中发挥作用。临床试验表明,施以芍药甘草汤加减[8-9]或甘草单味药[10]均可以有效改善帕金森病患者的相关症状。现代药理学实验也表明,甘草的活性成分甘草黄酮[11]、甘光草定[12]、甘草酸[13-14]以及异甘草素[15]对MPTP、6- 羟基多巴胺(6-hydroxydopamine,6-OHDA)或鱼藤酮等神经毒素诱导的帕金森病模型均具有神经保护作用。但关于甘草中的黄酮类化合物甘草苷在甘草治疗帕金森病中的作用,尚无文献报道。但相关证据显示,甘草苷能促进PC12 细胞轴突的生长、海马神经元轴突延长及诱导神经干细胞体外定向分化为胆碱能神经元[16-17]。Teng 等[18]研究表明甘草苷可以通过调节ERK 和AKT/GSK-3β 途径,修复谷氨酸诱导的PC12 细胞损伤。上述研究提示,甘草苷具有治疗帕金森病的潜力,其具体作用机制也有待阐明。
网络药理学融合了系统生物学、生物信息学和网络分析等学科理念,与中药多成分、多靶点协同发挥药效的原理相适应。运用此方法初探复方、单味中药或单体化合物治疗疾病的机理,可为后续的实验方向和机制验证提供重要的参考。本研究中,我们选取甘草苷治疗帕金森病潜在的作用靶点,构建“药物-疾病-靶点”网络和蛋白质-蛋白质相互作用(Proteinprotein interaction,PPI)网络,然后进行GO、KEGG分析及网络关键分子的分子对接,并通过Western blot实验对凋亡通路关键蛋白Caspase-3、Bax 和Bcl-2 的表达和活化水平进行检测,旨在为探讨甘草苷治疗帕金森病的有效性及潜在的作用机制提供依据和参考。
1 方法
1.1 甘草苷治疗帕金森病的网络药理学分析
1.1.1 获取甘草苷的作用靶点
通过PubChem 获得甘草苷不同格式的结构文件,通过BATMAN-TCM(Score cutoff≥5)(http://bionet.ncpsb.org.cn)、PharmMapper (http://www.lilab-ecust.cn)、SEA(http://sea. bkslab. org)、SuperPred(https://prediction.charite.de/)、Swiss Target Prediction (http://www.swisstargetprediction)等数据库获取甘草苷的作用靶点。通过Uniprot 数据库,将靶点名称进行标准化,去除重复靶点合并建立甘草苷靶点数据集。
1.1.2 收集帕金森病相关基因
以“parkinson's disease”为检索词,分别从GeneCards(https://www.genecards.org./)、OMIM(https://www.omim.org)、CTD(https://ctdbase.org/)等数据库收集帕金森病相关基因,去除重复基因合并建立帕金森病相关基因数据集。
1.1.3 构建“药物-靶点-疾病”网络
将甘草苷靶点数据集与帕金森病相关基因数据集相交,得到交集靶点数据集,是甘草苷治疗帕金森病的潜在作用靶点。将交集靶点、药物(甘草苷)及疾病(帕金森病)名称导入Cytoscape 3.7.2 软件,构建“药物-靶点-疾病”网络并进行可视化。
1.1.4 建立PPI网络
使用Cytoscape 的BisoGenet 插件,导入交集靶点,构建PPI网络。利用CytoNCA 插件进行网络拓扑结构分析,计算度中心性(Degree centrality,DC),中介中心性(Betweenness centrality,BC)等参数,并分别根据DC>74 和BC>600 依次筛选获得核心PPI 网络及核心网络基因。
1.1.5 GO功能分析与KEGG通路分析
使用R3.6.2 软件,利用Bioconductor 的org.Hs.eg.db,colorspace,stringi,DOSE,clusterProfile,pathview,ggplot2 和limma 等程序包,对核心网络基因进行基因ID 转换及GO 功能分析和KEGG 通路分析(校正P<0.05为标准)并进行结果的可视化。GO功能分析主要包括生物过程(Biological process,BP)、细胞组分(Cellular component,CC)和分子功能(Molecular function,MF)3 大类,分别选择三者中校正P值最小的前10 个条目进行展示。由于网络药理学的分析结果须遵循概率论原则,应是本质上具有统计学意义的预测性结论,且结果的客观性和准确性必须通过实验加以验证。因此,本研究选择具有统计学意义、已知参与帕金森病发生发展的重要机制、与本实验室前期研究高度相关及目前领域内研究热点相关的条目进行可视化。因此,KEGG 分析中选择感兴趣的15 条显著富集的通路进行可视化。
1.1.6 “基因-通路”网络分析
使用Cytoscape 3.7.2 软件,导入前20 条显著富集的KEGG 通路及其相关的核心网络基因,构建“基因-通路”网络,并根据DC 大小将它们进行可视化,以筛选甘草苷治疗帕金森病的关键靶点。
1.1.7 分子对接
将甘草苷与“基因-通路”网络中值较大的关键靶点进行分子对接。从PubChem 数据库下载甘草苷的SDF 结构,调用OpenBabel 2.4.1 转化为mol2 格式,使用AutodockTools 1.5.6 打开配体小分子,并进行加氢、加电荷、检测配体等操作,并保存为pdbqt 文件。靶点的三维结构从RCSB Protein Data Bank 数据库下载得到,作为对接所用的受体蛋白源文件。在AutodockTools1.5.6 中打开通过添加所有的氢原子、计算Gasteiger 电荷、合并非极性氢后,将其定义为受体并保存成pdbqt文件。采用Autodock vina 1.1.2进行半柔性对接,选取affinity 最佳的构象,作为最终的对接构象。选取对接结合能量最低的构象用于对接结合模式分析,并使用PyMOL作图。
1.2 甘草苷治疗帕金森病的实验验证
1.2.1 细胞株
SH-SY5Y(人神经细胞母细胞瘤细胞)细胞株(PWE-HU026)购自大连美仑生物科技有限公司。
1.2.2 主要药品、试剂及仪器
6-OHDA(J1110A)、L-抗坏血酸钠(D121212A)、DMEM/F12 培养基(PWL005)购自大连美仑生物技术公司;甘草苷(B20414),购自上海同田生物技术有限公司;胰酶(25200056),胎牛血清(04-001-1a),购自Gibco 公司;MTT(MC2128),购自Biosharp 白鲨生物科技公司;青霉素和链霉素溶液(60162ES76)购自上海中韬生物科技有限公司;一抗抗体β-actin(66009-1-l g)、Caspase-3/p17(19677-1-AP)、Bcl2(12789-1-AP)、Bax(50599-2-l g),均购自Proteintech 抗体公司;HRP 标记的羊抗兔二抗抗体(HA1001)购自杭州华安生物技术有限公司。光学显微镜(DGX-9003B)、多功能酶标仪(Gene.Company.Limited 公司 、型号BioTek.Synergy.2)、高速离心机(Eppendorf、型号Centrifuge 5417R)、垂直电泳仪及转膜仪(Bio-Rad、货号043BR41664)、化学发光仪(美国Protein Simple、92-15312-00(220)。
1.2.3 细胞培养
用含有10%的胎牛血清及1%双抗(青霉素和链霉素溶液)的DMEM/F12 培养基,置于5% CO2、37℃恒温培养箱培养SH-SY5Y 细胞。当细胞汇合度达80%-90%时,PBS清洗1次后,加入0.25%胰酶消化传代或接种到96孔板进行培养处理。
1.2.4 帕金森病细胞模型建立
1.2.5 实验分组及甘草苷干预
称取甘草苷溶于DMSO,配成100 mmol·L-1甘草苷溶液,-20℃保存备用。实验分为正常组、模型组、溶剂对照组及给药组,设为6 个复孔。按前述方法接种细胞,用不同浓度的甘草苷溶液(20 µmol·L-1、40 µmol·L-1、60 µmol·L-1、80 µmol·L-1、100 µmol·L-1)与6-OHDA共处理细胞,作为给药组。同时用相同浓度的甘草苷直接作用于正常细胞,观察其对细胞的毒副及促增殖作用。培养箱孵育24 h后用MTT法测定各组细胞活力,选择甘草苷发挥最佳保护作用且无明显毒性和促增殖作用的浓度作为后续实验的用药剂量。
1.2.6 MTT法测定细胞活力
将细胞悬液按1×104个/孔接种至96 孔板,同时设置空白对照孔。给药处理结束后,按每孔体积比培养基:MTT(5 mg·mL-1)=100:15 以换液的形式加入MTT,孵育4 h。吸去上清,按每孔100 µL 加入DMSO,溶解生成的甲臜颗粒。用酶标仪在570 nm 的波长下测定吸光度值(OD)。
1.2.7 Western blot法测定蛋白含量
实验终点吸去培养皿中的培养基,用4℃预冷的PBS 清洗2 次。加入裂解液于冰上裂解细胞,细胞刮刮取细胞收集至EP 管。4℃,14000 rpm 离心15 min。取上清用BCA 法进行蛋白定量,使各组蛋白上样质量为20 µg,总体积为20 µL。金属浴100℃加热10 min。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离总蛋白,设置电压80 V,40 min 使蛋白从上层胶进入下层胶,后改用120 V,80 min 使不同分子量的蛋白分离。转膜用孔径为0.22 µm 的PVDF 膜,200 mA,70 min。5%脱脂牛奶作为封闭液室温封闭1 h。根据目的蛋白分子量大小剪膜,4 ℃过夜孵育一抗:β-actin(1∶5000),Bax(1∶5000),Bcl-2(1∶2500),Caspase-3/P17(1∶1000)。TBST 洗膜,室温孵育二抗1 h。TBST 洗膜,使用ECL 发光液进行显影成像。利用Image J软件对蛋白条带的灰度值进行分析。
1.2.8 数据处理及统计方法
①宪法乃九鼎重器。宪法明确规定中国是依法治国的国家。公民法制意识的提高和全社会法制水平的提高是实现“法治”的基本前提。而国家机关“谁执法谁普法”责任制是不断加强法治教育,提高整个社会法制水平的重要途径。二者因果相关,不可割裂。
运用GraphPad Prism 8 软件对实验数据进行处理,多组间比较采用单因素方差分析,以P<0.05 为显著性标准。
2 结果
2.1 网络药理学分析及预测结果
2.1.1 甘草苷靶点、帕金森病相关基因获取及“药物-靶点-疾病”网络构建
经多个数据库检索及预测,删除重复靶点,共获得343 个甘草苷靶点,1328 个帕金森病相关基因。将甘草苷靶点与帕金森病相关基因取交集,得到46个甘草苷治疗帕金森病的潜在作用靶点(见表1)。以上述交集靶点、甘草苷和帕金森病为网络节点,建立“药物-靶点-疾病”网络,见图1。

图1 甘草苷治疗帕金森病潜在靶点获取与“药物-靶点-疾病”网络构建

表1 甘草苷与帕金森病的共有靶点
2.1.2 甘草苷治疗帕金森病潜在靶点的PPI网络构建及核心PPI网络筛选
甘草苷与帕金森病交集靶点构建的初级PPI网络共有2864 个节点和70168 条边(图2A)。按照DC>74的拓扑筛选,获得PPI 子网络,该网络由560 个节点和23205 条边组成(图2B)。进一步按BC>600 筛选获得核心PPI 网络,包括108 个节点和2298 条边(图2C)。甘草苷可能主要通过直接或间接调控这些核心网络基因发挥治疗帕金森病的作用。

图2 甘草苷治疗帕金森病潜在靶点PPI网络构建及核心网络筛选
2.1.3 GO功能分析结果
对上述核心PPI 网络的108 个靶蛋白进行GO 功能分析,共富集到1543 个GO 条目(校正P<0.05)。其中,BP 有1291 个条目,主要包括凋亡调控、DNA 合成及分解代谢过程、RNA 分解代谢过程和细胞周期、节律;CC 有112个条目,主要有核染色质、粘着斑、细胞-底物黏合连接;MF 有140 个条目,涉及泛素蛋白连接酶结合、泛素样蛋白连接酶结合和磷酸酶结合等。各类别校正P值最小的前10 个富集结果进行可视化,如图3所示。核心靶点可能通过上述过程介导甘草苷对帕金森病的治疗。
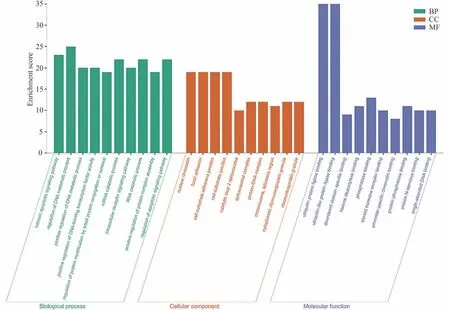
图3 核心靶点的GO功能分析柱状图
2.1.4 KEGG通路分析结果
为进一步阐释甘草苷治疗帕金森病的作用机制,对核心PPI网络的108个靶蛋白进行KEGG通路分析。共得到97 条富集结果(校正P<0.05),部分通路如图4所示,包括凋亡、PI3K-AKT、NF-κB、TGF-β、FoxO、HIF-1 等相关信号通路。提示这些通路相互调节,协同参与甘草苷帕对金森疾病的治疗。

图4 核心靶点的KEGG通路分析条图
2.1.5 “基因-通路”网络分析结果
使用前20 条通路及其相关的70 个基因构建了“基因-通路”网络(图5A)。图中的橘色矩形表示基因,红色V 形表示通路。节点形状的大小与节点的连接度成正比。其中TP53、AKT1、RELA 具有最高的连接度,分别参与了16、14、12 条信号通路,表明它们可能是甘草苷治疗帕金森病的关键靶点。

图5 “基因-通路”网络图及甘草苷与关键靶点的分子对接
2.1.6 分子对接结果
将甘草苷与“基因-通路”网络中“degree”值较大的前3 个基因TP53(degree=16)、AKT1(degree=14)及RELA(degree=12)进行了分子对接,结果见图5B。从图可以看出,甘草苷在TP53、AKT1 及RELA 的活性口袋中呈现出紧凑的结合模式,甘草苷与它们形成氢键作用,使得蛋白与甘草苷形成稳定的复合物。一般认为结合能≤-5.0 kcal·mol-1说明两者可以结合,结合能≤-7.0 kcal·mol-1说明有较好的结合能力。由表1 可以看出,甘草苷与AKT1 有很好的结合能力,与TP53 和RELA 亲和力也接近-7.0 kcal·mol-1,进一步证明了网络药理学预测的可靠性。
2.2 实验验证结果
2.2.1 6-OHDA损伤SH-SY5Y模型建立
结果显示,随着6-OHDA 浓度的增加,SH-SY5Y细胞存活率逐渐降低。与正常组相比,各剂量组均具有显著性差异(P<0.001)(图6A,表2)。

图6 不同浓度6-OHDA对SH-SY5Y细胞存活的影响,以及不同浓度甘草苷对6-OHDA损伤SH-SY5Y细胞的保护作用
表2 不同浓度6-OHDA对SH-SY5Y细胞存活的影响(,n=8)

表2 不同浓度6-OHDA对SH-SY5Y细胞存活的影响(,n=8)
注:与对照组相比,***P<0.001。
?
IC50曲线图显示6-OHDA对SH-SY5Y细胞的半数抑制浓度为50.77 µmol·L-1≈50 µmol·L-1(图6B),故选定此浓度为模型浓度。
2.2.2 甘草苷对6-OHDA损伤细胞存活的影响
结果显示,甘草苷可以剂量依赖地保护6-OHDA损伤细胞(P<0.01 或P<0.0001),并在100 µmol·L-1处发挥最佳的保护效果(图6C,表3)。进一步的实验表明,各浓度甘草苷对正常细胞无明显的毒性和促增殖作用(图6D,表4)。因此在本研究的量效范围内,选定100 µmol·L-1作为甘草苷的后续实验用药剂量。
表3 不同浓度甘草苷对6-OHDA损伤SH-SY5Y细胞的保护作用(,n=10)

表3 不同浓度甘草苷对6-OHDA损伤SH-SY5Y细胞的保护作用(,n=10)
注:与对照组相比,**P<0.01,与6-OHDA组相比,&&&&P<0.0001。
?
表4 Liquritin对SH-SY5Y细胞存活的影响(,n=6)

表4 Liquritin对SH-SY5Y细胞存活的影响(,n=6)
?
2.2.3 甘草苷对凋亡相关蛋白表达的影响
网络药理学的GO 及KEGG 分析结果均富集到凋亡相关生物学过程及信号通路,因此通过Western blot的方法对凋亡相关蛋白Bax、Bcl-2 和Caspase-3 的表达/活化量进行分析,以验证甘草苷对它们的调控作用。如图7A 所示,与正常组相比,模型组的Bax、Cleaved-Caspase-3 表达明显升高(P<0.05),Bcl-2 表达显著下降(P<0.001)。模型组与溶剂对照组相比,各蛋白表达变化无明显差异(P>0.05)。而给以甘草苷处理后,与模型组相比,Bax、Cleaved-Caspase-3 表达则明显减少(P<0.05),Bcl2表达显著增加(P<0.01)。
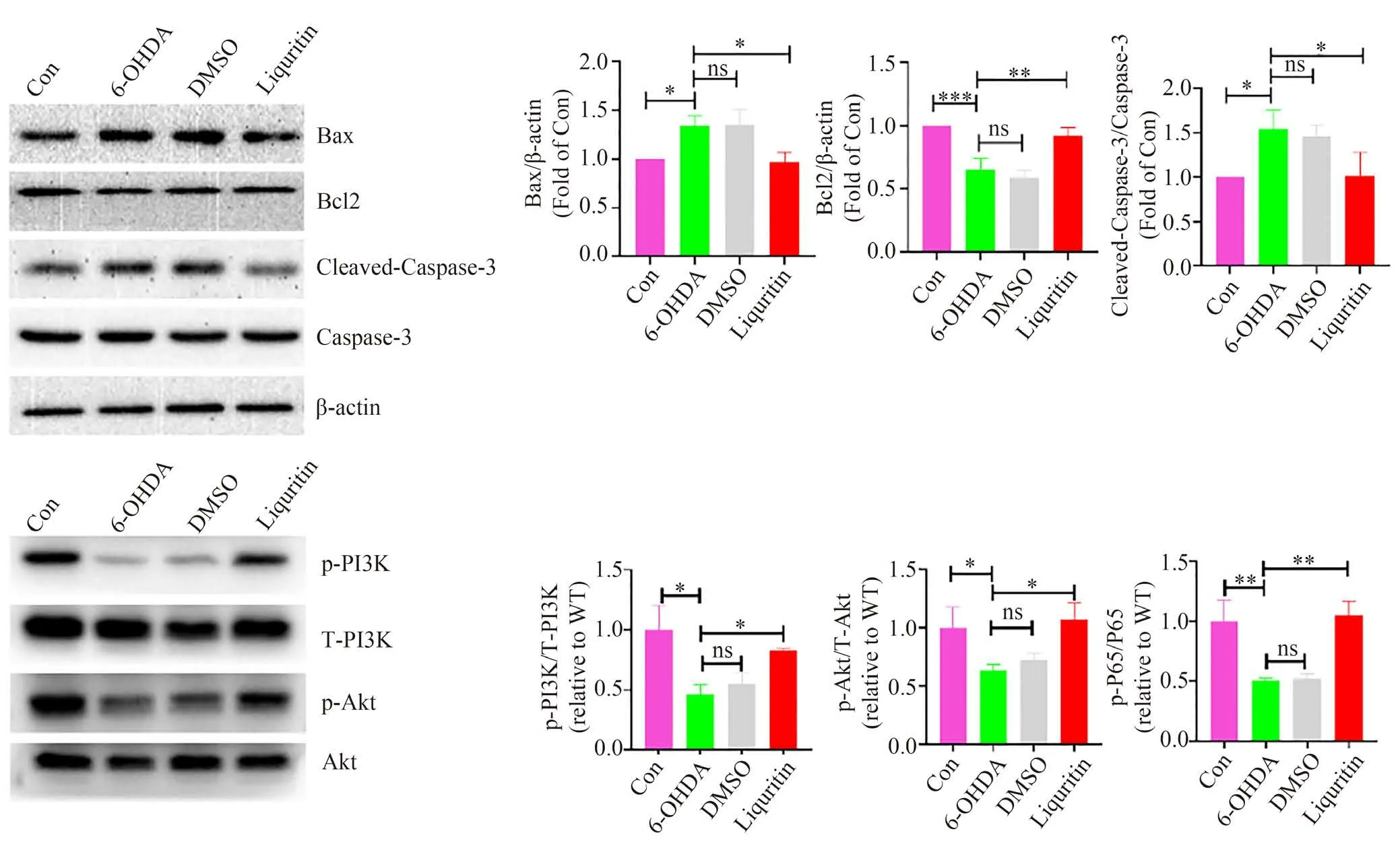
图7 甘草苷对凋亡相关蛋白Bax、Bc12、Cleaved-Caspase-3,通路关键蛋白p-PI3K、p-Akt的表达及活化的影响
2.2.4 甘草苷对通路关键蛋白表达的影响
如7 所示,与正常组相比,模型组的p-PI3K、p-Akt 磷酸化水平明显降低(P<0.05)。模型组与溶剂对照组相比,各蛋白磷酸化水平则无明显变化(P>0.05)。在给与甘草苷处理后,p-PI3K、p-Akt 磷酸化水平显著提高(P<0.01)。
3 讨论
已有的研究表明,甘草苷具有抗氧化、抗凋亡的药理作用[19-20],能够促进神经元生长和保护受损的神经细胞[16-18]。因此,甘草苷是一种治疗神经损伤相关性疾病十分有前景的化合物。然而其对神经退化性疾病——帕金森病是否具有治疗作用尚未见报道。因此,本研究运用网络药理学的方法分析了甘草苷治疗帕金森病的可能分子机制;并用6-OHDA 诱导的帕金森病细胞损伤模型,验证了甘草苷神经元保护作用的有效性并对其对凋亡通路关键分子表达与活性的调控作用进行了初步验证。
对甘草苷治疗帕金森病核心PPI 网络基因的GO功能分析和KEGG通路富集分析的结果显示,GO功能富集条目主要包括凋亡调控、细胞周期与节律、DNA合成及分解代谢、RNA 分解代谢、粘着斑、细胞-底物黏合连接;KEGG 通路富集结果主要涉及凋亡、PI3KAKT、NF-κB、TGF-β、HIF-1、FoxO 等97 条信号通路。并且由“基因-通路”网络筛选出的关键靶点TP53、AKT1 和RELA 均与凋亡密切相关。多项研究结果表明:凋亡在多巴胺能神经元丢失过程中起到核心作用,抗凋亡是相关药物发挥对PD 治疗作用的重要靶点和途径[21-23]。有关PD 患者的尸检结果表明:Bax 蛋白的存在及其向线粒体外膜的易位可能导致PD 中多巴胺能神经元的死亡[24-25]。此外,在PD患者的SNpc多巴胺能神经元中发现了Caspase-3 的活性增加[26]以及Caspase-8 和Caspase-9[27-28]的激活。α-synuclein 是散发性PD 中路易小体的主要成分之一[29-30],有研究表明,过表达α-synuclein 可以通过激活Caspase-9 和Caspase-3,在体内诱导凋亡杀死多巴胺能神经元。以上结果提示,对细胞凋亡的调控可能是甘草苷治疗帕金森病的重要机制。据此我们进行了关键靶点对接和对凋亡通路关键蛋白的实验验证。
TP53/P53,是一种调节DNA 稳定性、细胞正常生长、增殖和损伤修复的重要转录因子。细胞处于应激状态或损伤不可逆时,TP53会转移到线粒体,与Bcl-2结合并释放Bax/Bak 形成线粒体通透性转换孔,导致细胞周期阻滞,继而引发凋亡或是衰老。p53 过表达引起的线粒体功能障碍是帕金森病发生的重要因素[31]。AKT1 是一种丝氨酸/苏氨酸蛋白激酶,属于AKT 家族蛋白(包括AKT1、AKT2 及AKT3),催化众多细胞底物,参与多种信号通路的调节。在帕金森病模型中,AKT1 的氧化修饰导致其去磷酸化,其激酶活性丧失,引起黑质致密部神经元变性[32-33]。研究表明,与无姿势不稳定的帕金森患者相比,姿势不稳定帕金森患者的抗凋亡基因Akt-1 表达水平显著降低[34]。此外,AKT 的激活依赖于PI3K 通路,并且PI3K-AKT 信号通路在本研究的KEGG 通路分析中被显著富集,在“基因-通路”网络中,DC 值最大(degree=18)。有研究表明,PI3K/AKT 信号通路在减少多巴胺能神经元凋亡,改善帕金森病模型小鼠的神经行为中发挥重要作用[35-36]。RELA/P65 是NF-κB 的一个亚基, 它和P53 被SIRT1 去乙酰化可以限制凋亡和炎症反应[37]。而降低p65 的核表达,对鱼藤酮诱导的凋亡SH-SY5Y 细胞具有保护作用[38]。
大脑黑质纹状体的多巴胺能神经元凋亡是影响帕金森病发生发展的重要原因[39]。凋亡是一种程序性的细胞死亡模式,受多种信号分子调控,引发级联反应,导致细胞死亡。其中Caspase-3、Bax 和Bcl-2 蛋白在凋亡的发生中扮演重要角色。Caspase 属于半胱氨酸蛋白酶,是凋亡调控的核心分子。Caspase-3 是Caspase 家族成员之一,与其它家族成员Caspase-2、Caspase-6、Caspase-7、Caspase-8、Caspase-9、Caspase-10 和Caspase-12 密切联系,共同参与凋亡的启动与执行。Caspase3 作为凋亡执行分子,可以在Asp-28/Ser-29以及Asp-175/Ser-176 处被剪切,转变为活化的p17大亚基和p12 小亚基片段,最终形成活化形式的Cleaved-Caspase-3[40-41]。Caspase-3 的活化决定了凋亡的最终进程。Bax 和Bcl-2 为Bcl-2 家族的重要成员,Bax 是一种促凋亡蛋白,Bcl-2 是一种抗凋亡蛋白,两者通过控制线粒体通透性调节凋亡过程[42]。Bcl-2定位于线粒体外膜,抑制细胞色素C(Cytochromo C)从线粒体膜间隙释放至细胞质。Bax 则驻留于细胞质中,接受死亡信号后易位至线粒体中,促进细胞色素C的释放,导致Caspase 激活引起细胞死亡。因此,Bax/Bcl-2 蛋白比值增加通常反映凋亡的发生。本研究的实验部分,通过用6-OHDA建立SH-SY5Y细胞损伤模型,给予甘草苷处理后,与模型组相比,Cleaved-Caspase-3 和Bax 的表达下调、Bcl-2 上调、PI3K/AKT/NF-κB 通路关键蛋白磷酸化水显著增加,该结果与网络药理学预测、分子对接的结果高度一致,说明甘草苷保护受损的神经干细胞与其抗凋亡机制密切相关。这些实验结果表明,网络药理学方法的应用具有一定的可靠性和可行性,甘草苷可能通过调节PI3K/AKT/NF-κB 通路以及凋亡相关分子,抑制神经元凋亡来治疗帕金森病。
此外,甘草苷还可能通过调节细胞周期、TGF-β等信号通路治疗帕金森病。细胞周期在GO 和KEGG富集分析结果中均有涉及,且在KEGG 分析结果中拥有最小的校正P值(校正P=1.2124e-10)。大量研究数据表明,在帕金森病和其他神经退行性疾病中,细胞周期调控相关基因表达水平显著改变,引起细胞周期调控能力失常,最终导致神经元死亡[43-45]。Esteras等[46]发现帕金森病患者永生化淋巴细胞的细胞周期活动的增强与细胞周期蛋白D3/CDK6 复合物的活性增加有关,导致G1/S调节失控。TGF-β是一种转化生长因子,在细胞的生长、发育和分化中起关键作用。TGFβ/Smad3 信号通路与帕金森病多巴胺能神经变性、多巴胺能轴突和树突减少以及α-突触核蛋白聚集等病理特征有关[47]。研究表明,神经元TGF-β 信号转导缺失导致黑质纹状体变性,激活此信号则能减弱MPTP神经毒性[48]。
综上所述,本研究综合网络药理学和部分实验验证的方法初步探讨了甘草苷治疗帕金森病可能的机制,发现其与凋亡调控、PI3K-AKT、NF-κB 等信号途径密切相关,并在细胞水平证明了甘草苷对6-OHDA诱导的帕金森病模型的凋亡抑制作用。上述结果说明甘草苷治疗帕金森病的过程是由多靶点、多途径共同参与的,为后续进一步详细阐明其药理作用机制提供了重要方向和参考。而网络药理学作为一门新兴且正在发展的学科也具有一定的局限性。首先是数据库靶点信息的准确性和全面性有待提高[49];且不同的数据库数据收录差距大,数据相对独立、来源分散、整合难度较大[50]。其次是网络药理学技术只是定性地预测了药物成分和靶点,明确的药理作用还需要配合动物实验甚至临床试验来验证[51]。相信随着网络药理学和生物系统信息学技术的不断发展,利用网络技术发现中药复方中的有效成分,探索中药治疗疾病的作用机制,可以使中药在国际上得到更多的认可,在临床上灵活运用中药治疗疾病的前景将更加广阔。
