电针内关、公孙穴对功能性消化不良大鼠海马GluR1、GluR2及内脏高敏性的影响*
2023-09-01覃思敏谢云方邢博文展立芬伍萍香石海斌刘未艾
覃思敏,谢云方,邢博文,展立芬,伍萍香,江 钰,石海斌,刘未艾**
(1. 湖南中医药大学第二附属医院 长沙 410005;2. 海南医学院第二附属医院 海口 570216;3. 张家界市中医院 张家界 427000)
功能性消化不良(functional dyspepsia,FD)是指以胃十二指肠区域反复出现餐后饱胀早饱、上腹痛等上腹部不适症状,常规检查中无任何可能解释症状的器质性改变的疾病,是最普遍的功能性胃肠病(Functional gastrointestinal disorders,FGIDs)之一。内脏高敏性是指内脏痛阈值降低引起内脏疼痛不适感,是FD 最主要病理特征之一,与海马区功能异常密切相关[1-2]。目前FD暂无公认且疗效确切的治疗方案,临床上常运用莫沙比利等五羟色胺(5-hydroxytryptamine,5-HT)受体激动剂药物联合抗抑郁药物治疗FD,虽有疗效,但存在药物副作用大的问题[3]。待以寻求安全有效的治疗方案。
针灸作为一种经典的中医传统疗法,具有疗效确切[4]、无毒副作用等独特优越性,已被广泛应用于FD的防治。FD属中医痞满范畴,课题组前期对古籍中痞满的选穴规律进行了分析,发现内关、公孙穴是治疗痞满的首要配伍穴位[5]。现代研究也证实,针刺内关、公孙穴能有效改善FD 临床症状[6],但其作用途径仍有待阐明。故本研究通过观察电针内关、公孙穴对FD大鼠海马GluR1、GluR2 及内脏敏感性的影响,探讨其可能的作用机制及腧穴的特异性。
1 材料与方法
1.1 实验动物
采用湖南中医药大学动物实验中心提供健康SPF级SD 大鼠50 只(SYXK(湘)2019-0009),体质量200-250 g,雌雄各半,月龄3-4 月。饲养温度维持在20-25℃,湿度维持在50%-70%。所有动物方案均通过湖南中医药大学大学动物伦理委员会(LLBH-202103040007)。
1.2 主要仪器与试剂
DYCZ-40K 转印电泳仪(中国北京六一生物科技有限公司),ChemiScope 6000化学发光成像系统(上海勤翔科学仪器有限公司),JY 96-IIN超声细胞粉碎(宁波新芝生物科技有限公司),离心机(TGL-1 湖南星科科学仪器有限公司),Nikon E100 生物显微镜(尼康映像仪器销售有限公司),华佗牌SDZ-V 型电针仪(苏州医疗用品厂有限公司),12Fr 一次性使用无菌导尿管(江苏省华星医疗器械实业有限公司),一次性使用针灸针(0.16×7 mm)(吴江市云龙医疗器械有限公司),BCA 蛋白定量试剂盒(北京康为世纪生物科技有限公司,CWBOI CW0014S),GLUR1 抗体(Bioss,BS-10042R),GLUR2 抗体(Bioss,BS-1798R),GAPDH(安诺伦生物科技有限公司,YM3029,稀释比:20000∶1),HRP goat anti-mouse IgG SA00001-1(萊恩生物科技有限公司,稀释比:5000∶1),HRP goat anti-rabbit IgG SA00001-2(萊恩生物科技有限公司,稀释比:6000∶1),PBS 缓冲液(北京中杉金桥生物技术有限公司,ZLI-9062),DAB 显色液(武汉赛维尔生物科技有限公司,G1211),苏木素(武汉赛维尔生物科技有限公司,G1004),苏木素返蓝液(武汉赛维尔生物科技有限公司,G1340),柠檬酸抗原修复缓冲液(武汉赛维尔生物科技有限公司,G1202),4%多聚甲醛溶液(广州赛国生物科技有限公司,BL539A),二甲苯透明(国药集团化学试剂有限公司,10023418),水合氯醛(上海麦克林生化科技有限公司),黛力新(丹麦灵北有限公司),莫沙必利片(成都康弘有限公司)。
1.3 模型制备方法
参照王煜姣等[7]方法造模,于每天8∶00 置于束缚盒中限制3 h,同时夹尾30 min、摇晃5 min,14∶00置于盛有温水(21±1)℃的大塑料桶中游泳10 min。隔日禁食,隔日足量给食。模型组、双穴组(内关、公孙穴)、非经非穴组连续3 周进行造模。造模结束后,大鼠表现为靠边扎堆、打斗减少、攻击性减少、易受惊吓、毛发干枯不顺、粪便变软,佐以旷场试验验证造模成功。
1.4 干预方法
除空白组正常饲养外,其余各组分别按不同干预方法处理21 天。模型组、双穴组、非经非穴组同时进行捆绑束缚30 min,按大鼠体质量灌服等量生理盐水。双穴组参照[8]全国中医药行业高等教育十二五规划教材《实验针灸学》及华兴邦的大鼠穴位图谱;进行定位选穴“内关穴”“公孙穴”;用乙醇擦拭穴位,一次性使用针灸针行针刺治疗,针刺深度为3-10 mm 之间,采用平补平泻手法,捻转角度为180°,频率为每分钟120次,持续捻转0.5-2 min不等;行针结束后,选同侧的内关和公孙穴分别连接电针仪导线的正负极,采用疏密波(20/100 Hz)进行刺激,刺激强度以局部皮肤肌肉轻微颤动为准,电针刺激时间为每次30 min,每日1 次。非经非穴组穴位定位[9]于在胁下髂嵴上20-25 mm、后正中线旁开20 mm 处,针刺手法及电针方法同双穴组,选同侧非经非穴与大鼠尾部分别连接电针仪导线的正负极。西药组按大鼠体质量1 mL/100 g的灌服莫沙比利与黛力新溶液,两药间隔半小时。大鼠给药量参照正常成人(70 kg)的临床用量,按照实验动物与人剂量换算公式计算(大鼠的剂量=6.3×mg/kg),换算得出大鼠灌胃等效剂量。
1.5 观察指标及检测方法
旷场实验行为学评价:实验用自制立方形纸质旷场箱,长×宽×高为100 cm×100 cm×40 cm。内侧壁及底面为黑色,用白线划分为20 cm×20 cm 面积相等的25 块。实验开始后每周在四周由全封闭的遮光帘隔离开并杜绝参照物且安静的环境条件下进行。实验前先置大鼠于测试旷场箱内适应2 min,操作者握住大鼠尾根部1/3 处,轻轻将大鼠放入旷场箱的正中格内,观察3 min 内大鼠活动情况。取出大鼠后,用毛巾蘸清水及低浓度乙醇彻底擦拭箱底,并等待其挥发扩散,避免留有气味而干扰下一只大鼠的观察结果。观察各组大鼠造模前后的行为变化并进行比较。观察如下指标:①总穿格数:三爪以上跨入相临格的次数;②站立次数:两前肢向上抬起离开箱底面或攀伏在侧壁上,以后腿支撑使身体竖立的次数。③修饰次数:两前肢理毛、抓痒、洗脸、舔足的次数。
大鼠结直肠扩张容量阈值测定:大鼠在实验前24 h禁食不禁水,在清醒状态下进行,采用12 Fr一次性使用无菌导尿管作为结肠扩张球囊,将其外侧软阀开口端接“Y”形三通管,分别与血压计水银柱及气囊口相连。将球囊插入大鼠直肠5 cm后,缓慢向球囊注气,记录大鼠拱背抬高离开瓶底或明显收缩变平时水银柱刻度,该值为痛阈值[10],扩张压力范围0-80 mmHg。连续2-3次测定,取平均值。
海马组织HE 染色:腹腔注射麻醉(麻醉药物及剂量:10%水合氯醛以4 mL·kg-1注射)。每组随机取5只进行心脏灌注固定,断头剥离脑组织,置于4%多聚甲醛溶液中固定,包埋,沿海马吻合位置以4 µm 行冠状切片;取海马组织切片,脱蜡,水化,染色后脱水封片,于显微镜下观察海马组织形态。
海马GluR1、GluR2 蛋白含量免疫组化测定:取海马组织切片,置于修复缓冲液修复,冷却后放入PBS缓冲液中晃动,采用血清封闭后洗涤,加入一抗,4℃孵育过夜,再次洗涤后加入二抗,室温孵育50 min,置入新鲜配制的DAB 显色液中,采用显微镜进行显色观察,染色后取出,流水冲洗,复染3 min 左右返蓝,冲洗完毕后脱水晾干封片;显微镜镜检,图像采集,用Image J 软件对GluR1、GluR2 的免疫组化结果进行半定量分析,计算并统计平均光度值,进行分析。
海马GluR1、GluR2 蛋白含量Western blot 测定:5 只大鼠麻醉后直接断头取脑剥离海马组织,冲洗后放入液氮保存。取海马组织,按照BCA 蛋白定量试剂盒使用说明操作,测定蛋白浓度。制胶后取100 µL蛋白上清,加入25 µL 上样缓冲液混匀,沸水煮5 min,速冷后开始电泳,将切胶、NC 膜及转膜缓冲液至于转膜仪进行转膜,后用1×pBST 配制5%脱脂奶粉封闭液室温封闭2.5 h,用1×pBST 稀释将一抗按照比例稀释后与膜一同放入4℃冰箱过夜,次日室温放置30 min 进行孵育。分别用1×PBST 稀释HRP 标记的二抗,将稀释后的二抗与膜共同室温孵育1.5 h;显色曝光并拍照记录,Image J 对图像进行定量分析,以GAPDH 作为内参对蛋白条带进行对比分析。
1.6 统计分析
所有数据均采用SPSS 28.0进行统计分析,全部计量资料用样本含量、均数±标准差(即n,)表示,所有数据都进行正态性和方差齐性检验。符合正态性,多组间比较采用单因素方差分析与LSD 检验,不符合方差齐性采用Welch 检验及Tamhane’s T2 检验,同组前后对比采用配对t检验;不符合正态性,多组间比较采用Kruskal-Wallis 检验与Bonferroni 检验,同组前后对比采用配对Wilcoxon 检验,重复测量数据采用重复测量方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠行为学评分比较
2.1.1 一般行为学评价
造模前各组大鼠反应灵敏,性情温顺,精神良好,皮毛光泽,皮肤黏膜红润,粪便质软成形,干稀适中。造模后各组大鼠均出现反应迟钝,精神欠佳,食量欠佳,体质量增长缓慢,皮毛枯泽,皮肤黏膜色泽变淡,大便不规则,便质时干时稀。提示造模成功。
2.1.2 旷场实验结果
由表1 可知:造模前各组水平、垂直及修饰运动(总穿格数、站立次数、修饰次数)无明显差异(P>0.05),提示大鼠在陌生环境下具有较强的主动探索行为及反应。造模后,各组水平、垂直及修饰运动明显减少(P<0.01),组间比较无差异(P>0.05),提示大鼠运动、探索行为及摄食愉悦感均下降,对环境好奇度降低,呈倦怠抑郁样行为,提示造模成功。详见表1。
表1 各组大鼠旷场实验比较(n=10)

表1 各组大鼠旷场实验比较(n=10)
注:与造模前对比,▲▲P<0.01。
?
2.2 各组大鼠内脏痛阈值
与空白组相比,模型组大鼠内脏痛阈值明显降低(P<0.01),易出现腹背肌肉收缩、腹部上抬,提示大鼠内脏敏感性增强、痛阈降低;与模型组对比,西药组、双穴组FD大鼠内脏痛阈值均有明显的提高(P<0.01),非经非穴组痛阈值有所升高,无统计学差异(P>0.05),提示电针内关、公孙治疗有效;与非经非穴组对比,双穴组内脏痛阈值增高(P<0.01),提示内关、公孙穴在改善FD 内脏敏感性方面可能存在腧穴特异性;与西药组对比,两组无显著性差异(P>0.05),提示内关、公孙穴与西药疗效相当。见表2。
表2 各组大鼠痛阈值变化比较(n=10,,mmHg)

表2 各组大鼠痛阈值变化比较(n=10,,mmHg)
注:与空白组对比,▲▲P<0.01;与模型组对比,★★P<0.01;与非经非穴组对比,△△P<0.01。
?
2.3 各组海马区HE染色
空白组海马神经元细胞结构清晰,形态正常;与空白组相比,模型组海马可见个别神经元细胞变性,固缩,细胞间隙变大,胞体增大,空泡样性状明显;与模型组相比,双穴组及西药组海马神经元细胞结构较为清晰,趋于完整,细胞间隙变小,未见固化萎缩的神经元及空泡样性状改变;与非经非穴组相比,双穴组海马神经元细胞结构更为清晰,细胞间隙较小;详见图1。

图1 不同组别大鼠海马神经元的影响(×400)
2.4 各组海马免疫组化检测
与空白组对比,模型组大鼠海马GluR1 蛋白含量升高、GluR2 蛋白含量下降(P<0.01);与模型组对比,双穴组、西药组可下调海马GluR1、上调GluR2 蛋白含量(P<0.01),非经非穴组无差异(P>0.05),提示电针内关、公孙治疗有效;与非经非穴组对比,双穴组显著下调海马GluR1、上调GluR2 蛋白含量(P<0.01),提示内关、公孙穴在改善FD 海马GluR1、GluR2 蛋白含量方面可能存在腧穴特异性;与西药组对比,两组无显著性差异(P>0.05),提示二者对海马GluR1、GluR2 蛋白含量调节相当。见图2、3。

图2 不同组别大鼠GluR1、GluR2蛋白表达的影响(×400)

图3 不同组别大鼠海马GluR1、GluR2OD值(n=5,)
2.5 各组海马Western blot检测
与空白组对比,模型组大鼠海马GluR1 蛋白含量升高、GluR2 蛋白含量下降(P<0.01);与模型组对比,双穴组、西药组可下调海马GluR1、上调GluR2 蛋白含量(P<0.01,P<0.05),非经非穴组无差异(P>0.05);与非经非穴组对比,双穴组显著下调海马GluR1、上调GluR2 蛋白含量(P<0.01,P<0.05);与西药组对比,两组无显著性差异(P>0.05)。本结果与免疫组化结果一致,提示电针内关、公孙穴可下调GluR1、上调GluR2蛋白含量,可能存在腧穴特异性。见图4、5。

图4 不同组别大鼠GluR1、GluR2蛋白免疫印迹图
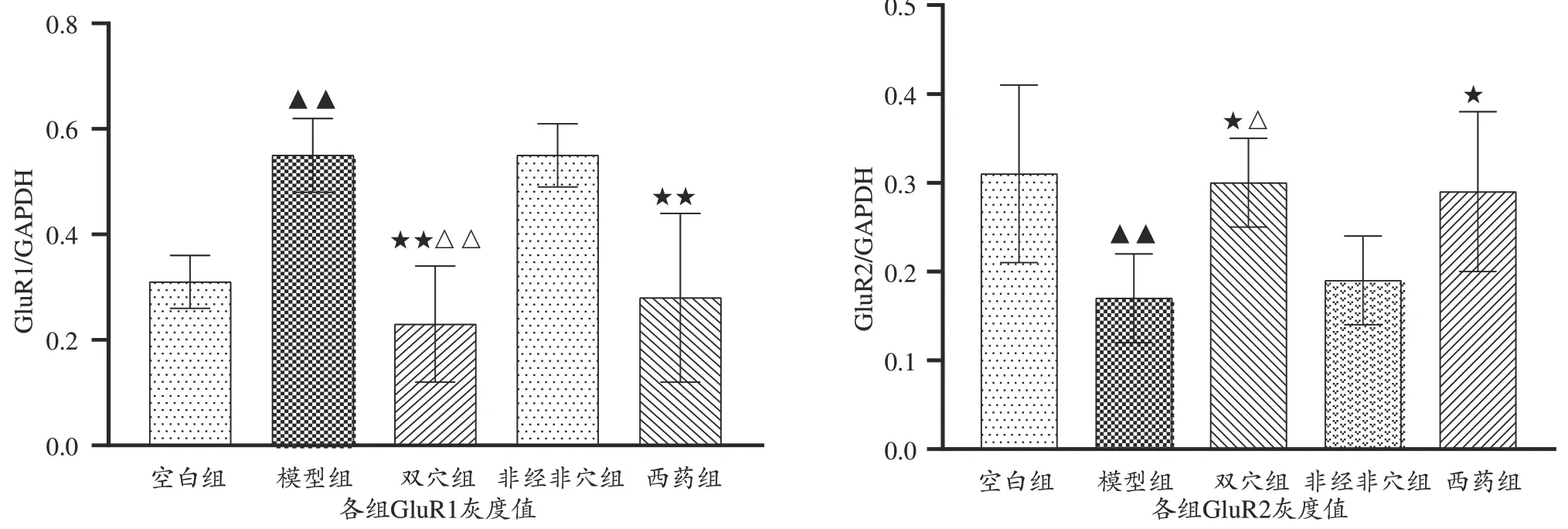
图5 不同组别大鼠GluR1、GluR2蛋白表达的影响(n=5,)
3 讨论
功能性消化不良(FD)属中医“痞满”“胃痞”范畴,虽以胃脘部疼痛不适为主要表现,但其发病与情志密切相关,当考虑精神心理治疗[11]。古人云“善医者,必先医其心,而后医其身”,从近代医者临床运用中发现,近代医家重视心主神志这一功能对脾胃的影响,在调治脾胃病时常加以调养心神之法,运用中药、针灸等治疗脾胃病,屡试不爽、疗效颇佳[12-14]。中医针灸疗法因其独特的理论体系能从整体而有效地运用于FD 的防治,达到身心同治的目的。内关穴联络心包,宣上导下;公孙为脾经之络穴,联络脾、胃二经,调理脾胃,疏通肠道;《针灸大成》[15]记载“肚疼须是公孙妙,内关相应必然瘳”,二穴属八脉交会穴,两穴配伍使用,能达调养心神、健运脾胃之效。二穴配伍治疗FD能有效缓解症状,改善患者情绪,但目前作用机制不明[9]。
内脏高敏是FD 患者内脏疼痛的主要原因,内脏高敏反应分为外周敏化和中枢敏化两种,外周敏化指的是对初级伤害感器的增敏,而中枢增敏指的是损伤期间或损伤后中枢突触传递的持续变化。以往对内脏高敏反应机制的研究多集中在外周敏化和脊髓背角突触可塑性变化方面。海马作为边缘系统的重要组成部分,参与疼痛与认知情绪的调控,由于疼痛的反复发作,诱发持续的异位冲动,导致突触结构和神经活动的功能变化,并最终导致产生“伤害性疼痛记忆”[16],这可能是患者精神心理的异常与腹痛症状反复的原因所在。海马区长期突触可塑性主要表现形式长时程增强(Long termpotentiation,LTP)和长期抑制作用(Long-term depression,LTD),需依靠海马神经元突触后氨基羟甲基恶唑丙酸受体(a-amino-3-hydroxy-5-methyl-4-isoxa-zolep-propionate receptor,AMPAR)胞吞和胞吐实现[17]。AMPAR 是由GluR1-4 组成的异源四聚体离子通道,以GluR1 和GluR2 蛋白起决定作用[18]。作为广泛存在于大脑中的谷氨酸受体,介导大多数快速兴奋性突触传递,是处理海马突触后信号的输入的主要场所,其快速激发神经传递、增强突触强度的作用,是调节突触LTP 传输和表达关键[19-21]。海马给予AMPARs抑制剂可显著减缓FGIDs大鼠内脏痛敏行为[22]。GluR1 是大鼠表达长时程增强LTP 的关键亚基,研究发现,内脏痛刺激导致AMPAR 的GluR1 的高表达可被非选择性AMPAR 拮抗剂所抑制,并可有效缓解内脏疼痛[23]。GluR2是AMPAR 控制Ca2+通透的关键亚基,正常情况对Ca2+不通透。有实验研究表明,慢性束缚应激导致海马CA1 区GluR2 mRNA 表达下降,形成Ca2+通透的AMPAR,钙超载,继发引起“细胞死亡程序”的转录活化,同步增强兴奋性氨基酸的毒性作用,导致海马神经元退行性变[24]。
本实验结果提示:①电针内关、公孙穴治疗能有效升高FD 大鼠内脏痛阈值,降低海马GluR1 蛋白含量、增加GluR2 蛋白表达,改善海马神经元细胞结构,这可能是电针内关、公孙穴治疗FD 作用机制之一。②电针内关、公孙疗效与西药莫沙比利联合黛力新相当,与临床研究大致相同[11]。电针作为FD 最常见的非药物治疗手段,能有效避免长期服用西药带来的毒副作用,值得临床进一步推广运用。③相较电针非经非穴,电针内关、公孙穴疗效更优。《针灸大成》记载道“肚疼须是公孙妙,内关相应必然瘳”,内关、公孙属于八脉交会穴,与奇经八脉脉气相通,内关为手厥阴心包经之络穴,联络心包、三焦二经,穴所通的阴维脉,为手足三阴经之纲维;公孙为脾经之经穴,联络脾、胃二经,穴所通的冲脉,为十二经脉之海;二穴联用,经脉脏腑相关,多经司控多脏,具有畅情志,调气机,安脾胃之功。近代研究也证实,针刺胃经穴或心包经穴均有调整胃机能的功能[25]。这可能是二穴对FD 治疗存在腧穴特异性而非经非穴效果欠佳的原因所在。
综上所述,电针内关、公孙穴可降低FD 大鼠内脏高敏性,其作用机制可能与下调海马区GluR1 蛋白含量、上调GluR2蛋白含量,改善海马神经元细胞结构相关;二穴对FD治疗可能存在腧穴特异性。
