京尼平苷对糖尿病视网膜病变大鼠视网膜微血管生成的影响及其机制△
2023-08-31杨馥宇蒋利生
苏 杰 杨馥宇 李 猛 蒋利生
糖尿病视网膜病变(DR)是糖尿病最常见的微血管并发症,高糖会引起视网膜微血管生成[1-2],严重影响患者视力。因此,探究视网膜微血管生成的潜在分子机制对于DR的治疗具有重要意义。血管内皮生长因子(VEGF)是血管内皮细胞特异性的肝素结合生长因子,可在体内诱导血管新生,是参与DR进展的关键因素[3]。研究发现,VEGF特异性抑制剂——可溶性血管内皮生长因子受体1(sFlt-1)可通过抑制VEGF表达,达到显著抑制视网膜微血管生成的效果[4]。京尼平苷(Gen)是栀子的主要活性成分,具有缓泻、镇痛、利胆、抗炎、治疗软组织损伤等药理学活性。已有研究证实,Gen可通过激活Nrf2信号通路,减轻氧化应激和炎症反应,进而改善高糖引起的大鼠视网膜细胞损伤[5]。此外,人们对类风湿性关节炎患者研究发现,Gen可通过抑制VEGF表达,降低滑膜血管生成[6]。但Gen是否对视网膜微血管生成有治疗作用鲜有报道。本研究探讨Gen对DR大鼠视网膜微血管生成的影响及其机制,以期为Gen防治DR提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组取6周龄SPF级雄性Wistar大鼠50只,体重220~250 g(河北伊维沃生物科技有限公司提供)。所有大鼠造模前行眼前节及眼底检查,排除患有眼部疾病的大鼠。将眼部正常的大鼠随机分为正常组、模型组、Gen低剂量组、Gen高剂量组和羟苯磺酸钙组,每组10只。将大鼠置于温度22~24 ℃、相对湿度50%~60%、明暗光照各12 h的环境中饲养,自由饮食。
1.1.2 试剂及仪器高糖高脂饲料(江苏协同生物有限公司),链脲佐菌素(美国Sigma公司),羟苯磺酸钙及Gen(美国MCE公司),大鼠VEGF ELISA试剂盒及大鼠sFlt-1 ELISA试剂盒(北京生研生物技术有限公司),过碘酸雪夫染色液(武汉塞维尔生物科技有限公司),考马斯亮蓝法蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),sFlt-1抗体(美国SantaCruz公司),VEGF(VEGF-A)抗体、缺氧诱导因子-1α(HIF-1α)抗体、细胞间黏附分子-1(ICAM-1)抗体和GAPDH抗体(英国Abcam公司),血氧仪(ACCU-CHEK,瑞士Roche公司),酶标仪(DR-200Bs,无锡华卫德朗仪器有限公司),电泳仪(美国Bio-rad公司),正置显微镜(CX23,日本Olympus公司)。
1.2 方法
1.2.1 DR大鼠模型构建正常组大鼠喂养普通饲料,模型组、Gen低剂量组、Gen高剂量组和羟苯磺酸钙组大鼠喂养高糖高脂饲料,连续喂养4周后,禁食12 h,模型组、Gen低剂量组、Gen高剂量组和羟苯磺酸钙组大鼠按照60 mg·kg-1剂量腹腔注射10 g·L-1链脲佐菌素溶液,正常组大鼠腹腔注射等量柠檬酸缓冲液。注射72 h后以随机血糖浓度>16.7 mmol·L-1视为糖尿病大鼠造模成功[7],剔除造模不成功大鼠。其间,动物只数及时补充。继续饲养4周后,进行眼底镜检查,视网膜出现微血管瘤、静脉串珠样改变以及动静脉异常视为DR造模成功[8]。模型构建成功后立即进行药物干预。Gen低剂量组和Gen高剂量组大鼠分别以25 mg·kg-1和100 mg·kg-1Gen灌胃,羟苯磺酸钙组大鼠给予5.8 mg·kg-1羟苯磺酸钙灌胃,而正常组和模型组大鼠灌胃等量溶剂,每天1次,连续4周。给药期间正常组大鼠继续喂养普通饲料,其余各组大鼠继续喂养高糖高脂饲料。
1.2.2 大鼠体重和空腹血糖检测及组织提取于药物干预当天(第0周)和药物干预结束(第4周),各组大鼠称体重后禁食不禁饮12 h,使用血糖仪进行尾部取血检测大鼠空腹血糖。第4周大鼠体重和空腹血糖检测完毕后,将所有大鼠麻醉,腹主动脉取血,室温静置30 min后离心收集血清置于-20 ℃保存。每组随机选取5只大鼠收集左右侧带有视神经的眼球,加40 g·L-1多聚甲醛固定12 h;剩余大鼠收集左右侧视网膜组织置于-80 ℃保存。
1.2.3 ELISA检测大鼠血清中VEGF、sFlt-1含量取各组大鼠血清,按照VEGF和sFlt-1 ELISA试剂盒说明书进行操作,检测大鼠血清中VEGF和sFlt-1含量。
1.2.4 HE染色取出已固定好的左侧眼球,进行常规石蜡包埋,制备6 μm石蜡切片。石蜡切片脱蜡至水后进行苏木精染色,盐酸酒精分化,稀氨水返蓝,伊红染色后脱水透明封片。于显微镜下观察各组大鼠视网膜病理形态变化。
1.2.5 视网膜血管网消化铺片过碘酸雪夫染色取出已固定好的右侧眼球置于培养皿中,剥离视网膜组织,于PBS溶液中浸泡1 h,吸出视网膜,放入装有10 mL胰蛋白酶和15 mL青霉素的玻璃小瓶中,橡胶塞密封,放入37 ℃烤箱中进行消化过夜。吸出视网膜,放入纯水中,轻轻吹打5次,转入80 ℃水中,再次吹打,直至视网膜血管网呈现透明状。吸取透明的视网膜血管网,放在石蜡防脱玻片上,使血管网完全展开,自然晾干。将晾干的血管网铺片浸入自来水中5 min;取出切片,加入5 g·L-1高碘酸浸染15 min,纯水浸洗;再加入常温的雪弗溶液中避光浸染20 min,流水冲洗5 min;再加入苏木素染液染色5 min,自来水冲洗,盐酸水溶液分化2 s,自来水冲洗,氨水水溶液返蓝5 s,自来水冲洗后将切片进行脱水透明,中性树胶封片。于显微镜下观察视网膜微血管生成情况,随机挑选5个视野,计数每个视野下微血管生成数,计算其平均值。
1.2.6 Western blot检测大鼠视网膜组织中VEGF、HIF-1α、ICAM-1、sFlt-1蛋白表达
将存放于-80 ℃的视网膜组织解冻后,加入裂解液收集蛋白样品,使用考马斯亮蓝法检测蛋白浓度。取10 μL蛋白样品加入蛋白上样缓冲液,沸水浴加热3 min,冷却至室温后,直接上样进行变性聚丙烯酰胺凝胶电泳,转膜,4 ℃封闭过夜,加入一抗VEGF抗体(11 000)、HIF-1α抗体(12 000)、ICAM-1抗体(11 000)、sFlt-1抗体(11 000)和内参GAPDH(11 000)抗体,室温振荡孵育1 h,用Western blot洗涤液清洗,加入按照110 000稀释的过氧化物酶标记的二抗再次孵育,用Western blot洗涤液充分清洗后显影,检测蛋白样品的光密度值,目的蛋白的相对表达量=目的蛋白的光密度值/GAPDH的光密度值。
1.3 统计学分析
采用SPSS 19.0统计学软件对数据进行分析,计量资料以均值±标准差表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准:α=0.05。
2 结果
2.1 DR造模情况
DR造模成功后,正常组大鼠视网膜无异常情况,模型组DR大鼠视网膜可观察到微血管瘤和动静脉异常(图1)。本研究DR造模成功率为 73.3%。
2.2 各组大鼠体重和空腹血糖变化情况
药物干预当天(第0周),模型组、Gen低剂量组、Gen高剂量组和羟苯磺酸钙组大鼠体重均低于正常组,而空腹血糖高于正常组,差异均有统计学意义(均为P<0.001)。药物干预结束(第4周),模型组大鼠体重低于正常组,空腹血糖高于正常组,差异均有统计学意义(均为P<0.001)。Gen高剂量组和羟苯磺酸钙组大鼠体重高于模型组,空腹血糖低于模型组,差异均有统计学意义(均为P<0.01);而Gen低剂量组大鼠以上指标与模型组相比差异均无统计学意义(均为P>0.05)(表1)。
2.3 各组大鼠血清中VEGF、sFlt-1含量
药物干预结束(第4周),模型组大鼠血清中VEGF含量高于正常组,sFlt-1含量低于正常组,差异均有统计学意义(均为P<0.001)。Gen高剂量组和羟苯磺酸钙组大鼠血清中VEGF含量低于模型组,sFlt-1含量高于模型组,差异均有统计学意义(均为P<0.001);而Gen低剂量组大鼠以上指标与模型组相比,差异均无统计学意义(均为P>0.05)(表2)。
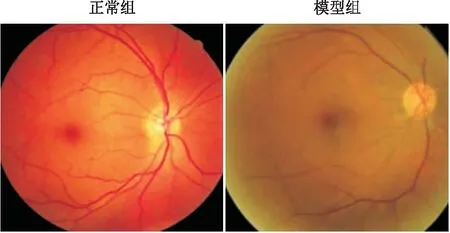
图1 DR造模后正常组和模型组大鼠视网膜观察结果
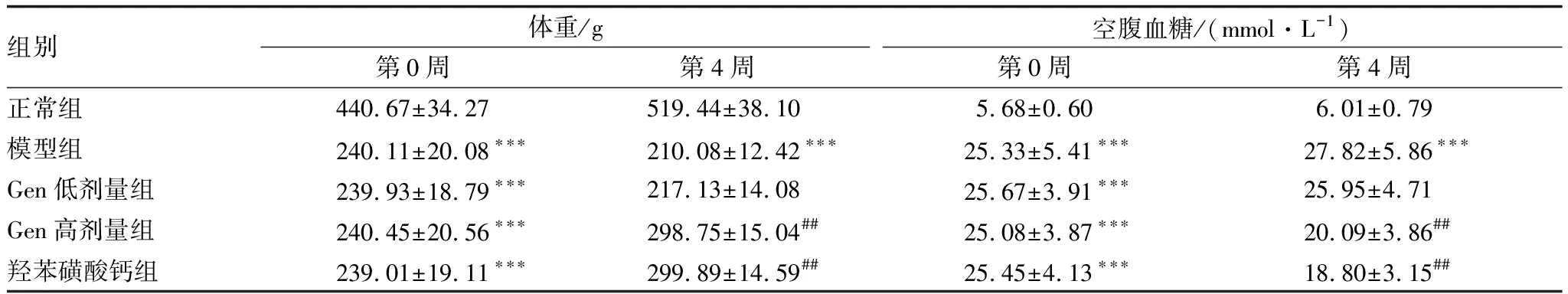
表1 药物干预当天(第0周)和药物干预结束(第4周)各组大鼠体重和空腹血糖变化

表2 药物干预结束(第4周)各组大鼠血清中VEGF、sFlt-1含量
2.4 各组大鼠视网膜组织病理学变化
药物干预结束(第4周),正常组大鼠视网膜组织形态正常,内核层与外核层细胞排列整齐。模型组和Gen低剂量组大鼠视网膜组织内核层与外核层细胞排列松散,神经节细胞减少,毛细血管充血。Gen高剂量组和羟苯磺酸钙组大鼠视网膜组织内核层与外核层细胞排列趋于正常,神经节细胞较模型组明显增多(图2)。

图2 药物干预结束(第4周)各组大鼠视网膜组织病理学变化
2.5 各组大鼠视网膜微血管生成情况
药物干预结束(第4周),正常组大鼠视网膜血管管径均匀一致,无明显微血管生成。模型组大鼠视网膜组织血管管径不均,出现节段性膨大,视网膜组织微血管生成数高于正常组,差异有统计学意义(P<0.05)。Gen高剂量组和羟苯磺酸钙组大鼠视网膜血管网分布较正常,微血管生成数低于模型组,差异均有统计学意义(均为P<0.05);而Gen低剂量组大鼠视网膜微血管生成数与模型组相比,差异无统计学意义(P>0.05)(图3)。
2.6 各组大鼠视网膜组织中VEGF、HIF-1α、ICAM-1、sFlt-1蛋白表达水平
药物干预结束(第4周),模型组大鼠视网膜组织中VEGF、HIF-1α和ICAM-1蛋白相对表达量均高于正常组,sFlt-1蛋白相对表达量均低于正常组,差异均有统计学意义(均为P<0.05)。Gen高剂量组和羟苯磺酸钙组大鼠视网膜组织中VEGF、HIF-1α和ICAM-1蛋白相对表达量均低于模型组,sFlt-1蛋白相对表达量均高于模型组,差异均有统计学意义(均为P<0.05);而Gen低剂量组大鼠以上指标与模型组相比,差异均无统计学意义(均为P>0.05)(图4)。

过碘酸雪夫染色,黑色箭头示微血管。与正常组相比,*P<0.05;与模型组相比,△P<0.05。图3 药物干预结束(第4周)各组大鼠视网膜血管网消化铺片结果
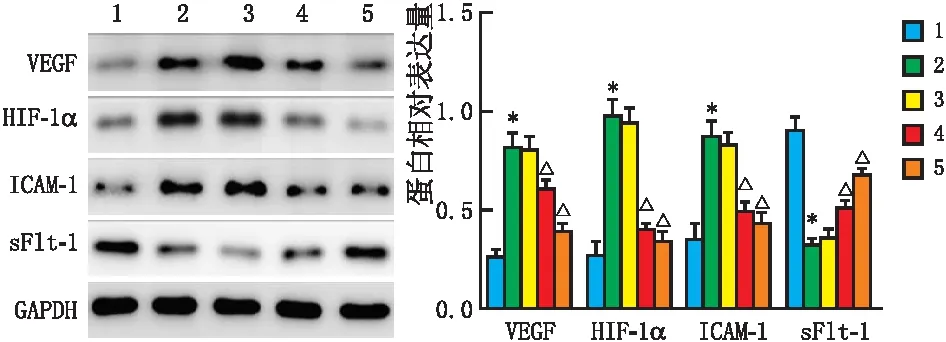
1、2、3、4、5分别代表正常组、模型组、Gen低剂量组、Gen高剂量组和羟苯磺酸钙组。与正常组相比,*P<0.05;与模型组相比,△P<0.05。图4 药物干预结束(第4周)各组大鼠视网膜组织中VEGF、HIF-1α、ICAM-1、sFlt-1蛋白表达水平
3 讨论
DR是糖尿病患者常见的眼部并发症,由于机体长期处于高血糖状态,患者血-视网膜屏障受损,视网膜组织内形成大量微血管,DR可导致患者出现视力丧失等症状,影响工作和生活[9]。目前,探讨DR视网膜微血管生成机制,以及寻找有效药物抑制微血管生成已成为眼底病领域的研究热点。
VEGF/sFlt-1轴是视网膜微血管生成的主要信号传输点[10]。DR患者血-视网膜屏障遭到破坏,致使患者视网膜内皮细胞处于缺氧状态,激活HIF-1α,引起下游VEGF表达上调,分泌促血管生成因子,上调ICAM-1表达,加速微血管生成[11-12]。 VEGF是最强的促血管生长因子,其表达水平与微血管形成数呈正相关,受体sFlt-1可抑制 VEGF表达[13]。Javanmard等[14]研究显示,DR 患者房水中sFlt-1低表达会刺激VEGF高表达,加重DR。本研究通过构建DR大鼠模型发现,模型组大鼠体重降低,空腹血糖升高,VEGF/sFlt-1轴失衡,HIF-1α和ICAM-1高表达,视网膜微血管大量生成,与上述研究结果一致。
Gen在草本栀子中含量丰富,具有抗炎和抑制氧化应激的作用,常治疗动脉粥样硬化和糖尿病等疾病[15]。目前,已有研究显示,Gen具有抗血管生成作用[16]。Zhang等[17]研究表明,Gen可抑制肝癌中VEGF 表达从而抑制血管生成。然而,Gen是否能抑制DR视网膜微血管生成暂无研究支持。本研究结果显示,Gen干预后,Gen高剂量组大鼠体重明显升高,空腹血糖明显降低,视网膜内外核层细胞排列趋于正常,视网膜微血管生成数明显降低;进一步研究发现,血清中VEGF含量及视网膜组织中VEGF、HIF-1α和ICAM-1蛋白表达水平明显降低,血清中sFlt-1含量和视网膜组织中sFlt-1蛋白表达水平明显升高。这提示Gen可通过促进sFlt-1表达,对VEGF表达起到抑制作用,从而阻断VEGF相关效应信号,达到抗视网膜微血管生成的效果。此外,本研究还发现,Gen低剂量组大鼠无明显治疗效果。时倩倩等[18]研究发现,羟苯磺酸钙作为血管保护剂,能够作用于 VEGF 及其受体信号通路抑制视网膜微血管生成。本研究中羟苯磺酸钙与Gen的治疗效果一致。本研究的不足之处在于Gen剂量梯度分组较少,且剂量数值差异较大。
4 结论
Gen通过抑制VEGF表达,促进sFlt-1表达,从而抑制DR大鼠视网膜微血管生成,达到治疗DR的作用。
