HGF抑制细胞凋亡干预心肌损伤的研究
2023-08-31梁明亭宫颖商鲲鹏贾国涛庞英
梁明亭,宫颖,商鲲鹏,贾国涛,庞英
·论 著·
HGF抑制细胞凋亡干预心肌损伤的研究
梁明亭1,宫颖1,商鲲鹏1,贾国涛2,庞英1
1.聊城市人民医院心内科,山东聊城 252000;2.聊城市人民医院病理科,山东聊城 252000
通过构建大鼠心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)模型并应用肝细胞生长因子(hepatocyte growth factor,HGF)干预,观察HGF对MIRI细胞凋亡的影响。24只雄性Wistar大鼠,采用随机数字表法分为假手术组(=8)、MIRI组(=8)和HGF组(=8)。假手术组只穿线不结扎,MIRI组结扎大鼠左前降支30min再灌注180min,HGF组在结扎大鼠前降支同时给予尾静脉注射HGF(1mg/kg)。检测各组大鼠血清肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)水平,采用TUNEL法测定心肌细胞凋亡指数,免疫组织化学法检测胱天蛋白酶(Caspase)-3及Bax蛋白表达,以及通过超声心动图检查大鼠心功能。与假手术组相比,MIRI组大鼠血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室舒张末期容积(left ventricular end diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end systolic volume,LVESV)、左心室质量指数(left ventricular mass index,LVMI)均显著升高(<0.05),左心室射血分数(left ventricular ejection fraction,LVEF)显著降低(<0.05)。与MIRI组比较,HGF组的血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达、LVESD、LVEDD、LVEDV、LVESV及LVMI均显著降低(<0.05),LVEF显著升高(<0.05)。HGF可通过抑制心肌细胞凋亡减轻MIRI,改善大鼠心功能。
肝细胞生长因子;心肌缺血再灌注损伤;细胞凋亡
冠状动脉粥样硬化性心脏病是危害人类健康的重要疾病,除药物治疗外,心肌再灌注治疗可提高急性心肌梗死的救治成功率,但是不可逆的心肌损伤已经发生,导致心肌坏死,进而引起心肌舒缩功能障碍和各种心律失常。在整个过程中,心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)扮演了重要的角色[1]。既往研究证实,不管是鼠、兔还是人类心肌细胞,在经历一定时间的缺血后进行再灌注,均显示出明显的凋亡现象,可导致工作心肌细胞减少,心功能恶化[2]。肝细胞生长因子(hepatocyte growth factor,HGF)是一种间充质来源的多功能性细胞因子,HGF及其受体可由多种细胞产生,组织分布广泛,HGF可通过多种信号通路发挥生物学效应[3]。有研究建立过氧化氢损伤大鼠心脏的模型,应用HGF进行干预,结果显示大鼠心肌损伤程度明显减轻,细胞凋亡减少,Bcl-xL表达增加,提示了HGF的抗心肌细胞凋亡作用[4]。但目前关于HGF对MIRI心肌细胞凋亡的保护作用未见报道,本研究主要观察了HGF对大鼠缺血再灌注损伤心肌细胞的抗凋亡作用。
1 材料与方法
1.1 实验动物
清洁级雄性Wistar大鼠24只(170~220g),由山东大学实验动物中心提供[实验动物许可证号:SCXK(鲁)2016002],均单独饲养,室温20~25℃,相对湿度45%~65%,自由摄食和饮水。所有大鼠给予标准大鼠饲料喂养,并进行7d的适应性饲养。
1.2 主要试剂
肝细胞生长因子(F3097),购自上海西唐生物科技有限公司;细胞凋亡原位检测试剂盒,购自美国罗氏公司;胱天蛋白酶(Caspase)-3免疫组织化学检测试剂盒(LOP 1010)、Bax免疫组织化学检测试剂盒(LOP 1002),均购自上海工硕生物技术有限公司;DAB显色试剂盒(AB201),购自上海拜力生物科技有限公司。
1.3 动物分组
采用随机数字表法将24只大鼠分为假手术组(=8)、MIRI组(=8)和HGF组(=8)。假手术组只穿线不结扎,MIRI组结扎大鼠左前降支30min再灌注180min,HGF组在结扎大鼠前降支同时给予尾静脉注射HGF(1mg/kg)[5]。
1.4 MIRI大鼠模型制作
用10%的水合氯醛麻醉大鼠,气管插管后连接动物呼吸机(潮气量6ml),呼吸频率60次/min,呼吸比1∶1.5,沿胸骨中线从胸锁关节平线至剑突上方切开皮肤,在胸骨左缘处剪断大鼠的第2~4肋骨,暴露心脏。持小圆弯针于肺动脉圆锥与左心耳夹角下l~2mm处进针,进针深度为0.2~0.4mm,以4-0无创缝合线穿过,在肺动脉圆锥旁出针。其中MIRI组及HGF组用带凹槽乳胶管垫于即将结扎部位,以备再灌注使用。结扎冠状动脉后,心电图ST段明显抬高或压低提示造模成功,结扎30min后松解结扎线,再灌注180min,心肌再灌注时局部心肌出现组织充血,ST段回落为再灌注成功表现。假手术组大鼠只穿线不结扎。
1.5 血清肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)水平检测
于再灌注180min后取大鼠腹主动脉血1.5ml,分离血清,应用自动生化分析仪检测CK-MB浓度。
1.6 TUNEL法测定各组心肌细胞凋亡指数
取结扎线下1~2mm左心室游离壁相同部位心肌组织制成蜡块,连续切片,厚度为4μm。正常心肌细胞核呈蓝色,凋亡阳性心肌细胞核呈不同深浅的黄色。每张切片在高倍镜(400倍)下,分别在缺血中心区及周围区随机计数10个不同视野的心肌凋亡细胞数及心肌细胞总数,凋亡指数=凋亡阳性心肌细胞核数目/总心肌细胞核数目×100%,求均值计算凋亡指数。
1.7 观察各组心肌病理学形态变化
使用苏木精–伊红(hematoxylin-eosin staining,HE)染色法,观察显微镜下各组心肌的病理变化,包括心肌结构、心肌纤维排列、炎细胞浸润及心肌细胞坏死情况等。
1.8 免疫组织化学法测心肌组织Caspase-3及Bax蛋白表达
用Image-Pro Plus病理显微图像分析系统,定量检测Caspase-3及Bax蛋白的表达。Caspase-3及Bax蛋白免疫组化染色阳性表达判定(DAB显色):蛋白阳性反应为黄色至棕褐色颗粒散在或弥漫状分布,主要定位于细胞质。每个切片在400倍高倍镜下,随机选择10个相同面积无重叠视野,计算每个视野下两种蛋白的吸光度(absorbance,)均值。
1.9 超声心动图测大鼠心功能变化
剪去大鼠胸部被毛,用飞利浦IE33彩色超声诊断仪,电子相控阵探头,频率14MHz进行测定。大鼠躯体左倾30°,将超声探头置于大鼠胸骨左侧,与胸骨中线呈10°~30°角。超声测定的指标包括左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室舒张末期容积(left ventricular end diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end systolic volume,LVESV)、左心室质量指数(left ventricular mass index,LVMI)、左心室射血分数(left ventricular ejection fraction,LVEF)。
1.10 统计学方法

2 结果
2.1 各组大鼠心肌病理学形态变化
假手术组大鼠心肌结构完整,心肌纤维排列规则,心肌组织无明显炎细胞浸润。MIRI组大鼠心肌纤维排列紊乱,细胞变性坏死,细胞结构破坏,心肌纤维大量溶解。HGF组大鼠心肌结构破坏较MIRI组比较明显减轻,细胞少量变性坏死,间质水肿减轻,心肌纤维溶解减少,见图1。
2.2 各组大鼠血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达比较
与假手术组比较,MIRI组大鼠血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达均显著升高(<0.05)。与MIRI组比较,HGF组的血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达均显著降低(<0.05),见表1,图2、3。

图1 各组大鼠心肌HE染色观察(×400)
A.假手术组;B.MIRI组;C.HGF组

表1 各组大鼠血清CK-MB、心肌细胞凋亡指数、Caspase-3和Bax蛋白表达比较()
注:与假手术组比较,*<0.05;与MIRI组比较,#<0.05

图2 各组大鼠Caspase3蛋白免疫组化表达(×400)
A.假手术组未见蛋白染色表达;B.MIRI组可见蛋白胞质染色为深褐色,强阳性表达;C.HGF组蛋白表达明显减少,少量胞质染色为浅褐色
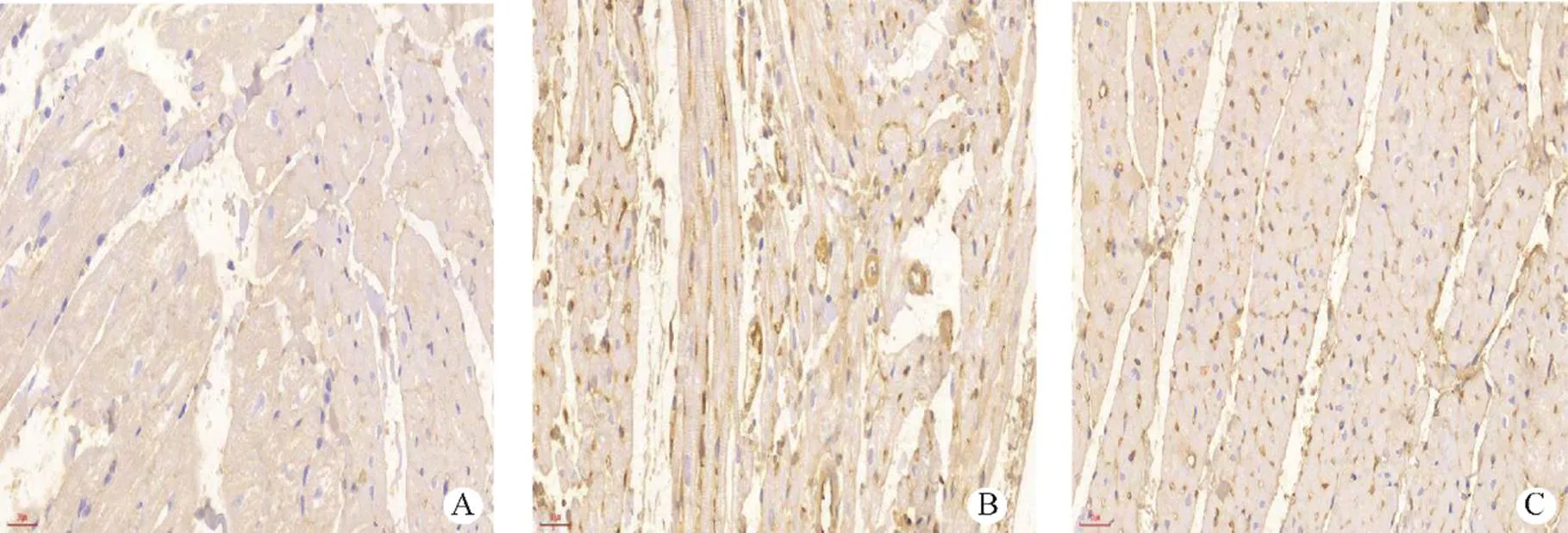
图3 各组大鼠Bax蛋白免疫组化表达(×400)
A.假手术组未见蛋白染色表达;B.MIRI组可见蛋白胞质染色为深褐色,强阳性表达;C.HGF组蛋白表达明显减少,少量胞质染色为浅褐色
2.3 各组大鼠心功能指标比较
与假手术组比较,MIRI组LVESD、LVEDD、LVEDV、LVESV及LVMI均显著增加(<0.05),但LVEF显著降低(<0.05);与MIRI组比较,HGF组LVESD、LVEDD、LVEDV、LVESV及LVMI均显著降低(<0.05),LVEF显著升高(<0.05),见表2。

表2 各组心脏超声指标比较()
注:与假手术组比较,*<0.05;与MIRI组比较,#<0.05
3 讨论
MIRI是心血管疾病治疗中常见的病理生理现象,其机制涉及氧自由基的变化、内皮细胞功能障碍、钙超载及炎症反应等多个环节。同时,细胞凋亡也是重要机制之一[6]。有研究建立MIRI犬模型,心肌缺血7h细胞凋亡并不明显,而缺血1h,再灌注6h则细胞凋亡显著,提示在心肌再灌注时更容易发生细胞凋亡[7]。
Caspase家族蛋白酶常以无活性形式存在,在某些凋亡信号刺激后才活化发挥作用,是细胞凋亡重要的通路之一[8]。心肌细胞凋亡信号转导通路主要通过线粒体/Caspase-9和死亡受体/Caspase-8两条途径,Caspase-3则是两条通路下游的共同效应酶[9]。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)是一种原癌基因,对于缺血再灌注损伤有抗细胞凋亡作用[10]。有研究建立了大鼠MIRI模型,分别检测再灌注区和非灌注区Bcl-2和Bax的表达水平,结果显示在心肌再灌注区Bax表达增加、Bcl-2无表达,在非灌注区结果相反,提示了Bax促细胞凋亡可加重心肌损伤的作用[11]。本研究结果显示,MIRI组大鼠心肌Caspase-3及Bax水平均明显升高,心肌细胞凋亡指数升高,证实了两个关键凋亡相关因子Caspase-3及Bax均参与了MIRI的发生。
HGF是一种多效性生长因子,可以刺激各种上皮细胞的生长,同时与组织损伤、细胞凋亡等密切相关[12]。将HGF作用于经凋亡诱导剂足叶乙苷处理后的慢性髓细胞性白血病K562细胞,观察细胞凋亡情况,结果显示HGF组Bax mRNA、Caspase-3 mRNA及Caspase-9 mRNA均低于模型组,证实HGF可通过与c-Met受体结合抑制K562细胞凋亡[13]。有研究通过建立自发性高血压大鼠模型,用携带腺病毒的HGF干预,检测Bcl-2、Bax蛋白水平及心肌凋亡指数,结果显示HGF组Bcl-2表达升高,而Bax明显降低,心肌凋亡指数下降,提示HGF可减轻高血压导致的左心室细胞凋亡[14]。
有研究用HGF干预大脑缺血再灌注损伤大鼠模型,结果显示HGF组凋亡细胞数明显减少,Caspase-3及Bax水平降低,提示HGF可抑制脑缺血再灌注损伤神经元的凋亡[15]。在大鼠心脏移植模型中应用HGF干预,结果显示HGF组心肌酶下降,心肌细胞凋亡减少,证实HGF可通过抗细胞凋亡减轻大鼠心脏移植的再灌注损伤[16]。本研究结果显示,HGF干预后Caspase-3及Bax蛋白均低于MIRI组,心肌细胞凋亡指数下降,心肌组织损伤减轻,大鼠心功能指标改善,说明HGF通过降低Caspase-3及Bax蛋白水平抑制细胞凋亡,从而减轻MIRI并改善心功能。
HGF抗细胞凋亡的机制尚不完全明确。磷酸肌醇3-激酶(phosphatidylinositide 3-kinase,PI3K)是HGF发挥各种生物学活性重要的信号传递分子,包括调节细胞的分裂、分化、凋亡等作用,PI3K是由调节亚基(p85)和酶促亚基(p110)组成的二聚体,其配体磷酸激酶B(protein kinases B,Akt)是一种与PKA及PKC均有很高同源性的蛋白丝/苏氨酸激酶[17]。PI3K调节亚基通过Src同源结构域与HGF受体上磷酸化的酪氨酸残基结合,从而使其磷酸化而激活PI3K,进而促使细胞膜中的磷脂酰肌醇-4,5-二磷酸生成磷脂酰肌醇-3,4,5-二磷酸,再结合到Akt的PH结构域上,使Akt转移到质膜内侧,进而磷酸化多种蛋白,发挥调节细胞代谢等多种效应[18]。
综上所述,HGF干预MIRI大鼠后,血清CK-MB明显降低,同时心肌细胞凋亡指数、Caspase-3及Bax蛋白水平均明显降低,大鼠心功能指标得到改善,提示HGF可通过抑制细胞凋亡减轻MIRI,其具体机制需要通过更多的试验进一步探讨。
[1] JIANG W, YIN Y, GU X, et al. Opportunities and challenges of pain-related myocardial ischemia-reperfusion injury[J]. Front Physiol, 2022, 13: 900664.
[2] RABINOVICH-NIKITIN I, KIRSHENBAUM L A. Circadian regulated control of myocardial ischemia- reperfusion injury[J]. Trends Cardiovasc Med, 2022, S1050-1738(22)00120-7.
[3] WANG L S, WANG H, ZHANG Q L et al. Hepatocyte growth factor gene therapy for ischemic diseases[J]. Hum Gene Ther, 2018, 29(4): 413–423.
[4] PINTADO M C, MACEDA L, TRASCASA M, et al. Prognostic tools at hospital arrival in acute myocardial infarction: copeptin and hepatocyte growth factor[J]. Egypt Heart J, 2022, 4(1): 35.
[5] ZHANG Z, LONG C, GUAN Y, et al. Hepatocyte growth factor intervention to reduce myocardial injury and improve cardiac function on diabetic myocardial infarction rats[J]. Eur J Histochem, 2020, 64(s2): 3142.
[6] ALGOET M, JANSSENS S, HIMMELREICH U, et al. Myocardial ischemia-reperfusion injury and the influence of inflammation[J]. Trends Cardiovasc Med, 2022, S1050-1738(22)00029-9.
[7] PARK B W, JUNG S H, DAS S, et al. In vivo priming of human mesenchymal stem cells with hepatocyte growth factor-engineered mesenchymal stem cells promotes therapeutic potential for cardiac repair[J]. Sci Adv, 2020, 6(13): eaay6994.
[8] KUNINAKA Y, ISHIDA Y, NOSAKA M et al. Forensic significance of intracardiac heme oxygenase-1 expression in acute myocardial ischemia[J]. Sci Rep, 2021, 11(1): 21828.
[9] ARAYA L E, SONI I V, HARDY J A, et al. Deorphanizing Caspase-3 and Caspase-9 substrates in and out of apoptosis with deep substrate profiling[J]. ACS Chem Biol, 2021, 16(11): 2280–2296.
[10] YUAN Z, DEWSON G, CZABOTAR P E, et al. VDAC2 and the BCL-2 family of proteins[J]. Biochem Soc Trans, 2021, 9(6): 2787–2795.
[11] SULTAN F, KAUR R, TARFAIN N U, et al. Protective effect of rosuvastatin pretreatment against acute myocardial injury by regulating Nrf2, Bcl-2/Bax, iNOS, and TNF-α expressions affecting oxidative/nitrosative stress and inflammation[J]. Hum Exp Toxicol, 2022, 41: 9603271211066065.
[12] CZYZ M. HGF/c-MET signaling in melanocytes and melanoma[J]. Int J Mol Sci, 2018, 19(12): 3844.
[13] LI B, SUN B, ZHU J, et al. Expression of RKIP in chronic myelogenous leukemia K562 cell and inhibits cell proliferation by regulating the ERK/MAPK pathway[J]. Tumour Biol, 2014, 35(10): 10057–10066.
[14] LEE H, KIM K C, HONG Y M. Changes of Bax, Bcl-2, CCR-2, MCP-1, and TGF-β1 genes in the left ventricle of spontaneously hypertensive rat after losartan treatment[J]. Korean J Pediatr, 2019, 62(3): 95–101.
[15] SAHAN O B, GUNEL-OZCAN A. Hepatocyte growth factor and insulin-like growth factor-1 based cellular therapies for oxidative stress injury[J]. Curr Stem Cell Res Ther, 2021, 16(7): 771–791.
[16] VASCO M, BENINCASA G, FILRITO C, et al. Clinical epigenetics and acute/chronic rejection in solid organ transplantation: an update[J]. Transplant Rev (Orlando), 2021, 35(2): 100609.
[17] JIA J Y, ZANG E H, LV L J, et al. Flavonoids in myocardial ischemia-reperfusion injury: therapeutic effects and mechanisms[J]. Chin Herb Med, 2020, 28, 13(1): 49–63.
[18] ZHANG P, GUO Z F, XU Y M, et al. N-Butylphthalide (NBP) ameliorated cerebral ischemia reperfusion- induced brain injury via HGF-regulated TLR4/NF-κB signaling pathway[J]. Biomed Pharmacother, 2016, 83: 658–666.
Effect of HGF on myocardial injury by inhibiting apoptosis
LIANG Mingting, GONG Ying, SHANG Kunpeng, JIA Guotao, PANG Ying
1.Department of Cardiology, Liaocheng People’s Hospital, Liaocheng 252000, Shandong, China; 2.Department of Pathology, Liaocheng People’s Hospital, Liaocheng 252000, Shandong, China
To observe the effect of hepatocyte growth factor (HGF) on apoptosis of myocardial ischemia-reperfusion injury (MIRI) in rats by constructing a model of MIRI with HGF intervention.A total of 24 male Wistar rats were divided into sham-operated group (=8), MIRI group (=8) and HGF group (=8) according to the random number table method. The sham-operation group was only threaded without ligation, the MIRI group ligated the left anterior descending branch of rats for 30 minutes and then perfused for 180 minutes, and the HGF group was given a tail vein injection of HGF (1mg/kg) at the same time as ligating the anterior descending branch of rats. The serum creatine kinase isoenzyme (CK-MB) level was measured in each group, the apoptotic index of cardiomyocytes was determined by TUNEL method, the expression of Caspase-3 and Bax protein was detected by immunohistochemistry, and the cardiac function of rats was examined by echocardiography.Compared with the sham-operated group, serum CK-MB, cardiomyocyte apoptotic index, Caspase-3 and Bax protein expression, left ventricular end systolic diameter (LVESD), left ventricular end diastolic diameter (LVEDD), left ventricular end diastolic volume (LVEDV), left ventricular end systolic volume (LVESV), left ventricular mass index (LVMI), and left ventricular mass index (LVMI). were significantly higher (<0.05), and left ventricular ejection fraction (LVEF) was significantly lower in the MIRI group (<0.05). Compared with the MIRI group, serum CK-MB, cardiomyocyte apoptotic index, Caspase-3 and Bax protein expression, LVESD, LVEDD, LVEDV, LVESV and LVMI were significantly lower (<0.05), and LVEF was significantly higher in the HGF group (<0.05).HGF can reduce myocardial ischemia reperfusion injury and improve cardiac function of rats by inhibiting cardiomyocyte apoptosis.
Hepatocyte growth factor; Myocardial ischemia-reperfusion injury; Apoptosis
R542.2
A
10.3969/j.issn.1673-9701.2023.23.012
庞英,电子信箱:piaoyang523@163.com
(2023–02–23)
(2023–03–20)
