卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌有效性及安全性的Meta分析
2023-08-31于豫鄂方祝君伊晓娇余彩龙李婷包剑锋
于豫鄂,方祝君,伊晓娇,余彩龙,李婷,包剑锋
·药物研究·
卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌有效性及安全性的Meta分析
于豫鄂1,方祝君2,伊晓娇1,余彩龙1,李婷1,包剑锋3
1.浙江大学医学院附属杭州市西溪医院药学部,浙江杭州 310023;2.浙江大学医学院附属第一医院临床药学室,浙江杭州 310003;3.浙江大学医学院附属杭州市西溪医院科研教学部,浙江杭州 310023
系统评价卡瑞利珠单抗联合阿帕替尼在原发性肝癌中的有效性及安全性。检索PubMed、Cochrane Library、Embase、中国知网、维普、万方数据库与卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌相关的所有研究,时间限定为建库至2022年7月31日。采用Stata12.0软件对卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌的整体有效性和安全性进行系统评价。共纳入8篇文献10项研究,包含560例患者。卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌的客观缓解率为29.0%[95%置信区间(confidence interval,): 0.22~0.37,<0.001]、疾病控制率为72.0%(95%: 0.67~0.77,<0.001)、中位无进展生存期为7.1个月(95%: 5.51~8.69,<0.001)、12个月生存率为45.59%(95%: 16.60%~74.58%,<0.01)、腹泻发生率为30.0%(95%: 0.25~0.35,<0.001)、3级及以上腹泻发生率为2.0%(95%: 0.01~0.04,<0.01)。所有级别的不良反应比较,差异均有统计学意义(<0.05);3级及以上的不良反应中,腹痛、手足综合征、血小板减少、白细胞减少、蛋白尿比较,差异有统计学意义(<0.05),其余无统计学意义。卡瑞利珠单抗联合阿帕替尼治疗原发性肝癌疗效确切,不良反应发生率低,为原发性肝癌的治疗提供参考。
卡瑞利珠单抗;阿帕替尼;原发性肝癌;Meta分析
原发性肝癌(primary liver cancer,PLC)的主要类型包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管癌等,据统计,2020年PLC已成为全球第五大常见癌症和第三大癌症死亡原因[1],2019年中国报告肝癌新增病例210462例,成为全球肝癌病例新增最多的国家[2]。手术是PLC的主要治疗手段,但早期肝癌大多无明显临床症状,多数患者确诊时已经是中晚期,错失了手术根治的最佳时机,5年生存率仅有10%~20%[3]。索拉非尼是第1个被证明可以提高晚期HCC患者生存率的药物,但其明显的耐药性和潜在的肝脏毒性使临床使用受到限制[4]。卡瑞利珠单抗是人源化免疫球蛋白4单克隆抗体药物,其抑制细胞程序性死亡受体1(programmed cell death protein 1,PD-1)与细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)结合的IC50和EC50明显低于其他PD-1抑制剂,对PD-1位点有更高的亲和力,能够高效阻断PD-1与PD-L1的结合[5-7]。阿帕替尼是一种新型的血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR-2)酪氨酸激酶的小分子抑制剂,当肿瘤细胞内VEGFR-2低表达时,阿帕替尼通过有效阻断细胞周期进程、减少新生血管生成、抑制VEGFR-2/Akt/ERK通路激活发挥作用,而当VEGFR-2表达水平较高时,阿帕替尼还可通过抑制线粒体依赖性途径诱导肿瘤细胞凋亡发挥作用[8-9]。但卡瑞利珠单抗与阿帕替尼联合应用于PLC的治疗并不是标准的治疗方案,对其有效性和安全性需要进一步验证,因此本研究对已发表的相关文献进行系统分析,为临床提供参考。
1 资料与方法
1.1 检索策略
以卡瑞利珠单抗、阿帕替尼、肝肿瘤及其自由词为中英文检索词,检索PubMed、Cochrane Library、Embase、中国知网、维普、万方数据库,时间限定为建库至2022年7月31日。具体检索策略:以中国知网为例,SU=(“卡瑞利珠单抗”+“卡瑞利珠单克隆抗体”)*(“肝肿瘤”+“肝癌”+“肝腺癌”+“肝细胞癌”+“肝脏肿瘤”+“肝部肿瘤”+“肝细胞瘤”+“肝恶性肿瘤”+“肝脏恶性肿瘤”)*“阿帕替尼”。
1.2 纳入与排除标准
纳入标准:①研究类型:全文发表的观察性或随机对照研究;②研究对象:年龄≥18周岁且符合PLC诊断的患者;③干预措施:同时使用卡瑞利珠单抗和阿帕替尼治疗。④结局指标:客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、中位无疾病进展(progression-free survival,PFS)时间、12个月总生存期(overall survival,OS),以及不良反应评价包括腹泻、腹痛、手足综合征、血小板减少、白细胞减少、蛋白尿、皮疹、疲劳、甲状腺功能减退、皮肤毛细血管增生症等。排除标准:①药物使用剂量与干预措施不符或治疗方法描述不详;②重复发表的文献;③文献资料记录不全或无法获得全文的文献;④病例报道、综述、会议论文、动物研究等其他类型文献。
1.3 文献筛选与质量评价
由两名研究员独立筛选文献并且提取相关资料,如有分歧通过共同讨论解决,必要时可以由第3名研究员协助解决。使用MINORS条目(methodological index for non-randomized studies,MINORS)对文献质量进行评价[10],评分≥9分认为是高质量研究。
1.4 统计学方法
采用Cochrane协作网提供的Stata12.0版软件,采用比值比(odds ratio,OR)为疗效分析统计量,各效应量均以95%置信区间(confidence interval,)表示,采用2检验分析各研究间的异质性,当各研究间存在高度统计学异质性(<0.1,2>50%)时,采用随机效应模型,否则采用固定效应模型。使用漏斗图及Begg’s检验对发表偏倚进行定量分析。
2 结果
2.1 文献检索
共检索出73篇文献,排除重复文献,阅读摘要和全文后排除不符合要求的文献,最终纳入8篇文献[11-18],见图1。纳入文献的基本特征及质量评价见表1。

图1 文献筛选流程图
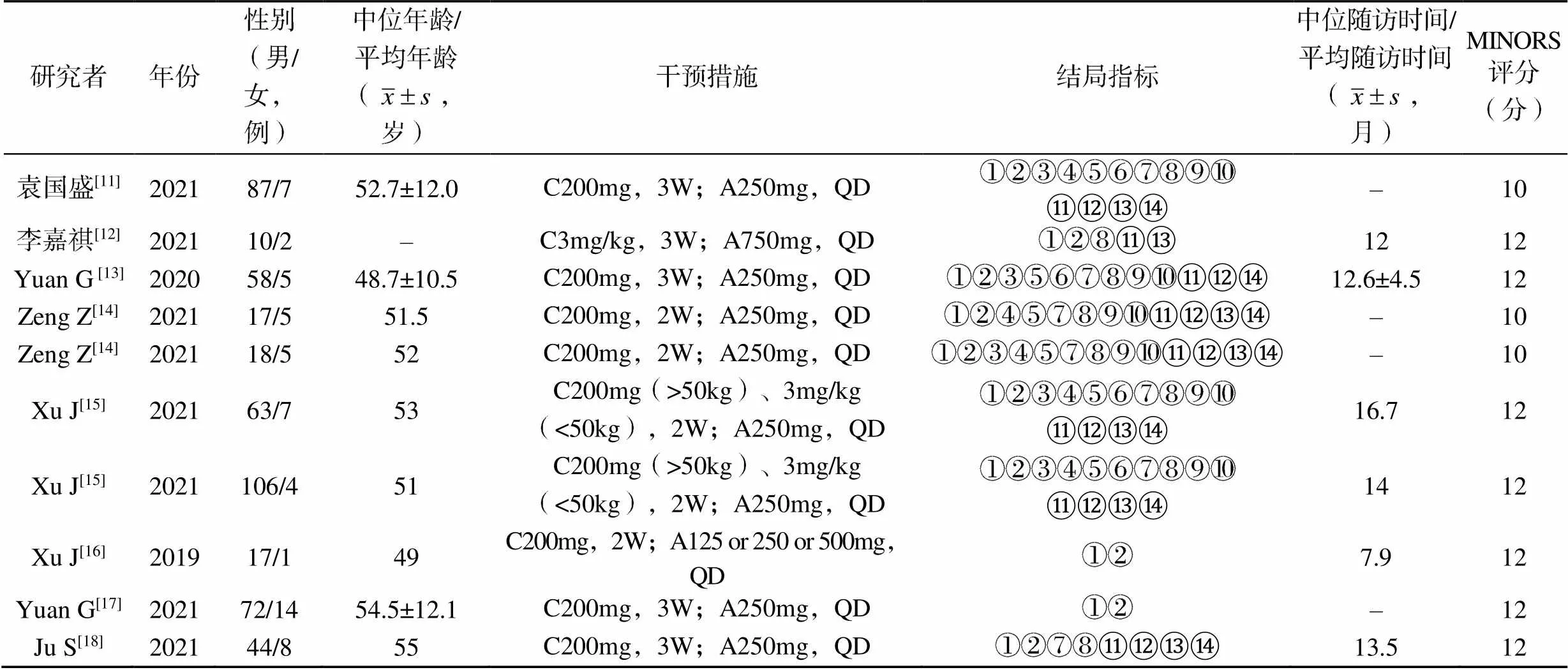
表1 纳入文献的基本特征与质量评价
注:C为卡瑞利珠单抗;A为阿帕替尼;2W为两周1次;3W为三周一次;QD为1次/d;①ORR;②DCR;③中位PFS时间;④12个月OS率;⑤腹泻;⑥腹痛;⑦疲劳;⑧手足综合征;⑨血小板减少;⑩白细胞减少;⑪甲状腺功能减退;⑫蛋白尿;⑬皮肤毛细血管增生症;⑭皮疹
2.2 Meta分析结果
2.2.1 主要指标 8篇文献10项研究报告了ORR,包括560例患者。异质性检验2=70.55%,检验<0.01,采用随机效应模型进行合并分析,结果显示ORR为29.0%(95%: 0.22~0.37,<0.001),见图2。
8篇文献10项研究报告了DCR,包括560例患者。异质性检验2=36.44%,检验=0.12,采用固定效应模型进行合并分析,结果显示DCR为72.0%(95%: 0.67~0.77,<0.001),见图3。
3篇文献6项研究报告了腹泻发生率,包括392例患者。异质性检验2=0.95%,检验=0.41,选择固定效应模型进行合并分析,结果显示全级别腹泻的总发生率为30.0%(95%: 0.25~0.35,<0.001),见图4。
3篇文献4项研究报告了3级及以上腹泻发生率,包括347例患者。异质性检验2=0,检验=0.40,采用固定效应模型进行合并分析,结果显示3级及以上腹泻的发生率为2.0%(95%: 0.01~0.04,<0.01),见图5。
2.2.2 次要指标 4篇文献5项研究报道了中位PFS时间,包括370例患者。异质性检验2=79.3%,检验=0.001,采用随机效应模型进行合并分析,结果显示中位PFS时间为7.1个月(95%: 5.51~8.69,=0.001),见图6。
3篇文献5项研究报道了12个月OS率,包括329例患者。异质性检验2=97.5%,检验<0.1,采用随机效应模型进行合并分析,结果显示12个月OS率为45.59%(95%: 16.6~74.58,=0.002),见图7。
研究中所有级别的不良反应比较,差异均有统计学意义(<0.05)。3级及以上的不良反应中,血小板减少、手足综合征、腹痛、白细胞减少以及蛋白尿比较,差异均有统计学意义(<0.05),其余比较差异均无统计学意义(>0.05),见表2。
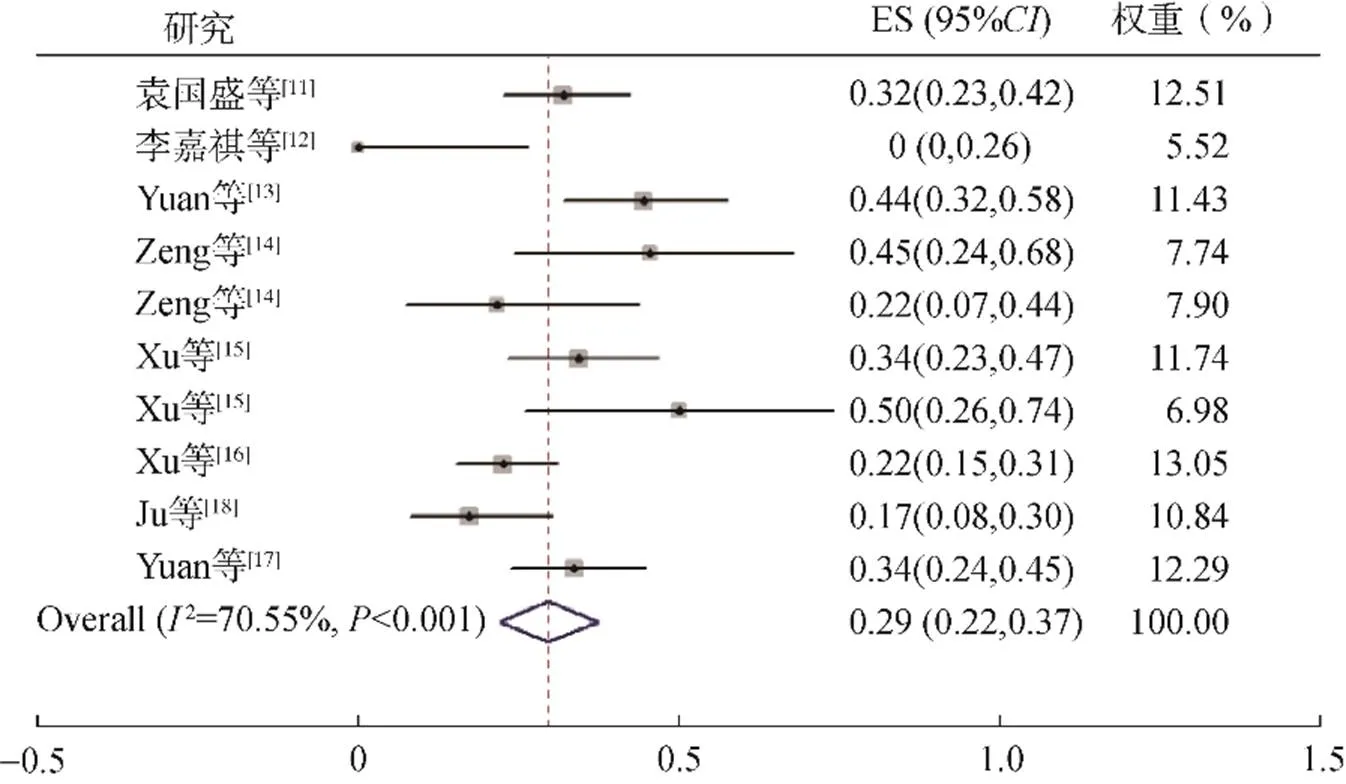
图2 ORR的Meta分析森林图
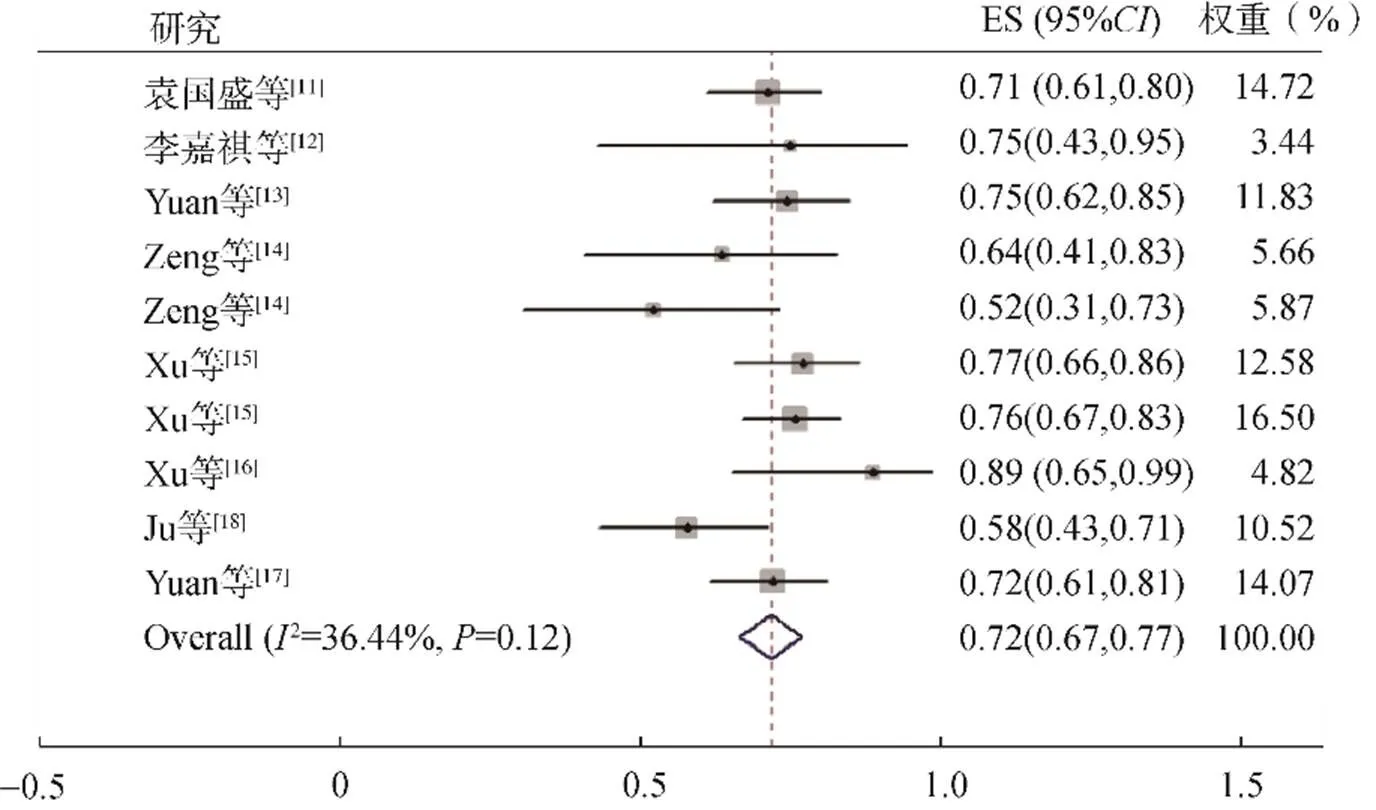
图3 DCR的Meta分析森林图
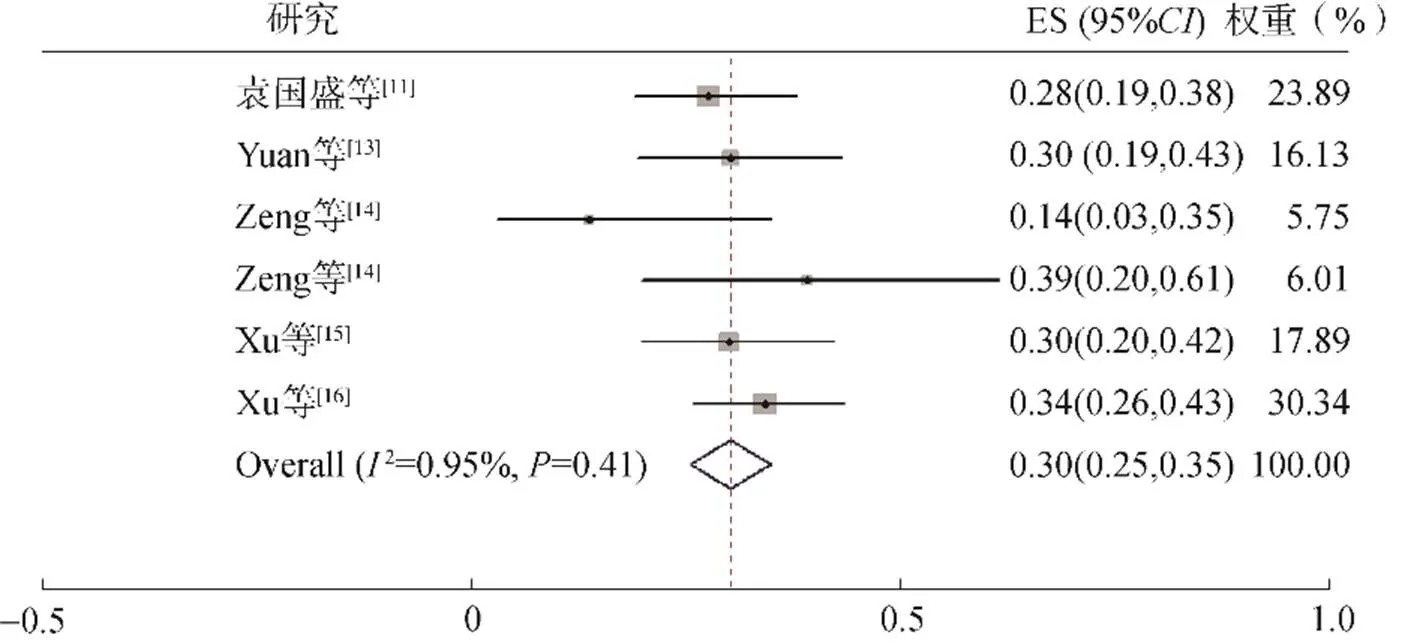
图4 腹泻发生率的Meta分析森林图

图5 3级及以上腹泻发生率的Meta分析森林图

图6 中位PFS的Meta分析森林图
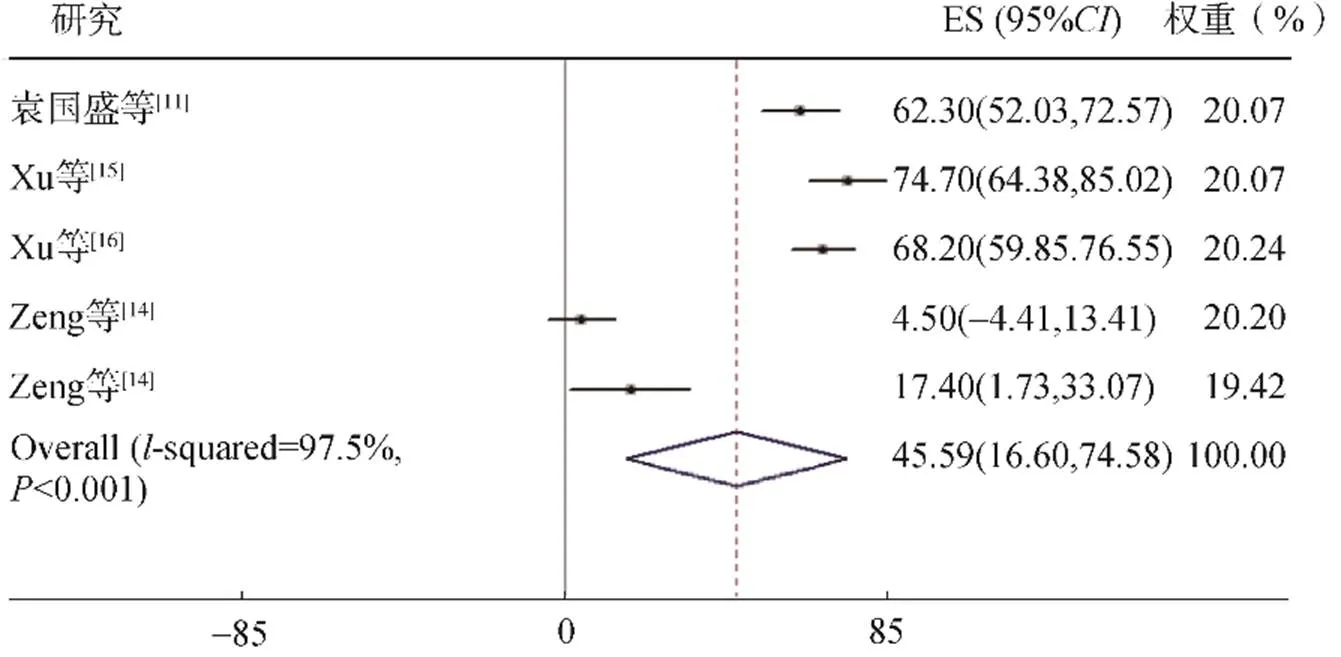
图7 12个月OS率的Meta分析森林图
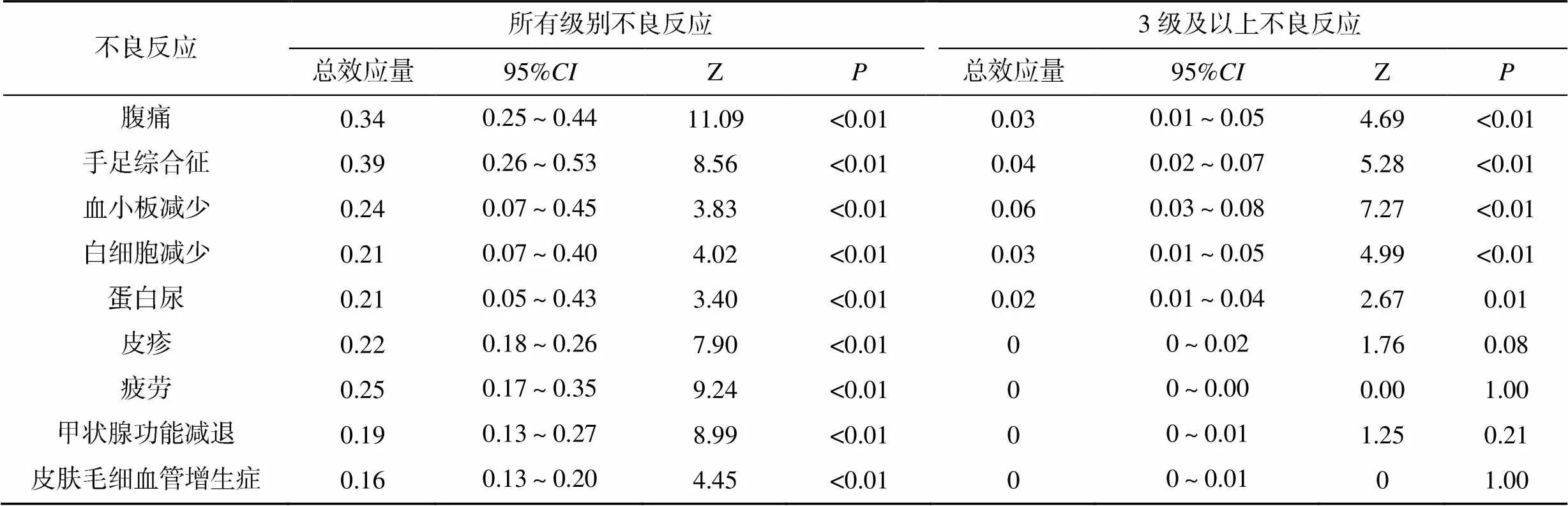
表2 其他不良反应的发生率
2.3 偏倚检验
ORR的漏斗图显示,两边基本对称,进一步使用Begg’s偏倚检验对发表偏倚进行定量检测(=0.655),见图8。DCR的Begg’s偏倚检验结果显示=0.788,均提示发表偏倚对ORR和DCR结果影响较小。
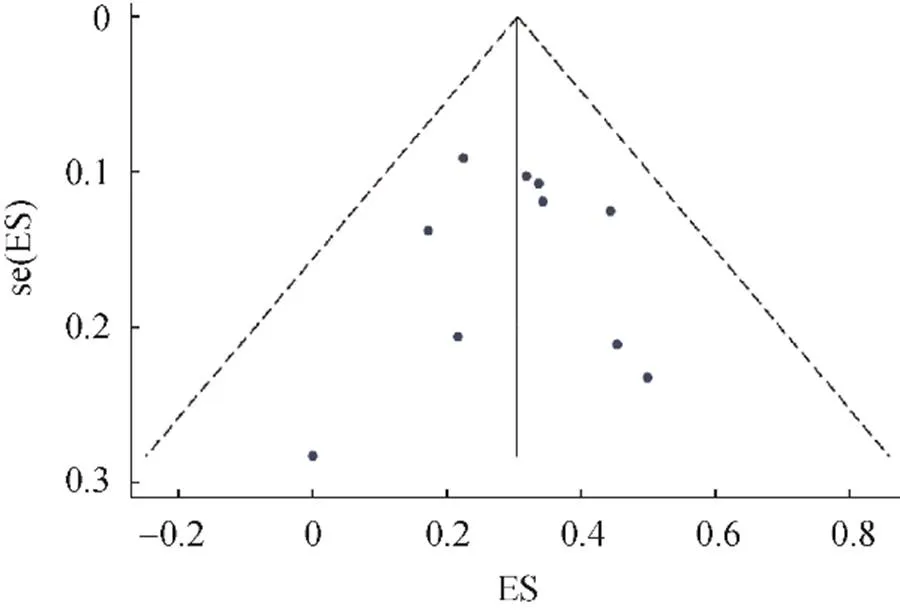
图8 ORR漏斗图
3 讨论
现有的研究表明,肿瘤微环境是肿瘤生长发育所必需的特殊环境,而肿瘤免疫微环境和肿瘤血管生成则是肿瘤微环境的两个重要分支,抗血管生成剂通过诱导肿瘤内皮微静脉增强T淋巴细胞的浸润和活性来促进PD-1/PD-L1治疗,扩大PD-1/PD-L1抑制剂单药治疗无效的疾病领域和疗效范围,PD-1/PD-L1阻断剂则可提高抗血管生成剂的敏感性并延长其疗效,免疫检查点抑制剂与抗血管生成剂联合使用具有协同作用[19-21]。PLC作为一种典型的炎症相关性肿瘤,同时还是一种典型的富血管肿瘤,故PD-1抑制剂和抗血管生成剂的组合在抑制肝癌肿瘤生长方面具有巨大的潜力。本研究结果显示,卡瑞利珠单抗联合阿帕替尼治疗PLC的ORR为29.0%,DCR为72.0%。与单用卡瑞利珠单抗的2期临床试验结果相比[7],两药联合使用的ORR(29.0%14.7%)和DCR(72.0%44.2.0%)均得到明显的提高,本研究结果与其一致,提示在PLC的治疗中,两药联用在ORR和DCR方面均优于任何单药治疗的效果。本研究结果显示,中位PFS时间为7.1个月,12个月OS率为45.59%。两药联用的12个月OS率(45.59%)不及一项单用卡瑞利珠单抗治疗晚期HCC的2期临床试验(55.9%)[7],未达到预期的效果,可能与此次对中位PFS和12个月OS率进行分析时纳入研究数量较少导致的结果偏倚有关。
腹泻是阿帕替尼最常见的不良反应之一,作用机制可能与其抑制在肠内皮细胞中高度表达的VEGF和VEGFRs通路有关[22]。本研究结果显示安全性评价中的全级别腹泻发生率为30.0%,3级及以上的腹泻发生率为2.0%。一项纳入207例接受阿帕替尼治疗HCC患者的研究结果显示,与阿帕替尼相关的全级别腹泻的发生率为22.7%,3级以上腹泻发生率为1.0%[23]。另有研究显示,全级别PD-1/PDL-1相关的腹泻发生率为9.47%,3级及以上腹泻发生率为0.59%[24]。综上,两药联用的腹泻发生率与单药相比均有升高,但与阿帕替尼单药应用的结果最为相近,故主要考虑与阿帕替尼相关的可能性较大,临床使用中可通过调整阿帕替尼的使用剂量缓解相关症状。
卡瑞利珠单抗在2019年才被批准用于肝癌治疗,故本研究纳入文献数量有限,结果存在一定的局限性,因此未来应继续深入开展更多的高质量临床研究。同时,由于本研究对中位PFS、12个月OS率、腹泻以及其他相关不良反应发生率指标进行分析时纳入的文献数量较少,漏斗图的准确性难以得到保证,因此未对这些指标进行发表偏倚的分析。
综上所述,卡瑞利珠单抗与阿帕替尼联合使用对于PLC的治疗效果确切,虽然两药联合使用时不良反应发生的种类多样,但是各不良反应的发生率均在40%以下,3级及以上不良反应的发生率也较低,为临床在选择PLC治疗方案时提供参考。
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209–249.
[2] LIU Y, ZHENG J, HAO J, et al. Global burden of primary liver cancer by five etiologies and global prediction by 2035 based on global burden of disease study 2019[J]. Cancer Med, 2022, 11(5): 1310–1323.
[3] ALLEMANI C, WEIR H K, CARREIRA H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J]. Lancet, 2015, 385(9972): 977–1010.
[4] 中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中国实用外科杂志, 2022, 42(3): 241–273.
[5] MO H, HUANG J, XU J, et al. Safety, anti-tumour activity, and pharmacokinetics of fixed-dose SHR-1210, an anti-PD-1 antibody in advanced solid tumours: a dose-escalation, phase 1 study[J]. Br J Cancer, 2018, 119(5): 538–545.
[6] XU B, SUN H C. Camrelizumab: an investigational agent for hepatocellular carcinoma[J]. Expert Opin Investig Drugs, 2021: 1–10.
[7] QIN S, REN Z, MENG Z, et al. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial[J]. Lancet Oncol, 2020, 21(4): 571–580.
[8] YANG C, QIN S. Apatinib targets both tumor and endothelial cells in hepatocellular carcinoma[J]. Cancer Med, 2018, 7(9): 4570–4583.
[9] 秦叔逵, 白玉贤, 欧阳学农, 等. 阿帕替尼一线治疗晚期肝细胞癌的前瞻性、随机、开放、全国多中心Ⅱ期临床试验[J]. 临床肿瘤学杂志, 2017, 22(12): 1057–1065.
[10] SLIM K, NINI E, FORESTIER D, et al. Methodological index for non-randomized studies (minors): development and validation of a new instrument[J]. ANZ J Surg, 2003, 73(9): 712–716.
[11] 袁国盛, 何伟猛, 胡晓云, 等. 卡瑞利珠单克隆抗体联合阿帕替尼二线治疗不可切除肝细胞癌的临床疗效及安全性分析: 一项多中心回顾性研究[J]. 中华肝脏病杂志, 2021, 29(4): 326–331.
[12] 李嘉祺. 阿帕替尼联合卡瑞利珠单抗治疗晚期肝细胞癌的临床观察[D]. 大理: 大理大学, 2021.
[13] YUAN G, CHENG X, LI Q, et al. Safety and efficacy of camrelizumab combined with apatinib for advanced hepatocellular carcinoma with portal vein tumor thrombus: a multicenter retrospective study[J]. Onco Targets Ther, 2020, 13: 12683–12693.
[14] ZENG Z, JIANG Y, LIU C, et al. Efficacy and biomarker exploration of camrelizumab combined with apatinib in the treatment of advanced primary liver cancer: a retrospective study[J]. Anticancer Drugs, 2021, 32(10): 1093–1098.
[15] XU J, SHEN J, GU S, et al. Camrelizumab in combination with apatinib in patients with advanced hepatocellular carcinoma (rescue): a nonrandomized, open-label, phase Ⅱ trial[J]. Clin Cancer Res, 2021, 27(4): 1003–1011.
[16] XU J, ZHANG Y, JIA R, et al. Anti-PD-1 antibody SHR-1210 combined with apatinib for advanced hepatocellular carcinoma, gastric, or esophagogastric junction cancer: an open-label, dose escalation and expansion study[J]. Clin Cancer Res, 2019, 25(2): 515–523.
[17] YUAN G, LI R, LI Q, et al. Interaction between hepatitis B virus infection and the efficacy of camrelizumab in combination with apatinib therapy in patients with hepatocellular carcinoma: a multicenter retrospective cohort study[J]. Ann Transl Med, 2021, 9(18): 1412.
[18] JU S, ZHOU C, YANG C, et al. Apatinib plus camrelizumab with/without chemoembolization for hepatocellular carcinoma: a real-world experience of a single center[J]. Front Oncol, 2021, 11: 835889.
[19] XU J, ZHANG Y, JIA R, et al. Anti-PD-1 Antibody SHR-1210 combined with apatinib for advanced hepatocellular carcinoma, gastric, or esophagogastric junction cancer: an open-label, dose escalation and expansion study[J]. Clin Cancer Res, 2019, 25(2): 515–523.
[20] FINN R S, IKEDA M, ZHU A X, et al. Phase Ib study of lenvatinib plus pembrolizumab in patients with unresectable hepatocellular carcinoma[J]. J Clin Oncol, 2020, 38(26): 2960–2970.
[21] ALLEN E, JABOUILLE A, RIVERA L B, et al. Combined antiangiogenic and anti-PD-L1 therapy stimulates tumor immunity through HEV formation[J]. Sci Transl Med, 2017, 9(385): 9679
[22] SCHMIDINGER M, DANESI R. Management of adverse events associated with cabozantinib therapy in renal cell carcinoma[J]. Oncologist, 2018, 23(3): 306–315.
[23] GU X, ZHANG S, YANG X, et al. Drug-related adverse events potentially predict the efficacy of apatinib on advanced hepatocellular carcinoma[J]. BMC Gastroenterol, 2022, 22(1): 1–9.
[24] WANG Y, ZHOU S, YANG F, et al. treatment-related adverse events of pd-1 and pd-l1 inhibitors in clinical trials: a systematic review and Meta-analysis[J]. JAMA Oncol, 2019, 5(7): 1008–1019.
Meta-analysis of the efficacy and safety of camrelizumab combined with apatinib in the treatment of primary liver cancer
YU Yu’e, FANG Zhujun, YI Xiaojiao, YU Cailong, LI Ting, BAO Jianfeng
1.Department of Pharmacy, Affiliated Hangzhou Xixi Hospital, Zhejiang University School of Medicine, Hangzhou 310023, Zhejiang, China; 2.Department of Clinical Pharmacy, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, Zhejiang, China; 3.Department of Scientific Research and Education, Affiliated Hangzhou Xixi Hospital, Zhejiang University School of Medicine, Hangzhou 310023, Zhejiang, China
To investigate the efficacy and safety of camrelizumab combined with apatinib for primary liver cancer.PubMed, Cochrane Library, Embase, CNKI, VIP, Wanfang were searched for English and Chinese study reports on camrelizumab and apatinib for primary liver cancer. The search period was from the establishment of the database to July 31, 2022. Stata 12.0 software was used to perform a Meta-analysis of the extracted date.A total of 8 literatures and 10 studies were included in this study, with a total of 560 cases with primary liver cancer. The Meta-analysis showed that the objective response rate was 29.0% [95%(confidence interval,): 0.22-0.37,<0.001), disease control rate was 72.0% (95%: 0.67-0.77,<0.001), median progression-free survival was 7.1 months (95%: 5.51-8.69,<0.001), 12-month overall survival rate was 45.59% (95%: 16.60%-74.58%,<0.01), all grades of diarrhea rate was 30.0% (95%: 0.25-0.35,<0.001), diarrhea rate of grade ≥3 was 2.0% (95%: 0.01-0.04,<0.01). All grades of adverse events were statistically significant, the adverse events of the grade ≥3 were statistically significant with abdominal pain, hand-foot syndrome, thrombocytopenia, leukopenia, and proteinuria.For patients with primary liver cancer, camrelizumab in combination with apatinib can achieve controllable safety and good efficacy, thereby providing a treatment option with clinical benefits.
Camrelizumab; Apatinib; Primary liver cancer; Meta-analysis
R735.7
A
10.3969/j.issn.1673-9701.2023.23.018
(2022–10–20)
(2023–01–03)
杭州市生物医药和健康产业发展扶持科技及专项(2021WJCY06)
包剑锋,电子信箱:zjbjf1972@aliyun.com
