负载丁香酚的改性纳米粒对玉米醇溶蛋白膜性能的影响
2023-08-30刘锦渊刘晓丽夏文水
刘锦渊, 刘晓丽, 夏文水
(江南大学 食品学院/食品科学与技术国家重点实验室/江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
塑料制品因价格低廉而被广泛用作包装材料,然而塑料的使用会对环境造成不利影响,威胁人类健康[1]。近年来,天然生物聚合物由于其天然可降解性而作为食品包装替代材料受到了越来越多的关注[2-3]。
蛋白质基生物聚合物具有良好的食品包装特性,可以部分代替塑料包装材料,减少对环境的危害,并可进一步提高食品的营养价值[4]。玉米醇溶蛋白(Zein)是一种植物蛋白,主要由非极性氨基酸残基(脯氨酸、亮氨酸和丙氨酸)组成,分子间以疏水键、氢键和二硫键相连,可用于制备食用膜[5]。然而,单一Zein膜的保鲜效果及其机械性能较弱,限制了其进一步应用[6]。有研究表明,将具有良好抑菌、抗氧化特性的天然提取物添加到Zein膜中,在保留成膜特性的同时,可以赋予其一定的功能特性[7]。

本研究拟将EG负载到CA与NH2-MSN共价接枝的纳米粒上,得到丁香酚/咖啡酸-介孔二氧化硅纳米粒(EG/CA-MSN)。将该纳米粒作为抑菌填料添加到Zein膜中,进一步获得丁香酚/咖啡酸-介孔二氧化硅纳米粒/玉米醇溶蛋白(EG/CA-MSN/Zein)复合膜,研究不同EG/CA-MSN质量分数对复合膜的阻隔性能、机械性能、抗氧化活性和抑菌性能的影响,并将复合膜应用于鱼片的保鲜研究中,以期得到一种性能优良的复合膜,为天然生物可食用膜的应用提供理论依据。
1 材料和方法
1.1 材料与试剂
鲜活鲫鱼购自当地超市。
玉米醇溶蛋白,Macklin生化有限公司(中国);丁香酚(纯度≥98%)、四乙氧基硅烷(TEOS)、3-氨丙基三乙氧基硅烷和十六烷基三甲基溴化铵(CTAB),北京伊诺凯有限公司;甘油、咖啡酸、硫代巴比妥酸、N-羟基琥珀酰亚胺(NHS)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、无水乙醇、1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-叠氮-(3-乙基苯并噻唑啉)-6-磺酸(ABTS),国药集团化学试剂有限公司。金黄色葡萄球菌(S.aureus,BNCC186335)和大肠杆菌(E.coli,BNCC336902),本实验室保藏。
1.2 仪器与设备
TA-XT plus型物性分析仪,英国SMS公司;IS10型傅里叶红外光谱仪,美国Thermo Fisher公司;SN-MS-9D型磁力搅拌器,上海尚普仪器设备有限公司;LHS-150HC-Ⅱ型恒温恒湿箱,上海一恒科学仪器有限公司;Stab MINI型恒温振荡培养箱,上海润度生物科技有限公司;SU8100型扫描电子显微镜,日本Hitachi公司;UltraScan Pro1166型高精度分光测色仪,美国Hunterlab公司;UV-1800型紫外分光光度计,日本Shimadzu公司;T10型均质机,德国IKA公司;K9840型自动凯式定氮仪,济南海能仪器股份有限公司;TGA 2型热重分析仪,梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1EG/CA-MSN的制备
EG/CA-MSN的制备过程如图1。
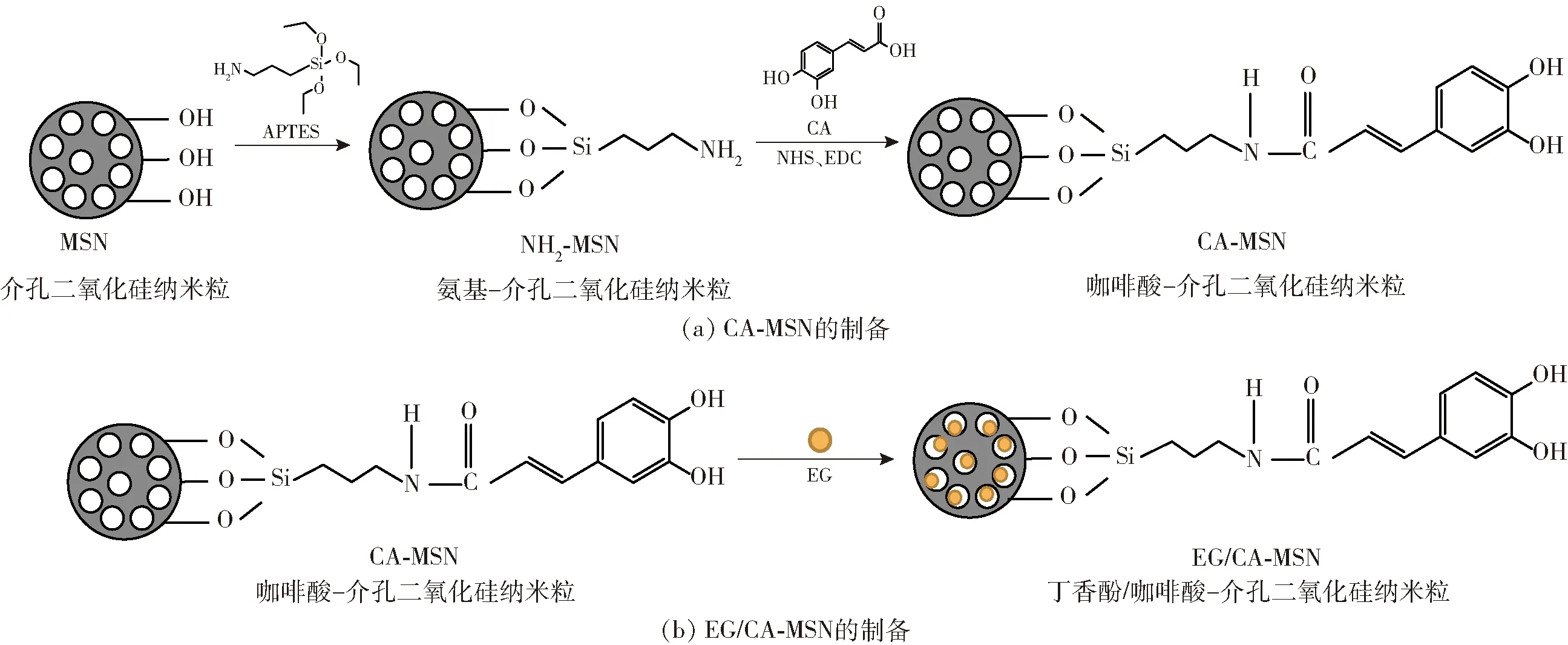
图1 EG/CA-MSN的制备过程
1)MSN的制备。参考Stöber方法并略加修改[18]。取一定量的CTAB溶于去离子水中,将pH值调至9~10,搅拌30 min。将5 mL TEOS逐滴添加到CTAB溶液中,于70 ℃下搅拌6 h,直到出现白色沉淀,冷却后离心。将沉淀置于550 ℃的马弗炉中6 h后,得到MSN粉末,备用。
2)CA-MSN的制备。取1 g MSN分散在无水乙醇中,加入2 mL APTES后于85 ℃下回流24 h,得到NH2-MSN。将500 mg的CA溶解在100 mL的PBS缓冲液中,分别添加500 mg的EDC和300 mg的NHS,在4 ℃下活化羧基后,加入500 mg的NH2-MSN进行接枝反应,离心并收集沉淀,用无水乙醇反复洗涤至少3次,获得产物。将产物冷冻干燥48 h后获得CA-MSN产物,备用。
3)EG/CA-MSN的制备。将CA-MSN(200 mg)超声分散于无水乙醇溶液中,加入10 mL EG后磁力搅拌12 h使EG被CA-MSN完全吸附,离心后收集沉淀物,冷冻干燥(0.5 MPa,-50 ℃)48 h后制备得到EG/CA-MSN。
1.3.2EG/CA-MSN/Zein复合膜的制备
EG/CA-MSN/Zein复合膜的制备过程如图2。
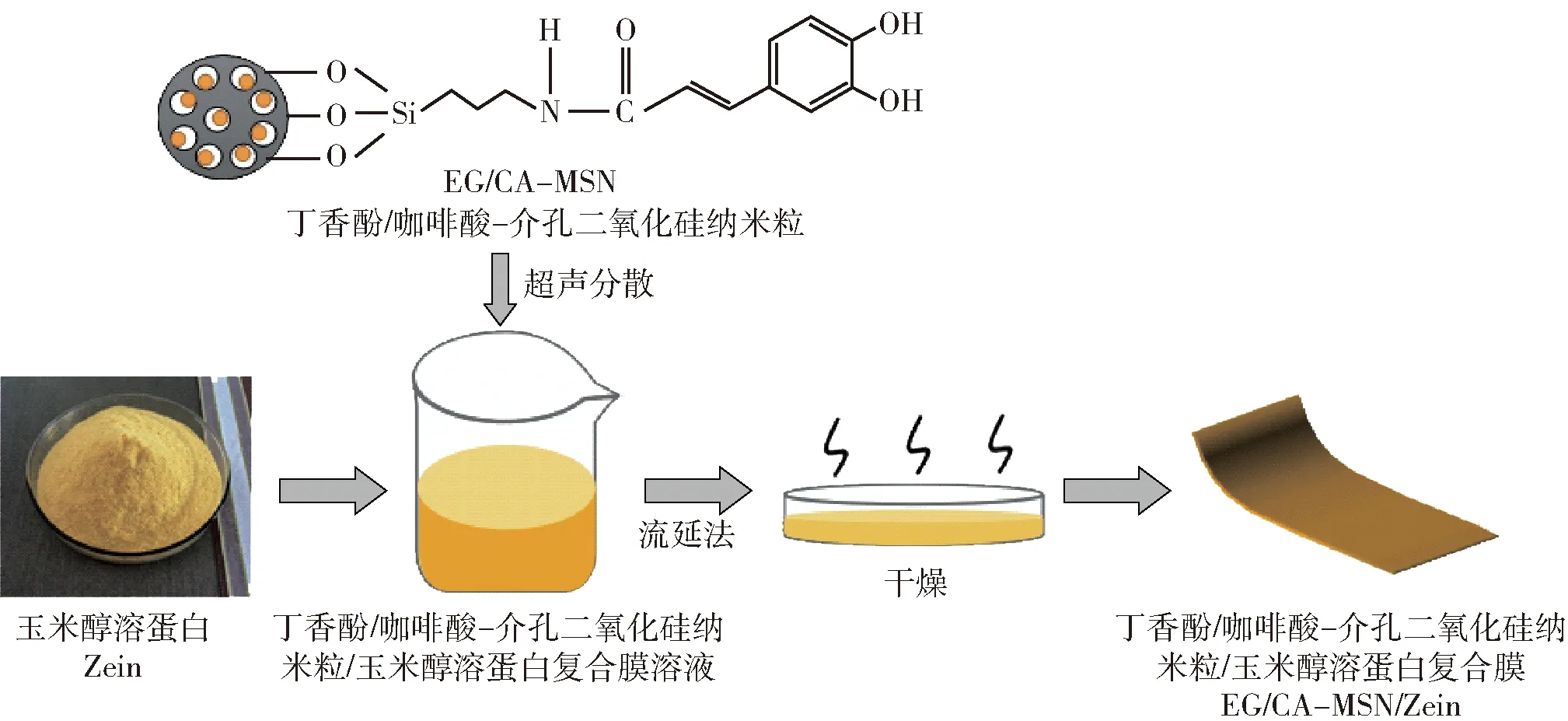
图2 EG/CA-MSN/Zein复合膜的制备过程
分别将一定量的Zein和质量分数为20%的甘油(基于Zein质量),置于体积分数为85%的乙醇溶液中,搅拌,得到Zein溶液。将不同质量分数的EG/CA-MSN(0、3%、6%、9%和12%,基于Zein的质量)添加到Zein溶液中,超声分散并磁力搅拌40 min,获得均匀的成膜溶液。将成膜溶液倒入圆形培养皿(10 cm×10 cm)中,在55 ℃下干燥24 h。测试前,将所有膜置于相对湿度53%的恒温恒湿培养箱中平衡48 h[19]。将制备含有质量分数为3%、6%、9%、12%的EG/CA-MSN复合膜分别命名为ECM-3、ECM-6、ECM-9、ECM-12,对照组为Zein膜。
1.3.3EG/CA-MSN的表征
1.3.3.1 红外光谱测定
将样品在光谱仪上扫描,波数为500~4 000 cm-1,扫描32次,分辨率为4 cm-1。
1.3.3.2 热稳定性测试
使用热重分析仪分析样品(3~5 mg)的热稳定性。将样品转移到坩埚中,在氮气气氛下,气体流速为20 mL/min。以10 ℃/min的加热速率在40~800 ℃进行测试。
1.3.4EG/CA-MSN/Zein复合膜的表征
1.3.4.1 红外光谱测定
将膜裁剪成1 cm×1 cm大小,在红外光谱仪上进行扫描,波数为500~4 000 cm-1,分辨率为4 cm-1。
1.3.4.2 表面形貌观察
将1 cm×1 cm复合膜样品贴在双面导电胶上,喷金处理后在3kV的加速电压下通过电子扫描显微镜(SEM)观察复合膜表面形貌。
1.3.5EG/CA-MSN/Zein复合膜的理化性质分析
1.3.5.1 热稳定性测试
使用热重分析仪测量复合膜的热稳定性。在 40~600 ℃(加热速率10 ℃/min)的氮气环境(流速 20 mL/min)下测试样品(3~5 mg)。
1.3.5.2 颜色及光学性质测定
根据Wu等[20]的方法测定复合膜的颜色和光学性质,并略加修改。样品表面颜色由色度计测定,以标准白板(L*=98.88,a*=-0.27,b*=0.35)为背景。测量复合膜的参数为a、b和L。总色差(ΔE)的计算方法见式(1)。
(1)
式(1)中,L为明暗度,a为红绿色,b为黄蓝色。
通过紫外分光光度计测量600 nm处复合膜的吸光度,膜的不透明度(Opacity)计算方法见式(2)。
Opacity=A600/d。
(2)
式(2)中,A600为600 nm处的吸光度;d为膜的厚度,mm。
1.3.5.3 机械性能测定
根据Zhou等[21]的方法略加修改。使用物性仪测定复合膜的拉伸强度(TS)和断裂伸长率(EB)。将不同复合膜样品剪成1 cm×6 cm的矩形条带,初始长度以及拉伸速度分别为40 mm和0.5 mm/s。TS和EB的计算方法见式(3)、式(4)。
TS=F/A。
(3)
EB=(L-L0)/L0×100%。
(4)
式(3)、式(4)中,F为最大力,N;A为膜的横截面积,m2;L为膜断裂时的长度,mm;L0为膜的初始长度,mm。
1.3.5.4 水蒸气透过率的测定
根据Yu等[22]的方法测量复合膜的水蒸气透过率(WVP)。将3 g无水CaSO4(0%RH)置于称量瓶中,用复合膜密封瓶口,并置于底部具有饱和K2SO4溶液(相对湿度97%)的干燥皿中。储存48 h后,根据杯子质量的变化计算WVP,计算方法见式(5)。
WVP=(Δm×d)/(A×t×Δp) 。
(5)
式(5)中,WVP,10-9g·mm/(m2·s·Pa);Δm为瓶子的增重,g;d为薄膜厚度,mm;A为薄膜的密封面积,m2;t为贮藏时间,s;Δp为水的饱和蒸汽压,Pa。
1.3.5.5 氧气透过率的测定
根据Zhang等[23]的方法测定复合膜的氧气透过率(OP)。向称量瓶中加入以铁粉、活性炭和氯化钠构成的脱氧剂。用活性膜密封后放入含有氯化钡饱和溶液的干燥器中48 h。通过式(6)计算OP。
OP=(Δm×d)/(A×t) 。
(6)
式(6)中,OP,10-6g·mm/(m2·s);Δm为瓶子的增重,g;d为膜厚度,mm;t为平衡时间,s;A为膜的密封面积,m2。
1.3.6EG/CA-MSN/Zein复合膜生物活性的测定
1.3.6.1 抗氧化活性测定
参照Hosseini等[24]的方法,评估复合膜的DPPH和ABTS+自由基清除活性。将复合膜(0.5 g)浸入50%的乙醇中,并在8 000 r/min下离心15 min后,分别与DPPH(3.9 mL)和ABTS(3.9 mL)溶液混合。避光反应20 min,分别在517 nm和734 nm处测量吸光度。DPPH和ABTS+自由基清除率计算方法见式(7)、式(8)。
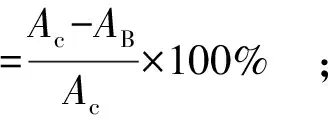
(7)

(8)
式(7)、式(8)中,Ac和AB分别为对照组和样品的吸光值。
1.3.6.2 抑菌活性测定
根据Abaza等[25]的方法略加修改,评估复合膜的抑菌活性。将直径为6 mm的膜置于接种有S.aureus和E.coli的琼脂培养基上,37 ℃孵育 24 h,测量复合膜周围抑菌圈的直径。
1.3.7复合膜对鱼片保鲜效果的测定
1.3.7.1 样品处理
取新鲜鲫鱼背部肌肉,切成大小均一的鱼块(4 cm×3 cm×1.5 cm)。随机分为4组,分别用保鲜膜(PE)、Zein膜、ECM-9复合膜包裹,未经处理组作为对照组(CK)。对照组和处理组均在4 ℃冰箱中贮藏,并分别在第0、2、4、6、8、10天测定各项指标。
1.3.7.2 挥发性盐基氮值的测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》的半微量定氮法,使用凯式定氮仪测定贮藏期间不同复合膜包裹的鱼片中的挥发性盐基氮(TVB-N),结果表示为mg/100 g。
1.3.7.3 硫代巴比妥酸值的测定
参考Yu等[26]的方法测定CK、PE、Zein、ECM-9各组膜包装鱼肉的硫代巴比妥酸(TBARS)值。将2.0 g鱼肉样品与20 mL 0.1 g/mL预冷的三氯乙酸混合,冰浴均质2 min。取上清液与TBA溶液(0.02 mol/L)混合,沸水浴20 min,冷却后测定吸光度,TBARS值以单位质量样品中的MDA质量表示,mg/kg。
1.4 数据处理
所有实验重复3次,结果以平均值±标准差表示。使用SPSS软件进行统计分析。邓肯多重比较用于显著性分析,P<0.05表示差异显著。
2 结果分析
2.1 EG/CA-MSN的结构表征
2.1.1EG/CA-MSN的红外光谱分析

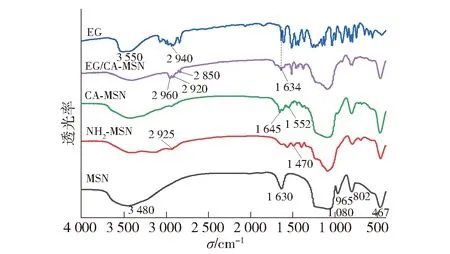
图3 MSN、NH2-MSN、CA-MSN、EG/CA-MSN 和 EG的红外光谱
2.1.2EG/CA-MSN的热稳定性分析
图4为MSN、NH2-MSN、CA-MSN、EG/CA-MSN和EG的热稳定性分析结果。由图4(a)可以看出,在40~100 ℃,所有样品均发生了质量损失,这主要是由吸附在其表面的水分蒸发导致的[31];NH2-MSN在105~300 ℃的质量损失主要是由于其表面连接的APTES分解所致。CA-MSN失重峰主要出现在400~600 ℃,这部分失重主要是接枝在NH2-MSN表面的CA开始分解。EG在185 ℃时的质量损失高达100%,这说明在185 ℃游离EG会完全挥发。EG/CA-MSN在150~300 ℃出现质量损失,这主要是由于吸附在介孔中的EG会以更高的温度挥发出来,在此温度范围内,失重率为32.38%,与EG/CA-MSN负载量相对应[32];而在400~600 ℃再次出现了质量损失,这主要是酰胺键的断裂以及CA的分解。结果表明,通过CA-MSN负载可以有效提高EG的热稳定性。
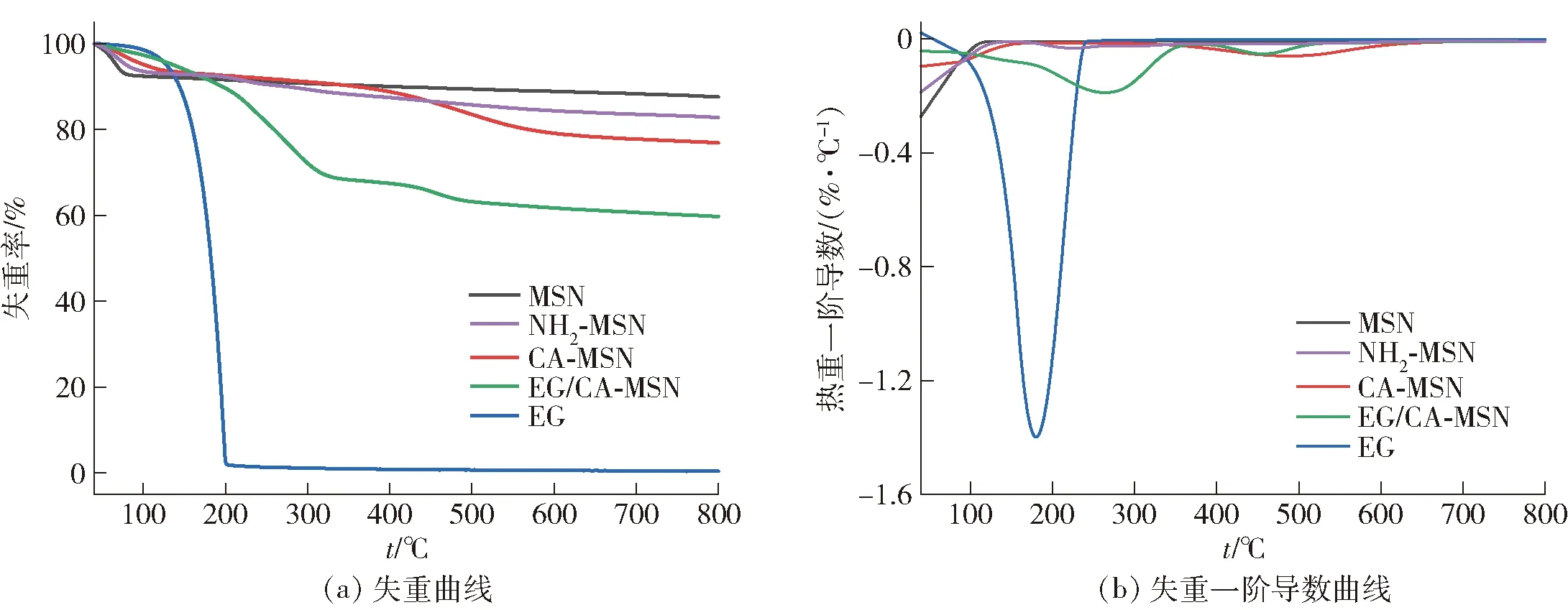
图4 MSN、NH2-MSN、CA-MSN、EG/CA-MSN和EG的热稳定性分析
2.2 EG/CA-MSN/Zein复合膜的结构表征
2.2.1复合膜的红外光谱分析

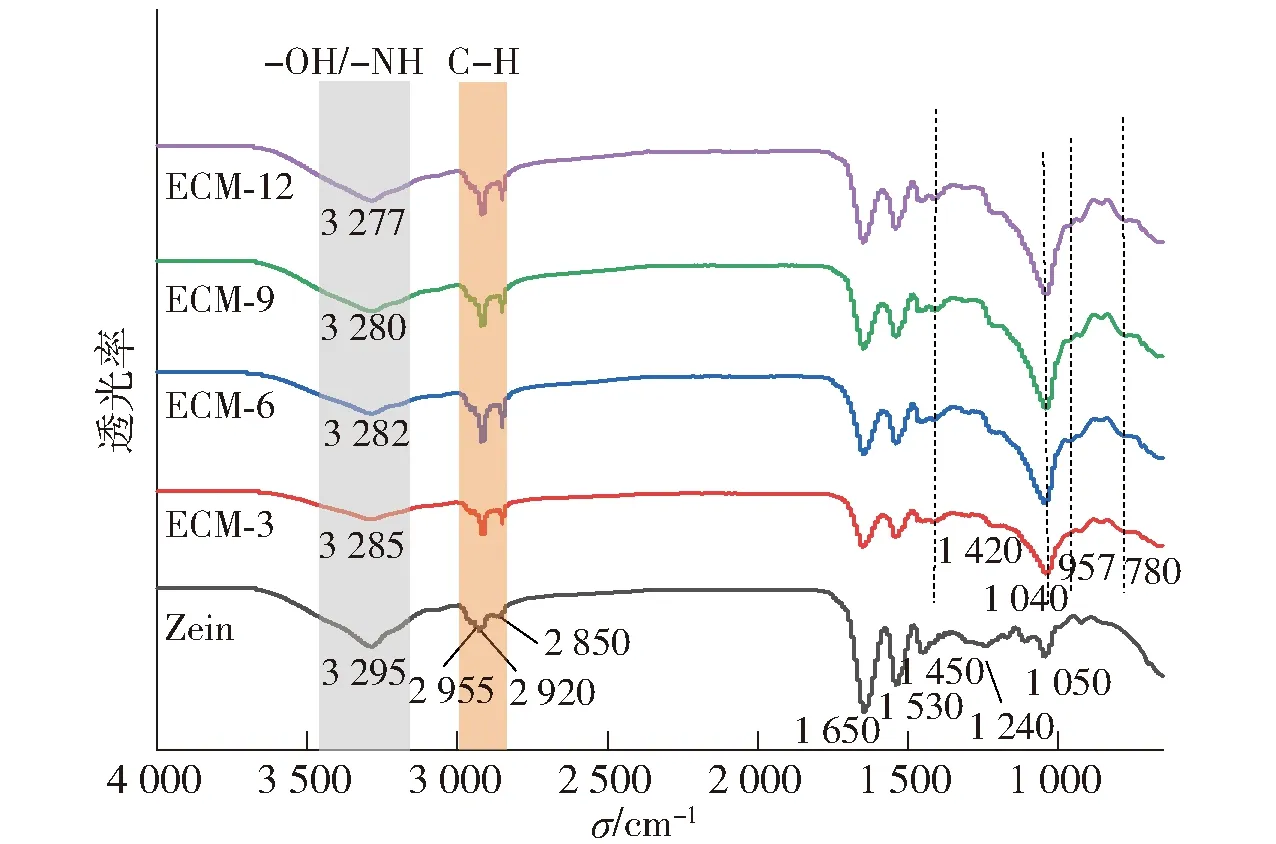
图5 EG/CA-MSN/Zein复合膜的红外光谱
2.2.2复合膜的表面形貌分析
EG/CA-MSN/Zein复合膜微观结构观察结果见图6。由图6可以看出,复合膜无明显分层,且整体呈现出平滑致密的微观结构。这表明,EG/CA-MSN与Zein膜基质之间具有良好的相容性,而随着EG/CA-MSN添加量的增加,复合膜表面出现了小颗粒状聚集,粗糙度随之变大。当EG/CA-MSN质量分数为12%时,膜表面颗粒聚集更加明显,且表面出现明显裂纹,导致膜致密性降低,这可能是由于过量的EG/CA-MSN在膜基质中分散不均匀。EG/CA-MSN还可能会导致界面区域Zein膜基质结构的变化,且由于分子间相互作用,EG/CA-MSN的添加使得膜整体结构更加紧凑和致密,这可能会对膜的机械性能和阻隔性能产生一定影响[36]。

图6 EG/CA-MSN/Zein复合膜的表面形貌
2.3 复合膜的理化性质分析
2.3.1复合膜的热稳定性分析
热重分析可以反映薄膜的热稳定性。TG/DTG曲线表示复合膜在热分解过程中的质量损失和最大降解温度(Tmax)。复合膜热稳定性的分析结果见图7。由图7(a)可知,复合膜的热分解过程主要有4个阶段。初始阶段发生在100~150 ℃,此阶段主要是复合膜中水分蒸发所造成的质量损失;第2阶段发生在180~200 ℃,该阶段的质量损失主要与甘油的分解有关[37]。在这两个阶段复合膜之间的失重率无明显差距。而在280~340 ℃,由于Zein中主要蛋白质化合物受热分解,发生了第3次质量损失,Zein膜失重率最大,约为50.17%,EG/CA-MSN的添加使复合膜的失重率略微降低,最低约为45.33%。第4阶段的质量损失主要发生在340~450 ℃和480~550 ℃,这是由于部分分解的蛋白质进一步氧化降解[38]。由图7(b)可以看出,不同添加量的EG/CA-MSN对复合膜热稳定性并没有产生显著性影响。
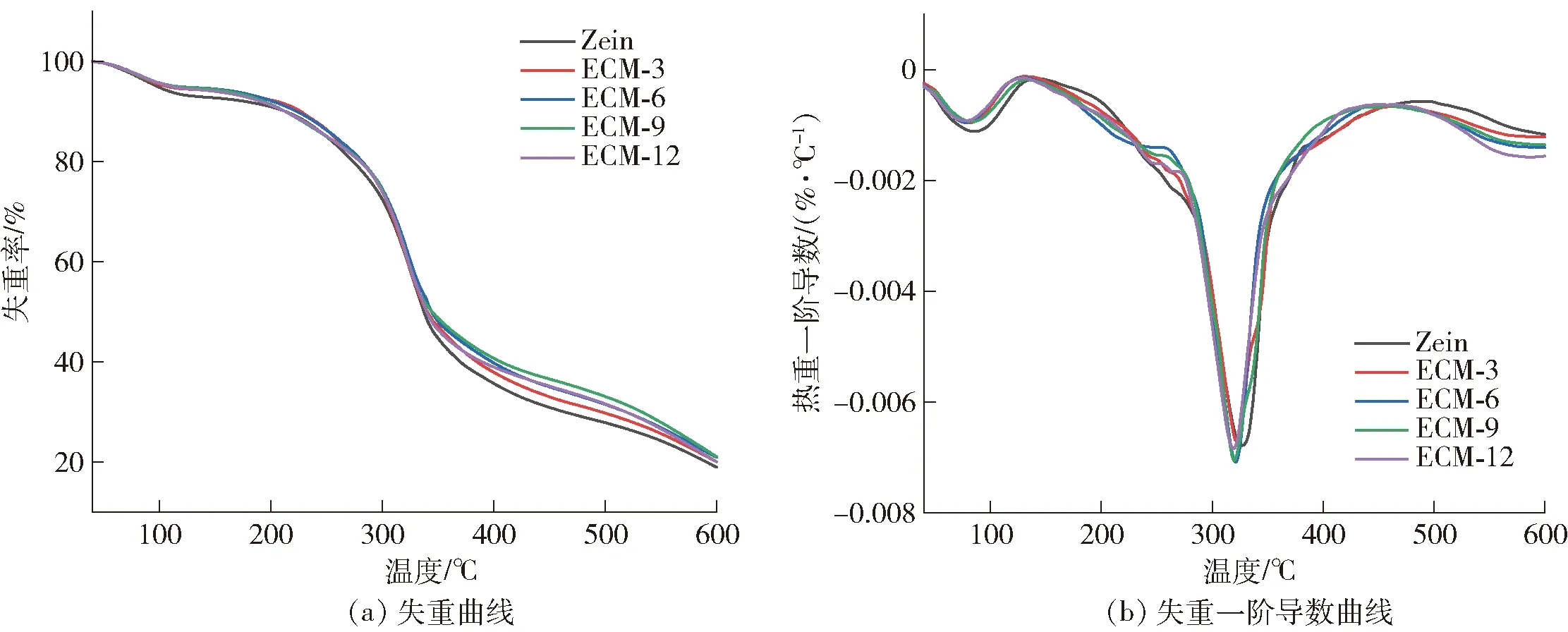
图7 EG/CA-MSN/Zein复合膜热稳定性分析
2.3.2复合膜的光学性能分析
表1为复合膜的颜色参数及其不透明度测定结果。由表1可见,与对照组相比,不同添加量的EG/CA-MSN/Zein复合膜在颜色参数方面表现出显著差异。EG/CA-MSN的加入显著增加了复合膜的黄度(b值由64.36升高至77.15),这是因为吸附丁香酚导致EG/CA-MSN呈现淡黄色。ΔE的增加主要是由于a、b值的增加和L值的减少。此外,随着EG/CA-MSN添加量的增加,复合膜的不透明度逐渐增大,二者呈正相关,这可能是EG/CA-MSN填充了Zein膜基质中的间隙,从而可以散射透射光[39]。
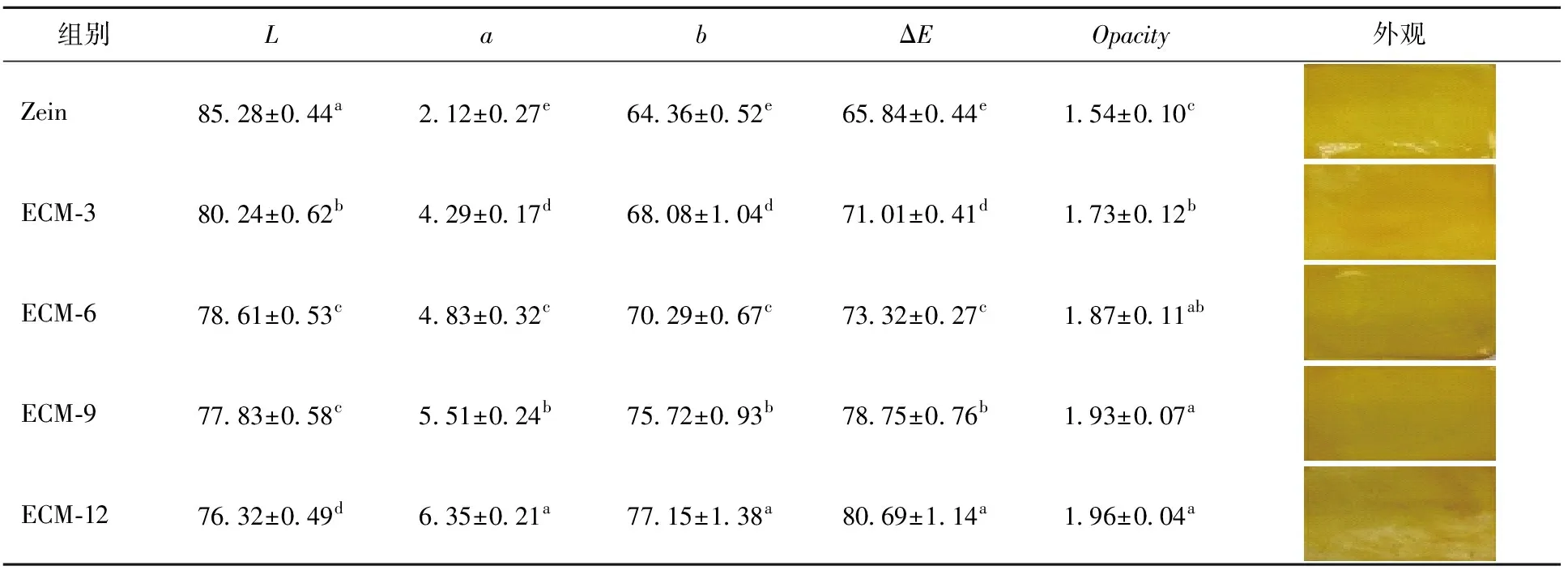
表1 EG/CA-MSN/Zein复合膜的颜色及不透明度
2.3.3复合膜的机械性能分析
膜材料良好的机械性能可以使食品在运输、储存过程中能够承受一定的外部应力,所以机械性能是评估包装材料质量的重要参数之一[40]。复合膜的机械性能测定结果见图8。由图8可知,随着EG/CA-MSN添加量的增加,复合膜的拉伸强度呈现先增加后减小的趋势。当EG/CA-MSN质量分数为9%时,复合膜的TS达到最大值(18.86 MPa),明显优于对照组(7.36 MPa)。TS的增加可能是由于适量的EG/CA-MSN可以填充Zein膜空隙,且EG/CA-MSN与Zein膜基质之间的交联会使膜内聚力增强,分子间缠结紧密,从而提高了复合膜的拉伸强度。而当EG/CA-MSN添加量进一步增加时,复合膜TS反而降低,这说明过量的EG/CA-MSN在膜基质中分散不均匀导致颗粒和基质之间应力传递不平衡,破坏了薄膜结构的完整性。而随着EG/CA-MSN质量分数从0增加到9%,复合膜的断裂伸长率(EB)从30.45%降低到18.27%(减少了12.18%),这可能是EG/CA-MSN与膜基质之间的强相互作用限制了Zein分子链的运动,分子流动性下降,导致膜刚性增加,柔韧性降低[41]。
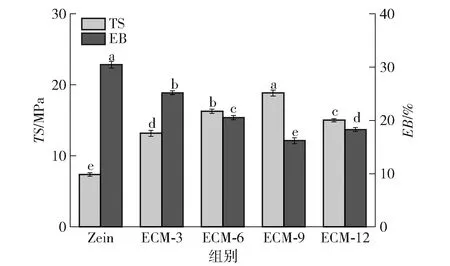
不同小写字母表示组间同一指标数据差异显著(P<0.05)。
2.3.4复合膜的阻隔性能分析
薄膜材料的阻隔性能会影响包装食品的货架期,若透水性较强,环境中的水分会影响食品的物理、化学性质及微生物数量的变化[42]。复合膜的水蒸气透过率和氧气透过率测定结果见图9。由图9可知,EG/CA-MSN/Zein复合膜的WVP值普遍低于单一Zein膜。这可能是EG/CA-MSN分散在膜基质中,为水的扩散引入了一条紧密而曲折的路径,使分子交换更加困难,限制了水分子通过薄膜的传递。随着EG/CA-MSN添加量的增加,复合膜的WVP值呈现先降低后升高的趋势。ECM-9和ECM-12复合膜的WVP值分别为3.11×10-9、3.31×10-9g·mm/(m2·s·Pa)。这可能是适量的EG/CA-MSN可以均匀地分布在膜中,膜的结构紧密均匀,进一步阻止了包装产品与外界的相互作用[43-44]。当EG/CA-MSN添加量进一步增加时,EG/CA-MSN聚集且分散不均匀,导致膜结构破坏,薄膜表面出现裂缝,从而提高了水蒸气的传递速率,这一结果与前文的SEM分析结果一致。
氧气会促进食品变质,较低的氧气阻隔性在延长食品保质期方面发挥着重要作用[45]。由图9复合膜的氧气透过率测定结果可知,薄膜的氧气阻隔性能与水蒸气阻隔性能变化趋势一致。EG/CA-MSN/Zein复合膜氧气阻隔性普遍优于对照组。当EG/CA-MSN质量分数为9%时,复合膜的OP值为2.55×10-6g·mm/(m2·s),显著低于其他添加量薄膜,原因可能是此时EG/CA-MSN均匀稳定地分散在膜基质中,并与膜基质之间发生分子间相互作用,形成了紧密的膜结构,分子间的紧密结合使氧气难以扩散,使复合膜具有更好的氧阻隔性能。然而,当EG/CA-MSN质量分数为12%时,EG/CA-MSN聚集导致膜结构破坏,削弱了薄膜的阻隔性能。
2.3.5复合膜的抗氧化性分析
薄膜的抗氧化活性常通过DPPH和ABTS+自由基的清除能力进行评估。图10显示了不同EG/CA-MSN添加量对复合膜抗氧化性的影响。由图10可以看出,对照组具有一定的自由基清除能力,这是因为Zein中含有天然抗氧化肽[46]。随着EG/CA-MSN添加量的增加,复合膜对DPPH和ABTS+自由基的清除能力逐渐增强。当EG/CA-MSN质量分数为12%时,复合膜的DPPH和ABTS+自由基清除率相较于对照组,分别从21.42%和33.24%提高到78.28%和85.49%。EG/CA-MSN上的CA以及负载的EG具有强抗氧化活性,EG从EG/CA-MSN迁移到膜基质中,再从膜基质中释放出来,通过其芳香结构和单电子供体减少自由基[12,47],从而赋予复合膜抗氧化性能,显示出较好的抗氧化能力,可用于食品包装应用。
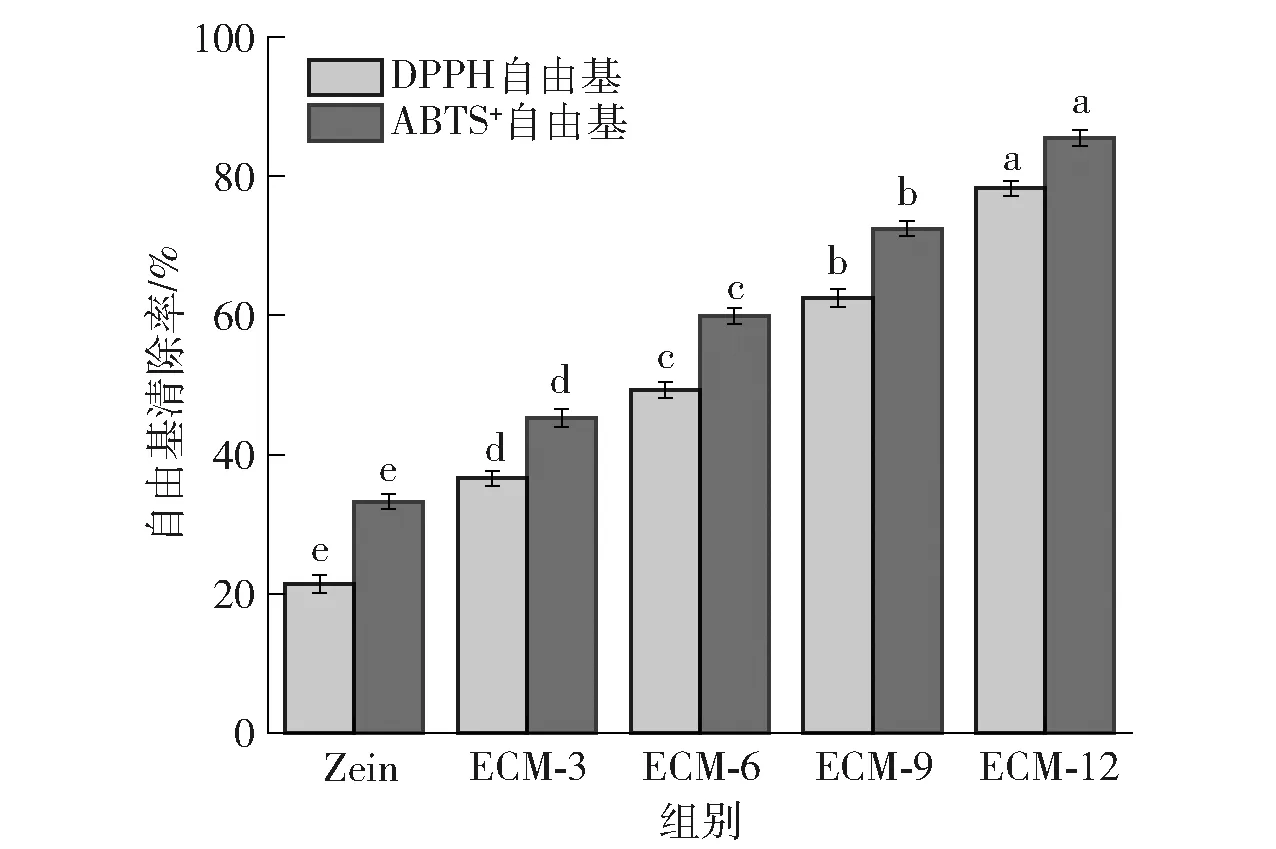
不同小写字母表示组间同一指标数据差异显著(P<0.05)。
2.3.6复合膜的抑菌性分析
表2为复合膜对E.coli和S.aureus抑菌作用的实验结果。从表2可以看出,对照组对氧气有良好的阻隔效果,从而可以在一定程度上抑制E.coli和S.aureus的生长。ECM-12复合膜对E.coli和S.aureus抑菌圈直径分别为(13.57±0.15)mm和(12.38±0.18)mm。这是由于CA本身具有抑菌作用,可以破坏细胞膜结构,而EG中的酚羟基可以与微生物细胞膜相互作用。结果表明,MSN经接枝CA后吸附EG,可使两者发挥协同抑菌作用;且纳米颗粒粒径小、比表面积大,可以与细胞壁快速相互作用,从而破坏微生物结构。在薄膜中加入具有抑菌活性的EG/CA-MSN可以提高薄膜的抑菌效果。与ECM-9相比,ECM-12复合膜的抑菌效果没有太大差异,这可能是纳米颗粒在较高浓度下在膜基质中分散不均匀,限制了其抑菌性能。此外,复合膜对E.coli的抑菌效果优于S.aureus,S.aureus是一种革兰氏阳性细菌,其细胞壁主要由含有少量蛋白质的肽聚糖组成,需要更多的氢氧自由基攻击才能破坏其细胞壁;而E.coli是一种革兰氏阴性细菌,其细胞壁由多种蛋白质、脂质和多糖组成,细胞壁比较薄,保护作用相对较弱,因此复合膜对E.coli具有较高的抑菌活性[48-49]。研究结果表明,EG/CA-MSN/Zein复合膜具有良好的抑菌性能,在抑制微生物引起的食品腐败方面具有潜力。
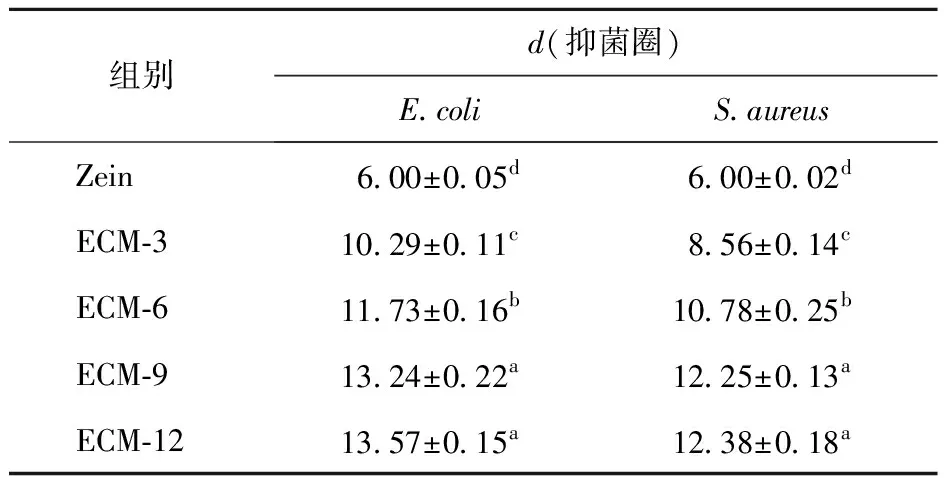
表2 EG/CA-MSN/Zein复合膜的抑菌性
2.4 复合膜对冷藏鱼片的保鲜效果分析
2.4.1复合膜对冷藏鱼片TVB-N值的影响
TVB-N是鱼类蛋白在内源性酶和细菌的作用下分解产生的氨、胺类等碱性含氮物质,可用于评价鱼肉的腐败程度。鲜鱼中的TVB-N值通常为5~20 mg/100 g[50]。不同复合膜包装对冷藏鱼片TVB-N值的影响,实验结果见图11。由图11可知,新鲜样品在储存开始时TVB-N值较低,此后,4个处理组的TVB-N含量在整个储存期间持续升高。这是由于微生物的作用,鱼类蛋白质发生分解,导致氮含量增加。CK和PE组样品的TVB-N值在第4天开始迅速增加。在第6天,CK组的TVB-N值超过上限达到了21.65 mg/100 g,而ECM-9复合膜处理的鱼片与CK组相比减少了32.8%,显著低于CK组(P<0.05)。实验结果表明,在Zein膜中添加EG/CA-MSN可增强复合膜的抑菌活性,减缓微生物诱导的蛋白质分解。
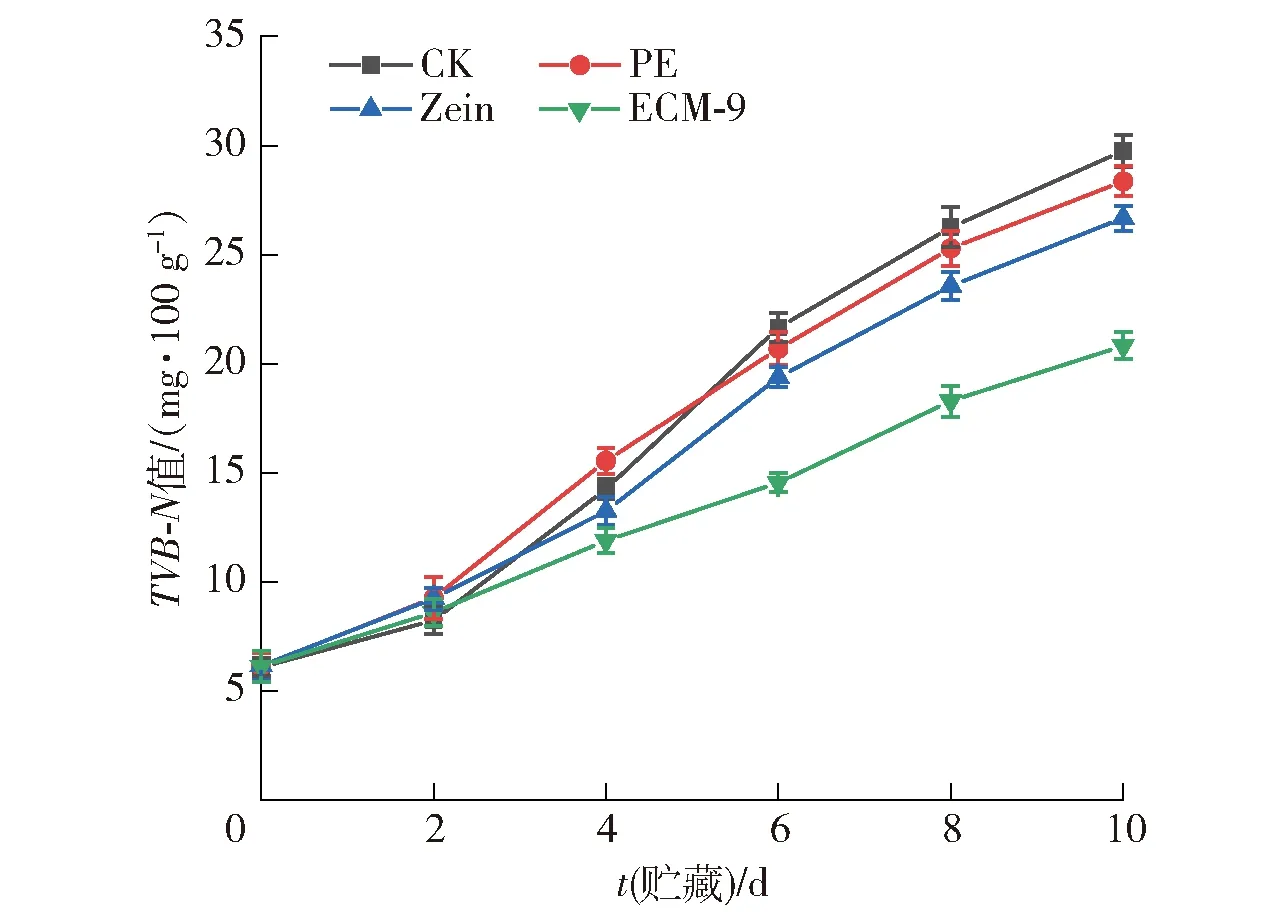
图11 不同膜包裹鱼片贮藏期间TVB-N的变化
2.4.2复合膜对冷藏鱼片脂肪氧化的影响
鱼在冷藏期间容易氧化,脂肪的氧化会产生丙二醛和其他物质,这些物质可以与硫代巴比妥酸反应,因此TBARS值可以有效地反映脂肪氧化的程度[51]。每组样品在储存期间TBARS值变化的实验结果如图12。由图12可见,在整个储存期间,所有样品的TBARS值均增加。在贮藏10 d后,CK、PE、Zein、ECM-9组样品的TBARS值分别上升至1.25、1.15、0.95、0.72 mg/kg。Zein组相较于CK与PE组可减缓鱼片氧化,这可能与玉米醇溶蛋白本身的抗氧化性有关;而向其中加入具有抗氧化性的纳米粒后,对鱼肉氧化抑制作用更加明显。实验结果表明,EG/CA-MSN/Zein复合膜可以有效抑制贮藏期内鱼肉的脂质氧化。
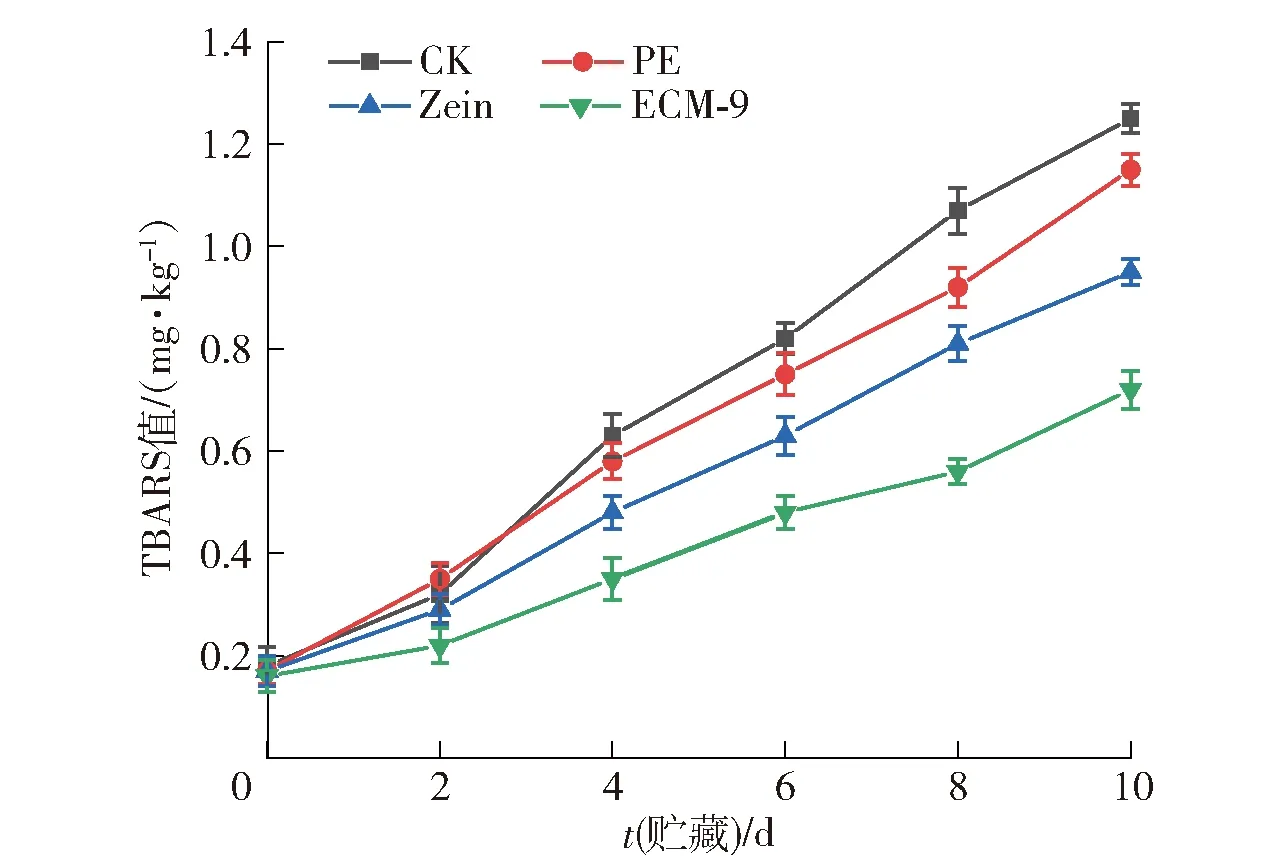
图12 不同膜包裹鱼片贮藏期间TBARS的变化
3 结 论
本研究将EG负载到CA与NH2-MSN共价接枝的纳米粒上,并将EG/CA-MSN以不同的质量分数与Zein薄膜结合制备新型EG/CA-MSN/Zein复合膜。EG/CA-MSN与膜基质具有良好的生物相容性,且存在着分子间相互作用。EG/CA-MSN的添加会对复合膜的理化性质和功能特性产生一定影响。当EG/CA-MSN质量分数为9%时,复合膜的阻隔性能和力学性能较佳[水蒸气透过率为3.11×10-9g·mm/(m2·s·Pa),拉伸强度为18.86 MPa]。复合膜也展现出良好的抗氧化和抑菌性能。将复合膜应用于鱼片的保鲜,可有效延缓鱼片TVB-N值的增长和脂肪氧化。研究结果表明,EG/CA-MSN/Zein 复合膜在食品包装中具有一定的应用前景,有望作为可降解食品包装材料替代传统石油基塑料。
