核桃多酚对皮质酮损伤PC12细胞的作用机制
2023-08-30邹存恩李孟雪王友升
邹存恩, 李孟雪, 王 珂, 黎 明, 安 磊, 王友升,*
(1.北京工商大学 北京食品营养与人类健康高精尖创新中心/老年营养与健康教育部重点实验室,北京 100048;2.山东凯普菲特生物科技有限公司 日照华伟大健康产业研究院,山东 日照 276801;3.定州市人民医院 临床营养科,河北 定州 073000)
随着生活节奏的加快,人们面临的压力持续增加,慢性压力应激引起的大脑功能受损及疾病状态,如抑郁症等,对人体健康的危害正日益凸显。现有缓解压力应激及抗抑郁治疗的药物大多存在不良反应多、起效慢、效率不高和价格昂贵等缺点。研究表明,营养干预或膳食补充剂在改善情绪和预防相关疾病中可能具有独特优势[1]。
核桃(JuglansregiaL.),又名胡桃,与腰果、榛子、扁桃并称世界四大干果。自古以来,核桃就被认为是健脑益智的佳品。核桃营养价值极为丰富,核桃仁含有大量多聚不饱和脂肪酸(polyunsaturated fatty acid,PUFAs)、多酚类成分、蛋白质以及多种矿物质等[2-3]。大量动物和人体实验研究表明,核桃可多方面促进大脑健康[4-6]。美国一项为期10年的健康和营养调查研究数据显示,食用核桃的消费者患抑郁症的风险显著低于不食用核桃的消费者(降低26%),也明显低于食用其他坚果的消费者(降低8%)[7]。最近的一项随机对照实验显示,为期8周的核桃饮食干预可明显改善非抑郁健康年轻男性的心境和情绪[8]。但目前,关于核桃潜在改善心境和抗抑郁的功能组分及作用机制尚不清楚。
应激性生活事件可诱发抑郁症已成为不争的事实。当机体感受应激源时,下丘脑-垂体-肾上腺轴(hypothalamic pituitary adrenal axis,HPA)兴奋性提高,肾上腺分泌的应激激素糖皮质类固醇(glucocorticoids,GC,人类为皮质醇,啮齿类动物为皮质酮)升高,从而动员储能,提高心血管张力、糖代谢等。适当应激反应有利于机体渡过短期恶劣环境,但若机体长期处于不良应激状态,HPA功能持续亢进,继而导致GC水平持续升高,造成对大脑,特别是海马等关键脑区神经元的选择性损伤,被认为是抑郁症发生发展的生理生化基础。体外实验发现,皮质酮可导致类神经细胞如大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)出现损伤和凋亡,模拟应激状态的海马神经元损伤,是目前最常用和最公认的压力应激和抑郁症的体外细胞模型[9]。经典的抗抑郁药和植物有效成分在该模型上表现出很好的细胞保护作用[10-12]。
前期研究发现,摄食质量分数为6%和9%的核桃饲料8周,可显著促进D-半乳糖脑老化模型大鼠海马环磷酸腺苷(cAMP)反应元件结合蛋白(cAMP-responsive element-binding protein,CREB)的磷酸化及其下游靶蛋白脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达,并上调海马齿状回部位神经元再生[13]。CREB及其靶蛋白BDNF是介导神经营养和神经可塑性的关键分子,CREB中133位点丝氨酸(S133)的磷酸化是激活CREB转录活性的关键,cAMP依赖性蛋白激酶A (cAMP-dependent protein kinase A,PKA) 是调控这一过程的主要激酶,并受到上游二级信使cAMP的调控。大量研究证实,PKA/CREB/BDNF 信号是调控海马神经元损伤及保护的关键细胞信号通路[14-16]。本研究团队在研究中证实,核桃多酚可显著逆转H2O2诱导的人神经母细胞瘤(SH-SY5Y)细胞损伤,并上调PKA/CREB/BDNF信号通路活性[17]。但是,核桃多酚对皮质酮所致PC12细胞损伤是否具有保护作用,其机制是否与PKA/CREB/BDNF信号通路的调控作用有关尚未见相关报道。鉴于此,本研究拟采用皮质酮损伤的PC12细胞模型,探讨核桃多酚的细胞保护作用及信号通路机制,希望为揭示核桃多酚的潜在抗抑郁活性及机制,并为核桃粕资源的高值化利用提供参考。
1 材料与方法
1.1 材料与试剂
大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞),购自美国细胞培养物收藏中心(ATCC®CRL1721.1TM)。
RPMI 1640培养基,美国Hyclone公司;马血清,美国Biological公司;胎牛血清,以色列Biological Industries 公司;胰蛋白酶、青霉素-链霉素双抗,美国Gibco公司;H89、皮质酮、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针、BDNF一抗,美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、钙离子试剂盒、二苯甲亚胺细胞凋亡(Hoechst 33342)染色试剂盒,碧云天生物技术研究所;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、牛血清白蛋白五组分,北京Biotopped公司;ECL显影液,北京全品速生物科技有限公司;β-actin一抗、p-PKA 底物(substrate)一抗、CREB 一抗,美国Cell Singal Technology公司;p-CREB(Ser133) 一抗,德国Merck公司;碘化丙啶(propidium iodide,PI),北京兰博利德公司;蛋白质定量试剂盒、羊抗兔二抗、羊抗小鼠二抗,北京普利莱基因技术有限公司。
1.2 仪器与设备
Infinite M1000 PRO型酶标仪,瑞士 Tecan 公司;Mini-PROTEAN Tetra型垂直电泳槽、Mini-PROTEAN Tetra型蛋白转印系统、Universal Hood Ⅲ型显影仪,美国Bio-Rad;170 liters型CO2培养箱,德国Galaxy S公司;Axiovert 200型倒置显微镜,蔡司光学仪器上海国际贸易有限公司。
1.3 实验方法
1.3.1核桃多酚的制备方法及成分鉴定
核桃多酚的制备方法参考本课题组前期研究。脱脂核桃粕经粉碎机粉碎后,过200目筛备用。按料液比(g∶mL)1∶50加入体积分数为75%的乙醇搅拌浸提,重复3次后合并滤液旋蒸浓缩。浓缩液按1∶1的体积比用乙酸乙酯萃取3次,旋干溶剂得到乙酸乙酯提取物。将提取物依次通过NKA-9和HP-20大孔吸附树脂进行纯化,洗脱液经45 ℃旋蒸浓缩后,冷冻干燥即得核桃多酚。产物通过UPLC-Q-TOF MS/MS鉴定成分[17]。
1.3.2细胞培养
采用RPMI 1640培养基,配置成含体积分数为10%的马血清、5%的胎牛血清和1%的双抗的完全培养液。在37 ℃、体积分数为5%的CO2细胞培养箱中培养PC12细胞。3~4 d传代1次,取对数生长期的细胞进行后续实验。
1.3.3皮质酮损伤PC12细胞模型的建立
将PC12细胞按照1×104个/孔的密度接种于96孔板中,每孔100 μL孵育过夜。用无血清培养基配置100、200、300、400 μmol/L的皮质酮溶液,与PC12细胞共孵育24 h,每组设置6个复孔。培养结束每孔加入5 mg/mL的MTT溶液10 μL,37 ℃孵育4 h后弃去上清液,每孔加入100 μL DMSO,振荡10 min使结晶充分溶解,用酶标仪检测490 nm处吸光值。相对细胞活力计算方法见式(1)。
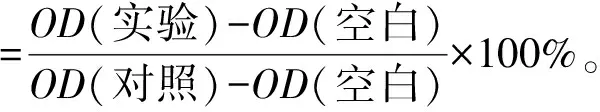
(1)
式(1)中,OD(实验)为处理后细胞孔中溶液的吸光值,OD(对照)为未处理细胞孔中溶液的吸光值,OD(空白)为PBS的吸光值。
1.3.4核桃多酚预孵育条件下的正常培养PC12细胞活力的测定
推荐理由:作者傅莹有深厚的学术功底,宝贵的外交经验,她曾任我国驻菲律宾、澳大利亚、英国大使,外交部副部长,十二届全国人大一至五次会议新闻发言人。本书集结傅莹大使数年文章和演讲精华,内容涉及世界秩序、全球格局与中国角色、中美关系、中俄关系、东亚问题、南海局势等,可帮助读者更好地了解和把握中国对外政策与国际关系的态势和趋势。
将PC12细胞按照1×104个/孔的密度接种于96孔板中,每孔100 μL孵育过夜。用无血清培养基配制质量浓度为50、75、100、150 μg/mL的核桃多酚培养液,加入96孔板中,对照组加入无血清培养液,每组6个复孔,孵育24 h。孵育结束采用MTT法检测细胞活力变化。
1.3.5核桃多酚预孵育条件下的皮质酮模型PC12细胞活力的测定
将PC12细胞按照1×104个/孔的密度接种于96孔板中,每孔100 μL孵育过夜。加入50、75、100、150 μg/mL的核桃多酚培养液,对照组和模型组加入无血清培养液,孵育12 h。12 h后,弃原培养液,模型组和核桃多酚处理组加入200 μmol/L皮质酮(根据1.3.3中实验结果选用200 μmol/L的皮质酮建立慢性应激模型),对照组加入无血清培养液,孵育24 h。孵育结束用MTT法测定细胞活力。
1.3.6PC12细胞凋亡检测
将PC12细胞按照1×105个/mL接种于6孔板中,孵育过夜。加入质量浓度为75、150 μg/mL的核桃多酚溶液,对照组和模型组加入无血清培养液,孵育12 h。弃原培养液,模型组与核桃多酚处理组加入200 μmol/L的皮质酮溶液,孵育24 h。处理结束后用PBS洗涤1次,并用质量分数为4%的多聚甲醛固定15 min,之后用PBS洗涤5 min,重复3次。用Hoechst 33342染色液(原液稀释100倍)在37 ℃下孵育10 min,PBS洗涤5 min,重复3次,再用PI (5 μg/mL)溶液染色5 min,用PBS洗涤5 min,重复3次后,在荧光显微镜下观察并拍照。
1.3.7LDH释放水平检测
按照1.3.6中的方法进行实验,细胞培养结束后,每孔取1 mL细胞培养液,离心后取上清液按试剂盒说明书操作,通过测定LDH在反应体系中生成的丙酮酸的量来表示LDH的活性。用酶标仪检测样品在450 nm处的吸光值。按式(2)和式(3)计算培养液中LDH活性和相对LDH活性。
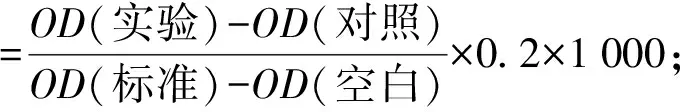
(2)
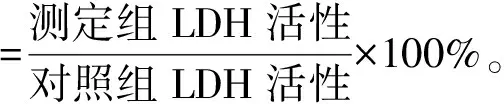
(3)
1.3.8细胞内钙离子水平检测
将PC12细胞按照1×104个/孔的密度接种于96孔黑边透明底板,孵育过夜。加入75、150 μg/mL的核桃多酚培养液,孵育12 h。12 h后,加入含有200 μmol/L的皮质酮溶液,孵育24 h。弃去培养液,加入无血清培养液配制的5 μmol/L探针溶液,37 ℃培养30 min。用PBS洗涤3次除去未装载的探针。采用酶标仪进行双波长检测,激发波长为340 nm和380 nm,发射波长为510 nm。用340 nm和380 nm两个荧光波长的比值来表示细胞内的钙离子浓度,最后结果用相对于对照组钙离子浓度的比值表示。
1.3.9PKA/CREB/BDNF信号通路活性检测
按照1.3.6中的方法进行实验,细胞培养结束后,采用蛋白免疫印迹法检测细胞内PKA/CREB/BDNF活性或表达量。用含有蛋白酶和磷酸酶抑制剂的 RIPA 裂解液在冰上裂解细胞,离心收集蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品经SDS-PAGE凝胶电泳分离,采用湿转法将蛋白转至 PVDF 膜上,用质量分数5%的脱脂奶粉室温封闭1 h。再分别加入一抗p-PKA substrate(1∶2 000)、p-CREB(1∶2 000)、CREB(1∶4 000)、BDNF(1∶4 000)、β-actin(1∶4 000),4 ℃摇床孵育过夜。PBST缓冲液洗涤10 min,重复3次,加入二抗室温孵育1 h,PBST 缓冲液再洗涤10 min,重复3次。加入ECL化学发光液,并采用凝胶成像仪进行曝光检测,通过Image J软件进行分析,以β-actin为内参计算相对灰度值,用来表示目标蛋白的表达水平。进行3次平行实验。
1.3.10H89阻断实验
PC12细胞种板后过夜培养,加入含有10 μmol/L的PKA 抑制剂 H89的空白培养液预处理1 h。加入质量浓度为75、150 μg/mL的核桃多酚,另设未经H89阻断的加药组,孵育12 h。弃原培养液,加入含200 μmol/L的皮质酮培养液,孵育24 h,通过MTT法测定阻断PKA后的细胞活力;另加入质量浓度为100 μg/mL的核桃多酚,细胞处理方法与MTT法相同。采用蛋白免疫印迹法测定阻断PKA后的 PKA/CREB/BDNF信号通路活性。
1.4 数据处理
采用GraphPad Prism 6软件进行分析,结果以平均值±标准误差(SEM)表示,每个实验结果至少进行 3次平行实验。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Dunnett检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 核桃多酚预孵育对皮质酮诱导的PC12细胞活力的影响
建立皮质酮诱导的PC12细胞损伤模型,模拟压力应激状态时高应激激素水平对大脑神经元损伤状态,实验结果如图1。由图1(a)可知,皮质酮作用24 h后能够剂量依赖性地诱导PC12细胞活力降低。200 μmol/L皮质酮处理的PC12细胞活力下降至对照组的60%左右(P<0.01),适宜进行保护作用的评价。因此,确定建立皮质酮损伤细胞模型的条件为200 μmol/L皮质酮作用24 h。
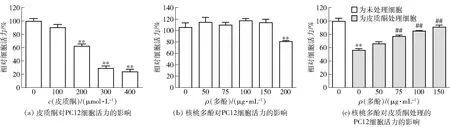
**表示与未处理细胞相比,组间数据具有极显著差异(P<0.01);##表示与仅皮质酮处理细胞相比,组间数据具有极显著差异(P<0.01)。
在核桃多酚保护作用实验前,先考察核桃多酚对正常培养的PC12细胞的影响。由图1(b)可见,核桃多酚(50、75、100、150 μg/mL)作用12 h对PC12细胞活力无明显影响,而较高浓度的核桃多酚(200 μg/mL)显著降低了细胞活力至80%左右(P<0.01),提示该浓度对PC12细胞存活有害。因此选用50~150 μg/mL剂量进行保护作用实验。由图1(c)可见,与损伤细胞相比,用核桃多酚预处理12 h,显著提高了皮质酮诱导的PC12细胞活力(P<0.01)。核桃多酚质量浓度为150 μg/mL时的作用效果最显著(P<0.01)。基于细胞活力的量效实验结果,后续实验选择代表性有效剂量75 μg/mL和150 μg/mL开展相关研究。
2.2 核桃多酚预孵育对皮质酮诱导的PC12细胞凋亡、LDH释放及钙离子含量的影响
为了进一步评价核桃多酚对皮质酮损伤的PC12细胞的保护作用,观察核桃多酚对细胞凋亡、细胞外LDH释放量和细胞内钙离子浓度的影响,实验结果见图2。采用Hoechst 33342染色法,通过观察细胞染色质的变化评价细胞凋亡情况。由图2(a)可知:正常活细胞呈弥散均匀低蓝色荧光,细胞核结构正常;皮质酮处理后,细胞核皱缩、染色质固缩凝聚,呈现出典型的凋亡样形态,发出亮蓝色荧光的凋亡细胞增多,而且晚期凋亡细胞的细胞膜受损,PI嵌入DNA显示浅红色荧光,坏死细胞DNA也被PI染色,呈现亮红色荧光;75、150 μg/mL的核桃多酚预处理后细胞核染色质形态正常化,凋亡细胞数量明显降低。LDH广泛存在于各种细胞中,当细胞膜不再完整或受损时,LDH就释放到培养基中,因此细胞外LDH水平是细胞损伤的重要指标。由图2(b)可知,皮质酮处理的细胞培养液中,LDH水平显著升高到对照组的1.5倍左右(P<0.01)。核桃多酚预处理后显著降低了LDH的释放。同样的核桃多酚预处理显著降低了由皮质酮导致的细胞内钙离子水平升高[图2(c)]。这些结果进一步证实了核桃多酚对PC12细胞的保护作用。

##表示与未处理细胞相比,组间数据具有极显著差异(P<0.01);**表示与仅皮质酮处理细胞相比,组间数据具有极显著差异(P<0.01)。
2.3 核桃多酚预孵育对皮质酮诱导的PC12细胞PKA/CREB/BDNF神经营养通路的影响
PKA是调控CREB磷酸化的主要上游激酶,可诱导CREB磷酸化而激活CREB介导的转录活性。本研究中,应用PKA磷酸化底物的抗体来检测PKA的活性[18],实验结果见图3。Western blot结果[图3(a)]表明,皮质酮处理显著降低了PC12细胞PKA磷酸化底物表达,抑制PKA的活性(P<0.05),而核桃多酚(75、150 μg/mL)处理显著上调PC12细胞PKA活性,并显著增加CREB Ser133位点的磷酸化水平[图3(b)]及其下游蛋白BDNF的表达(P<0.01)[图3(c)]。这些结果表明,核桃多酚处理显著上调了PC12细胞PKA/CREB/BDNF神经营养通路,这与前期的研究结果相一致,可能是核桃多酚发挥抗皮质酮损伤的重要机制。
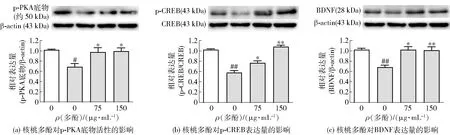
为未处理细胞,为皮质酮处理细胞。#表示与未处理细胞相比,组间数据具有显著差异(P<0.05),##表示与未处理细胞相比,组间数据具有极显著差异(P<0.01);*表示与仅皮质酮处理细胞相比,组间数据具有显著差异(P<0.05),**表示与仅皮质酮处理细胞相比,组间数据具有极显著差异(P<0.01)。
2.4 阻断PKA活性对核桃多酚预孵育的皮质酮诱导PC12细胞的影响
在确定核桃多酚可显著上调PKA/CREB/BDNF信号通路基础上,应用PKA特异性抑制剂H89(10 μmol/L)预处理PC12细胞1 h,观察核桃多酚对皮质酮诱导的PC12细胞活力的影响和阻断效果,实验结果见图4。图4(a)显示,单独用H89处理不影响PC12细胞活力,而用H89预处理取消了核桃多酚(75、150 μg/mL)的细胞保护作用。同样,在H89作用于PC12细胞的情况下,PKA磷酸化底物、磷酸化CREB和BDNF表达量上调作用均出现被抑制的现象[图4(b)、(c)、(d)]。研究结果表明,上调PKA/CREB/BDNF通路是核桃多酚改善皮质酮引发PC12细胞损伤作用的关键机制。

为未处理细胞,为皮质酮处理细胞,为皮质酮与H89共处理细胞,为仅H89处理细胞。##表示与未处理细胞相比,组间数据具有极显著差异(P<0.01);*表示与仅皮质酮处理细胞相比,组间数据具有显著性差异(P<0.05),**表示与仅皮质酮处理细胞相比,组间数据具有极显著差异(P<0.01);&表示与同等剂量多酚处理细胞相比,组间数据具有显著性差异(P<0.05),&&表示与同等剂量多酚处理细胞相比,组间数据具有极显著差异(P<0.01)。
3 讨 论
压力应激会引起胞内信号传导及基因表达变化,从而引起特定脑区神经营养障碍,神经可塑性下降。神经营养因子及其信号转导通路失调或改善是抑郁症发生与康复的重要细胞内机制[19]。BDNF是神经营养因子家族重要成员,是CREB的关键下游靶蛋白,BDNF与其特异性受体酪氨酸激酶受体B(TrkB)结合后,能够在促进神经元的生长、分化,维持成熟神经元功能和突触可塑性方面发挥重要作用[20]。上调CREB活性及其靶蛋白BDNF表达水平被认为是抗抑郁剂发挥作用的重要靶标和神经营养机制[21]。
研究表明,膳食多酚的消耗量和抑郁相关症状具有显著的负相关[22]。鞣花单宁(ellagitannins,ETs) 和鞣花酸 (ellagic acid,EA)是重要的膳食多酚,存在于多种水果、蔬菜和坚果中,研究显示,这些多酚类物质在多种动物模型上表现出良好的抗抑郁活性[23-24],并可显著增加抑郁小鼠海马BDNF表达量[25]。核桃中的多酚类化合物主要为鞣花单宁类物质[26],前期研究中我们应用UPLC/MS分析本研究中的核桃多酚样品,发现其主要为鞣花单宁或鞣花酸类成分,包括pedunculagin/casuariin、casuarinin/casuarictin、strictinin/isostrictinin、tellimagrandin I、valoneic acid dilactone、sanguisorbic acid dilactone、glansrin C、glansrin B、praecoxin A/platycariin和鞣花酸[17],进一步提示核桃多酚及其中的鞣花单宁类成分可能是核桃抗抑郁作用的重要功效组分。
4 结 论
本研究采用皮质酮诱导的PC12细胞损伤模型,通过细胞活力、LDH释放量和钙离子浓度等指标评价核桃多酚的细胞保护作用,并进一步采用蛋白免疫印迹分析与化学阻断方法相结合的方式,探讨核桃多酚细胞保护作用的分子机制。研究结果显示,核桃多酚可显著逆转皮质酮诱导的PC12细胞活力降低、细胞凋亡、LDH释放和钙超载,发挥细胞保护作用,提示核桃多酚具有潜在的抗抑郁活性。进一步的机制研究表明,核桃多酚可显著上调皮质酮损伤PC12细胞PKA/CREB/BDNF活性或表达,并且这一调控作用是核桃多酚发挥细胞保护作用的关键机制。本研究报道了核桃多酚的潜在抗抑郁活性,但限于体外细胞实验,可进一步采用动物实验评价核桃多酚的抗抑郁活性及神经营养作用。核桃加工的主要产品为核桃油,榨油的同时生成了大量的副产物核桃粕,而核桃多酚是核桃粕中重要的生物活性物质之一。目前核桃粕主要作为饲料或被废弃。对核桃多酚活性及作用机制的研究可望为核桃粕资源高值化利用以及将核桃多酚作为一种抗抑郁功效成分提供理论参考。
