花生原生质体分离方法探究
2023-08-30伍顺达梁绮雯王思远肖浪涛
伍顺达,梁绮雯,孙 敏,王思远,苏 益,肖浪涛
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
花生Arachishypogaea是一种广泛种植的重要经济和油料作物,我国花生总产量和消费量均稳居世界之首[1]。近年来,我国花生产业发展迅猛,播种面积超过465 万 hm2,约占世界花生种植面积的17.8%,花生年产量达1752 万t,约占全国油料总产量的一半,是世界花生总产量的39%[2]。花生是一种异源多倍体的豆科作物,其基因组由两个二倍体亚基因组组成,即Arachisipaensis和Arachisduranensis。由于其倍性差异、花粉育性低和杂交不亲和等障碍,传统的花生育种周期较长,花生高产、高营养、抗虫害等性状的筛选需要新技术获得突破[3—4]。分子标记技术是获取花生遗传多样性的有效手段,常用的技术包括随机扩增多态性DNA (RAPD)、限制性片段长度多态性(RFLPs)、扩增多态性DNA (AFLPs)、序列特征扩增区(SCARs)和简单序列重复序列(SSRs)等。前人利用PCR 技术在栽培花生中生成了111 个AFLP 标记,其中有3%标记具有多态性[5],使用308种AFLP 引物组合鉴定了花生莲座丛病中与蚜虫载体抗性相关的标记,构建了第一个栽培花生的部分遗传连锁图谱[6]。有学者利用SSR 标记对中国花生品种的遗传多样性和群体结构进行评估,揭示了中国南北方花生栽培品种的遗传变异[7—8]。随着花生全基因组和花生基因组数据库等生物信息学资源的不断完善[9—10],花生遗传学、基因组学和分子育种取得重要进展。然而,相比于其他粮油作物,花生的基础研究还相对滞后,遗传转化体系为主要瓶颈之一。早期研究主要通过农杆菌转染[11]或基因枪[12—13]的方法来获得花生的转基因植株。不同外植体,如子叶节、下胚轴、叶节和合子胚轴都能应用农杆菌的转化程序[14—19]。
原生质体没有细胞壁,能快速进行种群增长且具有同步性,仍保留了其时空表达的特异性。通过植物原生质体细胞培养,结合一些精细的遗传操作技术如显微注射、体细胞杂交、细胞融合等,可以替代传统技术进行转基因操作,从而获得不同的遗传变异类型,为优良品种的创制和选育提供便捷途径[20—23]。然而,花生的原生质体分离技术还不系统、完善,分离效率不高。本研究分别使用混合酶解液和崩溃酶制备花生原生质体,同时对比两种方法的酶解效果,改进花生原生质体的分离条件,为基于原生质体的花生遗传转化研究提供技术支撑。
1 材料与方法
1.1 植物材料
选用多粒型四粒红A.hypogaeavar.fastigiate‘Silihong’。花生浸种后,在30 ℃黑暗条件下催芽,自然光照下室外盆栽种植。
1.2 试剂仪器
1.2.1 试剂与耗材
KCl、CaCl2、NaCl 购自国药集团化学试剂有限公司(上海);纤维素酶(cellulase)、果胶酶(pectinase)、离析酶R-10 (macerozyme R-10)均购自麦克林生化科技有限公司(上海);崩溃酶(driselase)购自Sigma-Aldrich(上海);牛血清蛋白(BSA)购自北京鼎国生物技术有限公司;D-甘露醇(D-mannitol)、2-吗啉乙磺酸(MES)购自北京索莱宝科技有限公司;台盼蓝购自北京酷来搏科技有限公司。细胞滤网(40 μm)购自北京兰杰柯科技有限公司,血球计数板购自上海市求精生化试剂仪器有限公司。
1.2.2 仪器设备
高速冷冻离心机(Eppendorf 5415R、Sartorius SIGMAI-15K)、低速冷冻离心机(Eppendorf 5810R)、全温振荡器(HZQ-QX)、分析天平(SHIMADZU AUX220)、数显恒温水浴锅(W-201B)、显微镜(BS303)。
1.3 溶液配制
预处理液:0.02 mol·L–1KCl、0.02 mol·L–1MES、0.01 mol·L–1CaCl2、0.6 mol·L–1甘露醇和0.1% BSA;现配现用。
W5 溶液:154 mmol·L–1NaCl,125 mmol·L–1CaCl2,25 mmol·L–1KCl 和2 mmol·L–1MES,pH 5.7。
酶解液:酶解液 M1 (1%纤维素酶+2%果胶酶+1%离析酶R-10);酶解液M2 (1.5%纤维素酶+2%果胶酶+1%离析酶R-10);酶解液M3 (2%纤维素酶+2%果胶酶+1%离析酶R-10);酶解液M4 (2%纤维素酶+1%果胶酶+1%离析酶R-10);酶解液M5 (2%纤维素酶+1.5%果胶酶+1%离析酶 R-10);酶解液M6 (2%纤维素酶+3%果胶酶+1%离析酶 R-10)。
混合酶解液配制:称取酶粉后加入100 μL 2 mol·L–1KCl、1 mL 0.2 mol·L–1MES 和7.5 mL 0.8 mol·L–1甘露醇。将混合物55 ℃水浴10 min,使蛋白酶失活,冷却至室温后加入100 μL 1 mol·L–1CaCl2和200 μL 5% BSA。加入ddH2O,定容至10 mL。
酶解液 M7 (0.2 g 崩溃酶溶于 10 mL 0.6 mol·L–1甘露醇溶液中,用0.1 mol·L–1HCl 调整pH 至5.2,4 ℃避光混匀30 min 活化崩溃酶),4500 r·min–1离心10 min,取上清。
台盼蓝溶液:称取4 g 台盼蓝粉末,加100 mL ddH2O 溶解,过滤后4 ℃ 保存。使用时用磷酸缓冲液稀释至0.04%。
1.4 原生质体制备
取花生60 d 龄植株尚未展开的复叶、黄化叶、盛开的花瓣、幼嫩果针以及幼苗下胚轴,用75%乙醇清理样品表面,用刀片将其切成0.5~1.0 mm 细条状,置于预处理液中,抽真空10 min,吸去预处理液,再加入酶解液,固定在摇床上50 r·min–1、28 ℃避光酶解3 h。酶解完成后,加入1 mL W5 溶液中止酶解反应,用40 μm 细胞滤网过滤去除未消化的植物组织,700 r·min–1离心10 min,弃上清。吸取2 mL W5 溶液将原生质体重悬。随后冰上静置20 min,健康的原生质体沉降于试管底部,去除上清。用500 μL W5 溶液重悬沉淀,吸取少量原生质体悬浮液于血球计数板上,在显微镜下计数。
1.5 计数方法
原生质体计数:吸取10 μL 原生质体悬浮液用血球计数板计数 3 次以上,取平均值,可得出 1 mL悬浮液中的原生质体数为25 个中方格内的原生质体数×104。
原生质体产量(个·g–1)=原生质体密度(个·mL–1)× 纯化后原生质体体积(mL)/叶片质量(g)[24]。
1.6 台盼蓝染色
吸取10 μL 用0.04%台盼蓝染色后原生质体于血球计数板上,在显微镜下计数每种酶解液配方的原生质体,重复3 次。原生质体活性(%)=(未染色的原生质体数/原生质体总数)×100%。
1.7 数据分析
采用Excel 软件进行数据分析。
2 结果与分析
2.1 不同混合酶解液对原生质体制备的影响
植物的各个部位都能制备原生质体,但幼嫩组织往往是首选材料。本研究选用幼嫩的花生叶片为材料(图1A、B)。不同混合酶解液对原生质体的产量和状态具有重要影响。在果胶酶浓度不变的情况下,随纤维素酶浓度升高,花生叶片的原生质体产量逐渐增加;在纤维素酶浓度一定的情况下,随着果胶酶浓度的增加,样品的酶解效果变好,原生质体的产量增加。由图1 可知,不同的酶解液组合均能获得原生质体,其中酶解液M6,即 2%纤维素酶+3%果胶酶+1%离析酶R-10 的酶组合,花生叶片原生质体产量为 1.35×105个·g–1,且原生质体饱满透亮,形态完整。因此,2%纤维素酶+3%果胶酶+1%离析酶R-10 是分离花生叶片原生质体的最佳酶解条件。

图1 不同酶液组合的原生质体数目及产量的影响Fig. 1 Effects of enzyme combinations on protoplast number and yield
2.2 不同组织原生质体的分离效果比较
原生质体的产量和质量取决于样品的来源,不同组织获取原生质体的难易程度不同。除了叶片的原生质体(图2 A),本研究制备了花生的花瓣、果针、幼苗下胚轴以及幼苗黄化叶等的原生质体。其中,花瓣与黄化叶均能分离得到大量原生质体(图2 B~C),花生苗的下胚轴虽然能分离得到原生质体,但镜检时视野可见细胞极少(图2 D),而未能从果针中分离得到原生质体。
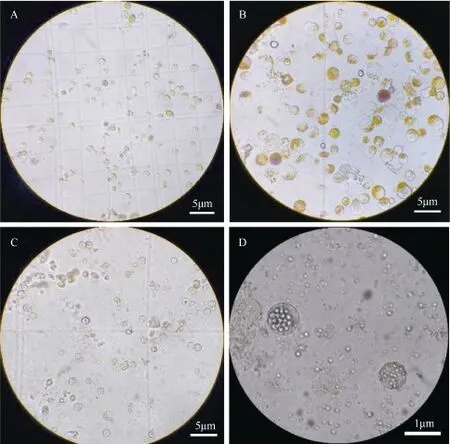
图2 花生不同组织分离的原生质体Fig. 2 Protoplasts from different tissues of peanut
2.3 不同酶处理对花生原生质体产量的影响
崩溃酶是一种从真菌-担子菌中提取出来的复合酶,内含昆布多糖酶、木聚糖酶和纤维素酶等,也具有消解植物细胞壁的功能。本研究在同等条件下使用混合酶液以及崩溃酶制备原生质体,对比混合酶液和崩溃酶之间的分离效果(图3)。使用崩溃酶制备原生质体,花生叶片消化不完全,收集到的原生质体少,每1 g 叶片仅获得约1.17×105个细胞,且细胞大多成团聚集,单个的游离细胞较少。混合酶液M6 的酶解效果明显优于崩溃酶,每1 g 叶片能获得约5.93×105个细胞(图3),游离的原生质体饱满透亮。对于花生花瓣而言,混合酶的酶解效果同样优于崩溃酶,混合酶液M6 处理花瓣3 h,原生质体产量为 2.55×105个·g–1,而崩溃酶处理仅有5.35×104个·g–1。因此,混合酶液要比崩溃酶更能在短时间获得较多的原生质体。
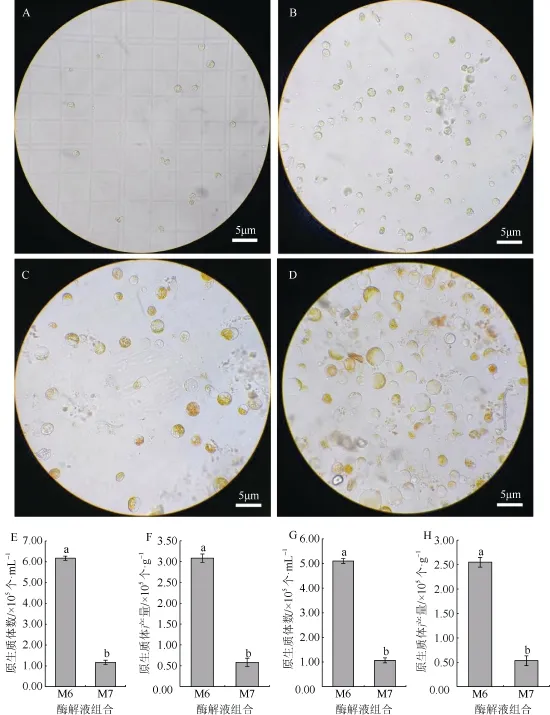
图3 不同酶处理对花生原生质体产量的影响Fig. 3 Effects of different enzyme treatments on protoplast yield
2.4 原生质体活性分析
正常的活细胞具有完整的细胞膜结构,台盼蓝染料不能够进入细胞内;而丧失活性或细胞膜不完整的细胞,细胞膜的通透性增加,可被台盼蓝染成蓝色。分析台盼蓝染色结果,经过M6 处理后,从花生花瓣中分离得到的原生质体有超过98%细胞未被染色,即具有活性的原生质体细胞比例超过98%(图4)。
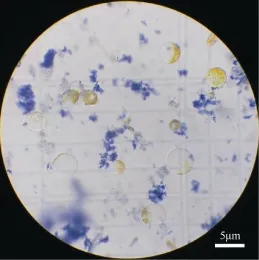
图4 花生花瓣原生质体台盼蓝染色Fig. 4 Vitality detection of protoplasts from peanut petals
3 讨论
植物原生质体可通过机械法和酶解法来获得[25]。1892 年Klercker 等[26]最先通过研磨的机械方法从藻类植物中得到完整的原生质体。酶解法可以通过应用不同的酶来消解细胞壁,从而释放出大量完整的原生质体[27]。植物细胞壁的主要成分是纤维素、半纤维素和果胶质,因此一般选择纤维素酶、果胶酶、半纤维素酶等来制备原生质体。酶液的浓度配比对花生原生质体的制备至关重要,所遵循的原则应是利用尽可能低的酶浓度,在尽可能短的酶解时间内,获取大量有活力的原生质体。
不同组织获取原生质体的难易程度不同,使用的酶浓度及酶解时间都有所区别。最早的花生原生质体是从幼苗和叶片中获得的[28—29],早期使用酶解的方式制备花生原生质体时间长达16 h,随着纤维素酶、半纤维素酶等酶制剂的生产技术不断革新,花生原生质体的制备也越来越容易,Biswas 等[30]用3%纤维素酶RS+0.1%离析酶+0.5%果胶酶,黑暗中酶解5 h,从5 日龄的花生未展开叶片中获得大量原生质体;Liu 等[4]使用3%纤维素酶R-10+1.5%离析酶R-10+0.3%果胶酶Y-23 处理7 日龄黄化苗叶片成功获得原生质体;Wang等[31]使用1%纤维素酶R-10+0.5%离析酶R-10+0.5%果胶酶进行第一次酶解,纯化后再用1.2%纤维素酶R-10+0.4%离析酶二次酶解后成功获得果针的原生质体。本研究通过调整酶解液配方(2%纤维素酶+3%果胶酶+1%离析酶 R10),在3 h 内从1 g 花生植株的叶片中获得约5.93×105个原生质体。由于取样的叶片是室外超过60 d 花生植株未展开的复叶,相较于之前的方法,本研究配方降低了纤维素酶浓度,提高了果胶酶和离析酶浓度,从而酶解花生叶片获得活性较好的原生质体。该配方使得制备花生原生质体的材料不仅仅局限于易酶解的幼苗或者黄化苗,其可以根据需要通过不同处理或者不同部位获得花生较成熟植株的叶片原生质体。
高产优质原生质体的获得首先依赖于选择合适的植物组织。对于豆科作物如鹰嘴豆Cicerarietinum和豇豆Vignaunguiculata而言,完全展开的叶片是原生质体分离的最佳选择[32]。就花生而言,在酶解液M6处理下,能在3 h内从未展开的叶片中分离得到大量原生质体,花生的花瓣和黄化叶片也是制备原生质体的合适材料,而幼嫩果针和花生苗下胚轴未能获得大量原生质体。本研究优化了花生原生质体分离条件,为探索花生原生质体再生系统建立和遗传转化奠定基础。
