有效积温对建泽泻和川泽泻抗氧化酶活性及功效物质的影响
2023-08-30郎培蕾邱蓉丽马奇翰吴文庆刘梦雪鞠瑞鑫
郎培蕾,韩 赟,田 荣,谷 巍,3*,邱蓉丽,马奇翰,吴文庆,刘梦雪,鞠瑞鑫
(1. 南京中医药大学,江苏 南京 210023;2. 南京中医药大学附属苏州市中医医院,江苏 苏州 215000;3. 江苏省中药资源产业化过程协同创新中心,江苏 南京 210023)
泽泻(Alismatis rhizoma)为泽泻科植物东方泽泻Alismaorientale或泽泻A.plantago-aquatica的干燥块茎[1],分别习称为“建泽泻”与“川泽泻”,传统道地产区分别为福建建瓯和四川彭山。泽泻的活性成分以原萜烷型三萜为主[2],其中23-乙酰泽泻醇B 具有利尿、降血脂、保肝和抗肿瘤等生物活性[3—5],23-乙酰泽泻醇C 除利尿、降血脂作用外还具有抗骨质疏松的功效[6],二者均被2020 版《中国药典》规定为泽泻质量控制的指标性成分[1]。有研究表明,泽泻品质受环境因素影响,其功效物质具有明显的产地特异性[7],而功效物质种类和含量差异均会影响临床疗效[8—9]。
生态因子是影响道地药材生长的主导因素[10]。有效积温是植物生育期内有效温度(日平均温度与生物学下限温度的差值)的总和[11],可反映植物生长发育对热量的需求,是影响植物生长发育的重要生态因子[12]。在长期进化过程中,植物通过调整抗氧化酶活性和次生代谢产物以适应环境变化[13—14],而对产地环境的适应正是道地药材形成的生态学机制之一[15]。相关研究表明,不同产地的药材其功效物质含量存在显著差异,且其含量与药材生育期内有效积温显著相关[16]。在不同有效积温条件下,植物体内的抗氧化酶活性也存在差异[17]。明确有效积温对不同基原泽泻抗氧化能力及功效物质积累的影响对阐述其道地性成因具有重要意义,但目前相关研究未见报道。本文通过分析建泽泻和川泽泻主产地近40 年气象数据,统计两地泽泻大田生长期有效积温数据并进行模拟研究,分析有效积温对建泽泻和川泽泻的抗氧化能力与功效物质积累的影响差异,明确有利于两者功效物质积累的有效积温,为探究泽泻道地性成因以及规范化栽培提供理论依据。
1 材料与方法
1.1 材料
实验材料为采自福建建瓯的建泽泻和四川彭山的川泽泻,经南京中医药大学谷巍教授鉴定分别为泽泻科植物东方泽泻和泽泻。
实验于南京中医药大学人工气候室进行,将建泽泻和川泽泻幼苗在大田栽培一周后,选取生长良好,长势一致的幼苗,栽植于盆高30 cm、上口径33 cm、下口径20 cm 的塑料盆内,每盆定苗3 株,置于人工气候室中缓苗10 d 后开始实验处理。
1.2 实验设计
将适应性培养后的建泽泻和川泽泻幼苗分别放置在2 间人工气候室中,按照两地建泽泻和川泽泻生长发育规律及其有效积温分析结果,设置整体处理时间为120 d。具体实验分组和各组有效积温见表1。

表1 建泽泻和川泽泻实验分组Table 1 Experimental grouping of Jian Zexie and Chuan Zexie
除温度外,两间人工气候室其他实验条件均一致,光照强度300 μmol·m–2·s–1,光照周期为12 h(08:00~20:00),相对湿度80%,按照规范化种植进行栽培管理。
从进行温度处理的当天开始取样,随后每隔15 d 取样一次,共取样9 次;每组指标均进行3 次生物学重复,结果取平均值。
1.3 测定指标与方法
1.3.1 有效积温计算
利用Wheat A(http://www.wheata.cn/)提取福建建瓯和四川彭山两地1982~2021 年近40 年建泽泻与川泽泻大田期(8 月下旬~12 月下旬)的逐日气温资料,计算统计期间各年份建泽泻与川泽泻大田生长期≥10 ℃有效积温(GDD),计算公式如下:
式中,n 为统计阶段连续天数(i=1,2,3....,n);当天有效积温ei计算方式如下:
式中,ti表示日均温,Tb(生物学零度)定为10 ℃。
第一,淘汰落后产能。炼油行业要认识到产能过剩的严峻性,推进部分产能退出或者企业转型,淘汰落后产能不是行政命令,而是市场选择。山东省公布了《关于加快七大高耗能行业高质量发展的实施方案》,推进全省500万吨/年及以下地方炼油企业炼油产能减量整合,规划建设产能为3000万吨/年的炼化一体化项目,实现规模集约化、园区化发展;同时形成“油头化尾”一体化产业模式,实现炼油与下游高端石化产品生产的平衡发展。未来我国炼油业要构建“沿海战略(七大炼化基地)+西部油田周边炼厂”格局。
1.3.2 保护酶与丙二醛活性测定
选取泽泻从内向外第三片完全展开功能叶,除去叶脉,剪碎混匀,精确称量1.0 g 置于预冷的研钵中,加入2 mL 磷酸缓冲液(pH 7.0)和石英砂在冰浴下研磨匀浆后,在4 ℃下15 000 r·min-1离心15 min,收集上清液待用。以愈创木酚法测定过氧化物酶(POD)活性[18]、紫外吸收法测定过氧化氢酶(CAT)活性[18]、总超氧化物歧化酶(T-SOD)测试盒测定超氧化物歧化酶(SOD)活性。
精确称取叶片1.0 g 置于预冷的研钵中,加入10% TCA 10 mL,研磨后将所得匀浆于4000 r·min-1离心10 min 后收集上清液备用。采用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量[18]。
1.3.3 功效物质含量测定
于各时间点取泽泻块茎,洗去表面泥土,于60 ℃下烘干并研磨成粉(过5 号筛),按《中国药典》(2020 年版)方法测定23-乙酰泽泻醇B 和23-乙酰泽泻醇C 含量[1]。
1.4 数据统计分析
采用Excle 2019、SPSS 24.0 等软件进行图表绘制和数据分析。
2 结果与分析
2.1 近40 年建泽泻与川泽泻大田生长期有效积温及其差异分析
通过分析近40 年建泽泻和川泽泻大田生长期有效积温,发现建泽泻大田生长期有效积温范围在1044~1340 ℃·d 之间;川泽泻大田生长期有效积温范围在602~962 ℃·d 之间,二者有效积温具有显著差异(P< 0.05)(图1)。建泽泻与川泽泻在各生长阶段所需有效积温不同,两者地上部分生长期为8 月下旬至10月,有效积温分别在815~1103 ℃·d 和539~784 ℃·d 之间,块茎积累期在11 月至12 月下旬,有效积温范围分别为96~285 ℃·d 和30~158 ℃·d 。
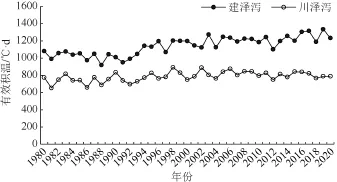
图1 近40 年建泽泻与川泽泻大田生长期有效积温分布趋势Fig. 1 The GDD trends in Jian’ou and Pengshan in recent 40 years
根据近40 年建泽泻与川泽泻大田期每日平均温度和有效积温范围,分别设置福建组(J)和四川组(C)温度处理,即依据两地昼夜温差平均值,两组处理的昼夜温差均设为8 ℃(图2)。

图2 实验期间福建组、四川组每日平均温度设置及有效积温变化Fig. 2 Variation of daily mean temperature and effective accumulated temperature in Fujian and Sichuan formations during the experiment
2.2 在不同有效积温条件下泽泻保护酶活性差异
建泽泻和川泽泻SOD、POD 和CAT 酶活性变化趋势均呈“M”型(图3)。其中SOD 在处理期间变化平稳,川泽泻和建泽泻SOD 活性第二次升高后变化趋势略有不同,四川组川泽泻(CAp) SOD 活性第二次升高的最高点出现在105 d,随后快速下降,福建组川泽泻(JAp) SOD活性则在75 d时达到高点,随后缓慢降低。福建组建泽泻(JAo)和四川组建泽泻(CAo) SOD 活性分别在105 d 和90 d 时到达最高点,随后快速下降(图3A)。

图3 不同有效积温条件下建泽泻和川泽泻抗氧化酶活性Fig. 3 Effect of GDD on the activities of protective enzymes in Jian Zexie and Chuan Zexie
在整个处理期间,建泽泻和川泽泻POD 酶活性均在道地产区有效积温条件下较高(图3B)。两组泽泻POD 酶活性升至最高的时间点也略有差异,其中福建组建泽泻(JAo)和川泽泻(JAp)及四川组川泽泻(CAp)叶片中POD 活性均在105 d 时增至最大,而四川组建泽泻(CAo)叶片POD 活性在90 d 升至最高,随后降低。
建泽泻和川泽泻CAT 活性有初始差异,但在处理60 d 时两组泽泻的CAT 酶活性均下降至最低值,随着处理时间的延长和温度降低,CAT 活性在90 d达到最高,此时在道地产区有效积温条件下的建泽泻和川泽泻中CAT 活性分别较四川组建泽泻(CAo)和福建组川泽泻(JAp)高19.86%和30.01%,随后在处理末期降至最低。在整个实验期间建泽泻和川泽泻CAT 酶活性均在道地产区有效积温条件下较高(图3C)。
2.3 不同有效积温条件下泽泻MDA 含量差异
建泽泻和川泽泻中MDA 含量均呈先上升后下降再上升的变化趋势,但变化幅度随品种和有效积温的不同而略有差异。福建组建泽泻(JAo)与四川组川泽泻(CAp)中MDA 含量变化较为平稳,而四川组建泽泻(CAo)和福建组川泽泻(JAp)中MDA 含量变化幅度较大,其中两组中的建泽泻MDA 活性在0~45 d 的变化幅度一致,在75 d 后两者差距增大,此时四川组建泽泻(CAo) 有效积温为770 ℃·d ,福建组建泽泻(JAo)有效积温为1028 ℃·d 。在处理末期,四川组建泽泻(CAo) MDA 含量较福建组建泽泻(JAo)高158.48%。
而福建组川泽泻(JAp)在生长前期受有效积温影响较大,其MDA 含量在0~30 d 快速上升,且在第30 天达最大值,此时MDA 含量较四川组川泽泻(CAp)高73.07%;在此期间四川组川泽泻(CAp)有效积温为400 ℃·d ,而福建组川泽泻(JAp)有效积温达511 ℃·d 。随后福建组川泽泻(JAp) MDA 含量在45~90 d 逐渐下降后趋于平稳;在采收期两组川泽泻MDA 含量变化趋势一致。整个处理期内,建泽泻与川泽泻MDA 含量均在道地产区有效积温条件下保持较低水平(图4)。

图4 不同有效积温对建泽泻和川泽泻MDA 含量的影响Fig. 4 Effect of GDD on the contents of MDA in Jian Zexie and Chuan Zexie
2.4 不同有效积温条件下泽泻功效物质含量差异
不同有效积温处理下的建泽泻和川泽泻功效物质含量呈现不同变化趋势,其中福建组建泽泻(JAo)和四川组川泽泻(CAp)中23-乙酰泽泻醇B 和23-乙酰泽泻醇C 含量均随生长时间延长而增加;福建组川泽泻(JAp)呈上升–下降–上升–下降–上升的趋势,而四川组建泽泻(CAo)呈上升–下降–上升的趋势(图5)。
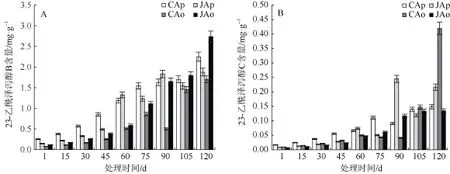
图5 有效积温对建泽泻和川泽泻功效物质积累的影响Fig. 5 Effects of GDD on active ingredient contents of Jian Zexie and Chuan Zexie
福建组建泽泻(JAo)和四川组川泽泻(CAp)的23-乙酰泽泻醇B 快速积累期均出现在处理105~120 d,此时两者有效积温(日均温度)分别为1185 ℃· d (10~12 ℃)、843 ℃· d (7~9 ℃),且在整个处理期间,23-乙酰泽泻醇C 含量增长均较为平稳。四川组建泽泻(CAo)与福建组川泽泻(JAp) 23-乙酰泽泻醇B 与23-乙酰泽泻醇C 的积累则呈不规律变化。四川组建泽泻(CAo)中23-乙酰泽泻醇B 的快速积累期出现在处理90~105 d,此时其有效积温(日均温度)为830~843 ℃· d (10~12 ℃),随着处理温度的下降,在105~120 d,日均温为7~9 ℃条件下,四川组建泽泻(CAo)中23-乙酰泽泻醇B 未见显著变化,而23-乙酰泽泻醇C 含量显著增加。福建组川泽泻(JAp)中23-乙酰泽泻醇B 的快速积累期出现在处理45~60 d (有效积温720~893 ℃· d)和75~90 d (有效积温1028~1126℃· d),而在90~120 d(块茎积累期),其23-乙酰泽泻醇B 含量未见明显增长,而23-乙酰泽泻醇C 含量在75~90 d (有效积温1028~1126 ℃· d)快速升高,随后呈现先降低后升高的规律。
在采收期,福建组建泽泻(JAo)和四川组川泽泻(CAp)块茎中23-乙酰泽泻醇B 含量分别较四川组建泽泻(CAo)和福建组川泽泻(JAp)增加 60.56%和19.81%,但23-乙酰泽泻醇C 含量却分别降低47.22%、37.73%。
3 讨论
有效积温作为反映植物生长发育对热量需求的指标[19],其不足或过高均会影响植物生长及其品质[20],如有效积温不足会导致魔芋Amorphophalluskonjac球茎膨大期生长时间缩短,发育受抑制[21],而有效积温过高会导致丹参Salviamiltiorrhiza中功效物质含量显著降低[22]。低温胁迫作为影响植物生存的最重要限制因子之一,能诱导植物体内次生代谢产物特别是萜类物质的变化[23],但过度胁迫会抑制植物体内次生代谢产物积累[24]。本研究发现,福建组和四川组建泽泻虽然都在10~12 ℃条件下完成23-乙酰泽泻醇B 的快速积累,但四川组建泽泻(CAo)的23-乙酰泽泻醇B 积累速率和采收时功效物质含量均低于福建组建泽泻(JAo),可能是四川组建泽泻在地上部分生长期有效积温不足,导致其生长发育迟缓,进而影响其次生代谢产物积累[25],且在处理末期,随着四川组温度设置的降低,23-乙酰泽泻醇B 含量几乎没有增长,这可能是后期温度低于建泽泻的适宜温度范围,导致其生长受到抑制。而福建组川泽泻(JAp)中23-乙酰泽泻醇B 的快速积累始于处理45 d,且在块茎积累期(90~120 d)并未出现23-乙酰泽泻醇B 含量快速增加。在最后采收时,其23-乙酰泽泻醇B 含量也低于道地产区有效积温条件下的川泽泻,这可能是由于福建组川泽泻在地上部分生长期有效积温较高导致其快速生长,块茎中23-乙酰泽泻醇B 提前积累;同时,在块茎积累期有效积温较高不利于川泽泻的生长,导致其块茎中23-乙酰泽泻醇B 含量几乎不变。23-乙酰泽泻醇B 作为泽泻的主要药效成分,在栽培中需考虑有效积温对其积累的影响。
研究表明,植物通过提高抗氧化酶活性,尤其是SOD、POD 和CAT 活性来减少外部温度变化对自身的影响[26—27]。实验发现道地产区有效积温条件下的建泽泻和川泽泻保护酶活性变化趋势一致,MDA 含量变化也较为平稳,说明两种泽泻均适应道地产区的温度条件,对此温度变化细胞能通过抗氧化保护酶之间的协同作用降低脂膜过氧化程度,同时清除细胞内活性氧,从而提高自身抗性[28]。而福建组川泽泻(JAp)在0~30 d 有效积温过高,四川组建泽泻(CAo)在地上部分生长期有效积温不足,保护酶活性受到抑制,导致其MDA 含量显著升高,有效积温对建泽泻和川泽泻的抗氧化能力影响显著。抗氧化酶系统作为植物自身的保护机制,与次生代谢产物一起,共同抵御外界环境变化带来的影响[29]。前人研究发现,植物抗氧化酶活性与其次生代谢产物积累密切相关[30]。本实验中除福建组川泽泻(JAp)外,福建组建泽泻(JAo)、四川组建泽泻(CAo)和川泽泻(CAp)块茎中23-乙酰泽泻醇B 快速积累期与其SOD 和POD 活性最高的时间几乎重合,这与Tang等[31]的研究结果一致,说明抗氧化酶和次生代谢产物在适应环境变化的过程中具有协同作用。
温度可以通过影响植物体内次生代谢途径相关基因的表达来影响萜类物质含量的变化[32],其中细胞色素P450(CPY450)对萜类物质的相互转化起到重要作用[33]。研究表明,栽培在四川彭山的建泽泻中CYP71 和CYP85 家族的差异表达基因(DEGs)表达水平较栽培在福建建瓯的建泽泻显著上调,这可能导致栽培在两地的建泽泻出现三萜组分含量差异[34]。本实验中,道地产区有效积温条件下的建泽泻和川泽泻23-乙酰泽泻醇B 含量升高,23-乙酰泽泻醇C降低,这可能是由于有效积温通过影响建泽泻与川泽泻体内代谢途径相关基因的表达导致功效物质间的竞争性转化,从而使23-乙酰泽泻醇B 和23-乙酰泽泻醇C 的含量产生差异,但其内在转化机制还需进一步研究。上述结果为以功效物质为目标的定向培育提供理论支撑。
