竹节香附素A体外诱导乳腺癌细胞凋亡的作用机制研究
2023-08-30田朝晖廖生伟
田朝晖 廖生伟 夏 伟 杨 超
(1 恩施土家族苗族自治州中心医院,恩施,445000; 2 南京中医药大学,南京,210029; 3 南京市江宁医院,南京,210029)
乳腺癌是全球女性最常见的恶性肿瘤之一,也是癌症致死的主要原因[1-2]。近年来,虽然乳腺癌的常规治疗和靶向治疗取得了很大的进展,患者的生存及生命质量得到了一定提高,但仍存在放化疗耐药、肿瘤复发及转移等诸多挑战[3-4]。因此,寻找治疗乳腺癌的有效药物已成为当前研究的热点。中药竹节香附是毛茛科银莲花属多被银莲花AnemoneraddeanaRegel的干燥根茎,性热,味辛,具有祛风湿、散寒止痛、消痈肿之效[5]。竹节香附素A(Raddeanin A,RaA)是一种齐墩果烷型三萜皂苷,为竹节香附中的有效成分之一[6]。有研究报道,RaA可通过抑制细胞增殖诱导凋亡等多种途径发挥抗肿瘤活性,因而具有较高的药用价值[7]。细胞凋亡是细胞的自发性死亡,诱导细胞凋亡是诸多化疗药物杀伤肿瘤细胞的重要途径[8]。此外,活性氧(Reactive Oxygen Species,ROS)/信号转导及转录激活蛋白3(Signal Transducer and Activator of Transcription 3,STAT3)/抑癌基因53(P53)信号通路对于细胞凋亡具有关键的调控作用[9-10]。当前已有关于RaA抗乳腺癌、胃癌、肝癌和非小细胞肺癌的研究,其中RaA能够通过调控肉瘤基因SRC/蛋白激酶B(Protein Kinase B,AKT)信号通路及真核延伸因子2激酶(Eucharyotic Elongation Factor-2 Kinase,eEF-2K)发挥体外抗乳腺癌MDA-MB-231细胞的作用,但RaA是否能够通过ROS/STAT3/P53信号通路调控MDA-MB-231细胞凋亡尚不清楚[11-12]。因此,本研究以乳腺癌MDA-MB-231细胞为对象,基于ROS/STAT3/P53信号通路介导的细胞凋亡探讨RaA的抗乳腺癌作用机制,以期为RaA的临床应用提供一定依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人乳腺癌细胞株(MDA-MB-231)(深圳华拓生物科技有限公司,货号:HTX1647)采用含10%胎牛血清(Fetal Bovine Serum,FBS)的达尔伯克改良伊格尔培养基(Dulbecco′s Modified Eagle′s Medium,DMEM)培养于5%CO2、37 ℃的恒温细胞培养箱。
1.1.2 药物 RaA(上海源叶生物公司,货号:B21677,纯度≥98%)、乙酰半胱氨酸(N-acetylcysteine,NAC)(MedChemexpress公司,美国,货号:HY-B0215)。
1.1.3 试剂与仪器 异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(Propidium Iodide,PI)双染试剂盒(默克公司,德国,货号:APOAF)、细胞计数试剂盒(Cell Counting Kit-8,CCK-8)(北京索莱宝公司,货号:CA1210)、线粒体膜电位检测试剂盒四氯四乙基苯并咪唑碘化碳氰胺(5,5′,6,6′-Tetrechloro1,1′,3,3′-tetraethylbenzimidazol carbocyanine Iodide,JC-1)(Abcam公司,英国,货号:ab113850)、ROS荧光试剂盒(Abcam公司,英国,货号:ab113851)、胎牛血清(Thermo公司,美国,货号:10099141C)、二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白定量试剂盒(Thermo公司,美国,货号:23246)、烟酸己可碱染色试剂盒(上海碧云天公司,货号:C0003);一抗:B细胞淋巴瘤-2蛋白(B-cell Lymphoma-2,Bcl-2)(北京博奥森公司,批号:bs-33411R)、Bcl-2相关X蛋白(BCL-2-associated X Protein,Bax)(北京博奥森公司,批号:bs-0127R)、活化胱天蛋白酶-3(active CASP3,CCASP3),(北京博奥森公司,批号:bsm-33199M)、细胞色素C(Cytochrome C,Cyt-C)(北京博奥森公司,批号:bs-0013R)、STAT3(北京博奥森公司,批号:bs-55208R)、p-STAT3(北京博奥森公司,批号:bs-1658R)、P53(北京博奥森公司,批号:bsm-33058M)、3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)(北京博奥森公司,批号:bs-0755R);二抗:兔辣根过氧化物酶标记羊抗IgG(Horseradish Peroxidase-labeled IgG,IgG-HRP)(北京博奥森公司,批号:32935S)。
CO2培养箱(IRM公司,德国,型号:ICA175)、Milli-Q超纯水系统(默克公司,德国,型号:SynergyTM)、生物显微镜(尼康公司,日本,型号:TS100、TS2R)、流式细胞仪(BD公司,美国,型号:Calibur)、酶标仪(Thermo公司,美国,型号:MK3)、小型垂直电泳仪(伯乐公司,美国,型号:MINI-4)。
1.2 方法
1.2.1 分组 体外培养乳腺癌细胞(MDA-MB-231),本实验分为空白组、RaA组、RaA联合NAC组3组。
1.2.2 干预方法 空白组:使用0.1%二甲基亚砜(Dimethyl Sulfoxide,DMSO)的培养基进行培养。RaA组:收集对数生长期的MDA-MB-231细胞接种于24孔板中,细胞密度为5×104个/mL,24 h后加入含有RaA终浓度为0(0.1% DMSO)、2、4和6 μmol/L的培养基进行培养。RaA联合NAC组:在RaA组干预方法基础上,加入含有RaA终浓度为0(0.1%DMSO)、4 μmol/L以及含有ROS抑制剂NAC终浓度5 mmol/L的培养基进行培养。
1.2.3 检测指标与方法
1.2.3.1 CCK8法检测细胞存活率 收集对数生长期的MDA-MB-231细胞接种于96孔板中,细胞密度为5×104个/mL。精密称取RaA溶解于DMSO中配置成50 mmol/L的母液,使用前使用培养基稀释。24 h后加入含有RaA终浓度为0(0.1% DMSO)、0.2、0.5、1、2、5、10、20和50 μmol/L的培养基干预。24 h后,每孔加入10 μL CCK8溶液,继续孵育1 h,在490 nm处测定吸光值并计算存活率,24 h后计算半抑制浓度(Half Maximal Inhibitory Concentration,IC50)值。
1.2.3.2 Hochest法检测凋亡 收集对数生长期的MDA-MB-231细胞接种于24孔板中,细胞密度为5×104个/mL,24 h后加入含有RaA终浓度为0(0.1% DMSO)、2、4和6 μmol/L的培养基干预。24 h后弃液,磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗涤3次,加入300 μL染液,避光孵育10 min后PBS洗涤2次,随后加入300 μL PBS,最后使用荧光倒置显微镜观察处理后的细胞并拍照。
1.2.3.3 流式细胞术检测凋亡 收集对数生长期的MDA-MB-231细胞接种于6孔板中,细胞密度为2×105个/mL,24 h后加入含有RaA终浓度为0(0.1% DMSO)、2、4和6 μmol/L的培养基干预。24 h后用不含乙二胺四乙酸(Ethylenediaminetetra-acetic Acid,EDTA)的胰酶收集各组细胞,用PBS洗涤细胞2次,随后加入500 μL的结合缓冲液(Binding Buffer)重悬细胞,加入5 μL Annexin V-FITC混匀后,再加入PI染液,室温混合后避光反应15 min,最后采用流式细胞仪检测处理后的细胞凋亡率。
1.2.3.4 JC-1法检测线粒体膜电位变化 细胞处理同“1.2.3.2项”,24 h后用不含EDTA的胰酶收集各组细胞,用500 μL的JC-1工作液将细胞悬浮后,孵育15 min,用1×Incubation Buffer洗2次,最后使用荧光倒置显微镜观察处理后的细胞并拍照,使用Photoshop制作Merge荧光图片。
1.2.3.5 DCFH-DA法检测ROS水平 细胞处理同“1.2.3.2项”,给药干预3 h后,弃去培养基,加入500 μL含有DCFH-DA荧光染料的培养基,避光孵育30 min。吸去荧光染料,用4 ℃预冷的PBS冲洗3次,加入500 μL 4%多聚甲醛溶液固定30 min,PBS冲洗3次,最后使用荧光倒置显微镜观察处理后的细胞并拍照。
1.2.3.6 流式细胞术检测ROS水平 细胞处理同“1.2.3.2项”,在此基础上加入0(0.1% DMSO)、4 μmol/L RaA、5 mmol/L ROS抑制剂NAC的培养基进行培养。24 h后依据ROS试剂盒说明书步骤处理,采用流式细胞仪检测处理后的细胞ROS水平。
1.2.3.7 蛋白质印迹法(Western Blotting)检测相关蛋白表达 蛋白质印迹法检测Bax、Bcl-2、Cleaved Caspase-3、Cyt-C、P53、p-STAT3和STAT3蛋白表达。细胞处理同“1.2.3.2项”,在此基础上加入0(0.1% DMSO)、4 μmol/L RaA、5 mmol/L ROS抑制剂NAC的培养基干预。24 h后提取总蛋白,按BCA试剂盒说明书步骤定量,按每孔30 μg蛋白量进行SDS聚丙烯酰胺凝胶电泳,结束后转膜至聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜,5%脱脂奶粉溶液,用0.1%洗涤缓冲液(Tris Buffered Saline Tween,TBST)配制,封闭2 h。0.1% TBST 1∶1 000稀释相应一抗,4 ℃孵育过夜,0.1% TBST润洗。0.1% TBST 1∶10 000稀释HRP标记的二抗,室温孵育1 h,0.1% TBST润洗。加入显影液,反应结束后吸干显影液。曝光、显影并扫描图像。最后导入分析软件分析并计算相应蛋白的相对表达水平。

2 结果
2.1 RaA对MDA-MB-231细胞存活率的影响 RaA干预24 h后,MDA-MB-231细胞存活率明显下降,并且该效果呈现一定的浓度依赖性,24 h后的IC50值为6.35 μmol/L。因此,后续实验选择浓度为2、4、6 μmol/L RaA进行。见表1。
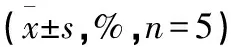
表1 RaA对MDA-MB-231细胞存活率的影响
2.2 RaA对MDA-MB-231细胞凋亡率的影响 未给药干预的MDA-MB-231细胞核表现状态正常;随着RaA的干预,MDA-MB-231细胞核出现明显的凋亡特征(浓染致密的颗粒块状蓝色荧光)。结果表明,RaA可诱导MDA-MB-231细胞凋亡。见图1。
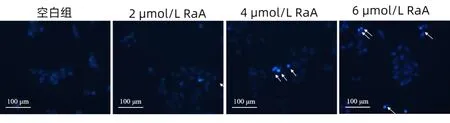
图1 RaA对MDA-MB-231细胞凋亡的影响
与空白组比较,2、4、6 μmol/L RaA干预后,MDA-MB-231细胞凋亡率(早期凋亡和晚期凋亡)明显增加,差异均有统计学意义(均P<0.01)。结果表明,RaA可诱导MDA-MB-231细胞发生凋亡。见图2,表2。
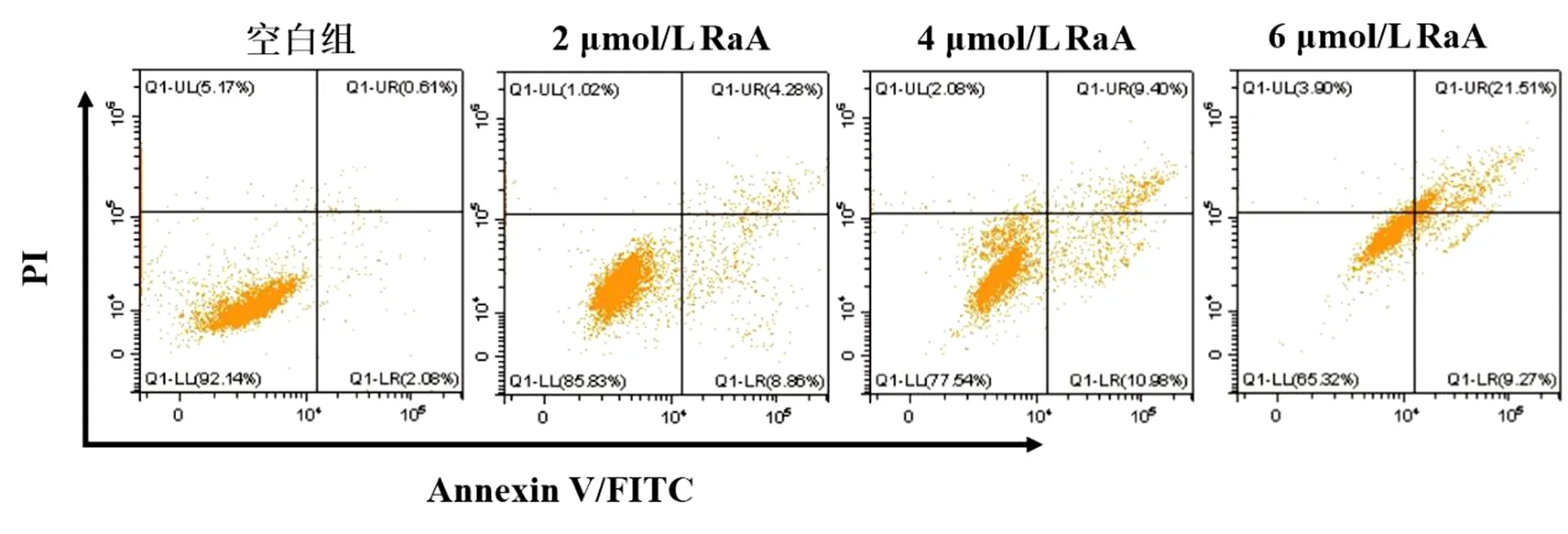
图2 RaA对MDA-MB-231细胞凋亡率(早期凋亡和晚期凋亡)的影响
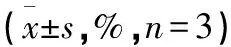
表2 RaA对MDA-MB-231细胞凋亡率(早期凋亡和晚期凋亡)的影响
2.3 RaA对MDA-MB-231细胞线粒体膜电位的影响 未给药干预的MDA-MB-231细胞红色荧光较强;随着RaA浓度的增加,MDA-MB-231细胞红色荧光逐渐变弱,绿色荧光逐渐加强,Merge亦呈现变绿趋势。结果表明,RaA可促进MDA-MB-231细胞线粒体膜电位坍塌。见图3。
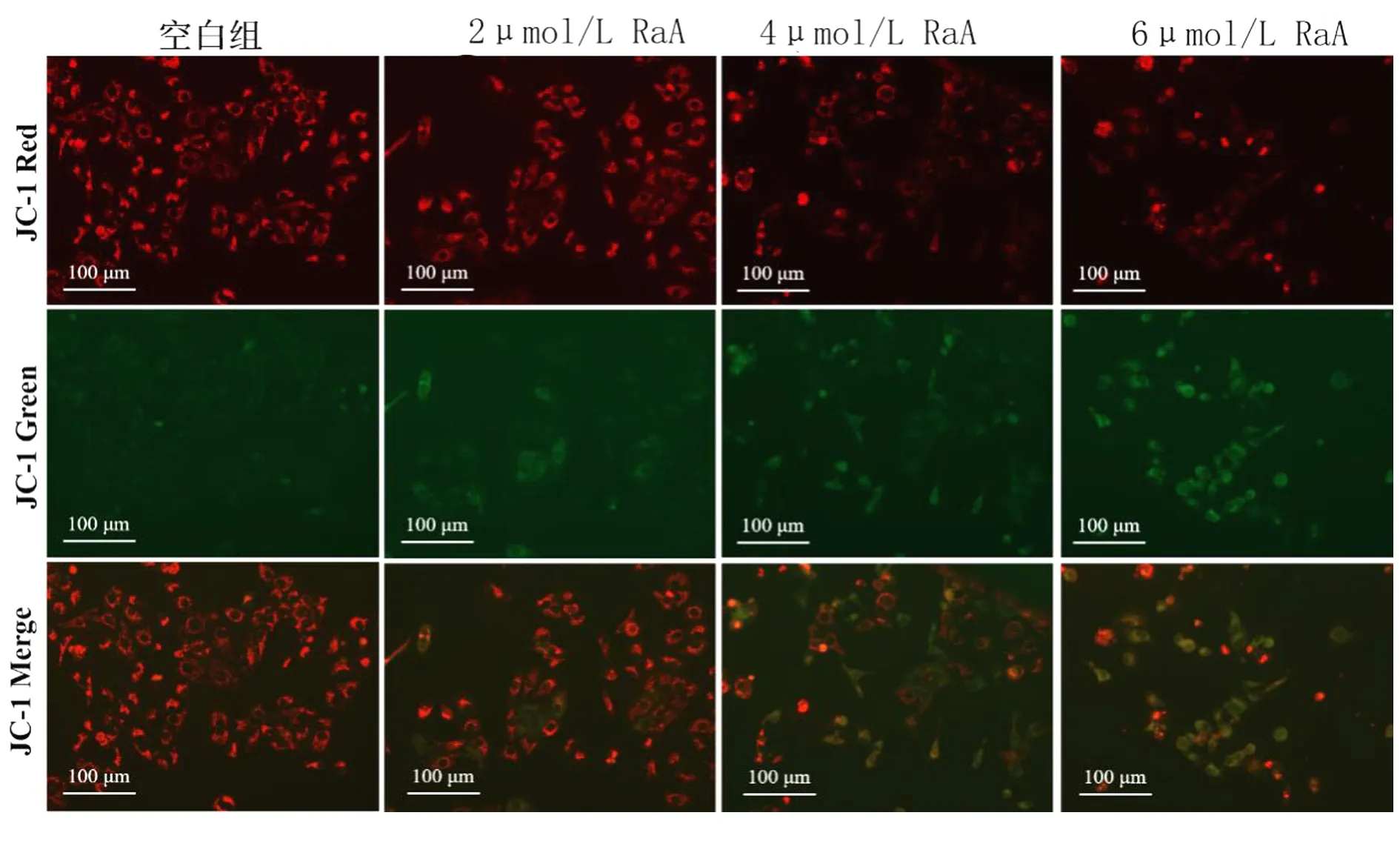
图3 RaA对MDA-MB-231细胞线粒体膜电位的影响
2.4 RaA对MDA-MB-231细胞ROS水平的影响 未给药干预的空白组比较,MDA-MB-231细胞ROS绿色荧光较弱;随着RaA浓度的增加,MDA-MB-231细胞ROS绿色荧光逐渐增强。结果表明,RaA可提升MDA-MB-231细胞ROS水平。见图4。
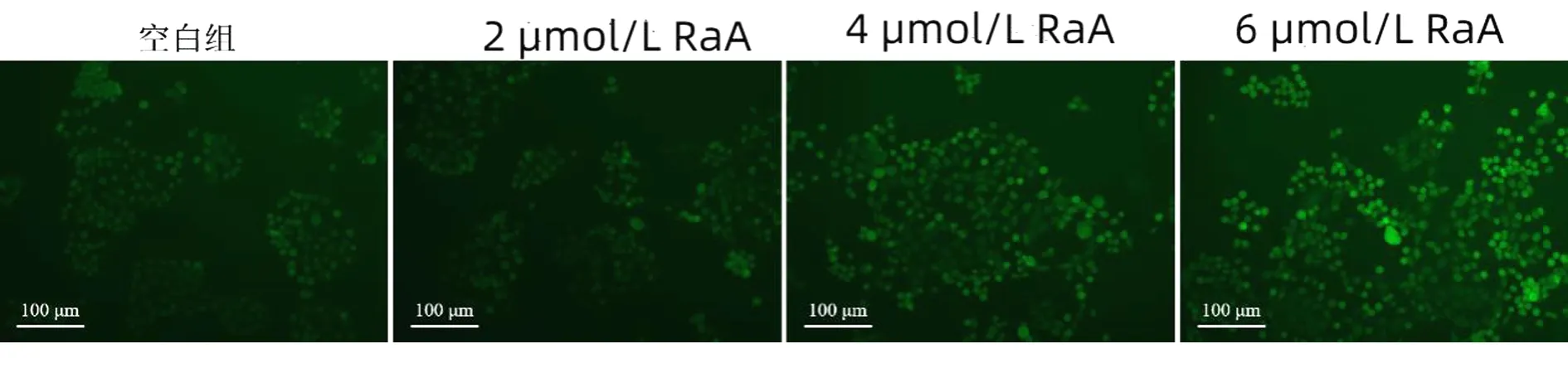
图4 RaA对MDA-MB-231细胞ROS水平的影响
与空白组比较,2、4、6 μmol/L RaA干预后,RaA组MDA-MB-231细胞ROS水平明显增加,差异有统计学意义(P<0.05,P<0.01)。见图5,表3。
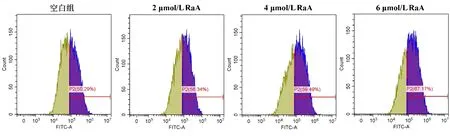
图5 RaA对MDA-MB-231细胞ROS水平的影响
表3 RaA对MDA-MB-231细胞ROS水平的影响
2.5 RaA对MDA-MB-231细胞蛋白表达的影响 与空白组比较,2、4、6 μmol/L RaA干预后,RaA组MDA-MB-231细胞CCASP3、Cyt-C、P53蛋白表达明显升高,差异有统计学意义(P<0.05,P<0.01),STAT3磷酸化水平明显降低,差异有统计学意义(P<0.05,P<0.01);4、6 μmol/L RaA干预后,RaA组MDA-MB-231细胞Bax/Bcl-2比值明显升高,差异有统计学意义(P<0.05,P<0.01)。见图6,表4。

图6 RaA对MDA-MB-231细胞Bax、Bcl-2、CCASP3、Cyt-C、P53、p-STAT3和STAT3蛋白表达影响的电泳图
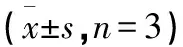
表4 RaA对MDA-MB-231细胞Bax、Bcl-2、CCASP3、Cyt-C、P53、p-STAT3和STAT3蛋白表达的影响
2.6 RaA联合NAC对MDA-MB-231细胞ROS水平的影响 与RaA组比较,RaA联合NAC组MDA-MB-231细胞ROS水平明显下降,差异有统计学意义(P<0.01)。见图7,表5。
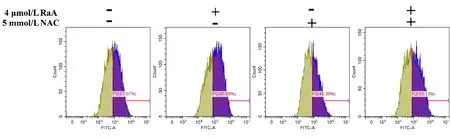
图7 RaA联合NAC对MDA-MB-231细胞ROS水平的影响
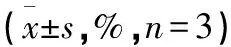
表5 RaA联合NAC对MDA-MB-231细胞ROS水平的影响
2.7 RaA联合NAC对MDA-MB-231细胞蛋白表达的影响 与RaA组比较,RaA联合NAC组MDA-MB-231细胞Bax/Bcl-2比值明显降低,差异有统计学意义(P<0.01),CCASP3、Cyt-C、P53蛋白水平明显降低,差异有统计学意义(P<0.01),STAT3磷酸化水平明显升高,差异有统计学意义(P<0.01)。见图8,表6。
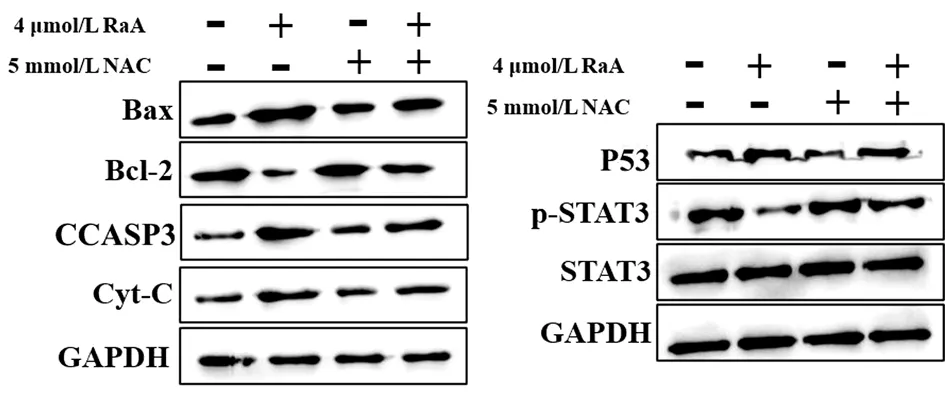
图8 RaA联合NAC对MDA-MB-231细胞Bax、Bcl-2、CCASP3、Cyt-C、P53、p-STAT3和STAT3蛋白水平影响的电泳图
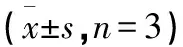
表6 RaA联合NAC对MDA-MB-231细胞Bax、Bcl-2、CCASP3、Cyt-C、P53、p-STAT3和STAT3蛋白水平的影响
3 讨论
我国绝大多数中药来源于药用植物,其原植物的成分十分复杂,这种复杂性体现在成分的结构类型各不相同,复杂的成分正是中药发挥多种药理作用和多方面功效的重要基础[13]。值得注意的是,不断有研究证实这些中药单体成分可通过调节多种生物学过程,在肿瘤的发生及进展中发挥作用,并且具有高效低毒的特点[14]。因此,包括RaA在内的诸多中药单体成分可能成为肿瘤的潜在治疗药物。
不受控制的细胞增殖和逃避细胞凋亡是肿瘤的2大特征,抑制增殖和诱导凋亡成为治疗肿瘤的重要途径[15]。本研究中,RaA明显抑制乳腺癌MDA-MB-231细胞增殖并诱导其凋亡,显示出较好的抗乳腺癌活性。线粒体凋亡途径是细胞凋亡主要的分子途径,线粒体膜电位去极化是其发生的重要标志[16]。本研究中,RaA可诱导乳腺癌MDA-MB-231细胞线粒体膜电位坍塌,提示RaA可能诱导线粒体凋亡途径。线粒体凋亡途径主要受Bcl-2家族蛋白包括Bax、Bcl-2的调控[15]。随着Bax/Bcl-2比值的变化,导致线粒体膜电位降低及通透性增加,线粒体内部的Cyt-C因而释放至细胞质[17-18]。胞质中Cyt-C可以与凋亡因子作用形成凋亡复合体,活化Caspase-9,进一步活化凋亡最终执行蛋白Caspase-3,进而启动线粒体凋亡途径[19]。在本研究中,RaA明显提升MDA-MB-231细胞Bax/Bcl-2比值,以及上调Cyt-C和CCASP3蛋白表达,进一步提示RaA可能通过诱导线粒体凋亡而发挥体外抗乳腺癌作用。
ROS作为细胞氧代谢的副产物,通常可以参与细胞内信号转导,但较高浓度的ROS会破坏细胞内蛋白质和,DNA,导致细胞死亡[20]。肿瘤抑制基因P53是一种关键的转录因子,对细胞信号如DNA损伤和ROS等做出防御性反应。STAT3是STAT家族成员之一,可被上游ROS信号激活而调控Bcl-2家族的抗凋亡蛋白表达,在恶性肿瘤细胞逃避细胞凋亡中起关键作用[21]。另有研究表明,阻断癌细胞中的STAT3活性可促进P53的表达,从而导致P53介导的细胞凋亡[22]。因此,ROS/STAT3/P53信号通路为调控细胞线粒体凋亡的重要途径。在本研究中,RaA明显提升MDA-MB-231细胞的ROS水平,下调STAT3的磷酸化水平,以及上调P53的蛋白表达,提示RaA可能通过激活ROS/STAT3/P53信号通路诱导线粒体凋亡。NAC为一种常用的ROS抑制剂。在本研究中,NAC与RaA联用后,MDA-MB-231细胞ROS水平降低,STAT3磷酸化水平上调,P53蛋白表达下调,MDA-MB-231细胞ROS/STAT3/P53信号通路被抑制。此外,MDA-MB-231细胞Bax/Bcl-2比值降低,Cyt-C和CCASP3蛋白表达下调,MDA-MB-231细胞线粒体凋亡被逆转。以上说明,RaA通过激活ROS/STAT3/P53信号通路诱导线粒体凋亡而发挥体外抗乳腺癌作用。
综上所述,中药单体RaA可通过调控ROS/STAT3/P53信号通路诱导线粒体凋亡而在体外发挥抗乳腺癌作用,本研究结果可为RaA及含RaA中药临床防治乳腺癌提供一定思路。后期将结合更多乳腺癌细胞系及动物实验,并纳入更为全面的上下游信号途径分子系统阐明RaA的抗乳腺癌机制。
利益冲突声明:无。
