补阳还五汤治疗大鼠气虚血瘀型脑缺血的代谢组学研究
2023-08-30宋文婷孙明谦尹春园马彦雷刘建勋
宋文婷 丁 昭 苗 兰 孙明谦 尹春园 曹 慧 史 跃 马彦雷 李 磊 刘建勋
(1 中国中医科学院西苑医院基础医学研究所,北京市中药药理重点研究室,北京,100091; 2 莱顿大学莱顿药物研究中心,莱顿,2333CD)
中风是严重危害中国国民健康的重大慢性非传染性疾病,具有致残率高和死亡率高的特点[1]。60%的中风患者为缺血性中风[2]。中医认为,气能推动血液运行,气机调畅,则血液能够正常运行。但在气虚状态下,气无力推动血行,形成瘀滞[3]。临床上常用益气活血法治疗气虚血瘀型中风[4]。补阳还五汤由黄芪、川芎、赤芍、红花、桃仁、当归、地龙等7味传统中药组成[5],对于气虚血瘀型中风有较好治疗作用[6-7]。
代谢组学是研究生物体受到内外刺激后,体内小分子代谢物变化的一项技术,它反映了多种因素作用的终点效应,是各种因素效应的综合体现[8]。代谢组学的整体性和系统性与中医药的整体性思维相吻合。本实验观察补阳还五汤对气虚血瘀型脑缺血大鼠的治疗作用,再借助代谢组学技术,对大鼠血清中的内源性小分子代谢物进行检测和通路分析,探讨给药前后大鼠机体代谢产物的动态变化,以期为深入探索其作用机制提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠30只,无特定病原体(Specific Pathogen Free,SPF)级,7周龄,体质量200~220 g,购于维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0006。饲养于中国中医科学院西苑医院SPF级实验动物中心,温度23~25 ℃,湿度50%~70%,12 h交替照明,大鼠5只一笼,可自由饮水摄食。本研究经中国中医科学院西苑医院伦理委员会审批通过(伦理审批号:2018XLC003-2)。
1.1.2 药物 黄芪配方颗粒(批号:1812002C),川芎配方颗粒(批号:1812001S),赤芍配方颗粒(批号:1812005S),红花配方颗粒(批号:1812001S),桃仁配方颗粒(批号:1812004S),地龙配方颗粒(批号:1812001S),当归尾配方颗粒(批号:1812003S),均购自华润三九有限公司。
1.1.3 试剂与仪器 乙腈(色谱纯,Fisher公司,美国,批号:F19M9J202),甲醇(色谱纯,Fisher公司,美国,批号:198267),甲酸(分析纯,西陇化工股份有限公司,批号:101117),纯净水(中国娃哈哈有限公司,批号:20170317),二甲基亚砜(分析纯,西陇化工股份有限公司,批号:111115),荧光微球(UVPMS-BY2,Cospheric公司,美国,批号:100309-7),医用水合氯醛(上海源叶生物有限公司,批号:Z16J10Y80098),大鼠血栓素B2(Thromboxane,B2,TXB2)酶联免疫检测试剂盒(南京建成生物工程研究所,批号:20191016),大鼠6-酮前列腺素F1α(6-keto-prostaglandin F1α,6-keto-PGF1α)酶联免疫检测试剂盒(南京建成生物工程研究所,批号:20191016),右旋糖酐D40(大连美仑生物,批号:M1001A),API-TOF参比质量溶液试剂盒[包含hexakis(1H,1H,3H-tetrafluoropropoxy)phosphazine和7-purine](Agilent公司,美国,批号:LB97178),Agilent高效液相色谱仪(Agilent公司,美国,型号:1200),Agilent Q-TOF质谱仪(Agilent公司,美国,型号:6520),高速离心机(Hettich公司,德国,型号:MIKRO 220 R),超声波破碎仪(Sonics公司,美国,型号:VCX150)。
1.2 方法
1.2.1 分组与模型制备 将30只雄性健康SD大鼠随机分为假手术组、模型组和补阳还五汤组,每组10只。配制荧光微球右旋糖酐混悬液:称取5 g右旋糖酐D40,溶解于100 mL纯净水中。将BY2 180~212 μm微球与BY2 106~125 μm微球分别称取5 mg与10 mg,悬浮于10 mL5%右旋糖酐D40溶液中,每只实验大鼠共注射200 μL。2种微球浓度分别为0.5 mg/mL与1 mg/mL。
睡眠剥夺复合多发性脑梗死(Multiple Cerebral Infarction,MCI)大鼠模型制备:大鼠先接受睡眠剥夺2周,然后制备微球致MCI手术,术后继续复合睡眠剥夺,并给药4周。睡眠剥夺方法参考文献[9]“水环境小平台法”,睡眠剥夺结束后回笼正常饮食饮水。为不使大鼠耐受睡眠剥夺,每天在不同时间进行操作。见表1。
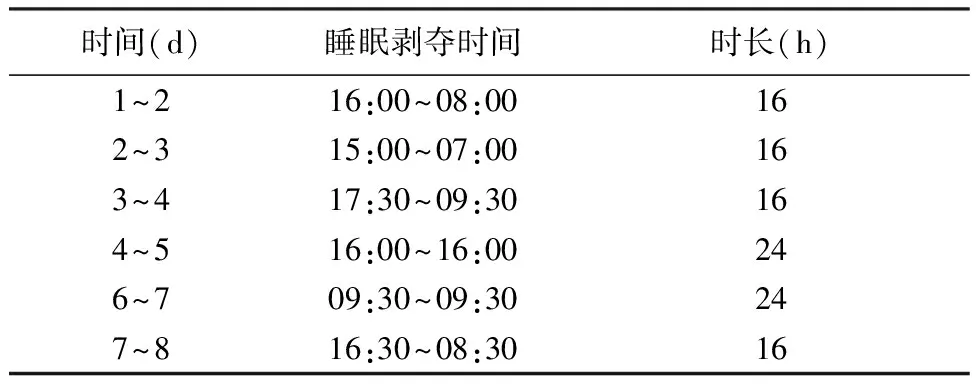
表1 睡眠剥夺时间
大鼠MCI模型制备:麻醉大鼠,颈部正中切口,分离颈总动脉、颈内动脉和颈外动脉。用动脉夹夹闭颈总动脉,颈外动脉的远心端用线结扎,用注射器从颈外动脉向颈内动脉注入配制好的荧光微球右旋糖酐混悬液0.2 mL,微球经由颈内动脉分散至大脑各动脉。假手术组大鼠则从颈外动脉向颈内动脉注入右旋糖酐溶液0.2 mL。松开动脉夹,将颈外动脉近心端结扎,逐层缝合伤口,回笼正常饲养,术后24 h进行神经功能缺陷评分,正常0分,无神经性征象。1分:提尾时大鼠不能完全伸展左前肢。2分:大鼠左侧肢体瘫痪,行走时向左侧转圈,出现追尾现象。3分:大鼠行走向左侧跌倒或不能站立或翻滚。4分:无自发活动,有意识障碍。淘汰死亡、0分及4分大鼠,1~3分为MCI模型建造成功。评分结束后,各组有10只造模成功。手术结束3 d后开始给药,并恢复睡眠剥夺操作。干预4周后取材。
1.2.2 给药方法 药物配制:黄芪、川芎、赤芍、红花、桃仁、地龙、当归尾配方颗粒的饮片当量分别为10 g/g、6 g/g、5 g/g、6 g/g、20 g/g、6.7 g/g、5 g/g,在配药时先将各个颗粒剂分别进行称量后再混合,以蒸馏水配制成混悬液。大鼠全方组每天给予配方颗粒3.49 g/kg,相当于2倍临床等效剂量。
补阳还五汤:分别称取黄芪颗粒10.8 g、赤芍2.7 g、川芎2.16 g、当归尾3.6 g、地龙2.16 g、红花2.16 g、桃仁2.16 g,混合后配至100 mL,相当于给药量3.49 g/kg。
具体实验方案流程见图1。
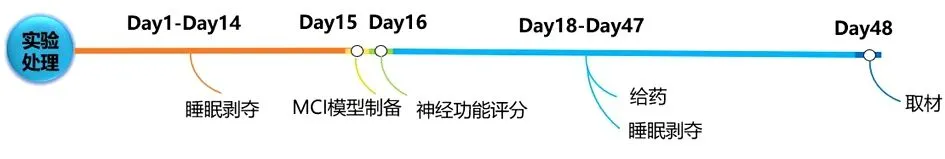
图1 实验方案流程
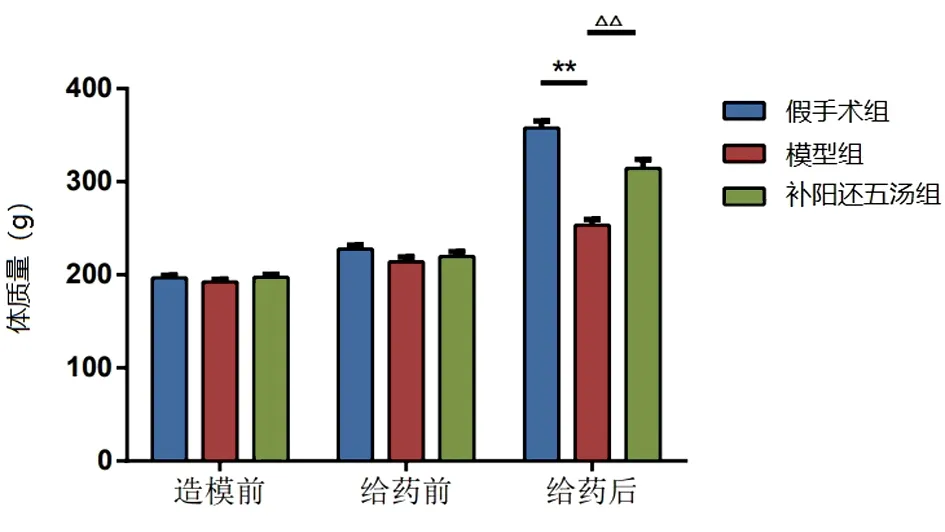
图2 各组大鼠体质量比较
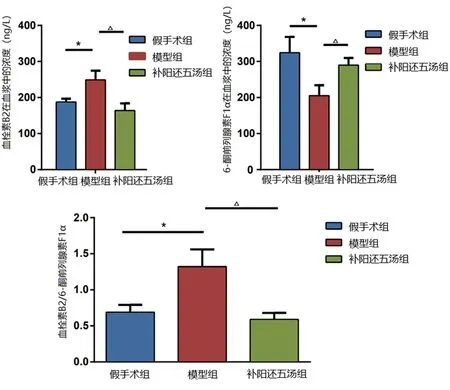
图3 各组大鼠血清TXB2、6-keto-PGF1α、 TXB2/6-keto-PGF1α值比较
1.2.3 检测指标与方法
1.2.3.1 体质量测量 手术造模当天称重,手术恢复后每天给药时称重,各组称重后分别给予药物或相应体积的蒸馏水。
1.2.3.2 气虚血瘀相关指标检测 大鼠腹主动脉取血,试管内静置1.5 h,4 ℃预冷,4 000×g离心15 min,分离血清,冻存在-80 ℃冰箱中,按照酶联免疫吸附试验试剂盒说明书操作,检测血清中TXB2、6-keto-PGF1α等相关指标。
1.2.3.3 血清样本制备 取50 μL血清加入有机溶剂[乙腈-甲醇(1∶1)]200 μL,混匀振摇1 min,于4 ℃,12 000×g离心10 min后,取上清液进样分析。
1.2.3.4 液相色谱和质谱联用分析 色谱条件:Agilent Waters HILIC Amide色谱柱(Waters公司,ACQUITY UPLC,BEH amide1.7 μm,2.1 mm×100 mm);流动相A为含0.1%甲酸的乙腈-水(1∶9)混合液,流动相B为含0.1%甲酸的乙腈溶液,梯度洗脱(0~11 min,92% B~70% B;11~13 min,70% B;13~15 min,70%~92% B),18 min停止,两针之间平衡时间3 min。流速0.3 mL/min,柱温35 ℃,进样量10 μL。
质谱条件:离子源为电喷雾离子源,雾化气和干燥气均为氮气,碰撞气为氦气,采集模式为正离子模式,毛细管电压3 500 eV,雾化温度350 ℃,干燥气流速600 L/h,雾化气压力207 kPa,扫描范围m/z 80~1 000,数据储存模式为Centroid。质谱采集数据通过2个已知的对照品[hexakis(1H,1H,3H-tetrafluoropropoxy)phosphazine和7-purine,二者对应的m/z分别为922.009 8和121.050 9]进行实时矫正。参比液通过Agilent Isocratic泵以0.01 mL/min的速度喷入质谱。Auto MS/MS实验采用碰撞诱导裂解的方式,碰撞能量30 eV。

2 结果
2.1 大鼠体征及体质量观察 造模前后大鼠的精神状态和体质量差异有统计学意义(P<0.05)。造模结束后,与假手术组大鼠比较,模型组大鼠精神萎靡,毛发直立且晦暗无光,身体消瘦,体质量变化明显(P<0.01)。补阳还五汤组大鼠精神状态有所改善,体质量比模型组有显著增加,差异有统计学意义(P<0.01)。见表2。
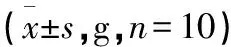
表2 各组大鼠体质量比较
2.2 各组大鼠血清TXB2、6-keto-PGF1α、TXB2/6-keto-PGF1α值比较 与假手术组比较,模型组TXB2、TXB2/6-keto-PGF1α值均升高,6-keto-PGF1α值下降,差异均有统计学意义(均P<0.05);与模型组比较,补阳还五汤组TXB2、TXB2/6-keto-PGF1α值均下降,同时6-keto-PGF1α值升高,差异有统计学意义(P<0.05,P<0.01)。见表3。
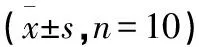
表3 各组大鼠血清TXB2、6-keto-PGF1α、TXB2/6-keto-PGF1α值比较
2.3 血清代谢轮廓图 大鼠血清代谢组学结果显示模型组和假手术组有较为明显的区别,而补阳还五汤组有明显的向假手术组回调的趋势,且补阳还五汤组和假手术组差异无统计学意义(P>0.05)。见图4。模型组与假手术组的PLS-DA模式识别图显示,模型组和假手术组之间的内源性代谢成分出现了较为明显的变化(R2=0.996,Q2=0.854)。见图5。利用PLS-DA分析,选出模型组与模型组差异大的离子进行初步鉴定和分析,筛选条件为变量重要性投影VIP(Variable Importance in the Project,VIP)>1.2,Pvalue(Student′s t)<0.05,结果显示,筛选模型组与给药组补阳还五汤组差异有统计学意义(P<0.05),且均有向对照组水平恢复的趋势。通过将这些潜在生物标志物的质谱数据与METLIN、HMDB等数据库进行对比,鉴定出11种与补阳还五汤治疗作用相关的生物标志物,大鼠气虚血瘀证模型和补阳还五汤药效潜在生物标志成分及其通路富集得到的代谢通路。见表4。

图4 血清样本PCA图
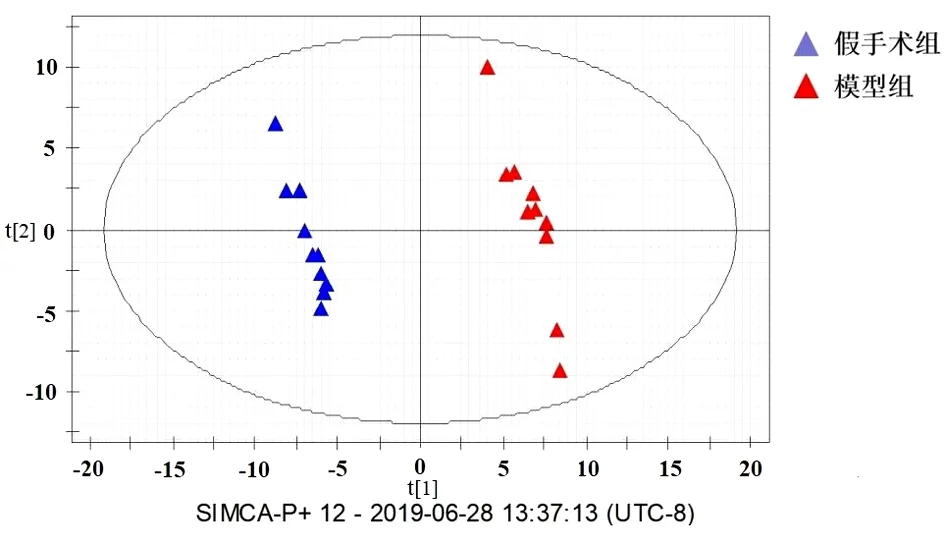
图5 血清样本PLS-DA平面
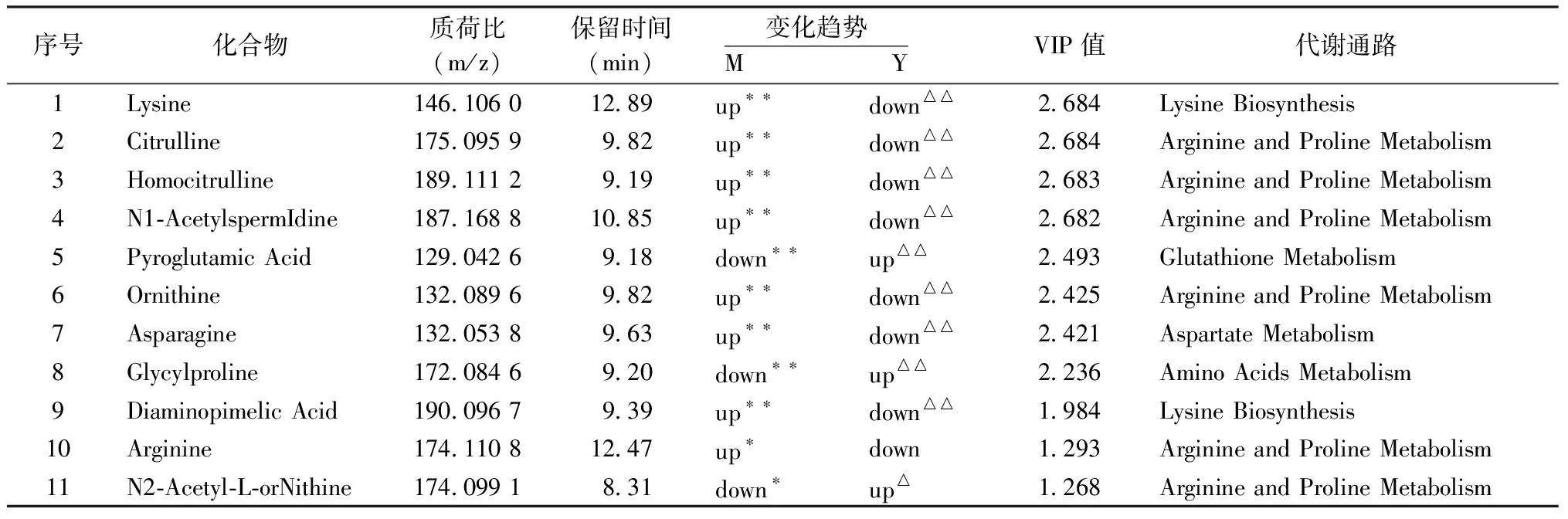
表4 补阳还五汤治疗大鼠气虚血瘀证模型血清中的潜在生物标志成分
3 讨论
TXB2和6-keto-PGF1α分别为血栓素和前列环素的稳定代谢物,TXB2、6-keto-PGF1α和一氧化氮都是与血管内皮损伤和血小板活化密切相关的活性物质[10]。TXB2能够收缩血管、促进血小板聚集;6-keto-PGF1α能够舒张血管、抑制血小板聚集,二者平衡的破坏会促进血小板聚集,也是造成血液黏度高的重要因素之一[11]。实验结果显示,模型组与假手术组比较,TXB2水平升高,6-keto-PGF1α水平降低,导致模型组中二者比值显著高于假手术组,表明在模型组中血小板花生四烯酸代谢途径亢进,内皮细胞功能异常,血管舒缩功能异常,血小板异常聚集,血液黏度增加,继而引起血液流变学改变[12]。而补阳还五汤对模型组表现出的内皮损伤有良好的纠正作用,能够降低血清中TXB2并升高6-keto-PGF1α值,使TXB2/6-keto-PGF1α值降低,发挥抗血小板聚集、保护血管内皮、改善血瘀的作用。
代谢组学结果显示,模型组与假手术组比较呈现出明显的区别,补阳还五汤组部分逆转模型组的变化,指标向假手术组回调的趋势明显,说明模型组大鼠的体内代谢成分已经受到干扰,而补阳还五汤组可以对体内异常的生物代谢途径进行有效的调整。本研究主要发掘补阳还五汤发挥治疗作用生物标志物,首先使用PLS-DA分析假手术组与模型组间代谢轮廓的总体差异,筛选正常组与模型组之间的差异代谢物,根据这些潜在生物标志物在补阳还五汤组中含量的变化进一步筛选,发掘出补阳还五汤组中浓度变化趋于正常组的代谢成分作为潜在生物标志物并进行下一步的分析。结果显示,模型组和假手术组之间的内源性代谢成分出现了较为明显的变化,PLS-DA分析筛选模型组与补阳还五汤组差异有统计学意义,且均有向对照组水平恢复的趋势,即为补阳还五汤作用的潜在生物标志物[9]。经代谢产物分析后,精氨酸的生物合成、精氨酸和脯氨酸代谢、谷胱甘肽代谢、赖氨酸的生物合成是代谢产物中重要的信号通路。精氨酸和脯氨酸代谢:本研究中,有多种代谢异常组分都与精氨酸和脯氨酸的代谢相关。其中,瓜氨酸(Citrulline)的和鸟氨酸(Ornithine)是尿素循环的关键节点,而高瓜氨酸(Homocitrulline)、N1-乙酰亚精胺(N1-Acetylspermidine)、天冬酰胺(Asparagine)都通过上游的代谢途径与精氨酸和脯氨酸的代谢相关[13]。精氨酸可在精氨酸酶的作用下转化为鸟氨酸,由鸟氨酸氨基转移酶(Ornithine Aminotransferase,OAT)代谢形成脯氨酸,鸟氨酸脱羧酶(Ornithine Decarboxylase,ODC)代谢形成多胺。脯氨酸可用于胶原蛋白合成,而多胺可促进细胞增殖[14]。其中多胺的代谢也被研究者证明与神经元细胞的缺血性损伤有关[15]。L-精氨酸也是一氧化氮合酶(Nitricoxide Synthase,NOS)的底物。一氧化氮是生物体内重要的信号分子,具有抗炎、舒张血管和改善微循环的作用,对缺血性脑组织具有保护作用。一氧化氮分为3种亚型,神经元型NOS(Neuronal NOS,nNOS)、内皮型NOS(Endothelial NOS,eNOS)、诱导型NOS(Inducible NOS,iNOS)。eNOS在血管内皮细胞中可以通过催化精氨酸转化为一氧化氮和瓜氨酸来维持适当的血流量,因此,在血管健康中起着关键作用[16]。在脑损伤早期,精氨酸含量降低,一氧化氮的合成减少会导致脑血流量减少[17]。有研究者发现,在大鼠脑缺血早期使用精氨酸可以加速缺血区域一氧化氮的合成,从而缓解脑损伤[18]。本实验中,模型组与假手术组比较,瓜氨酸和鸟氨酸的含量上升,提示一氧化氮的生成途径发生异常,而精氨酸可以通过精氨酸酶的代谢,转化为鸟氨酸,并产生尿素,模型组中高瓜氨酸含量的升高与这一途径异常导致的尿素积累相关。在补阳还五汤组中,几种物质的含量均得到调整,说明补阳还五汤可以通过调节精氨酸和脯氨酸代谢的多个节点来达到对脑的保护作用。
赖氨酸的生物合成:本研究中Lysine(赖氨酸)和二氨基庚二酸等与赖氨酸生物合成相关的物质含量出现了异常,这说明在模型组中赖氨酸的合成受到了影响。赖氨酸是一种机体必需氨基酸,在骨骼肌、血清蛋白、多肽激素等多种蛋白质的合成中起重要作用,还具有免疫调节作用,因此与机体生长和修复密切相关。赖氨酸缺乏会导致疲劳、脂肪酸代谢受损和全身蛋白质能量缺乏[19]。二氨基庚二酸是赖氨酸合成中的重要物质。本实验中,模型组与假手术组比较,赖氨酸和合成它所需二氨基庚二酸含量升高。说明大鼠体内有多发梗死灶和血瘀致内皮损伤,需要大量赖氨酸为修复受损组织提供必要的氨基酸及能量,促进受损组织修复。在气虚血瘀脑缺血模型大鼠体内,虚意味着能量代谢匮乏,赖氨酸产生反应性增加,促进酮体和葡萄糖代谢,弥补能量不足;当药物干预后,改善了脑缺血的状态,对赖氨酸的需求恢复正常,从而赖氨酸的生成较模型组下降。
谷胱甘肽代谢:在模型组中,焦谷氨酸(Pyroglutamic Acid)的含量下降,在体内,焦谷氨酸可以在5-羟脯氨酸酶的作用下,转化为谷氨酸(Glutamic Acid,Glu)和γ-氨基丁酸(Gamma-aminobutyric Acid,GABA)[20],也可以在γ-谷氨酰半胱氨酸合成酶、5-羟脯氨酸酶和谷胱甘肽生物合成酶等作用下,转化为谷胱甘肽。谷胱甘肽具有清除自由基,保护神经细胞膜的作用[21]。在模型组中,焦谷氨酸含量下降,提示可能有更多的焦谷氨酸在酶的作用下转化为谷胱甘肽,谷胱甘肽增加以保护受损神经细胞,当药物干预后,改善了脑缺血的状况,对谷氨酰胺的需求恢复正常,从而减少了焦谷氨酸的消耗。
本研究采用代谢组学的方法对气虚血瘀型脑缺血大鼠模型的血清样本进行分析,结果显示该模型中赖氨酸、焦谷氨酸、瓜氨酸等成分的代谢都受到干扰。补阳还五汤可以通过调节精氨酸和脯氨酸代谢,调节一氧化氮与尿素的合成与积累起到对脑组织的保护作用;也可以通过调节谷胱甘肽代谢和赖氨酸的生物合成,弥补能量缺乏,改善气虚情况,气虚改善后,对血液的推动力增加,可有效缓解血瘀的症状。
利益冲突声明:无。
