基于Aβ42转基因果蝇对红参多糖防治阿尔茨海默病作用及机制的研究
2023-08-30白玉莹徐新房张姝妍程水清李春帅徐文娟杨琳琳李向日
白玉莹 徐新房 张姝妍 程水清 王 璇 文 佳 李春帅 徐文娟 杨琳琳 李向日
(北京中医药大学中药炮制研究中心/中药品质评价北京重点实验室,北京,102488)
中医治疗痴呆历史悠久,痴呆病名首见于汉代《华佗神医秘传》,主要病机为神机失用,脑髓空虚,气血不足,导致心神失养。本病多表现为本虚标实,以心肝脾肾虚为本,痰瘀内生、气血逆乱为标[1]。治疗以补益气血元阴为主,兼以祛痰、活血化瘀等。人参为五加科植物人参PanaxginsengC.A.Mey.的栽培品,于秋季采挖,洗净,蒸制后,干燥而得的根和根茎。鲜人参经蒸制后得到红参,《中华人民共和国药典》(2020版)中记载其味甘、微苦,温。归脾、肺、心、肾经。具有大补元气、复脉固脱、益气摄血的作用[2]。红参味甘而厚,性偏温,其药性与AD的证候相对应。因此,在临床上,红参广泛用于AD的治疗。
果蝇寿命短,繁殖力强,其代谢、生理状况和生长发育同哺乳动物基本相似,是研究寿命及抗衰老药物的理想模型。因此,常被用来研究人神经退行性疾病[3]。果蝇成虫大脑有着复杂的神经回路和神经纤维网,可调节各种行为,如飞行、打斗、梳理、觅食、学习和记忆、睡觉和昼夜节律等。因此,许多作用于哺乳动物中枢神经系统的药物被证实能在果蝇的大脑内发挥同样的作用[4]。人和果蝇在基因和代谢水平上也都存在着极大的相似性[5-6]。
红参多糖是红参中主要活性成分之一,具有抗氧化、抗炎、抗衰老、提高免疫力等作用[7-9],然而关于红参多糖治疗AD的研究较少。故本实验以转基因AD果蝇为模型,通过果蝇攀爬能力实验,果蝇嗅觉记忆实验,测定果蝇脑组织β淀粉样蛋白1-42(Beta Amyloid 1-42,Aβ1-42)、超氧化物歧化酶(Superoxide Dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、环腺苷酸(Cyclic Adenosine Monophosphate,cAMP)及乙酰胆碱酯酶(Acetylcholinesterase Chloride,AChE)水平,探究红参多糖对AD的治疗作用机制,进一步拓宽红参多糖的药用途径,为相关研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1 动物 野生型(Canton-S)黑腹果蝇(Drosophila Melanogaster)、Aβ42转基因果蝇,均由北京师范大学孙林教授惠赠。对果蝇生活环境实行每天12/12 h明暗光照周期处理,温度(25±1)℃,相对湿度50%~60%。
1.1.2 药物 人参药材(JARS-180506X)于吉林(南岭参场)收集,经北京中医药大学李向日教授鉴定为五加科植物人参PanaxginsengC.A.Mey.的根及根茎。红参多糖:根据课题组前期建立的红参炮制专利方法对人参原药材进行炮制得到红参药材,将所得到的红参药材按实验室前期研究的提取方法制得红参多糖。盐酸多奈哌齐(上海源叶生物有限公司,批号:110119-84-1)。
此功能是本系统的主要功能,需要实现对查询条件的设置与检查、对票务数据的收集,并将数据传输至视图页面进行展示。由于在线查询需要使用网络带宽,所以需要对此功能进行限制,用户登录后才可使用在线查询系统。
1.1.3 试剂与仪器 苯甲酸(北京化工厂,货号:20211025);丙酸(天津福晨化学试剂有限公司,货号:20220117);蔗糖(天津福晨化学试剂有限公司,货号:20211025);琼脂(北京奥博星生物技术有限责任公司,货号:20210203);总蛋白(Total Protein,TP)试剂盒(货号:RGB-30002)、Aβ1-42试剂盒(货号:RGB-60332H)、SOD试剂盒(货号:RGB-40001)、MDA试剂盒(货号:RGB-40003)、cAMP试剂盒(货号:RGB-60320D)、AChE试剂盒(货号:RGB-60410D)均购于北京瑞格博科技发展有限公司。全自动生化分析仪(贝克曼库尔特有限公司,美国,型号:UniCel DxC 600 Synchron);酶标仪(赛默飞世尔科技有限公司,芬兰,型号:Multiskan MK3)。
1.2 方法
1.2.1 分组与模型制备 12 h内孵化出的幼虫不会交配,在12 h内把雌雄果蝇分开培养,所得的果蝇即为处女蝇。每天晚上19:00—20:00将培养瓶内的成蝇转移,次日早晨7:00—8:00对新羽化的果蝇进行挑选,在二氧化碳麻醉板上收集12 h内羽化的雄性处女蝇,将其移入装有新鲜培养基的玻璃指管内,每个玻璃指管按照实验需求装入果蝇20或30只,并标明日龄。每2天更换1次培养基。共分为4组:野生组,即正常Canton-S型处女蝇;Aβ42转基因处女蝇随机分为模型组、阳性对照组和红参多糖组3组。连续喂养8 d,每2天更换1次培养基。
1.2.2 给药方法 基础培养基的制备:玉米粉40 g、琼脂3.5 g、蔗糖35 g,以上材料倒入500 mL蒸馏水中,不断搅拌并加热,煮沸后3 min,停火,放凉至70 ℃左右,加入15%苯甲酸1 mL、丙酸1 mL,持续搅拌,冷却至60 ℃后,加入酵母粉10 g,混匀后,倒入高12 cm、直径3 cm经高温灭菌的指管中,培养基厚度约3 cm。培养基需要倒置于干燥实验室内24 h以上。经过摸索确定最佳给药剂量,在基础培养基中分别加入实验室自制的红参多糖和盐酸多奈哌齐(阳性对照药物),制成浓度为1 mg/mL红参多糖和10 μmol/L盐酸多奈哌齐培养基。
1.2.3 检测指标与方法
1.2.3.1 果蝇攀爬能力实验 果蝇攀爬能力实验是利用果蝇的反趋地性,通过观察果蝇在垂直的指管内的爬行情况来测试果蝇的运动能力。将以上4组待测果蝇分别装入未装培养基的空指管中,果蝇于空指管内适应5 min,轻晃指管将果蝇摇至瓶底,果蝇由于习性将向上爬。测试10 s到达指管顶部的果蝇个数(A),至少连续记录5次,每次至少间隔1 min,每次晃动的力度一致。计算攀附指数(Climbing Index,CI)即CI=A/总数。记录5次,取平均值。CI越高,证明果蝇的运动能力越强。测试时,每管内随机放置果蝇20只,每个组别各测试6管,每组共计120只,4组共计480只(正常Canton-S型处女蝇120只,Aβ42转基因处女蝇随机分为模型组、阳性对照组和红参多糖组共360只,雌雄各半)。
1.2.3.2 果蝇嗅觉记忆实验 将以上4组待测果蝇分别放入空指管内饥饿2 h后,放入1 000 mL的烧杯中。烧杯中放有2个100 mL带孔离心管,其中一个离心管内直接放入香蕉(可食离心管,也可简称为可食管),果蝇可闻到气味,并且通过孔洞进入离心管内时可直接吃到香蕉;另一个在香蕉的外面包有纱布,果蝇只能闻到气味,但无法吃到香蕉。每隔1 h记录进入无障碍可食离心管果蝇的数目,连续记录8 h,每组记录6次,取平均值。测试时,每管内随机放置果蝇30只,每组别各测试6管,每组共计180只,4组共720只。
1.2.3.3 果蝇脑组织TP含量测定 将果蝇脑组织匀浆提取液适当稀释,按TP含量测定试剂盒步骤,用酶标仪在546 nm处测定其OD值,根据公式计算TP含量。测定时,每30只果蝇为一个样本,每组别各测定6个样本,每组180只,4组共720只。
1.2.3.4 果蝇脑组织Aβ1-42含量的测定 按Aβ1-42试剂盒操作说明,用酶标仪在450 nm处测定其OD值,根据Aβ1-42回归曲线计算Aβ1-42含量。测定时,每30只果蝇为一个样本,每个组别各测定6个样本,每组180只,4组共720只。
1.2.3.5 果蝇脑组织SOD活性的测定 按SOD试剂盒操作说明,用酶标仪在550 nm处测定其OD值,根据公式,计算SOD活性。测定时,每30只果蝇为一个样本,每个组别各测定6个样本,每组180只,4组共720只。
1.2.3.6 果蝇脑组织MDA含量的测定 按MDA试剂盒操作说明,用酶标仪在532 nm处测定其OD值,根据公式,计算MDA含量。测定时,每30只果蝇为一个样本,每个组别各测定6个样本,每组180只,4组共720只。
1.2.3.7 果蝇脑组织cAMP含量的测定 按cAMP试剂盒操作说明,用酶标仪在450 nm处测定其OD值,根据cAMP回归曲线计算cAMP含量。测定时,每30只果蝇为一个样本,每个组别各测定6个样本,每组180只,4组共720只。
1.2.3.8 果蝇脑组织AChE含量的测定 按AChE试剂盒操作说明,用酶标仪在450 nm处测定其OD值,根据AChE回归曲线计算AChE含量。测定时,每30只果蝇为一个样本,每个组别各测定6个样本,每组180只,4组共720只。

2 结果
2.1 红参多糖对Aβ42转基因果蝇攀爬能力的影响 雌性和雄性果蝇,野生组与模型组、红参多糖组、阳性对照组CI差异有统计学意义(P<0.01)。与模型组比较,红参多糖组、阳性对照组CI均显著升高,差异有统计学意义(P<0.01),此外,雌雄红参多糖组与阳性药对照组比较,差异无统计学意义(P>0.05)。见表1。

表1 红参多糖对Aβ42转基因雄/雌性果蝇攀爬能力的影响
2.2 红参多糖对Aβ42转基因果蝇嗅觉记忆的影响 各组果蝇进入无障碍可食离心管的数量随着时间的增长皆呈上升趋势,且在同一时间段内,野生组果蝇进入无障碍可食离心管的数量始终高于其他组,直至果蝇全部进入。与模型组比较,阳性对照组、红参多糖组进入无障碍可食离心管的数量显著增加,差异有统计学意义(P<0.05或P<0.01);2 h后,红参多糖组与野生组数量比较,差异无统计学意义(P>0.05);7 h后,阳性对照组与野生组数量比较,差异无统计学意义(P>0.05)。见表2,图1。
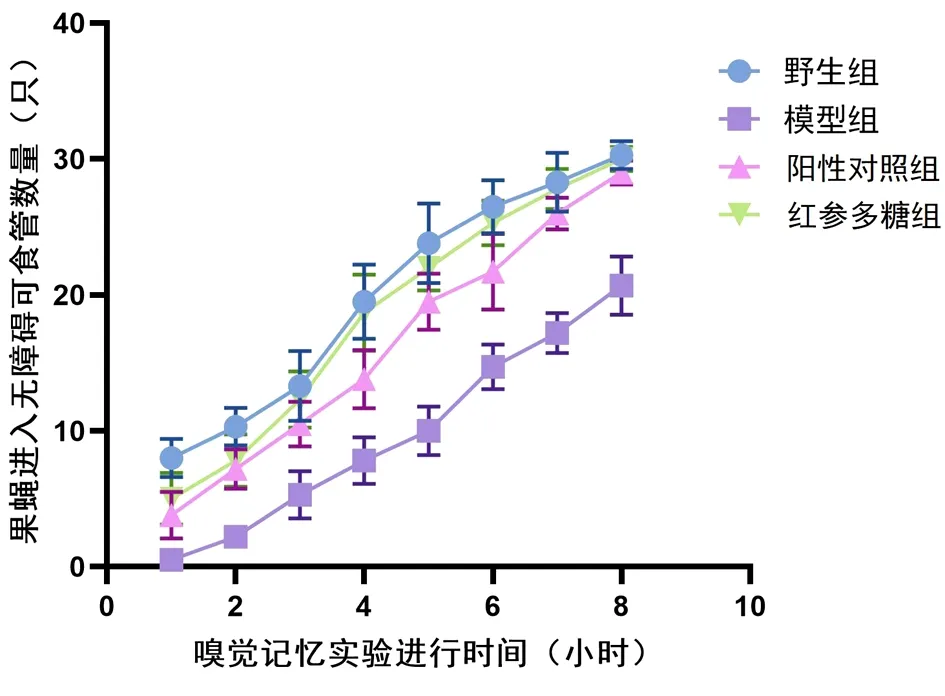
图1 不同给药组的Aβ42转基因果蝇各时段进入无障碍可食管的数量
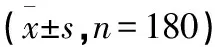
表2 红参多糖对Aβ42转基因果蝇嗅觉记忆的影响
2.3 红参多糖对Aβ42转基因果蝇脑组织Aβ1-42含量的影响 4组Aβ1-42差异有统计学意义(P<0.05或P<0.01)。与模型组比较,红参多糖组、阳性对照组果蝇脑组织Aβ1-42含量显著降低,差异有统计学意义(P<0.01),而红参多糖组与阳性对照组比较,差异无统计学意义(P>0.05)。见表3。
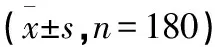
表3 红参多糖对Aβ42转基因果蝇脑组织Aβ1-42含量的影响
2.4 红参多糖对Aβ42转基因果蝇脑组织SOD活性和MDA含量的影响 与模型组比较,红参多糖组、阳性对照组SOD活性均显著升高,差异均有统计学意义(均P<0.01),而红参多糖组与阳性对照组比较,差异无统计学意义(P>0.05)。与模型组比较,红参多糖组、阳性对照组MDA含量显著降低,差异均有统计学意义(均P<0.01),而红参多糖组与阳性对照组比较,差异无统计学意义(P>0.05)。见表4。
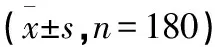
表4 红参多糖对Aβ42转基因果蝇脑组织SOD活性及MDA含量的影响
2.5 红参多糖对Aβ42转基因果蝇脑组织cAMP、AChE含量的影响 4组cAMP含量差异有统计学意义(P<0.05或P<0.01)。与模型组比较,红参多糖组、阳性对照组的cAMP、AChE含量均显著降低,差异有统计学意义(P<0.01),而红参多糖组与阳性对照组比较,差异无统计学意义(P>0.05)。见表5。
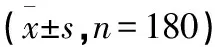
表5 红参多糖对Aβ42转基因果蝇脑组织cAMP、AChE含量的影响
3 讨论
神经元细胞外Aβ沉积是AD主要病理变化特征之一。脑脊液中其水平能够在一定程度上反映大脑中Aβ的沉积。Aβ根据C末端结构分为Aβ1-40和Aβ1-42形式,在脑组织、脑脊液和血液中均能检测出。因此,Aβ1-40、Aβ1-42是临床比较公认的AD诊断生物学标志物。其中,Aβ1-42是大脑中毒性较强、易于形成原纤维的一种沉积[10]。
SOD是一种抗氧化酶,可以清除自由基[11]。MDA是脂质发生过氧化反应产生的代谢产物,可作为机体脂质过氧化程度的指标[12]。大脑是耗氧最多、抗氧化酶较少的器官之一,导致其神经元清除自由基能力弱,不饱和脂肪酸更易氧化。此外,血脑屏障阻止了某些抗氧化剂通过。因此,大脑对氧化应激特别敏感,这是导致多种神经退行性疾病的主要原因[13-14]。氧化应激在AD各阶段均表现明显,氧化程度随疾病进展而增加[15]。因此,抗氧化可能是开发治疗或延缓AD治疗方法的有效途径。许海顺等[16]通过体外实验发现红参精制多糖具有一定的清除自由基及抗氧化作用。PENG等[8]发现在D-gal诱导的衰老小鼠中,红参较人参更能抑制AChE和MDA水平的升高,提高血清中SOD和过氧化氢酶(Catalase,CAT)的表达并改善脑组织结构和行为学实验,认为红参抗衰老活性优于人参可能是依赖于其中存在更多的非淀粉多糖。cAMP是影响神经细胞信号转导的因子,在果蝇学习记忆中心蘑菇体神经细胞中发挥重要作用,cAMP的上调会减少神经元的存活造成神经毒性以及认知功能下降。乙酰胆碱为一类能对各类胆碱受体发挥特异性作用的神经递质,AChE是乙酰胆碱的水解酶。当AChE水平下降时,脑内乙酰胆碱分解率降低,有利于神经信号的传导。所以AD认知功能受损伤程度与AChE含量负相关[17]。
中药多糖的抗AD作用取得了很大的进展,并得到了广泛关注。胡文继[18]发现猴头菌发酵菌丝体纯化多糖能够改善AD小鼠在行为学测试中的表现,可改善AD小鼠脑中的神经元损伤,且对其他脏器无不良反应,同时该多糖还减少了小鼠海马区的Aβ1-42的沉积和Tau蛋白的过度磷酸化。研究表明,碳水化合物在蛋白质折叠、分泌、生物大分子识别和相互作用等过程中发挥着重要作用。因此,它们影响细胞的生长和分化、形态发生、迁移和信号转导等[19]。从忍冬花中分离到的均质多糖LJW0F2,它能以剂量依赖性的方式抑制Aβ42的聚集,并减弱在SH-SY5Y神经母细胞瘤细胞中由Aβ42聚集诱导的细胞毒性[20]。
SHIN等[9]发现红参多糖显著减轻了5XFAD小鼠AD模型下丘细胞中Aβ的积累、神经炎症、神经元丢失和线粒体功能障碍,改善了Aβ处理的HT22细胞的线粒体缺陷。同时,红参多糖显著增加了健康和AD大脑中神经干细胞的成人海马神经发生,显著增加了HT22细胞的增殖,增强和恢复了AD小鼠的认知功能。其认为红参多糖参与老年大脑中枢神经系统组织维持的蛋白质的改变,并改善了AD的病理状况,认为红参多糖可能是衰老和AD治疗的潜在候选药物。
课题组前期实验发现,红参较人参有更好的防治AD作用,推测红参中多糖以及皂苷的变化可能是增强防治AD的活性基础[13]。以往对于红参的研究主要集中在皂苷上,尤其是稀有皂苷[21]。研究表明红参皂苷对衰老和年龄相关神经退行性疾病具有疗效,然而目前关于红参多糖在衰老和AD大脑中的治疗应用和可能的作用机制研究较少。课题组前期通过对红参中的多糖含量进行测定,发现其含量较高(约为30%)[22],且中药多糖对抗AD的作用取得了很大的进展,故开展本研究以探讨红参多糖对于AD的治疗作用。
本研究从果蝇攀爬能力实验,嗅觉记忆实验,果蝇脑组织Aβ1-42、SOD、MDA、cMAP及AChE的水平论证了红参多糖对于AD果蝇的治疗作用。实验结果表明,红参多糖可显著提高Aβ42转基因果蝇的CI以及进入无障碍可食管的数量。嗅觉短期记忆能力实验发现,果蝇可以凭借敏锐的嗅觉来辨认气味的方向,经过多次练习后,最后能趋向可以吃到的食物,避开不能吃到的食物。此外,红参多糖可降低果蝇脑组织Aβ1-42、MDA、cAMP、AChE的含量,提高果蝇脑组织SOD活性。由此得出,红参多糖对AD确有治疗作用,包括提高果蝇的运动能力、学习记忆能力、改善认知功能障碍。其作用机制可能与其改善果蝇脑组织Aβ蛋白沉积、抗氧化、改善神经细胞信号转导等方面有关,这一结论为红参的开发利用提供了又一可靠思路。
利益冲突声明:无。
