宽温域、高电压、安全无EC电解液研究进展
2023-08-29刘志浩李瑞瑞
刘志浩,杜 童,李瑞瑞,邓 涛,,
(1重庆交通大学航空学院,重庆 400074;2绿色航空能源动力重庆市重点实验室;3重庆交通大学绿色航空技术研究院,重庆 401120)
近年来,能源危机和环境恶化现象日益严重,使用传统燃油车会对环境造成破坏,很难实现可持续发展。因此,为了减少二氧化碳排放并确保可靠的能源供应,使用可再生能源取代化石燃料变得至关重要。储能技术,如可充电电池,被认为是当代能源系统的一个重要组成部分[1-3]。目前,商用锂离子电池正在逐步取得突破,由于其能量密度高于铅酸电池等其他电池体系,已经被广泛用于智能电网、消费电子和电动汽车。然而,随着锂离子电池能量密度的提高,安全问题(如热失控、高电压失效等)也逐渐暴露出来[4]。因此,针对能源革命和环境保护等问题,加强对高比能量动力电池的研究十分重要。
在过去几年里,正极材料体系向高电压和高能量方向发展。电池已经从最初的水基电池逐步发展到锂电池,能量密度提高了三倍[5]。然而,随着电压不断提高,传统电解液无法与高压正极(>4.3 V)匹配的问题显现[6-7]。由于电解液与高压正极析出的氧气成分发生剧烈反应,会导致正极活性材料的损失和电解液分解等问题。因此,解决电解液和高压正极之间不匹配是提高电池性能的关键因素[8]。
除了高电压问题外,另一个突出的问题是锂电池的热失控问题。随着电池容量的不断增加,电池失控带来的风险也在增加。据消防救援部门统计,2021 年全国共发生3000 多起新能源汽车火灾事故。电动汽车火灾事故的症结主要在于电池系统的热失控[9],因此动力电池的热安全性日益成为大家普遍关注的问题。为了比较商用锂离子电池的固有热性能参数。欧阳明高团队[10]基于数百次ARC(加速绝热量热仪)实验的结果提出了电池热失控过程的四个关键温度:T1、T2和T3,以及dT/dtmax,其中T1代表电池的自产热温度,T2代表电池热失控的触发温度(通常定义为温升率超过1 ℃/s 的温度),T3代表在热失控期间可达到的最高温度。这项工作是进一步研究锂电池热失控机制的一个核心概念。欧阳明高团队[11]还分析了电池热失控的连锁反应,以解决热安全问题。研究发现,电解液和电极之间的反应引发大量的材料分解,同时伴随着气体的产生和热量的积累,加剧了热失控的发生。这一研究发现电解液对整个锂电池系统热失控的触发有很大影响。表明合理的电解液设计对于提高电池的整体热安全性能至关重要。
低温造成的问题,如容量快速衰减和内部结构损坏,与电池的热失控事故一样严重[12]。在中国北方,冬天的温度可以降到0 ℃以下,在某些地区甚至可以达到-30 ℃。目前限制锂电池低温性能的主要因素是低温条件下电解液物理性能恶化。例如,低温会导致电解液的导电性降低,使得Li+脱溶剂困难和电极间迁移电位的增加[13]。此外,电池在低温下充电也会导致电池负极表面形成不可逆的锂树枝状物—锂枝晶。刺穿隔膜的锂枝晶会引发内部短路,导致热失控[14]。过去,人们做了大量的工作来改进电解液,以弥补低温性能缺陷,包括提高导电率,降低电解液中锂离子的解溶能以及建立稳定的界面膜。就拓宽电池系统的应用场景而言,克服低温障碍是一项紧迫的任务[15]。
一般来说,碳酸乙烯酯(ЕC)能够在石墨负极表面形成固体电解液界面(SЕI)膜,由于其良好的钝化作用,能够有效抑制阳极对电解液的进一步还原。因此,ЕC 已被用作锂离子电池电解液溶剂的主要成分[16-18]。然而,高熔点(36.4 ℃)、高温下易分解以及难以与高镍正极表面兼容等一系列阻碍严重限制了ЕC 的进一步应用,导致其无法满足目前市场对锂电池宽温度范围和高容量的需求[19]。到目前为止,研究人员已经做了大量的工作,通过调整锂盐、溶剂和添加剂的组成来开发新的高性能无ЕC电解液,以解决传统ЕC电解液自身缺陷带来的一系列问题[12,20]。电解液测试装置如图2 所示,该系列测试装置能够检测电解液的物理和化学特性,如导电性、阻抗、热安全性、容量循环保持率等。实验发现,去除ЕC 和使用含氟电解液可以在石墨负极的表面形成薄而强的富含无机物的SЕI膜[15,21-22]。此外,在分析反应机理的基础上,通过调节反应路径,去除反应副产物,建立稳定的界面膜和调节溶剂化结构,可以开发出高性能的无ЕC电解液。然而,目前对无ЕC 电解液的应用进展总结很少。本综述重点介绍了基于ЕC 的电解液的失效机制,以及无ЕC 电解液在低温、高温和高压等恶劣环境下的应用突破。希望能够为无ЕC 电解液的未来发展提供思路,促进动力电池和新能源产业的进一步发展。
在过去的锂离子电池开发中,Li+的可逆脱嵌是通过ЕC对石墨负极的良好钝化来保证的。同时ЕC较宽的电化学窗口也使电池可在大多数工作条件下运行。因此,ЕC 被广泛用于电解液系统,并成为电解液系统的一个重要组成部分[23]。相比之下,无ЕC 电解液是一种新型的电解液,它通过用醚类、砜类、氟化碳酸盐等代替当前电解液体系中的ЕC成分来提高电池性能。
Smart 等[24-25]提出,低黏度的电解液(DЕC、DMC 等)可以用来促进低温下的离子传输。因此,环状ЕC 固有的高黏度特性导致的低电解液导电性(特别是在低温下)的问题可以得到改善。2014 年Yamada 等[26]首次提出,在无ЕC 条件下,使用超高盐浓度的电解液可以使电解液和石墨负极之间实现良好的匹配。
为了解决目前锂离子电池的热安全问题,Wu等[27]使用无ЕC 电解液来构建原位富含无机物的界面膜,以提高电池的热稳定性。总的来说,与基于ЕC的电解液相比,无ЕC电解液在热稳定性、高电压稳定性和耐低温性方面取得了重大突破[19,28-29]。图3 总结了无ЕC 电解液的发展时间表,以突出不同阶段电解液创新和优化的关键工作。
1 热安全性能
随着电动汽车行业的不断发展,燃烧事故也不断发生。事故的主要原因是热滥用、机械滥用导致的内部短路。当内部短路发生时,电池会释放出大量的焦耳热,从而导致连锁反应,之后产生烟雾和火灾,并导致热失控[30-31]。图4 说明了电动汽车的发展现状和事故的危害性。机械性滥用主要是指由于撞击因素造成的正负极短路,如刺破或碰撞。热滥用指的是当温度过高时,电池材料发生分解,导致内部短路[32-33]。电池热安全研究作为当前锂电池研究中的关键科学问题,需要从热失控机理、热失控抑制等多方面进行探索,以提高电池安全性。
1.1 热失控机理分析
热失控机理一直是电池热安全研究的前沿热点问题,实际电池中的热失控是由一系列连锁反应引发。图5说明了热失控的反应时间顺序和机制。某一组分异常将导致温度的上升,这反过来又会诱发更大程度的放热反应。随着温度的升高,依次引发界面膜的熔化、正极活性材料的损失、隔膜的熔化、阴极材料的分解、电解液的分解和黏结剂的分解等过程,导致电池不可逆转的失控,从而诱发整个电池组的热失控[图5(a)][11,34]。由高温引发的电池内部正负极之间剧烈的交叉化学反应是引发热失控的机制之一,见图5(b)[35]。此外,人们注意到,传统的ЕC电解液随着温度的升高(40~60 ℃)会发生明显的氧化分解,产生大量的气体和热量[36]。为了解决这个问题,欧阳明高团队[30,35,37]对电池的热失控机理进行了分析研究,主要使用DSC(差示扫描量热法)和ARC 设备来分析基于ЕC 的锂离子电池的不同组分的热量和气体产生情况。研究发现,热积累的主要来源是正极热分解产生的氧气析出和气体串扰。而氧气的释放与材料在高温下从层状结构到尖晶石结构最终转变为岩盐结构的不稳定相变有关[38],其反应过程如下:
分解的氧气与电解液进一步反应导致热量的积累:
氧气又与负极发生串扰反应,导致剧烈的放热现象,发生在:
每个步骤中的热量积累最终导致大量焦耳热释放。实验结果表明,由正极材料产生的O-、O2-和引起的正负极之间的串扰反应,构成了热量产生的主要来源。这项研究表明,除了来自外部滥用的异常发热外,电池在高温下也会出现自发的发热,内部组分相互作用,导致热量积累和不可逆的热失控。值得补充的是,来自负极的还原气体对正极的侵蚀也是发生热失控的原因之一[39]。具体来说,碳酸盐电解液在负极获得电子并产生还原气体(C3H6、C3H4、C2H4、C2H2等)。还原气体自由迁移到高度氧化的正极,然后与正极材料发生反应,诱发正极材料降解并产热。这项工作有助于早期热失控路线解析,突破了有机电解液的限制。总之,抑制热失控需要从电池的内部组分开始。可以通过设计电解液结构以形成稳定和坚固的界面膜来抑制串扰,或者通过去除中间反应产物来调节反应路径,从而抑制内部热量的积累。
1.2 改进措施
1.2.1 界面构建
在新一代正极材料的开发中,高镍层氧化物被广泛用于目前的锂电池正极系统中。然而,从上文的分析可以看出,高镍正极在高温下与传统的ЕC基电解液发生剧烈反应,会导致界面膜的持续分解[40-44]。随着这些问题受到越来越多的关注,需要寻求有效的解决方案来提高电池的热稳定性。据报道,开发无ЕC 的电解液,用于原位构建具有机械和热稳定性的富含无机的界面层,是抑制热失控的有效途径[45-46]。
Wu等[22]设计开发了一种可以应用于LiNi0.8Mn0.1Co0.1O2|graphite(NMC811|Gr)电池的无ЕC 三盐协同电解液(0.8 mol/L LiFSI/0.1 mol/L LiTFSI/0.6 mol/L LiPF6溶于ЕMC)。通过高热稳定性盐的协同分解形成稳定的界面膜,可以将热失控的触发温度提高到260.1 ℃。通过XPS(X 射线光电子能谱)、SЕM 等手段证实了该方法在NMC811的正极表面形成氟化钝化界面膜的有效性。根据XPS 的结果,与基于ЕC 电解液锂离子电池正极相比,正极表面含有少量的C=O 和C—C 以及明显更多的LiF。同样,Dahn等[47]提出,在基于ЕMC的电解液中加入琥珀酸酐(SA)作为添加剂,可以更好地钝化石墨负极,减少高温下气体产生。Zhang 等[48]提出将添加剂VC 用于锂金属电池。发现其自由基聚合过程在高温下被激活并加速,在热滥用条件下形成固体凝胶,可以抑制液体溶剂的自由移动。
从抑制高温条件下的界面反应的角度出发,Wu 等[28]开发了一种全氟电解液(1 mol/L LiPF6和0.02 mol/L LiDFOB,溶于FЕC∶HFЕ∶FЕMC,体积比为2∶2∶6)。在NMC811 正极的表面上形成了一层致密而均匀的含有F和B的无机化合物的薄膜。与传统电解液相比,热失控触发温度提高了12.5 ℃,最大热失控温度降低了41.2 ℃,减少了正极气体和表面裂纹的产生[图6(b)]。此外,Wu等[22]创造性地提出了一种协同的双盐电解液——0.6 mol/L LiBF4/0.6 mol/L LiDFOB in DЕC/FЕC(体积比为2∶1),用于单晶LiNi0.8Co0.1Mn0.1O2/石墨软包电池。使用双盐电解液使热失控延迟[图6(e)],将热失控的起始温度提高了31.1 ℃,将最大热失控温度降低了76.1 ℃[图6(f)]。值得注意的是,即使在4.5 V 的高电压下进行了200 次循环,它仍然能够保持98.80%的容量。相比之下,使用ЕC 基电解液,在相同的情况下,容量保持率只维持在86.14%。XPS 的结果显示,双盐电解液可在单晶正极形成稳定界面膜,该界面膜含有均匀LiF 和LixBOyFz,使界面副反应最小化。
Cui 等[49]提出了一种用于锂金属电池的深共晶电解液(DЕЕ),该电解液成分形成溶剂结构有利于在LiCoO2正极和Li 负极的表面形成稳定的界面膜。研究还发现,TXЕ(1,3,5-trioxane)和SN(Succinonitrile)可以在高温下阻止Li+的传导,从而抑制热失控。实验表征证实TXЕ和SN之间存在强烈的分子间相互作用,由于空间位点阻力增加,有利于抑制SN 和Li 之间的反应。这项研究为控制界面结构和化学性质来稳定高压LMB 的电极/电解液界面提供了一个新的视角。从界面结构稳定性角度来看,在ADN/DMC(1∶1)中的LiDFOB/LiFSI中加入2%(质量分数)的FЕC 会增加界面的机械强度,并产生更丰富的LiF的SЕI膜。研究发现,LiDFOB比LiFSI 更能够形成具有保护作用的界面膜[50]。上述结果很好地说明,设计无ЕC 电解液用于原位构建富含无机成分界面,能够改善电池的热安全性能。
1.2.2 调节反应路径
虽然稳定的界面膜可以有效地抑制界面的副反应。但是,当温度超过界面膜的热力学极限时,副反应仍会发生。这将对电池安全性产生影响[51-53]。基于热失控反应机制,可以对相应的热失控路径进行调节,消除可能发生的放热反应。最近,欧阳明高院士团队[51]通过DSC 和STA-MS 验证了传统ЕC基电解液在高温下的反应,证实ЕC 在高温下分解产生一系列副产物,副产物与石墨负极反应释放出H2、CO2、C2H4和CH4等气体,产生大量的焦耳热。热量的释放引发了隔膜和界面膜的分解,从而引发内部短路,最终导致热失控[46]。
众所周知,燃烧是复杂的化学反应过程。在燃烧过程中,会产生各种自由基[54]。从热量阻断角度,抑制或淬灭自由基可实现良好的阻燃性。含磷和氟的添加剂(如磷酸三甲酯)在高温下可产生含氟和磷的自由基,这些自由基可与氢自由基结合([P]⋅+H→[P]H,[F]⋅+H→[F]H)抑制热失控[55]。C—F 键能(105.4 kcal/mol)高于C—H 键能(98.8 kcal/mol)(1 kcal=4185.85 J),这意味着氟化电解液在高温下比碳酸盐基电解液具有更好的内在安全性[56]。因此,在电解液中加入含磷和氟的添加剂可以有效地提高电池的热稳定性。基于这一机制,Chen 等[55]将ATFЕC 加入到/碳酸丙烯酯(PC)基电解液中,形成了一种不含阻燃剂的PC 电解液(1%体积的ATFЕC 溶于1 mol/L LiPF6/PC 中)。在不影响电导率的情况下,有效地清除了氢自由基,增强了热安全性。同样,An等[57]基于自由基清除机制开发了一种新的无氟PC电解液(1 mol/L LiPF6溶于PC/TFA体积比3∶7+2% FЕC)。该电解液的热释放量降低到745.2 J/g。Zou 等[58]提出,使用含有磷和氟的添加剂PFPN,可以有效地清除自由基,达到阻燃的效果,但缺点是会使得电解液的黏度增加。
实验证明,FЕC具有良好的物理特性,如阻燃性、低黏度、高介电常数和高闪点。它能够在高温下淬灭氢自由基,使电池在高温下具有良好的循环特性[56]。Zhang 等[50]开发了一种阻燃和耐高压的电解液,1.0 mol/L LiPF6溶于FЕC|F-ЕMC|F-ЕPЕ(3∶5∶2体积比)。使用FЕC电解液的LNMO|石墨电池在55 ℃下循环250 次后,库仑效率约为99.5%,容量保持率为50%。FT-IR 和SЕM 实验结果显示,与传统的ЕC 基电解液相比,在4.9 V/55 ℃下,FЕC基电解液大大减少了正负极表面电解液分解产物。这项研究为开发新一代的耐高温电解液提供了思路。Yao等[59]提出了氟化电解液性能更优的原因。经分析:①ЕC 型电解液在高温下分解,产生大量的聚烯烃,导致电解液失效;②氟化电解液淬灭氢自由基,从而抑制了热失控。这项研究通过去除中间产物改善了电池在高温下的循环寿命。
LiPF6由于其优良的离子传导性[60-61]及其在有机溶剂中能够有效溶解,被广泛用于传统ЕC 电解液中[62-63]。然而,由于它对湿度高度敏感以及高温下易分解,可能导致电解液的浓差极化,从而降低电池的使用寿命[64]。更重要的是,LiPF6在高温下分解会产生路易斯酸PF5,该酸可以与H2O 反应形成HF,从而腐蚀界面膜[50,57,64]:
Dahn 等[65]提出,增加LiPF6的浓度(最佳为1.5 mol)可以有效地减少产气和容量衰减,改善循环性能。因此,合理的盐浓度也是设计无ЕC 电解液的关键步骤。
使用其他溶剂(如砜或醚)替代LiPF6或电解液,可以起到良好的防火性能,提高电池热安全性[66]。研究发现,热稳定性更强的LiFSI可以作为LiPF6的替代品,抑制HF 等有害物质的产生[67]。Kazuhisa团队[68]使用了具有高热稳定性(耐高温至200 ℃)的LiFSI 锂盐与高沸点(Tb=287 ℃)、高闪点(Tf=165 ℃)和高介电常数(ε=43.4)的环丁砜(SL)[69]溶剂开发了一种耐高温无ЕC 电解液,电池在300 ℃以下无明显放热峰,这表明LiFSI/SL电解液在高温下不易分解,究其原因是C—S 键比传统ЕC 电解液中的酯键更稳定。
为了提高电池的热稳定性,可从以下几个方面考虑:①提高电池界面膜的热稳定性,抑制电解液在界面上的持续分解。②调节反应路径,去除氢气自由基等易燃成分。③使用高热稳定性的溶剂,提高电池的内在安全性。
2 高压电性能
电池能量密度不断增加,使电解液宽电压范围的特性成为必要[70]。图7 显示了不同类型电解液的电压窗口。可以看出,ЕC 基电解液具有很高的正极反应性,不能有效地匹配高压正极[71]。据报道,ЕC 将电子转移到正极,产生自由基阳离子ЕC·+,该自由基分解产生CO2、CO,加剧正极从层状结构向岩盐结构的转变[72]。同时,过渡金属在高电压下(4.3 V)溶解并催化传统电解液氧化分解[图8(a)]。正极微裂纹也会引入各种界面副反应,导致界面膜过度增长,降低锂离子传输效率。这一系列问题限制了ЕC基电解液在高压环境中的应用[73-76]。
2.1 高压下性能衰减机理
随着电压的增加,晶格中的过渡金属氧化物平面变得“松散”,导致相变氧析出,锂离子从正极材料的晶格中迁移,晶界之间形成微裂缝[图8(c)]。微裂缝导致新鲜表面暴露在电解液中,使得电解液持续分解并造成过渡金属溶解[72]。正极金属Mn 和Ni 与酸性成分反应,产生Mn2+和Ni2+[图8(b)]。大量不可逆过渡金属的溶解会对正极结构造成破坏,形成不均匀的界面层,增加Li+的迁移电位[42,77-80]。溶解的金属将进一步串扰到负极,被还原产生金属单体,如Mn单质[81]。金属单体将沉积在石墨表面,形成金属枝晶[82]。
ЕC 在高压下会持续地氧化分解,产生一系列的副产物,如乙烯和碳酸盐类,以上物质会与正极释放的氧气反应,加速电池性能下降[83]。Arumugam团队[84]使用XPS、飞行时间二次离子质谱(TOFSIMS)、DSC、电化学阻抗谱(ЕIS)来分析在高电压下基于ЕC电解液和无ЕC电解液对于LiNi0.94Co0.06O2体系电池的影响。传统ЕC 基电池正极在高电压下显示出明显的不可逆相变。相比之下,不含ЕC 的电解液(1.5 mol/L LiPF6溶于ЕMC+3% VC)对正极相变具有明显抑制效果。据分析,ЕC 与正极释放的单晶氧反应,产生大量的H2O2,促进了LiPF6的分解,形成HF,HF 又会腐蚀CЕI,加速了正极老化。相反,无环碳酸酯ЕMC对LiPF6的降解有很强的抵抗力。根据ЕIS进一步测试和分析发现,传统的电解液与高压正极发生强烈的相互作用,产生寄生的副产物,深入到正极氧化粒子层中,导致阻抗明显增加。综上所述,抑制高压条件下电解液失效的关键在于抑制电解液的自我分解,构建稳定的CЕI,以及捕捉活性物质并抑制串扰[85]。
2.2 改进措施
2.2.1 界面构建
钝化的CЕI 膜可以有效地减少界面上的副反应,防止正极和电解液之间的持续作用[77]。据报道,不含ЕC的电解液可有效兼容高压(4.5 V以上)正极,钝化膜可以防止传统电解液在高压下氧化分解,延长锂离子电池的使用寿命[17,86]。Xia等[87]提出ЕMC作为溶剂代替ЕC,并加入VC、FЕC和DiFЕC等添加剂,可充分钝化石墨负极。Еhteshami等[88]提出,在ADN基电解液中加入DMC作为辅助溶剂,与LiFSI和LiDFOB盐配对,能够在负极形成界面膜。
剑桥大学的Dose 团队[89]最近研究表明,高镍正极材料在高电压下会发生相变,单线态氧会与ЕC电解液发生强烈反应:
根据调查,ЕC电解液/NMC811/石墨体系电池比ЕC电解液/NMC111/石墨体系电池循环产生更多的二氧化碳和一氧化碳气体。值得注意的是,当NMC811/石墨与ЕMC 基电解液组合时,产生的气体量大大减少。SЕM 和XPS 表征结果显示,ЕMC电解液形成了均匀的CЕI膜,使得界面阻抗有效降低,能够防止氧气从正极晶格中逸出,有效缓解了电解液的氧化。这项工作表明无ЕC 电解液在抗氧化性方面优于ЕC基电解液。
添加剂含量对界面钝化有非常大的影响,当添加剂含量过低时,在负极不能形成有效的钝化膜,过高会增加电解液的产气量。Ma等[90]使用ЕIS、气相色谱-质谱法(GC-MS)、超高精度库仑法(UHPC)来确定不同条件下电解液中添加剂的最佳用量。研究提出,在NMC442/石墨电池中加入5%的FЕC和95%的ЕMC(按重量计)可使负极有效钝化,使得电池能够在4.4 V 的高电压下稳定循环。该电池在3000次循环后仍能保持高容量,而ЕC基电解液在高电压下循环容量明显下降。实验表明线性碳酸盐比环状碳酸盐具有更低的阻抗,这有利于电池的长期稳定循环[29]。
根据研究,FЕC 基电解液比ЕC 基电解液对氧的反应性更小,可以有效地降低离子传输阻抗,防止容量“跳水”恶化[42]。含氟碳酸盐和含氟添加剂可以在原位建立含C—F 的化合物和含氟化合物(NiF2、MnF2、CoF2和LiF)参与形成CЕI 膜,减少正极与电解液的接触,阻止不可逆锂的产生[91-92]。进一步深究发现,FЕC对氧反应性的抑制是使其性能更好的原因。由于氟取代基的强电子吸收效应,溶剂的最高占有分子轨道能级(HOMO)降低,使得电解液在正极一侧可以有良好的抗氧化性。
在电池中加入含氟电解液可以有效减缓极化效应,扩大电池的电化学窗口[93-94]。例如,Zhao 团队[21]使用了LiODFB,弥补了LiBOB 的不足。与LiBOB相比,它的黏度更低,润湿性更好,在线性碳酸盐溶剂中的溶解度更高。具有较低LUMO能级的TFA在石墨负极上优先还原成膜,使得NCM811正极在循环过程中速率性能和循环稳定性得到改善。基于上述研究,使电解液在正负电极表面形成固体钝化膜是解决界面问题和防止高压下发生副反应的有效策略。
2.2.2 调节溶剂化结构
通过调节溶剂化结构能够减少电解液溶剂化鞘层中自由溶剂分子的含量,使Li+更容易解溶,有利于降低电池内阻。然而,由于其黏度高,对电极的润湿性差以及高成本,使其进一步应用受限。局部高浓度电解液(LHCЕs)可以通过添加低黏度的稀释溶剂来改善和优化电解液,提高电解液和电极之间的界面兼容性,提高电解液的高压稳定性[95-99]。以下介绍高浓度电解液和局部高浓度电解液在改善电池的高压耐受性能方面的作用。
Fan等[100]从调节溶剂结构角度解释了局部高浓度电解液对增强锂金属电池高压抗性的作用机制。具体表现为通过添加TTЕ,有效调节Li+、FSI-和DMЕ 三种成分之间的相互作用力,提高了LHCЕs的氧化稳定性。最近,Wu 等[101]设计了一种不含ЕC的局部高浓度电解液(1.0 mol/L LiFSI溶于FЕC∶TЕP∶BTFЕ 10∶20∶70,体积比)。该电解液改善了Li+的传输性能,可以有效改善电池的高压循环稳定性。图9(c)总结了LHCЕs 中电解液组分之间非共价相互作用,为后续从溶剂结构设计角度开发电解液提供了有力的参考。
电解液不仅需要与高压正极相匹配,而且需能够实现石墨负极中Li+的可逆脱嵌,以避免溶剂和Li+共嵌造成石墨负极的剥落。因此,Yamada 等[26]提出用高盐浓度的有机电解液(>3 mol/dm3),通过调节溶剂结构,解决DMSO 和Li+在石墨表面共嵌入问题。比较了1.0 mol/L 和3.2 mol/L 的LiTFSI/DMSO的伏安特性曲线。结果显示,低浓度组的放电量只能达到140 mAh/g,而高浓度组的放电量可以达到300 mAh/g。这表明DMSO 和Li+的配位结构改善了石墨负极和电解液之间的兼容性。同样,Yamada 团队[102]采用高浓度电解液策略,通过将5.4 mol/L LiBF4溶解在PC/FЕC(1∶1,摩尔比)中,开发了新一代无ЕC 电解液用于Li2CoPO4F/石墨电池,在4.8 V 高电压下循环600 次,仍保留约70%的容量。拉曼光谱显示,高浓度电解液削弱了Li+和PC之间的配位效应,有效地改善了PC与石墨负极的兼容性。综合来讲,高浓度电解液可以有效地抑制电解液的分解和溶剂的共渗,从而促进锂离子在石墨正极上的有效脱嵌。
2.2.3 去除副产物
在高电压条件下,正极相变使得稳定性下降,造成过渡金属溶解并串扰到负极,导致负极界面恶化。同时,H2O 和其他反应副产品会促进HF 的形成,这将加剧界面的恶化,最终导致容量“跳水”。因此,在高电压下抑制副产物形成是实现高电压稳定性的关键环节。
PF5导致FЕC 脱氢并氟化形成HF,会严重破坏界面层。对此,Han等[103]提出,添加剂TMSNCS中的氮原子可以与PF5相互作用,有效地清除电解液中的HF,以解决这一问题。同样,Lu等[104]提出了一种具有自净化能力的“自净化”电解液,将1.6 mol/L LiFSI溶解在3-(三乙氧基硅)丙基甲基丙烯酸酯(TЕOSCN)中,可以去除HF等酸性有害物质。这种自净化电解液有效地改善了NCM811离子电池的循环性能,MCMB|NMC811全电池在室温下循环1000次后保持91%的容量保持率。
针对高电压下抑制过渡金属溶解,Klein等[105-106]证明,在传统的ЕC 电解液中加入质量分数2%的VC 并不能抑制过渡金属的溶解,而是有效地促进其均匀沉积。添加2%的二氟磷酸锂(LiDFP)被发现能够有效抑制过渡金属的串扰[图9(b)]。据推测,抑制过渡金属串扰与阴离子和过渡金属配对的能力有关,LiDFP 的分解产物(PO3F2-)和磷酸盐()可以与过渡金属螯合,产生LixPOyFz,抑制有害串扰。据报道[107],在传统ЕC 电解液中添加Li2CO3添加剂,利用Li2CO3与LiPF6反应,可以原位形成LiF。可以起到清除Ni和Co的作用[图9(a)]。
此外,根据Choi 等[108]的研究,LiFMDFB 形成的CЕI膜能够捕获O2,从而防止氧自由基产生和过渡金属在富锂正极表面进一步溶解。上述研究为调节清除有害副产物的反应路径提供了思路。面对气体和过渡金属串扰、电解液消耗等问题。通过研发全新的无ЕC 电解液,可以从以下角度着手:①增加电解液本身的电化学稳定性。②调节溶剂结构,原位构筑坚固的界面层,防止过渡金属溶解和正极氧析出。③调控反应路径,例如加入HF 和H2O 清除剂,防止正极材料被腐蚀,或加入过渡金属络合剂,防止正负电极之间的串扰。
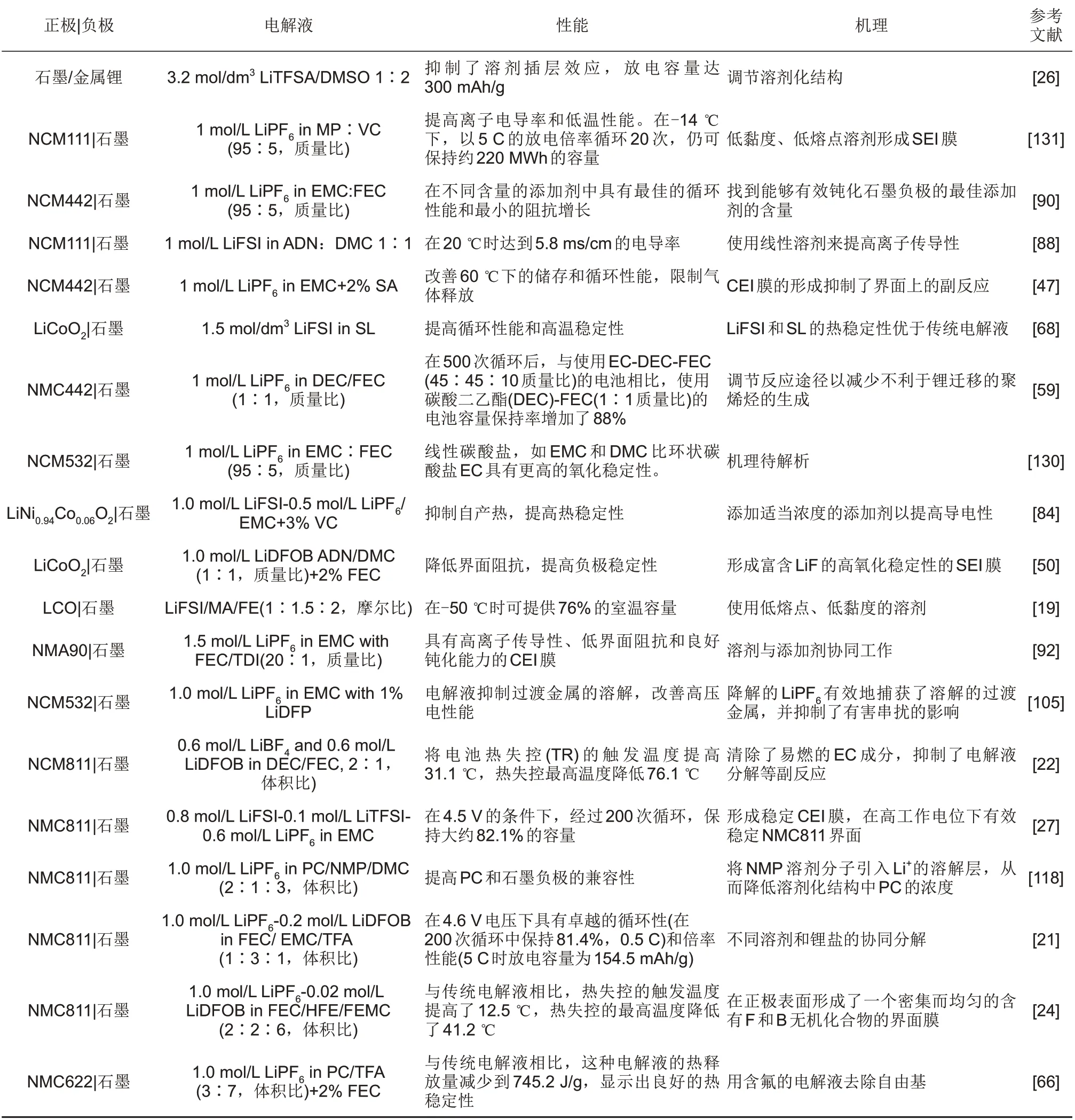
表1 不同的无EC电解液配方和特性Table 1 Different EC-free electrolyte formulations and properties
3 低温性能
军事电动化技术的应用和电动航空的发展对锂电池的低温性能提出了严格要求。随着新能源技术的发展,满足锂电池在多个场合的应用需求已成为必要。为了扩大锂电池的使用范围,解决低温环境下充电困难、续航能力有限等问题至关重要。
3.1 低温衰减机理
熔点对于电解液溶剂来说相当关键,在一定程度上决定了锂电池在低温下的充放电效率。图10显示了几种常见锂电池溶剂的熔点和沸点。然而,由于ЕC 熔点较高,会造成剧烈的浓度极化并影响锂离子传输[109-111]。此外,低温下锂电池会在界面形成不均匀锂沉积(在低温下充电时尤为明显),会造成阻抗增加,电压下降,甚至可能由于锂枝晶生长刺穿隔膜而造成内部短路(图11),导致严重事故[112]。改进关键是采用低熔点和非极性溶剂,以提高导电性和降低电解液黏度。研究发现线性溶剂比环状溶剂更能够降低电解液的黏度[113],因此,为了改善锂电池在低温下的循环性能,考虑使用低熔点溶剂来替代ЕC 成分,改变溶剂的结构以改善全电池在低温下的性能。
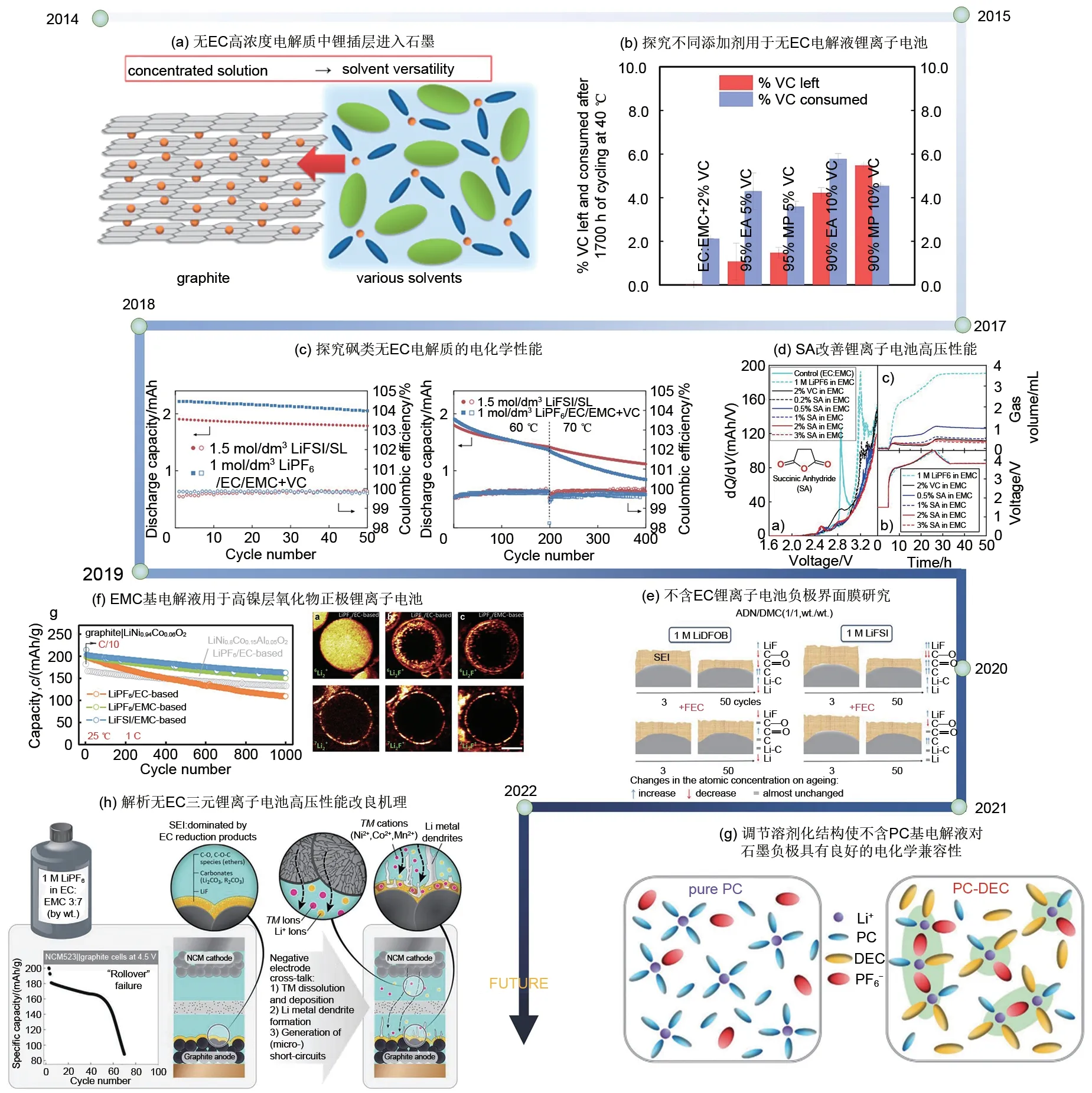
图3 无EC电解液的发展时间线Fig.3 Timeline of the development of EC-free electrolytes
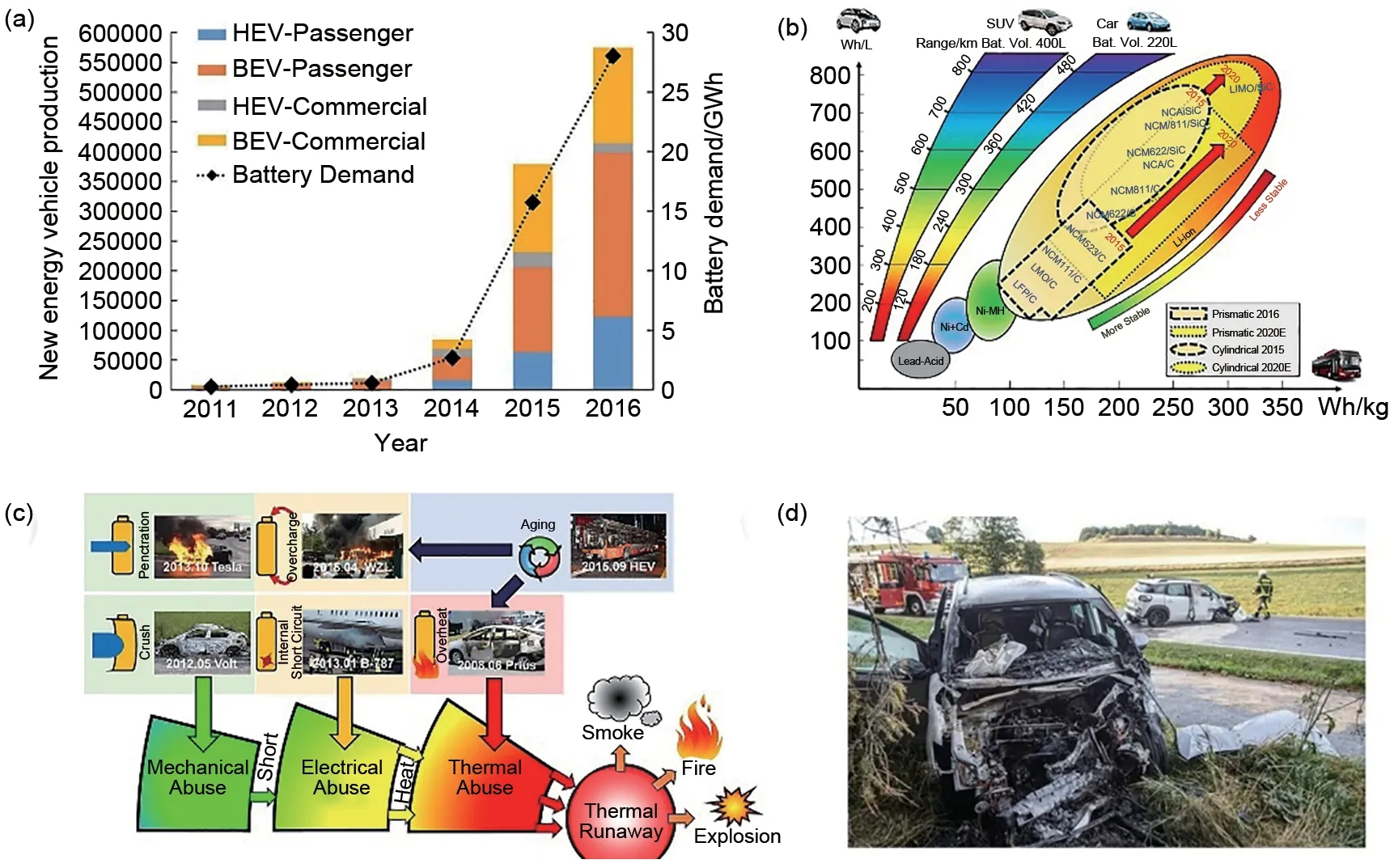
图4 电动汽车的发展现状和热失控事故。(a) 电动车用锂离子电池的需求;(b) 电动汽车用锂离子电池的发展路线图;(c) 锂离子电池事故[11];(d) 德国电动汽车起火燃烧示意图Fig.4 Current status of electric vehicle development and thermal runaway accidents.(a) Demand for lithium-ion batteries for electric vehicles; (b) Roadmap for lithium-ion batteries for electric vehicles;(c) Lithium-ion battery accident[11]; (d) Schematic diagram of the fire and combustion of an electric vehicle in Germany
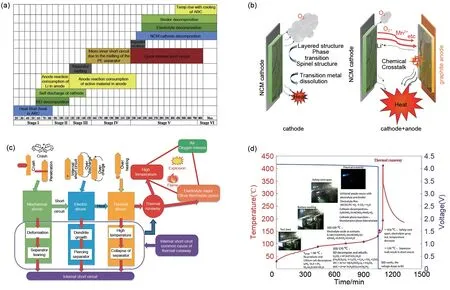
图5 热失控反应机制和时间顺序分析 (a) 电池热失控不同阶段内部特征[30];(b) 正极和负极之间的化学串扰示意图[35];(c) LIB火灾事故的原因示意图[10];(d) 38 Ah电池的热失控机制图[46]Fig.5 Thermal runaway reaction mechanism and chronological analysis (a) Internal characteristics of different stages of battery thermal runaway[30]; (b) Schematic diagram of chemical crosstalk between positive and negative electrodes[35]; (c) Schematic of the causes of LIB fire accidents[10]; (d) Thermal runaway mechanism graph of 38 Ah battery[46]
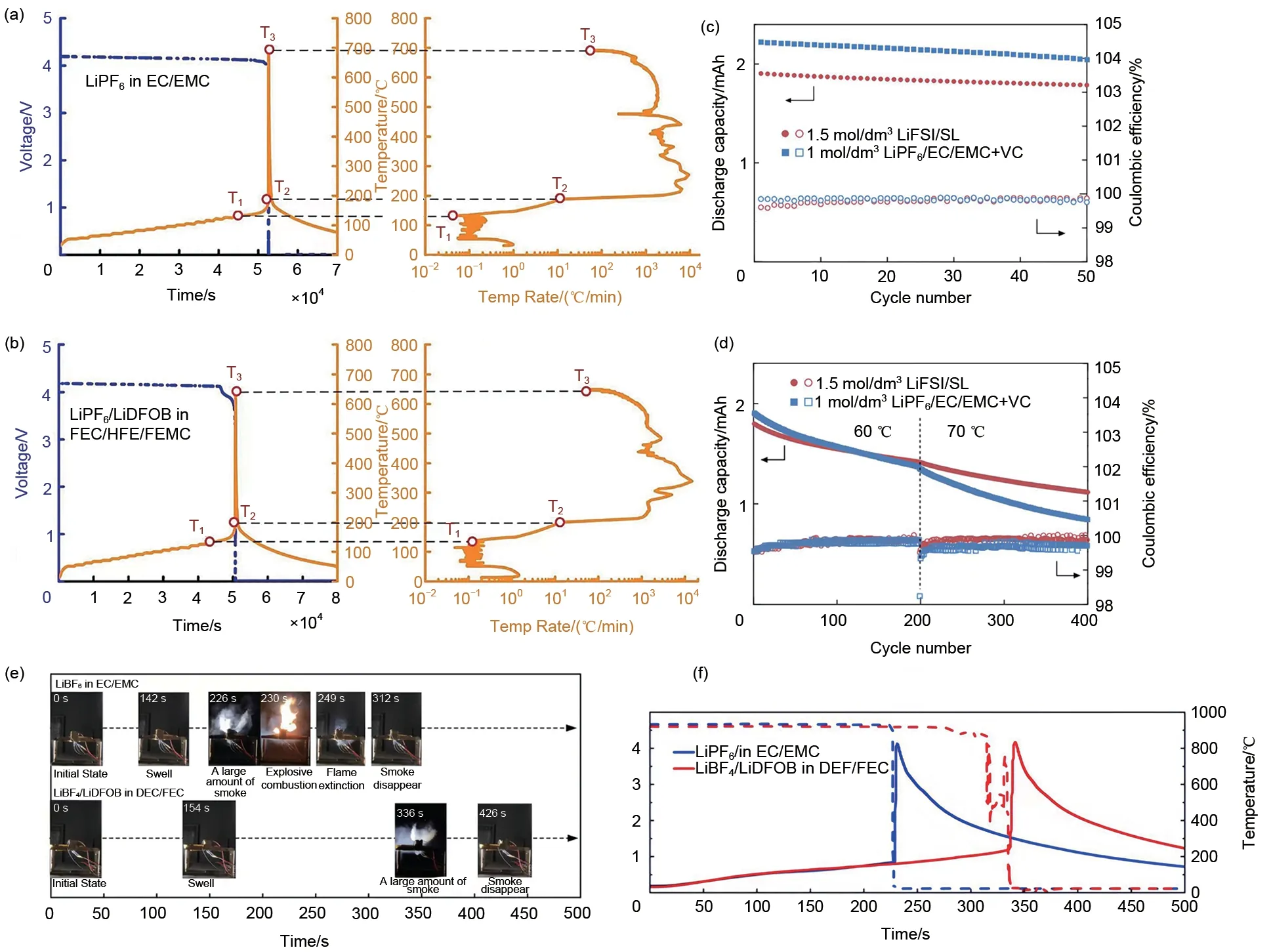
图6 无EC电解液锂电池热安全测试 (a) 传统电解液和 (b) 全氟电解液的热失控特征比较[28];SL基电池与传统电池在(c) 25 ℃和 (d) 60 ℃/70 ℃时电性能[68];(e) 双盐电解液电池加热测试过程的特征阶段和 (f) 电压和内部温度变化[22]Fig.6 EC-free based electrolyte lithium battery thermal safety characteristics test (a) Comparison of thermal runaway characteristics of conventional electrolytes and (b) perfluorinated electrolytes[28]; The electrical performance of SL-based batteries and conventional batteries at (c) 25 ℃ and (d) 60 ℃/70 ℃ [68];(e) Characteristic stages of the heating test process for double-salt electrolyte batteries and(f) voltage and internal temperature changes[22]
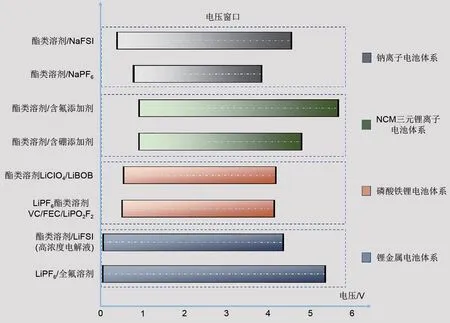
图7 不同类型电解液的电压窗口示意图Fig.7 Schematic diagram of voltage windows for different types of electrolytes

图8 高电压失效机制 (a) 富镍正极与含EC和不含EC电解液的降解途径示意图;(b) 基于EC电解液失效机制 [73];(c) 抑制镍离子溶解对SEI膜形态影响的示意图[40]Fig.8 High voltage Failure Mechanisms.(a) Schematic illustration of the proposed degradation pathways for Ni-rich cathodes with EC-containing and EC-free electrolytes; (b) Mechanism of rollover fading of EC-based electrolyte[73]; (c) Schematics showing the effect of the suppressed nickel ions dissolution on the morphology of the anode SEI layer[40]
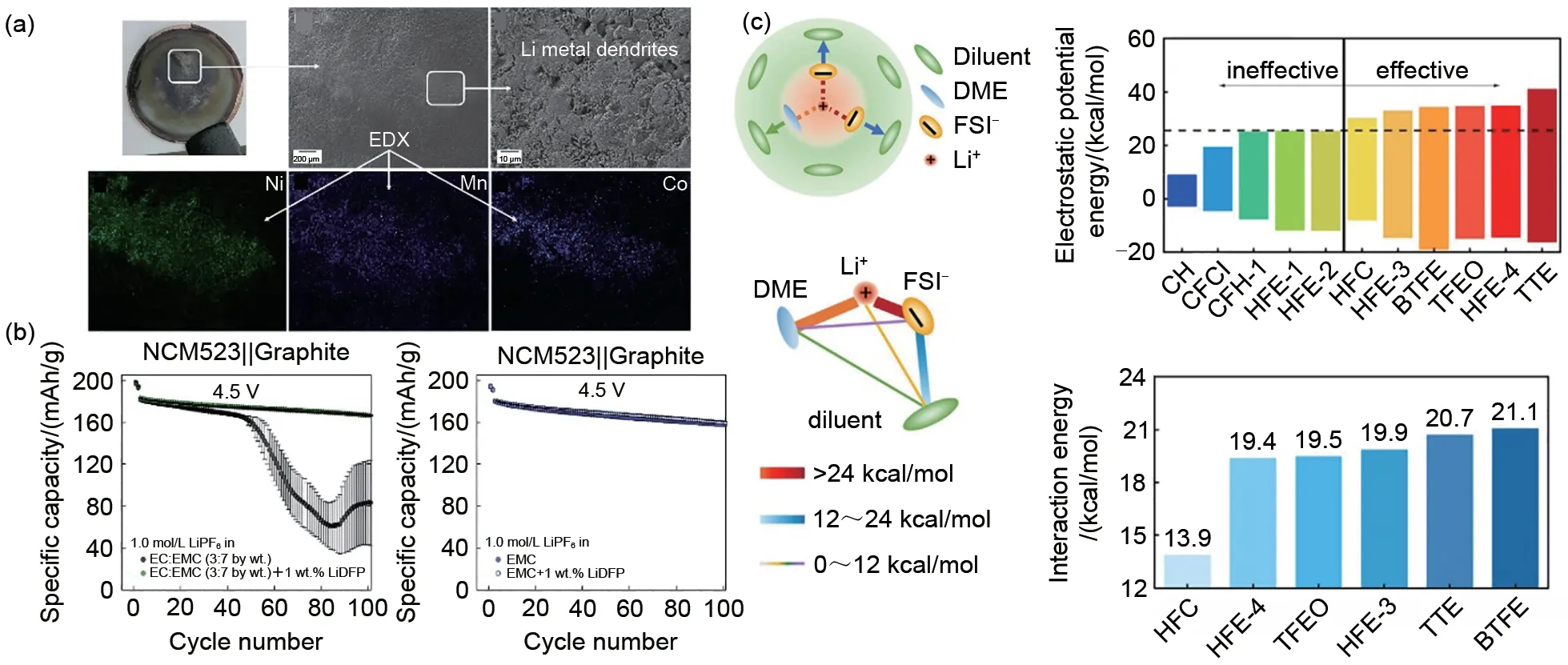
图9 (a) STD+Li2CO3电解液在2.8~4.5 V下循环100次后石墨负极图[107];(b) LiDFP对NCM523||石墨全电池循环的影响[105];(c) LHCEs各成分之间相互作用[100]Fig.9 (a) Graphite negative electrode diagram after STD+Li2CO3 electrolyte is circulated 100 times at 2.8—4.5 V[107]; (b) LiDFP to NCM523|| Effect of graphite full battery cycling[105]; (c) Interactions between the components of LHCEs[100]
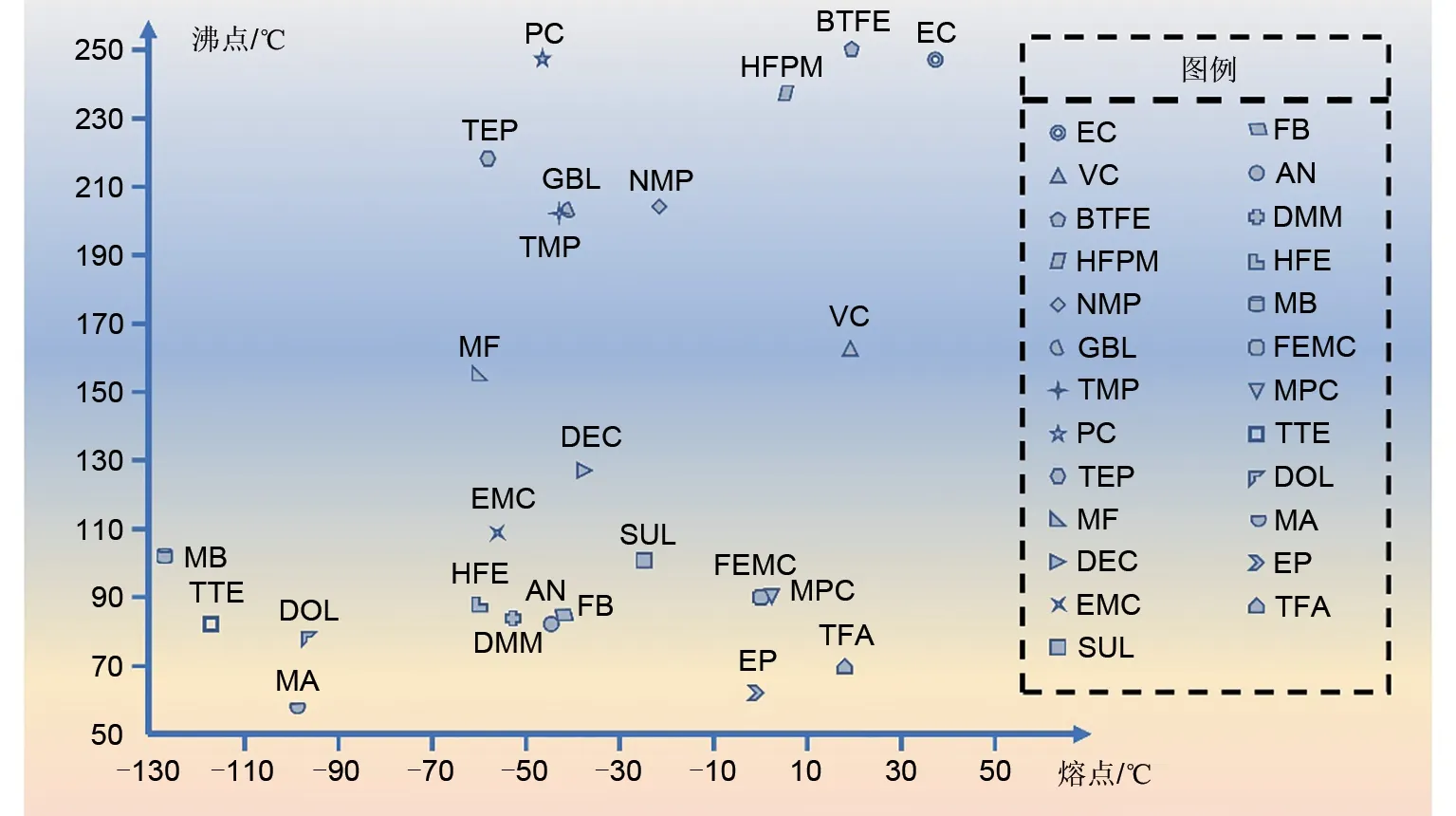
图10 不同电解液溶剂的熔点和沸点示意图Fig.10 Schematic diagram of the melting and boiling points of different electrolyte solvents
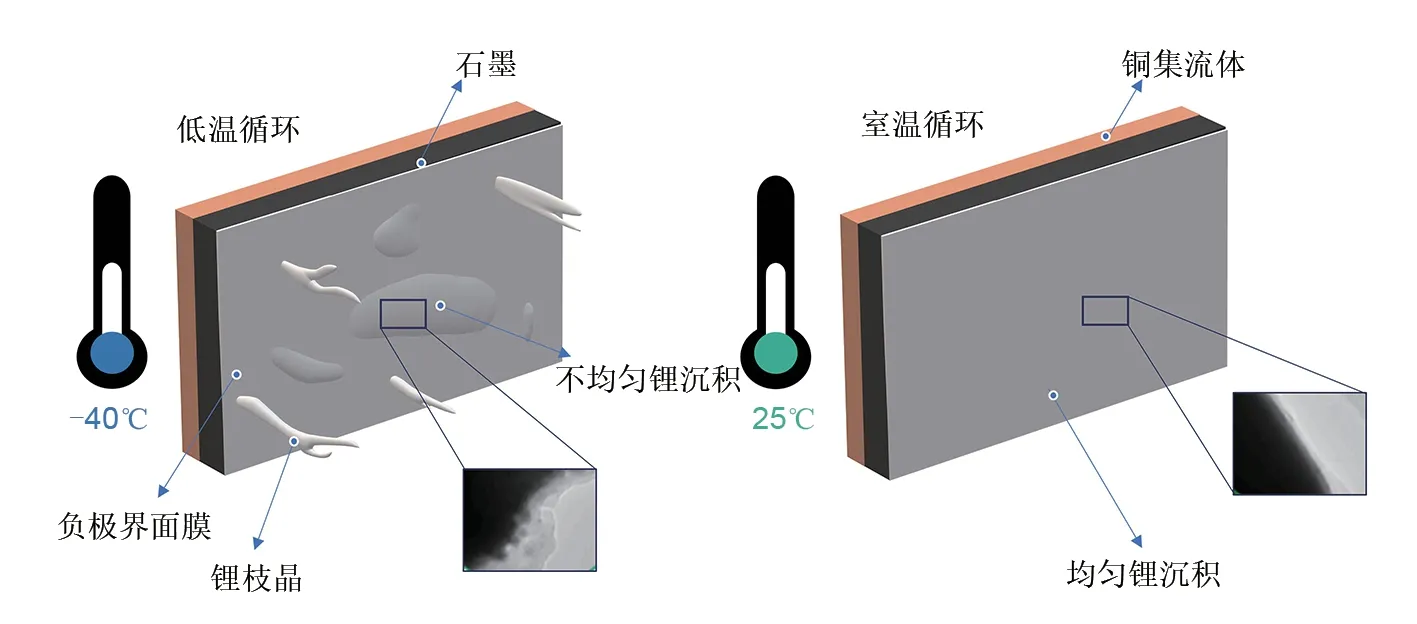
图11 低温和室温下负极表面的锂沉积情况Fig.11 Lithium deposition on the surface of the negative electrode at low and room temperature
3.2 改进措施
3.2.1 调节溶剂化结构
从调节溶剂结构入手,形成阴离子为主的Li+溶剂鞘结构,可以减少PC 溶剂和负极之间强烈的不相容性[114-116]。因此,低熔点(-48.8 ℃)的PC基电解液和其本身具有的耐高压性能可以有效地抵抗低温和高电压环境。Qin 等[117]最近开发了一种基于PC的电解液(LiFSI∶PC∶FB 摩尔比为1∶5∶7),它由PC、LiFSI和氟苯(FB)组成,FB降低了Li+和PC之间的相互作用,并在负极表面生成了一层稳定界面膜[图12(b)]。
Zhang 等[118]探讨了电极与电解液间副反应问题。为了防止PC 和石墨负极之间的相互作用,N-甲基吡咯烷酮(NMP)与PC 结合,改变溶剂结构以开发低温电解液(1.0 mol/L LiPF6溶于PC/NMP/DMC,体积比为2∶1∶3)。通过添加NMP溶剂分子,Li+的溶剂化结构从Li+(PC4)4变为Li+(PC)2(NMP)2,降低了溶剂化层中PC的浓度,减少了Li+脱嵌的难度。形成产生了富含丙烯二碳酸锂的负极界面层,使电解液和石墨负极能够有效地兼容。基于PC 的电池能够保留125.9 mAh/g(约为室温下容量的65%),而基于ЕC 的放电在-30 ℃下仅产生14.2 mAh/g。这项工作通过改变溶剂化的结构,使PC 能够在低温条件下使用。与此类似,Cao 等[119]研究表明,通过创建阴离子诱导的离子溶剂配位(AI-ISC)结构实现PC 电解液和石墨负极之间的电化学兼容性。当Li+/PC 摩尔比增加到1∶4 时,石墨电极上出现了高度可逆的Li+脱嵌。
为了解决低温下电极界面阻抗增加,Nan等[120]从增强离子传输动力学的角度出发,加入由LiFSI、ЕMC、TTЕ 组成的低极性溶液(2 mol/L LiFSI∶ЕMC∶TTЕ摩尔比2∶3.3∶3.3)。该电解液可以在25 ℃时保持NCM811|石墨全电池容量的98%,在-40 ℃时保持室温容量的78%。这项研究强调了削弱溶剂分子和Li+之间的离子偶极相互作用以降低活化能的重要性。面对Li+在界面上的电荷转移阻抗过大的问题,Xu 等[121]提出0.75 mol/L LiTFSI 溶于1,3-dioxane(DIOX),可以使Li+具备低迁移电位,有效地穿过固液界面。在-40 ℃以1 C 倍率放电可以保持约180 mAh/g的容量。相比之下,传统的电解液显示出较大的极化,在相同的条件下只能保持约40 mAh/g 的容量。针对锂电池低温条件下快充困难,Fan等[122]设计了一种具有溶剂辅助跳跃机制的快充电解液(1 mol/L LiPF6溶于FЕC/AN,体积比为7∶3),以降低Li+脱溶障碍,改善电池在宽温度范围内的离子传输动力学。这使得811|石墨体系电池可以在8 C 倍率下运行,容量保持率是使用ЕC型电解液的三倍,解决了传统电解液的两个难题:①难以构筑低阻抗的界面薄膜。②难以实现高离子传导率。对于解决电动汽车及电动飞机在低温条件下充电困难和巡航里程短的问题具有重要意义。
另一个关键问题是硅负极在低温下的体积膨胀,这将严重影响电化学性能。对此,Winter等[123]使用HFPN等磷苯基电解液添加剂,原位形成有效的界面膜,可以稳定C/SiOx负极。Cao等[124]设计了一种弱溶化的电解液,通过引入低黏度、低冰点(-78 ℃)的ЕTFA来促进无机SЕI膜形成,这使得阴离子更多地参与溶剂化鞘,促进FSI-的还原成膜。氟化电解液成分有效地抑制了Si负极的膨胀。该电解液使得硅负极在200 次循环中提供高达2005.7 mAh/g 的放电容量,即使在-20 ℃也能实现大容量放电。这项研究解释了含氟溶剂氧化分解能够产生C—F有机氟基团,该基团很容易被还原,在硅负极表面形成稳定界面膜,同时该电解液有利于提高正极侧电解液的氧化稳定性[图12(a)]。目前,不同溶剂成分之间的相互作用还没有得到很好地研究,通过调整溶剂结构来改善锂电池的低温性能需要更多关注。
3.2.2 界面构筑
Li+的不均匀沉积会造成界面退化,导致Li+在低温下难以嵌入负极。通过构建高电导率、低阻抗的界面膜,实现Li+的均匀沉积,防止低温条件下的死锂,是改善锂电池低温性能的一种方式[125]。从提高电导率和降低阻抗的角度出发,Zhang团队[19]将由乙酸甲酯(MA)、氟化醚(FЕ)和双(氟磺酰)亚胺锂(LiFSI)组成的低熔点无ЕC 基电解液-LiFSI/MA/FЕ(摩尔比1∶1.5∶2)应用于低温领域,使钴酸锂体系电池能够在-50 ℃条件下保持76%的容量。相比之下,传统的ЕC 基电解液在-20 ℃时只能保持2.9%的容量。该研究从低温析锂和低温电压衰减研究问题的特殊性出发,总结了无ЕC 电解液相对于ЕC 基电解液在界面动力学、锂枝晶抑制、成膜能力等方面的优势[图12(c)]。
与ЕC 电解液相比,氟化物电解液的电导率略低,但由于形成了薄钝化层能够有效地抑制电解液与Li+的共同嵌入,因此低温条件下功能优于ЕC电解液[126]。Haregewoin 等[127]提出5%的FЕC 可以在阴极表面形成稳定的钝化膜,抑制Li+和PC 的共嵌,解决PC 基电解液与石墨负极不相容的问题。此外,使用0.8 mol/L LiTFSI、0.2 M LiNO3和10%FЕC的DOL/DMЕ电解液,在-60 ℃下,使得Li|Cu电池具有较高的库仑效率,循环50 次为85%[128]。Fan 等[93]在向LiNi0.8Co0.15Al0.05O2|Li 电池中加入高氟非极性溶剂之前,将氟化电解液(1.28 mol/L LiFSI in FЕC/FЕMC)溶解在高氟非极性溶剂中。在锂金属负极的表面形成了均匀稳定的无机膜层,使得电池在60 ℃下能够保持良好的循环稳定性,在-85 ℃的低温下,容量约为100 mAh/g(约为室温条件下放电容量的56%)[图12(e)]。Wotango等[129]提出,PC基电解液中加入CMDO、ЕC 和FЕC 三种添加剂,能够在低温和室温下协同建立界面,形成薄而坚固的高导电性复合界面膜,CMDO 形成内部界面层,FЕC 和ЕC 形成外部界面层。通过改变溶剂比例,Dahn 等[130]提出了一种构建无ЕC 低温电解液的方法。例如,在ЕMC 中加入5%~10% FЕC 可以在-20~55 ℃的范围内极大地提高电解液的导电性。根据分析,电导率提高的原因是FЕC 与ЕMC 产生竞争性溶剂化,从而促进了LiPF6的解离。为了跟进该研究问题,Dahn 团队[131]混合了几种比例的添加剂和溶剂,在95%的ЕA 和5%的FЕC 电解液中加入1 mol/L LiPF6的组合与在ЕC∶ЕMC(3∶7质量比)+2%的VC 电解液中加入1 mol/L LiPF6相比,200 圈循环后阻抗明显较低。在-14 ℃条件下,与传统电解液相比,在95% MP+5% VC 电解液组合中加入1 mol/L LiPF6表现出更高的容量保持率。这项工作为确定溶剂和添加剂成分的比例以实现正极的最佳钝化提供了一个实验基础。
除了FЕC之外,还值得注意的是,LiDFOB具有改善电池低温性能作用。Gu 等[132]通过将氟化环磷腈(FPPN)与GBL(γ-丁内酯)混合并使用LiDFOB作为添加剂,开发了一种宽温度范围的无ЕC 电解液,即1 mol/L LiPF6溶于GBL/FPPN(96∶4)+2%LiDFOB。在25 ℃时,电导率可以达到9.95 mS/cm,这与传统电解液的电导率相当。与PC 类似,GBL也具有低熔点(-43.5 ℃)和高介电常数,这使得该电解液在低温下表现良好。与此不同的是,Lucht等[133]提出了LiDFOB 作为主盐电解液(1 mol/L LiDFOB溶于GBL/MB,体积比为1∶1)。实验结果表明,与传统的基于ЕC 的电解液相比,这种电解液在低温(-10 ℃)下的阻抗明显增加。XPS和SЕM表征显示,LiDFOB 的过度分解产生了草酸锂,导致产生了更厚的界面膜,从而导致低温性能变差。Song等[134]提出,将LiDFBOP作为添加剂添加到传统的电解液中,发现由LiDFBOP 构建的膜具有高离子传导性(由于锂离子和聚合物阴离子的结合作用所致)。上述研究的比较说明调节锂盐含量和溶剂类型构建有效界面膜对于提高全电池低温性能尤为重要。
综合来讲,可以通过以下方式改善电解液的低温性能:①用低熔点和低黏度的线性溶剂代替ЕC,如线性碳酸盐;②选择合理添加剂(如氟化碳酸盐)来降低阻抗,防止低温下充电引起界面膜过度生长,提高低温条件下界面膜强度,防止开裂和失效;③使用几种溶剂协同改变溶解化结构,以改善低温下的锂传输和插层动力学。
4 结论
尽管ЕC 基电解液因其较低的成本和一般性工作条件下具备良好性能而被广泛应用于锂电池体系,但目前ЕC 的电解液愈加不能满足新时期能源行业在电动交通领域更广泛的应用要求。到目前为止,耐高压协同盐电解液、具有良好热安全性的全氟电解液、以及具备良好低温抗性的PC 基电解液都在不断优化迭代。尚待开发的是能够在各种环境下均可应用的锂电池电解液。无ЕC 电解液的未来研究和开发机会仍然存在于以下领域。
(1)开发先进的表征方法,以表征电解液的溶剂化结构、界面膜的成分和形态。这有助于深入研究电解液各组分之间的相互作用机制以及高温、低温、高压条件下正负极之间的反应机制。
(2)进一步了解和调节锂电池在不同极端条件下的失控机制和反应途径。
(3)基于大数据和机器学习进一步探索不同类型和浓度的溶剂、锂盐和添加剂,以开发适用于不同环境的高性能电解液。
(4)通过化学合成的方式开发新的溶剂或添加剂。例如,合成低黏度、低熔点的溶剂,有助于改善低温下的离子传输。合成能够去除中间副产物(如H2O 和HF)的络合剂,以改善电池的界面稳定性。
总之,无ЕC 电解液仍处于开发阶段,很难找到一种适应性强的电解液。基于此,探索和开发能够满足下一代高安全性和高能量密度锂电池要求的无ЕC 电解液体系对于进一步探索和发展新能源相关技术具有重要意义。本综述希望在以往发展的基础上,为电解液后续研究提供思路。
