阿拉伯半乳聚糖处理对采后青脆李果实贮藏特性的影响
2023-08-25曾昌平汪于波李佳艳曾凯芳邓丽莉
曾昌平,汪于波,李佳艳,曾凯芳,2,明 建,2,邓丽莉,2,
(1.西南大学食品科学学院,重庆 400700;2.西南大学食品贮藏与物流研究中心,重庆 400715)
李果实是中国重要的经济类水果之一,在我国种植范围较广,青脆李(Prunus salicinaL.)也是重庆市重要的特色农产品之一,每年为重庆地区种植业创造了巨大的经济效益[1]。作为一种典型的呼吸跃变型水果[2],青脆李果实在采后贮藏过程中会发生一系列变化,使果实转变为消费者喜欢的风味和较软的质地[3]。但由于青脆李果实多成熟于潮湿、炎热、多雨的夏季[4],其在采后也极易出现品质劣变[5],如软化、转黄、腐烂率增加等,给青脆李果实的贮藏和流通都带来了一定挑战。
前期已有研究表明,1-MCP[6]、腐胺[7]、氨基乙氧基乙烯基甘氨酸[8]、一氧化氮[9]、水杨酸[10]、二氧化氯[11]等外源处理在延长李果实的采后贮藏寿命,提升李果实采后品质方面均表现出一定的作用,但这些保鲜方式多存在着操作复杂、成本高、与现有商品化处理设施匹配性不佳等问题,导致其中真正用于产业应用的处理较少。综合考虑消费者对食品安全需求的增加以及目前果蔬采后商品化处理程度增加、劳动力成本激增等现象,进一步寻找安全、便捷、有效的,适用于产业应用的青脆李保鲜方式对青脆李产业发展具有重要意义。
青脆李果实成熟衰老过程中有明显的质地软化和转色发生。果实质地变化与细胞壁的变化具有密切关系,采后果实质地的改变通常认为是果实细胞初生壁和胞间层组织中的多糖降解,引起细胞壁超微结构改变所导致的[12]。而细胞壁组装可能受到阿拉伯半乳聚糖蛋白(AGP)的影响[13],同时,AGP 也是组成细胞壁的一种糖蛋白,参与细胞壁的构成[14]。相关研究表明,AGP 与番茄和苹果等果实的成熟衰老密切相关,AGP 也有可能在植物抗病和生长过程中发挥调节作用[15-16]。阿拉伯半乳聚糖(AG)是一类长的、高度支链的由阿拉伯糖与半乳糖组成的中性多糖[17-18],是AGP 的重要组成成分。国家卫生和计划生育委员会(现国家卫生健康委员会)《关于批准番茄籽油等9 种新食品原料的公告(2014 年第20 号)》中明确规定,AG 食用量≤15 g/d[19]。表明,AG 具有较高的安全性,且其较好水溶性,为其在大规模商品化过程使用提供了可能。目前果蔬中AG 的研究主要集中在其结构[20]与功能[13],而将AG 应用于果蔬保鲜领域则鲜有探究。
本文通过测定贮藏过程中青脆李果实颜色、硬度、可溶性固形物、可滴定酸、抗坏血酸、总酚和类黄酮等品质指标变化,探讨了外源AG 处理对采后青脆李果实贮藏特性的影响,以期为AG 在采后青脆李果实贮藏保鲜方面的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
实验所用青脆李 采摘于重庆市北碚区,采后剔除病果、伤果、畸形果,挑选果实饱满、色泽鲜亮、无异常斑点、大小相近、成熟度基本一致的青脆李果实,DA-Meter 便携式水果成熟度检测仪测定IDA值(叶绿素吸收率指数,the chlorophyll absorbance index)在1.8~2.0;阿拉伯半乳聚糖 上海源叶生物科技有限公司;氢氧化钠、亚硝酸钠、硝酸铝 成都市科隆化学品有限公司;抗坏血酸、甲醇 上海麦克林生化科技有限公司;草酸 上海沪试实验室器材股份有限公司;没食子酸、芦丁 北京索莱宝科技有限公司;磺基水杨酸 重庆川东化工试剂厂;所用试剂均为分析纯。
DA-Meter 便携式水果成熟度检测仪 意大利T.R. Turoni Srl 公司;H1 型全自动酶标仪 美国伯腾仪器有限公司;L-8800 型氨基酸自动分析仪 日本日立公司;GS-15 型质地分析仪 南非GUSS 公司;DW-HL528 型超低温冷冻储存箱 中科美菱低温科技股份有限公司;TGL-18MS 型高速冷冻离心机 上海卢湘仪离心机仪器有限公司;F920 型CO2分析仪 美国菲利克斯仪器公司;CR-400 型色差仪日本柯尼卡美能达公司;PAL-1 型数显手持式折射仪 日本ANTAGO 公司;DDS-307A 型电导率仪上海仪电科学仪器股份有限公司;GC2010 型气相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 果实处理及贮藏条件 将受试果实随机分为3 组,一组于5 g/L AG 溶液中浸泡10 min,一组于10 g/L AG 溶液中浸泡10 min,对照组于清水中浸泡10 min,果实在常温下晾干后于常温下贮藏(20±1 ℃),贮藏期为12 d,每3 d 进行相关指标的测定并取赤道部位果肉样品用液氮冷冻后于-80 ℃下保存,用于相关指标的测定。
1.2.2 色差的测定 果实色差值采用色差仪测定。根据国际照明委员会L*、a*、b*的色彩空间,测定果实果皮赤道部位的L*、a*、b*值。其中,L*表示光泽度;a*表示红绿值;b*表示黄蓝值。每组测定20 个果实,每个果实测定赤道对应的3 个点,取其平均值作为该果实的色差值。
1.2.3 硬度、失重率和腐烂率的测定 硬度的测定参考曹建康等[21]的方法,略有修改。通过GS-15 质地分析仪测定青脆李果实(为去皮)赤道部位的硬度,探头直径为8 mm,下压距离为1.0 mm,在赤道部位等距离测定3 个位置的硬度,以3 个位置硬度的平均值为该果实的硬度,硬度以kg 表示。
失重率的测定参考Hossein 等[10]的方法,略有修改。每组随机取20 个果实用于测定失重率,按照下式计算每组果实的失重率(%),计算平均值。
腐烂率的测定参考龚娣[1]的方法,略有修改。每组取60 个果实用于测定腐烂率,每隔3 d 统计腐烂果实个数。将表面有破裂、有凹陷、发生褐变、局部软化的果实记为腐烂果实,按照下式计算每组果实的腐烂率(%),计算平均值,腐烂率达到50%时则认为该组果实失去商品价值。
1.2.4 相对电导率、呼吸速率和乙烯生成速率的测定 相对电导率的测定:参考曹建康等[21]的方法,使用电导率测定仪进行测定。
呼吸速率的测定:测定青脆李的质量以及体积后,将其置于密闭空间中,使用CO2分析仪检测30 min 后该密闭环境中CO2含量的变化,青脆李呼吸速率以μL CO2·min-1·g-1表示。
果实乙烯生成速率的测定参考Zaidi 等[22]方法,略有修改。测定青脆李的质量以及体积后,将其置于密闭容器中,30 min 后抽取该容器中气体保存于取气袋中用于乙烯含量测定。使用气相色谱仪对乙烯含量进行测定,气相色谱测定条件为:色谱柱:DB-5MS(毛细管柱)30.0 mm×0.25 mm×0.25 mm;进样口(SPL)100.0 ℃,柱温60 ℃,氢离子火焰检测器(FID)温度130 ℃;载气氮气流速30 mL/min;燃气氢气流速为30 mL/min;助燃气空气流速为400 mL/min;压力控制流量,压力为113.5 kPa;样品采集时间为5 min。
1.2.5 可溶性固形物、可滴定酸和抗坏血酸含量的测定 可溶性固形物含量的测定参考曹琦[23]的方法,使用数显手持式折射仪测定,单位用%表示。
可滴定酸含量的测定参考曹建康等[21]的方法,略有修改。称取1.0 g 果肉磨碎后加入20 mL 蒸馏水,充分摇匀后静置30 min,离心(8000 r/min,5 min),取上清液用0.05 mol/L 氢氧化钠溶液滴定。
抗坏血酸含量的测定参考周婷等[24]的方法,使用2,6-二氯酚靛酚滴定法进行测定。
1.2.6 总酚和类黄酮含量的测定 总酚和类黄酮含量的测定参考徐燕红[25]的方法,并略有修改。称取1.0 g 青脆李果实,于液氮中研磨成粉末,用4 mL 1%盐酸-甲醇溶液低温超声避光提取1 h,然后离心30 min(4 ℃,8000 r/min),重复提取两次,合并上清液,用于总酚、类黄酮的测定。
总酚含量的测定:将0.1 mL 提取液、3.9 mL 蒸馏水和0.25 mL 福林酚试剂,混匀后于室温下放置3 min,随后加入0.75 mL 20% Na2CO3溶液,混匀后于40 ℃水浴中反应30 min,立即置于冰浴中停止反应,10 min 后取出,再于室温下放置30 min,随后在730 nm 下测定吸光值。根据没食子酸标准曲线(y=0.008x+0.0453,R2=0.9996)计算总酚含量,用mg/g表示。
类黄酮含量的测定:将1 mL 提取液,0.3 mL 5%NaNO2溶液混匀后静置6 min,再加入10% Al(NO3)3溶液0.3 mL,摇匀后静置6 min;再加入4% NaOH溶液4 mL,摇匀;最后用蒸馏水定容至10 mL,静置15 min 后,在510 nm 下测定其吸光度值。根据芦丁标准曲线(y=0.0006x+0.0393,R2=0.9988)计算类黄酮含量,用mg/g 表示。
1.2.7 游离氨基酸含量的测定 游离氨基酸含量的测定参考令阳[26]的方法,称取2.0 g 的青脆李样品,于液氮中研磨成粉末,再将青脆李样品粉末置于10 mL离心管中,加入6%磺基水杨酸2 mL,振摇约1 min后,离心15 min(4 ℃,10000 r/min)后,使用0.22 μm水相过滤,将滤液于L-8800 型氨基酸自动分析仪中进行分析,各类氨基酸含量之和记为总氨基酸含量。
1.2.8 转录组分析 对0、3 和6 d 的青脆李果实样本进行转录组测序,测序委托广州基迪奥生物科技有限公司进行,提取质量合格的RNA 样本进行转录组测序,测序得到的原始图像数据经碱基识别转化为序列数据的原始读数,利用HISAT2 将数据质控后得到的clean reads 与参考基因组进行比对,本研究中参考的基因组为Prunus salicinaSanyueli Whole Genome v2.0 Assembly & Annotation,组间的差异基因采用DESeq2 软件分析,以|lg2(Fold Change)|>1且P<0.05 作为筛选差异基因的指标。
1.3 数据处理
以上指标均设3 个平行。所有数据用Excel 2019统计。使用GraphPad Prism 9.0(GraphPad Software,CA,USA)进行统计分析并绘图,采用独立样本T检验进行方差分析,差异水平为P<0.05。
2 结果与分析
2.1 AG 处理对采后青脆李果实成熟衰老特性的影响
2.1.1 AG 处理对采后青脆李果实外观和色差的影响 不同浓度AG 处理组青脆李果实的外观变化如图1(a)所示,青脆李果实在贮藏过程中颜色逐渐由绿色转变为黄色,在3 d 和6 d 时,三组青脆李果实色泽均保持绿色,但是对照组和10 g/L AG 处理组果实的绿色较浅,而5 g/L AG 处理组果实的绿色较深;随着贮藏时间的增加,对照组和10 g/L AG 处理组在12 d 转变为黄色;5 g/L AG 处理组在15 d 仍然保持较浅的绿色,此时,对照组和10 g/L AG 处理组青脆李果实几乎完全转变为黄色。

图1 AG 处理对青脆李果实外观和色差的影响Fig.1 Effects of AG treatment on the appearance and color difference of Qingcui plum fruit
不同浓度AG 处理组青脆李果实色差的变化如图1(b~e)所示,青脆李果实贮藏过程中L*值呈现逐渐下降的趋势,表明青脆李果实贮藏过程中亮度在不断降低;a*值、b*值和a*/b*值呈现逐渐上升的趋势,表明青脆李果实在贮藏过程中逐渐由绿色转变为黄色,与果实外观变化一致。如图1(c~e)所示,5 g/L AG 处理组果实的a*值、b*值始终显著低于对照组和10 g/L AG 处理组(P<0.05),a*/b*值始终显著低于对照组和10 g/L AG 处理组(P<0.05),表明5 g/L AG 处理能够显著延缓贮藏过程中青脆李果实由绿变黄的转色过程。
2.1.2 AG 处理对采后青脆李果实硬度、失重率和腐烂率的影响 如图2(a)所示,青脆李果实在贮藏过程硬度呈现逐渐下降的趋势,贮藏3 d 时,5 g/L AG处理组的硬度显著高于10 g/L AG 处理组(P<0.05),与对照组无显著性差异;贮藏6~15 d 时,5 g/L AG处理组的硬度均显著高于对照组和10 g/L AG 处理组(P<0.05),在贮藏15 d 时,5 g/L AG 处理组的硬度分别是对照组的10 g/L AG 处理组的1.22 倍和1.27倍,表明5 g/L AG 处理能够延缓青脆李果实贮藏过程中硬度的降低。

图2 AG 处理对青脆李果实硬度、失重率和腐烂率的影响Fig.2 Effects of AG treatment on firmness, weight loss rate and rot rate of Qingcui plum fruit
青脆李果实贮藏过程中失重率的变化呈现出逐渐上升的趋势(图2b),贮藏3 d 和6 d 时,5 g/L AG处理组的失重率略低于对照组和10 g/L AG 处理组,但并不存在显著性差异;贮藏到9 d 和12 d 时,5 g/L AG 处理组的失重率显著低于10 g/L AG 处理组(P<0.05),到15 d 时,5 g/L AG 处理组的失重率分别为对照组10 g/L AG 处理组的85.6%和80.1%,表明5 g/L AG 处理能够延缓青脆李果实贮藏过程中重量的降低。
青脆李果实贮藏过程中腐烂率呈现出逐渐上升的趋势(图2c),贮藏12 d 时,对照组和10 g/L AG处理组开始发生腐烂,5 g/L AG 处理组在15 d 才发生腐烂,且其15 d 时的腐烂率仅为13.33%,仅为对照组的44.44%,10 g/L AG 处理组的52.17%。
综合贮藏过程中不同处理组果实色差、硬度、失重率、腐烂率指标的变化,5 g/L AG 处理组能够明显地延缓青脆李果实的成熟衰老进程,后续针对该浓度进行进一步分析。而10 g/L AG 处理组效果明显较5 g/L 处理组差,这可能与AG 在果实表面具有一定的成膜性,过高浓度的AG 影响青脆李果实的正常呼吸作用和蒸腾作用有关,因此后续选择5 g/L AG 处理进行进一步实验。此外,综合前述指标发现,常温贮藏超过12 d,果实商品价值显著降低,因此,后续指标重点关注12 d 以内变化。
2.1.3 AG 处理对采后青脆李果实相对电导率、呼吸速率和乙烯生成速率的影响 青脆李在贮藏过程中相对电导率的变化如图3(a)所示,果实相对电导率整体呈现上升趋势,5 g/L AG 处理的相对电导率在各个时间点均低于对照组,在6 d 和12 d 显著低于对照组(P<0.05),表明5 g/L AG 处理能够抑制青脆李果实果皮采后相对电导率的上升。
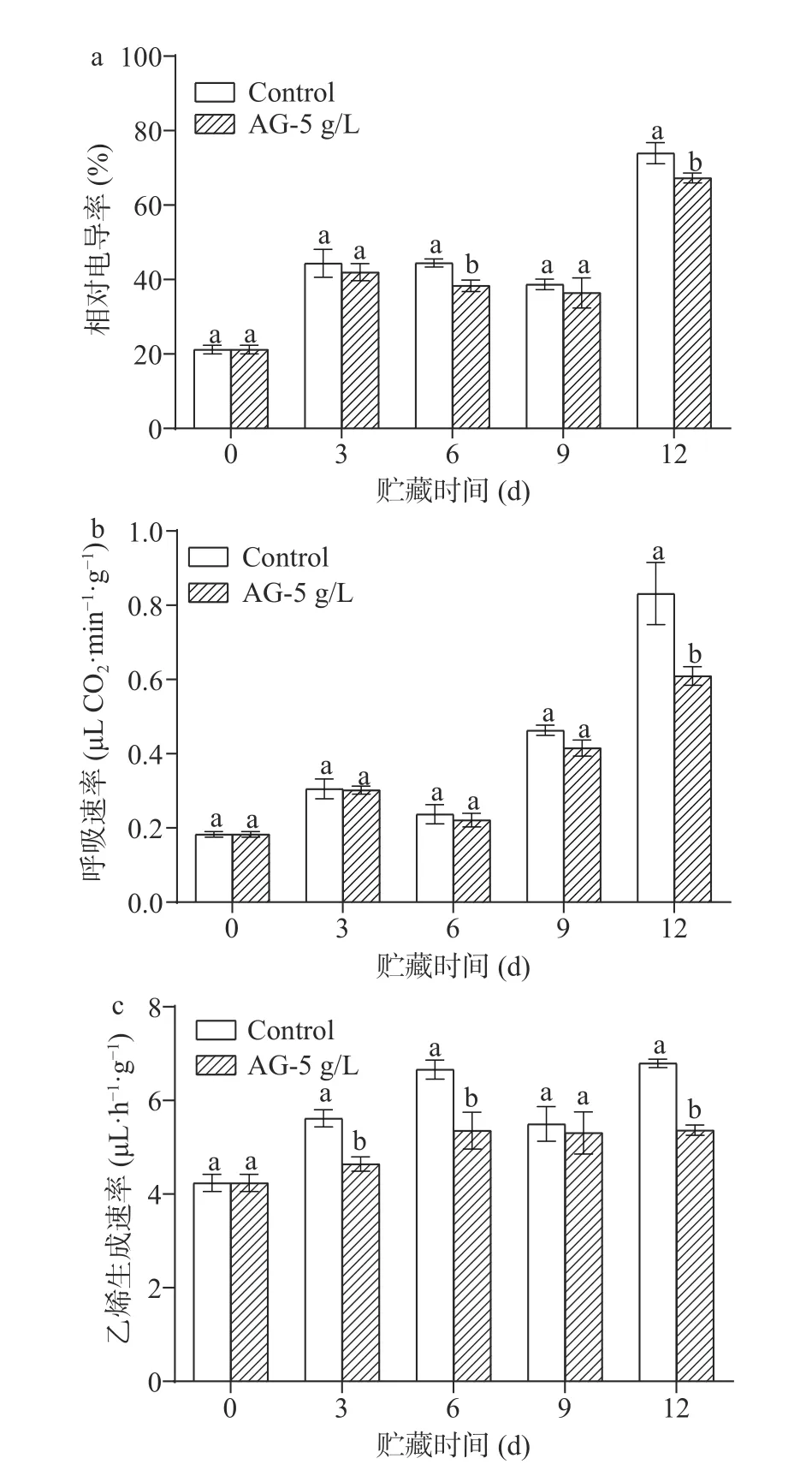
图3 AG 处理对青脆李果实相对电导率、呼吸速率和乙烯生成速率的影响Fig.3 Effects of AG treatment on relative conductivity,respiration rate and ethylene production rate of Qingcui plum fruit
青脆李在贮藏过程中呼吸速率的变化如图3(b)所示,果实呼吸速率呈现出逐渐上升的趋势,在3 d和6 d 时,对照组和5 g/L AG 处理组青脆李果实的呼吸速率无显著差异,贮藏到9 d 时,5 g/L AG 处理组的呼吸速率低于对照组,12 d 时,5 g/L AG 处理组的呼吸速率显著低于对照组(P<0.05),仅为对照组呼吸速率的73.3%。因此,5 g/L AG 处理能够降低青脆李的呼吸速率。
贮藏过程中,青脆李果实乙烯生成速率逐渐上升(图3c),5 g/L AG 处理果实的乙烯生成速率在3、6 和12 d 显著低于对照组(P<0.05),且整个贮藏期的乙烯变化幅度明显小于对照组果实。表明5 g/L AG 处理能够抑制采后青脆李果实乙烯的生成。
2.2 AG 处理对采后青脆李果实营养品质的影响
2.2.1 AG 处理对采后青脆李果实可溶性固形物含量、可滴定酸含量和抗坏血酸含量的影响 青脆李贮藏过程中可溶性固形物含量呈现逐渐上升的趋势(图4a),对照组果实可溶性固形物含量在贮藏9 d时出现明显上升;5 g/L AG 处理组果实可溶性固形物含量在贮藏12 d 时出现明显上升,表明5 g/L AG 可以在一定程度上延缓青脆李果实采后可溶性固形物的上升。贮藏期间青脆李果实可滴定酸含量无显著变化,但贮藏后期5 g/L AG 处理组果实可滴定酸含量略高于对照组果实(图4b)。青脆李贮藏过程中抗坏血酸含量呈现逐渐下降趋势(图4c),5 g/L AG 处理组可以延缓青脆李果实抗坏血酸含量的下降,贮藏6、9 和12 d,AG 处理组果实抗坏血酸含量分别比对照组高5.1%、12.0%和4.4%。

图4 AG 处理对青脆李果实可溶性固形物含量、可滴定酸含量和抗坏血酸含量的影响Fig.4 Effects of AG treatment on soluble solid content,titratable acid content and ascorbic acid content of Qingcui plum fruit
2.2.2 AG 处理对采后青脆李果实总酚、类黄酮含量的影响 青脆李果实贮藏过程中的总酚含量整体呈现出上升的趋势(图5a),但是在各个时间点、各处理之间均未呈现显著性差异(P>0.05),类黄酮含量变化整体呈现出先上升后下降的趋势(图5b),但贮藏过程中各个时间点、各处理之间并未呈现显著性差异(P>0.05)。

图5 AG 处理对青脆李果实总酚、类黄酮含量的影响Fig.5 Effects of AG treatment on the content of total phenols and flavonoids of Qingcui plum fruit
2.2.3 AG 处理对采后青脆李果实游离氨基酸含量和游离氨基酸代谢相关基因表达量的影响 游离氨基酸含量是采后果实品质的关键指标之一,多种氨基酸在果蔬抗逆方面具有重要作用,如组氨酸对植物的金属离子稳态、生长和发育至关重要[27];蛋氨酸是具有抗氧化特性的巯基物质,蛋氨酸处理已被用于保持采后西兰花的品质[28];精氨酸是多种生物活性化合物的前体,可以转化为NO 和多胺,调节植物的多种生理过程[29-30],相关研究表明,外源施用精氨酸可增强采后木瓜的耐寒性[31]。
贮藏过程中青脆李果实游离氨基酸含量的变化如图6 所示。5 g/L AG 处理显著提升了青脆李果实中多种游离氨基酸的含量。贮藏6 d 时,5 g/L AG处理组青脆李果实中的组氨酸含量比对照组高14.88%;蛋氨酸含量为处理组的119.99%;精氨酸含量为对照组的1.42 倍。此外,5 g/L AG 处理组必需氨基酸苯丙氨酸、亮氨酸、缬氨酸含量在6 d 均高于对照组,分别为对照组的108.16%、110.96%和115.32%,天冬氨酸、丝氨酸、甘氨酸的含量在6 d和12 d 均有一定程度的提升;从总氨基酸含量来看,5 g/L AG 处理组的青脆李果实6 d 时总氨基酸含量是对照组的1.19 倍。因此,5 g/L AG 处理能够提升与采后青脆李果实抗逆性和营养品质有关的多种氨基酸含量。
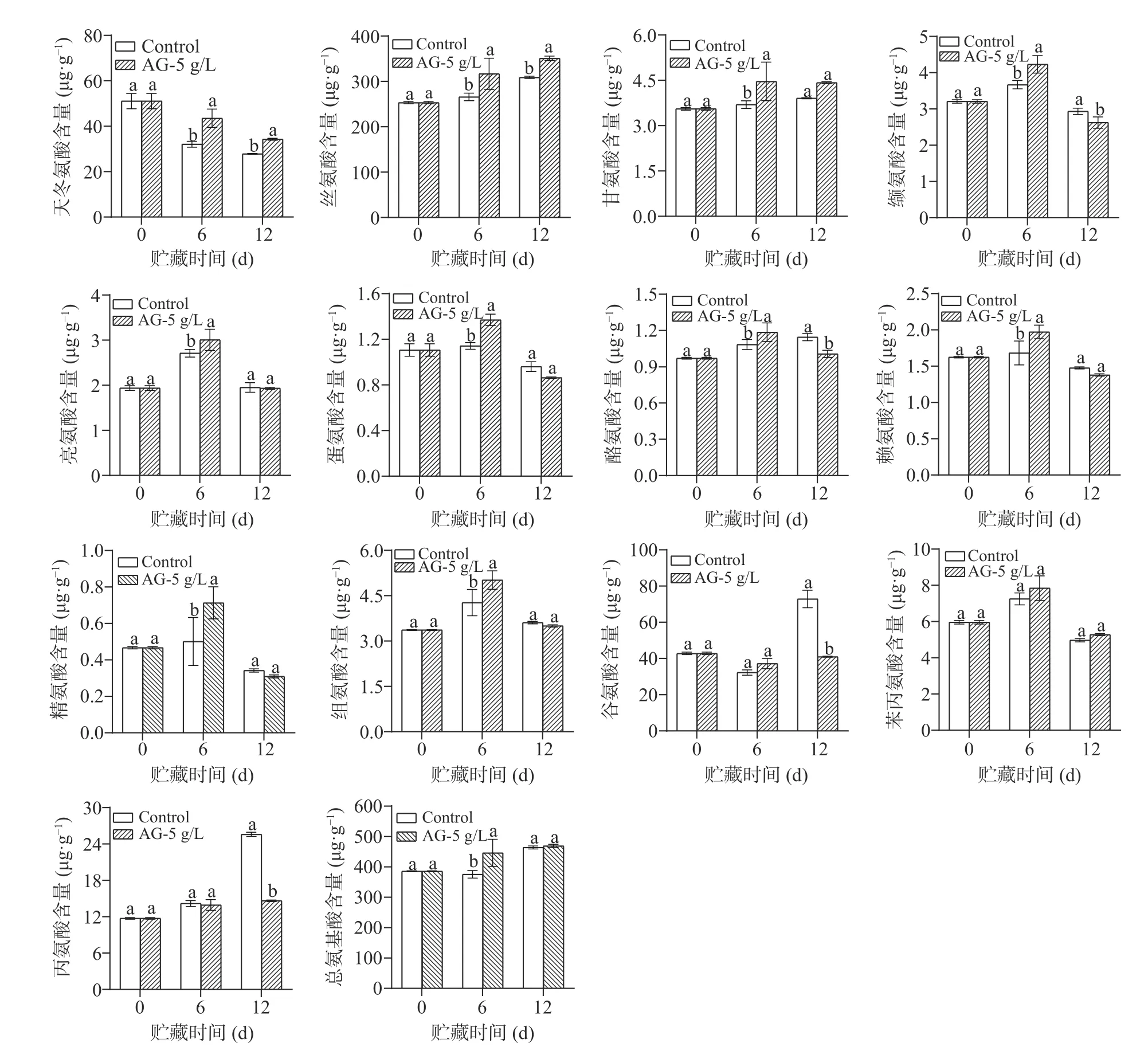
图6 AG 处理对青脆李果实游离氨基酸含量的影响Fig.6 Effects of AG treatment on content of free amino acids of Qingcui plum fruit
青脆李果实游离氨基酸含量变化表明,5 g/L AG 处理组青脆李果实多种游离氨基酸含量均在贮藏第6 d 时出现显著上升或下降趋势,这可能与贮藏前期某些氨基酸代谢相关基因表达量变化有关,因此,进一步重点关注了贮藏第3 d 时果实游离氨基酸代谢相关基因表达情况。转录组数据分析表明(图7),5 g/L AG 处理组青脆李果实中与天冬氨酸合成有关的L-天冬酰胺水解酶基因(At3g16150)表达量在6 d显著高于对照组(P<0.05),与天冬氨酸分解有关的天冬酰胺合成酶基因(AS)表达量在3 d 和6 d 显著低于对照组(P<0.05),与丝氨酸合成有关的磷酸丝氨酸氨基转移酶基因(PSAT1)表达量在3 d 和6 d 均呈现显著的上调表达(P<0.05),与精氨酸分解代谢有关的多胺氧化酶基因(PAO5)和脯氨酸脱氢酶基因(POX2)表达量在3 d 和6 d 均呈现出下调表达,表明5 g/L AG 处理能够通过调控氨基酸代谢相关基因的表达量提升其天冬氨酸、丝氨酸和精氨酸含量。
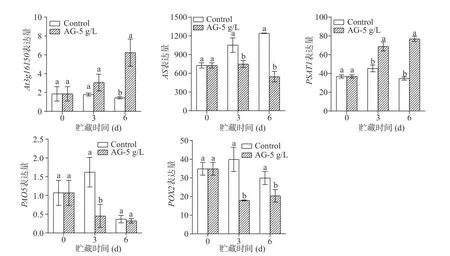
图7 AG 处理对青脆李果实游离氨基酸代谢相关基因表达量的影响Fig.7 Effects of AG treatment on expression of free amino acid metabolism-related genes of Qingcui plum fruit
3 讨论与结论
青脆李果实是一种极易发生品质劣变的水果[32],在采后贮藏过程中,青脆李果实品质逐渐下降,可滴定酸、可溶性固形物、抗坏血酸、总酚、类黄酮、游离氨基酸含量逐渐改变。本研究结果表明,5 g/L AG 处理降低了青脆李果实采后的呼吸速率,这可能与壳聚糖处理类似[33],部分AG 附着于青脆李果皮表面,形成物理保护屏障,减少了青脆李果皮与空气的接触面积,减少青脆李果实水分的散失,进而降低李果实贮藏过程中的失重率,但浓度过高时可能产生不良影响。此外,呼吸速率的降低也有助于延缓李果实代谢和酶的活动,从而延缓细胞壁成分的降解过程,提升青脆李果实的硬度,延缓其贮藏过程中相对电导率和乙烯生成速率的上升。同时,AGP 参与植物下包多种代谢调控过程[13],AG 处理可能会影响李果实中AGP 含量,从而激活李果实中与抗逆性相关的某些代谢途径,进而提升李果实的耐贮藏性,对照组和处理组总酚和类黄酮含量差距不大的原因可能是由于AGP 未参与其代谢调控,从而导致其含量变化并不显著。
综上所述,5 g/L AG 处理能够延缓青脆李果实采后颜色的改变,抑制青脆李果实的软化,延缓青脆李果实采后的相对电导率、呼吸速率、失重率、腐烂率、乙烯生成速率的上升以及抗坏血酸含量的下降,提升果实组氨酸、蛋氨酸、精氨酸、苯丙氨酸等与果实抗逆有关氨基酸和天冬氨酸、丝氨酸、甘氨酸、亮氨酸、缬氨酸等与果实营养有关氨基酸的含量,并能将常温贮藏青脆李果实的货架期延长3 d 以上。即5 g/L AG 处理能有效延缓青脆李果实采后的衰老进程,维持青脆李果实采后贮藏过程中的品质,在采后青脆李常温贮藏保鲜中具有一定的应用前景。
