紫苏籽粕迷迭香酸的亚临界水提取工艺优化及其抗氧化活性
2023-08-25闫林林王艳辉张佳婵郑光耀
闫林林,王艳辉,张佳婵,郑光耀,
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业和草原局林产化学工程重点实验室,江苏省生物质能源与材料重点实验室,江苏省林业资源高效加工利用协同创新中心,江苏南京 210042;2.北京工商大学,北京市植物资源研究开发重点实验室,北京 100048)
迷迭香酸(Rosmarinic acid,RA)是一种优质的天然抗氧化剂,具有抗氧化、抗炎、抗菌、抗病毒、抗过敏等多种活性功效,在制药、食品和化妆品等领域具有重要的应用价值[1-5]。迷迭香酸广泛存在于唇形科、紫草科和伞形科的多种植物中,尤以唇形科和紫草科含量较高[6-7]。紫苏(Perilla frutescensL.)为唇形科一年生芳香草本植物,具有较高的营养价值和药用价值,长期以来一直用于食品、香料和传统中草药领域[8-11]。研究发现,紫苏籽榨油后的饼粕(即紫苏籽粕)中含有大量的迷迭香酸[12-15],是一种价格低廉、资源丰富的迷迭香酸提取原料。
目前,迷迭香酸的常用提取方法有浸渍法[12,15-16]、加热回流提取法[4,14]、酸水解法[17-19]、索氏提取法[20]、超声辅助提取法[13,21]、酶辅助提取法[22]、微波辅助提取法[23]等,这些方法大多存在耗时长、成本高、效率低、提取溶剂有毒性、易造成环境污染等问题,不符合绿色化学的理念[24-25]。近期,也有研究者使用离子液体作为溶剂提取植物材料中的迷迭香酸[26],但离子液体的成本较高且并非完全无毒,存在生物不可降解性、溶质分离困难、溶剂残留等问题[27-28]。
相较于上述提取方法,亚临界水提取(Subcritical water extraction,SWE)是以安全、价廉、环境友好的水为提取介质,近年来受到越来越多的关注[24-25,29]。亚临界水在一定的高温高压条件下依然能够保持液体状态,但理化性质发生了改变,如介电常数降低、极性降低、扩散系数增加、溶解力增加等,具有与有机溶剂相似的性质,使得提取效率显著提高[29-31]。目前,亚临界水提取法已被应用于多酚、黄酮、多糖、生物碱、萜类等多种活性成分的提取[29,32-36]。例如,Shi 等[37]利用亚临界水提取红心火龙果种子中的酚类物质;Wang 等[38]利用亚临界水提取覆盆子中的花青素;Dazh 等[39]利用亚临界水提取苦荞多酚,研究结果均显示亚临界水提取的目标物质得率和生物活性显著高于传统溶剂提取法。然而,目前尚未有利用亚临界水提取紫苏籽粕中迷迭香酸的相关报道。
因此,本研究以紫苏籽粕为原料,采用亚临界水提取法提取其中的迷迭香酸,考察提取温度、提取时间、料液比等参数对提取得率的影响,用响应面法优化迷迭香酸的亚临界水提取工艺,并评价其抗氧化活性,以期为紫苏籽粕中迷迭香酸的提取提供一种绿色、高效、经济的技术途径。
1 材料与方法
1.1 材料与仪器
紫苏籽粕 甘肃灵台县陇香食品有限公司;没食子酸(纯度≥98%)、芦丁(纯度≥98%)、迷迭香酸(纯度≥98%) 南京春秋生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS)、抗坏血酸(VC)Sigma 公司;甲醇、乙腈、甲酸 色谱级,阿拉丁试剂(上海)有限公司;碳酸钠、六水氯化铝、铁氰化钾、氯化铁、三水乙酸钠和甲醇等其他试剂 国药化学试剂有限公司。
LC-20AT 液相色谱工作站配有自动进样器(SIL-20A)、PDA 检测器(SPD-20A)、柱温箱(CTO-10AS)、UV-1700 型紫外-可见分光光度计 日本岛津公司;TGL-16C 型高速台式离心机 上海安亭科学仪器厂;亚临界水萃取装置(HAWG 型反应釜)江苏华安科研仪器有限公司;KH5200DB 型数控超声波清洗器 昆山禾创超声仪器有限公司;Sigma HD 型热场发射扫描电子显微镜 德国蔡司公司。
1.2 实验方法
1.2.1 紫苏籽粕预处理 干燥的紫苏籽经冷榨法萃取紫苏油脂后立即收集其饼粕(即紫苏籽粕),将紫苏籽粕于50 ℃烘箱干燥,粉碎,过60 目筛,密封保存,使用前干燥至恒重。
1.2.2 亚临界水提取 精确称取紫苏籽粕5 g,置于亚临界水萃取罐中,按照一定的料液比加入去离子水,设定适当的提取压力和提取温度,提取一定时间后,得到紫苏籽粕提取液,迅速将其抽滤,重复提取两次,合并滤液上清,定容,备用。
1.2.3 单因素实验 采用1.2.2 中的提取方法考察各单因素(提取温度、提取时间、料液比和提取压力)对紫苏籽粕中迷迭香酸提取得率的影响。固定提取压力为3.0 MPa、提取时间为20 min、料液比为1:20 g/mL 的条件下,设置提取温度为100、120、140、160、180、200、220 ℃;固定提取压力为3.0 MPa、提取温度为160 ℃、料液比为1:20 g/mL 的条件下,设置提取时间为10、20、30、40、50、60 min;固定提取压力为3.0 MPa、提取温度为160 ℃、提取时间为30 min 的条件下,设置料液比为1:10、1:20、1:30、1:40、1:50、1:60 g/mL;固定提取温度为160 ℃、提取时间为30 min、料液比为1:40 g/mL 的条件下,设置提取压力为1.0、2.0、3.0、4.0、5.0 MPa。
1.2.4 响应面试验优化 在单因素实验的基础上,选择对迷迭香酸提取得率影响较大的三个因素提取温度(X1)、提取时间(X2)和料液比(X3)为自变量,以迷迭香酸提取得率为响应值(Y),按照Box-Benhnken实验设计原理,设计3 因素3 水平响应面分析试验(具体见表1),根据回归模型分析各因素对响应值的影响,优化亚临界水提取工艺参数。

表1 响应面试验因素与水平Table 1 Factors and levels in response surface experiment
1.2.5 迷迭香酸含量的测定及其提取得率计算
1.2.5.1 高效液相色谱分析条件 采用高效液相色谱(HPLC)法测定紫苏籽粕提取物中迷迭香酸的含量,色谱条件和方法参考文献并稍作改进[14]。色谱柱:Diamonsil RP-C18色谱柱(250 mm,4.6 mm,5 μm);流动相为0.2%甲酸水(A):甲醇(B);梯度洗脱程序为:0~40 min,流动相B 为5.0%~65%;40~45 min,流动相B 为65%~5%。40~45 min,流动相B 为5%;流速为1.0 mL/min;进样体积20 μL;检测波长为330 nm;柱温35 ℃。
1.2.5.2 迷迭香酸标准曲线 精密称取适量迷迭香酸标准品,用50%甲醇水溶液配制成浓度为0.1 mg/mL的母液,再用50%甲醇水溶液稀释成一系列浓度的标准品工作液,分别进HPLC 测定其峰面积。以迷迭香酸的浓度为横坐标(x),以峰面积为纵坐标(y)作图,得到标准曲线y=68733.85x-70126.21,R2=0.9994,迷迭香酸在浓度0.01~0.10 mg/mL 范围内线性良好。
1.2.5.3 迷迭香酸提取得率的计算 将紫苏籽粕提取液用50%的甲醇水溶液稀释,过0.22 μm 微孔滤膜后,进HPLC 分析。按照公式(1)计算迷迭香酸的提取得率[14]。
式中:Y 表示迷迭香酸的提取得率,mg/g dw(dry weight);C 表示通过标准曲线计算得出的迷迭香酸浓度,mg/mL;n 表示样品提取液的稀释倍数;V 表示样品提取液的体积,mL;m 表示紫苏籽粕原料的用量,g。
1.2.6 不同提取方法的比较 比较亚临界水提取法与常规溶剂提取法(如甲醇回流、水回流、甲醇超声、水超声)对迷迭香酸提取得率及其抗氧化活性的影响。其中,亚临界水提取采用响应面实验优化后的工艺参数,常规溶剂提取则参考相关文献,具体如下。
1.2.6.1 加热回流提取 参考Yan 等[19]的方法并稍作修改。精确称取紫苏籽粕5 g 置于圆底烧瓶中,按料液比1:40 g/mL 分别加入80%甲醇水溶液和纯水,设置提取温度为80 ℃,加热回流提取1 h 后,得到紫苏籽粕提取液,迅速将其抽滤,在上述相同条件下重复提取两次,合并滤液上清,定容,测定提取液中迷迭香酸的含量并计算得率。
1.2.6.2 超声辅助提取 参考Tang 等[13]的方法并稍作修改。精确称取紫苏籽粕5 g 置于圆底烧瓶中,按料液比1:40 g/mL 分别加入80%甲醇水溶液和纯水,设置超声提取温度60 ℃,超声功率为90 W,超声频率50 Hz,提取1 h 后,得到紫苏籽粕提取液,迅速将其抽滤,在上述相同条件下重复提取两次,合并滤液上清,定容,测定提取液中迷迭香酸的含量并计算得率。
1.2.7 抗氧化活性的测定 本研究通过DPPH 和ABTS 自由基清除试验比较不同提取方法下紫苏籽粕提取液的抗氧化活性。
1.2.7.1 DPPH 自由基清除能力测定 参考文献[14,40]方法并稍作修改。首先,用去离子水配制一系列浓度的VC标准品溶液(0.05、0.10、0.15、0.20 mg/mL),取0.1 mL 的VC标准品溶液,加入0.25 mL 新鲜配制的DPPH 甲醇溶液(浓度为1 mmol/L),再加入2 mL 甲醇,充分混合后于室温下避光放置20 min,以甲醇为空白对照,于517 nm 下测定其吸光值,按照公式(2)计算VC标准品溶液的DPPH 自由基清除率(%)。以VC浓度为横坐标(x),以DPPH 自由基清除率(%)为纵坐标(y),绘制标准曲线,得到其线性方程y=492.7x+6.4747,其R2=0.9994,在浓度0.05~0.20 mg/mL 范围内线性良好。将紫苏籽粕提取液样品稀释一定倍数,按照上述方法测定其DPPH 自由基清除率(%),代入线性方程,计算其DPPH 自由基清除能力的VC当量(mg VC/g dw),即每g 紫苏籽粕干样的自由基清除能力相当于多少mg 的VC[41]。
式中,A0表示空白对照在517 nm 处的吸光值;As表示VC标准品(或紫苏籽粕提取液样品)溶液在517 nm 处的吸光值。
1.2.7.2 ABTS 自由基清除能力测定 参考文献[14,40]方法并稍作修改。首先,用去离子水配制一系列不同浓度的VC标准溶液(0.01、0.015、0.02、0.03、0.04、0.06、0.08 mg/mL)。取0.15 mL 的VC标准品溶液,加入2.85 mL 用甲醇新鲜配制的ABTS+·工作液,充分混合后于室温下避光放置6~10 min,以甲醇为空白对照,在734 nm 下读取样品吸光值,按照公式(3)计算VC标准品(或待测样品)溶液的ABTS 自由基清除率(%)。以VC浓度为横坐标(x),以ABTS 自由基清除率(%)为纵坐标(y),绘制标准曲线,得到线性方程y=1036.8x-2.1096,其R2=0.999,在浓度0.05~0.20 mg/mL 范围内线性良好。同上,将测得的紫苏籽粕提取液样品的ABTS 自由基清除率(%)代入线性方程,计算其ABTS 自由基清除能力的VC当量(mg VC/g dw)。
式中,A0表示空白对照在734 nm 处的吸光值;As表示VC标准品(或紫苏籽粕提取液样品)溶液在734 nm 处的吸光值。
1.2.8 紫苏籽粕粉末的物理形态观察 将紫苏籽粕原料和经过不同提取方法处理后的残渣于50 ℃烘干至恒重后,取适量在扫描电镜(SEM)下观察其在提取前后的微观结构变化。
1.3 数据处理
通过SPSS 22.0 软件进行实验数据分析,每个实验条件下均进行3 次平行操作,结果以平均值±标准差来表示。采用Design-Expert 8.0.6 软件进行响应面分析,并进行模型优化。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 提取温度对紫苏籽粕中迷迭香酸提取得率的影响 由图1A 中可知,随着提取温度的升高(100~160 ℃),迷迭香酸的提取得率也逐渐升高,在160 ℃时达到最大值(3.23 mg/g dw);但是,当提取温度超过160 ℃之后,其提取得率有明显下降的趋势;当温度达到220 ℃时,只能检测到微量的迷迭香酸(0.13 mg/g dw)。相关研究表明,在亚临界水提取过程中,提取温度起着关键性的作用,温度的升高可加速分子的扩散运动,提高亚临界水对原料中目标化合物的溶解性,从而提高目标化合物的提取得率[42],但是由于迷迭香酸是热敏感性化合物,过高的提取温度会造成迷迭香酸的降解,从而导致其提取得率降低[26]。因此,在后续的单因素实验中选取160 ℃作为亚临界水提取紫苏籽粕的温度。
2.1.2 提取时间对紫苏籽粕中迷迭香酸提取得率的影响 由图1B 中可知,当提取时间在10~30 min内,随着提取时间的逐渐增加,迷迭香酸的提取得率不断升高,在30 min 时达到最大值(3.71 mg/g dw);超过30 min 后,迷迭香酸的提取得率有下降趋势,提取时间为50 min 时,其提取得率为2.37 mg/g dw。在一定提取时间范围内,随着提取时间的延长,亚临界水溶解的物质不断增加,原料中的活性成分与提取溶剂逐渐达到了固液平衡;当达到平衡之后,继续延长提取时间不能再增加目标化合物的得率,相反长时间的高温条件会导致目标化合物的降解,从而使其得率降低[42-44]。因此,在后续的单因素实验中,选取30 min 作为亚临界水提取紫苏籽粕的提取时间。
2.1.3 料液比对紫苏籽粕迷迭香酸提取得率的影响
由图1C 中可知,迷迭香酸的提取得率随料液比的增加而增加;但是当料液比超过1:40 g/mL 后,迷迭香酸的提取得率逐渐趋于稳定。在一定范围内,增加料液比有利于加快介质传递,提高目标化合物的得率[45];但是当达到平衡之后,目标化合物的提取得率便趋于稳定、不再增加,过多的提取溶剂不仅会造成资源浪费,还会增加后期除去溶剂过程的工作量。因此,在后续的单因素实验中,选取1:40 g/mL 作为亚临界水提取紫苏籽粕的料液比。
2.1.4 提取压力对紫苏籽粕迷迭香酸提取得率的影响 由图1D 中可知,起初随着压力的增加,迷迭香酸的提取得率有升高趋势,但达到3.0 MPa 后不再变化。相关文献表明,亚临界水提取过程中提取压力的作用是使水能够保持液体状态,提取压力对提取得率的影响较小,甚至可以忽略不计[29,46]。因此,本研究选取3.0 MPa 作为后续响应面优化实验中亚临界水提取紫苏籽粕的提取压力,且不再对提取压力参数进行优化。
2.2 响应面优化设计及结果分析
2.2.1 响应面优化模型的建立 根据单因素实验的结果,选取提取温度(X1)、提取时间(X2)和料液比(X3)为自变量,以迷迭香酸提取得率为响应值(Y),根据Box-Benhnken 实验设计原理,设计3 因素3 水平响应面试验,具体实验结果见表2。根据回归模型分析各因素对响应值的影响,优化得到亚临界水提取紫苏籽粕迷迭香酸的工艺参数。
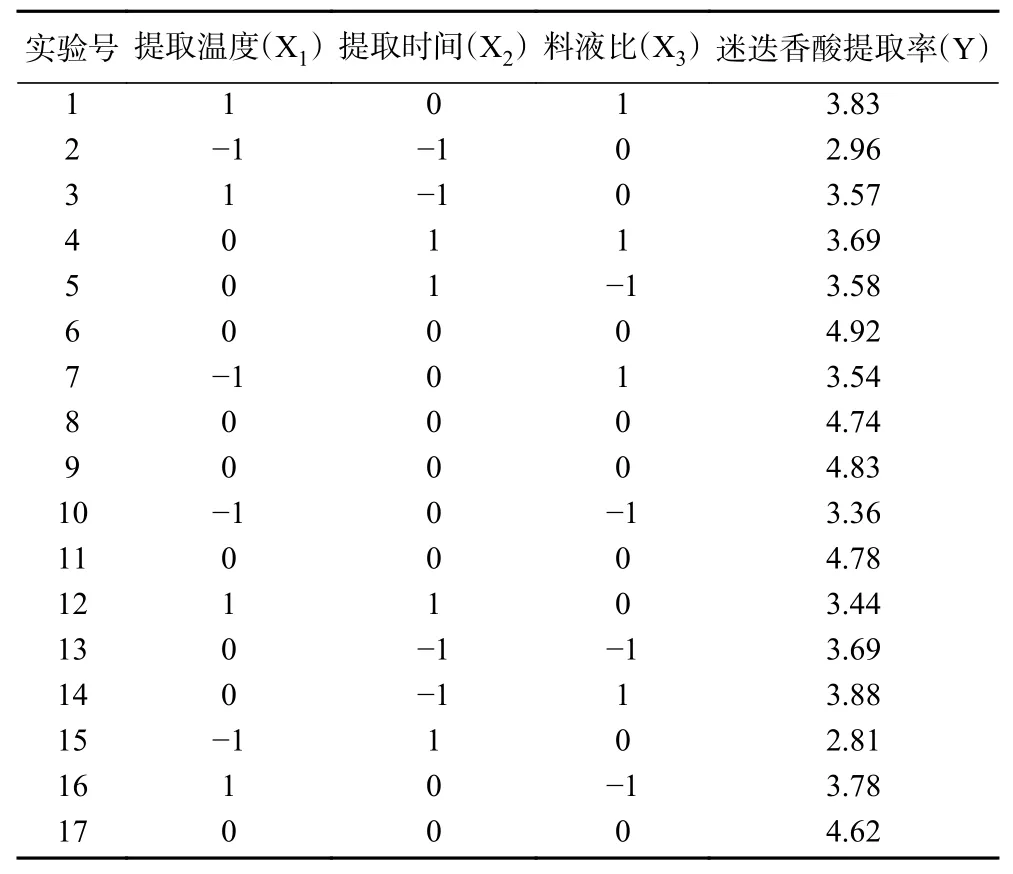
表2 响应面优化试验结果Table 2 Results of response surface optimization experiment
运用Design-Expert 软件对表2 中的数据进行拟合,得到迷迭香酸提取得率(Y)的回归模型方程为:Y=-63.51175+0.68414X1+0.44690X2+0.29283X3+0.000025X1X2-0.0001625X1X3-0.0002X2X3-0.00208187X12-0.0075025X22-0.0031775X32。通过表3 中的方差分析及和相关系数判断该模型的可靠性。由表3 可知,该模型达到了极显著水平(P<0.01);失拟项(P=0.4901>0.05)不显著,说明该模型的预测值和实验值较吻合,能够较好地反映自变量与各因素之间的关系,实验可靠;该模型的决定系数R2=0.9877、调整决定系数R2Adj= 0.9719,说明三个自变量与响应值之间的关系显著,模型和试验较为可靠,可解释97.19%的响应值变化[45]。变异系数(CV)是用平均值的百分比来表示标准偏差的量度,用来描述数据的分散程度,值越小说明模型的重现性越好、可靠性越高[42-43],该模型中变异系数CV 值为2.84%,说明模型可靠。模型中的一次项X1对提取得率(Y)的影响极显著(P<0.01),X2和X3(P>0.05)对其影响不显著;二次项X12、X22和X32均影响极显著(P<0.01);交互项X1X2、X1X3和X2X3的影响不显著(P>0.05),说明各因素之间的交互作用小,这与闫拯等[43]报道的结果相似,可能是因为各因素对其响应值的影响并不是简单的线性关系[47]。由各因素的F值和P值可知,三个因素对迷迭香酸提取得率(Y)的影响程度依次是X1>X2>X3,即提取温度(℃)>提取时间(min)>料液比(g/mL)。
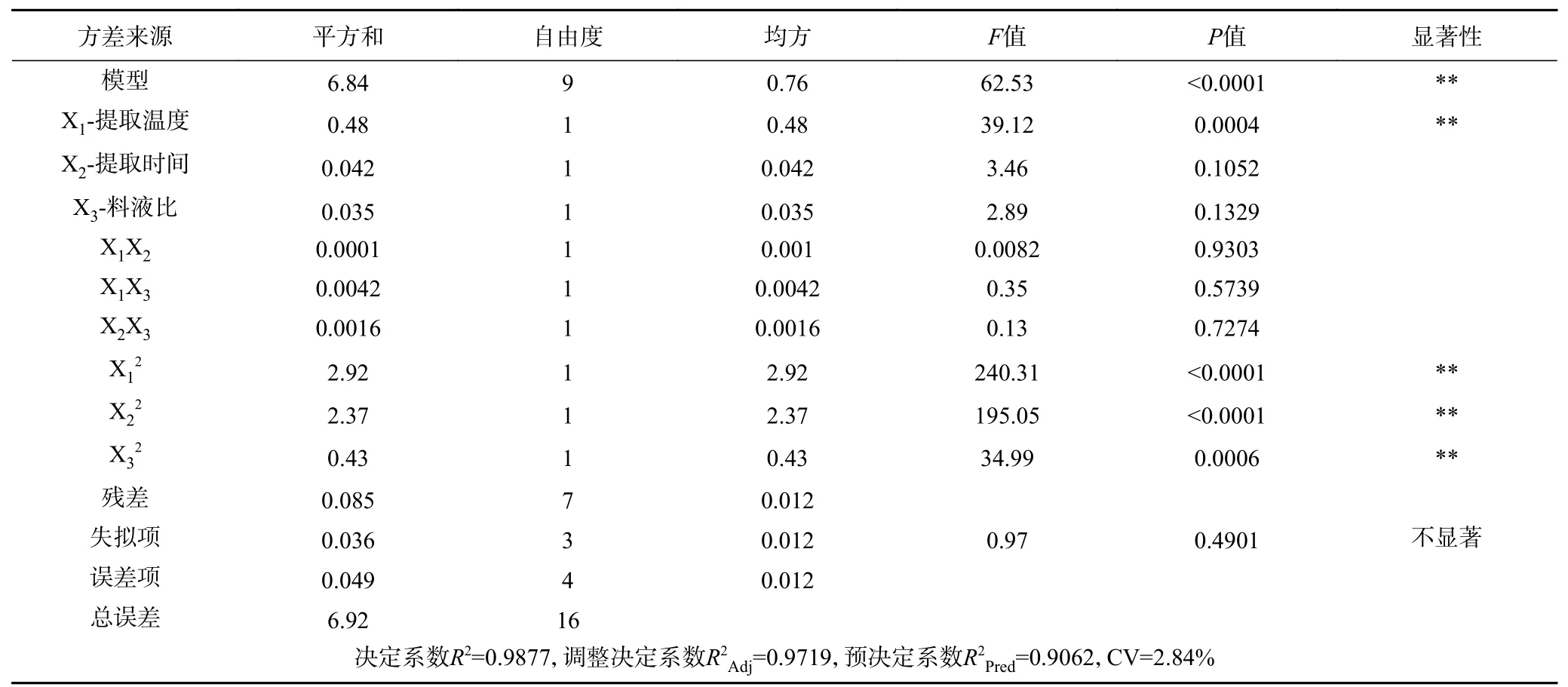
表3 响应面回归模型方差分析Table 3 ANOVA of variance for response surface quadratic model
2.2.2 模型的响应曲面分析及验证实验 通过回归模型拟合了迷迭香酸提取得率(Y)随各提取参数变化的二维和三维曲面图(见图3),可反映出提取温度(X1)、提取时间(X2)和料液比(X3)三个因素对迷迭香酸提取得率(Y)的影响。曲面的曲线越陡峭,说明该因素对迷迭香酸提取得率的影响越大;相反,曲面越平缓,则影响越不显著[48]。椭圆形的等高线说明两个因素的交互作用强,等高线的形状越扁平,说明各因素之间的交互作用就越强,等高线越密集说明该因素对响应值的影响越显著[49]。由结果可知,对迷迭香酸提取得率(Y)的影响较大的因素是提取温度和料液比的交互作用(X1X3),这与文献[43]中结果相似;其次是提取时间和料液比的交互作用(X2X3);但各交互作用均未达到显著水平(P>0.05)。
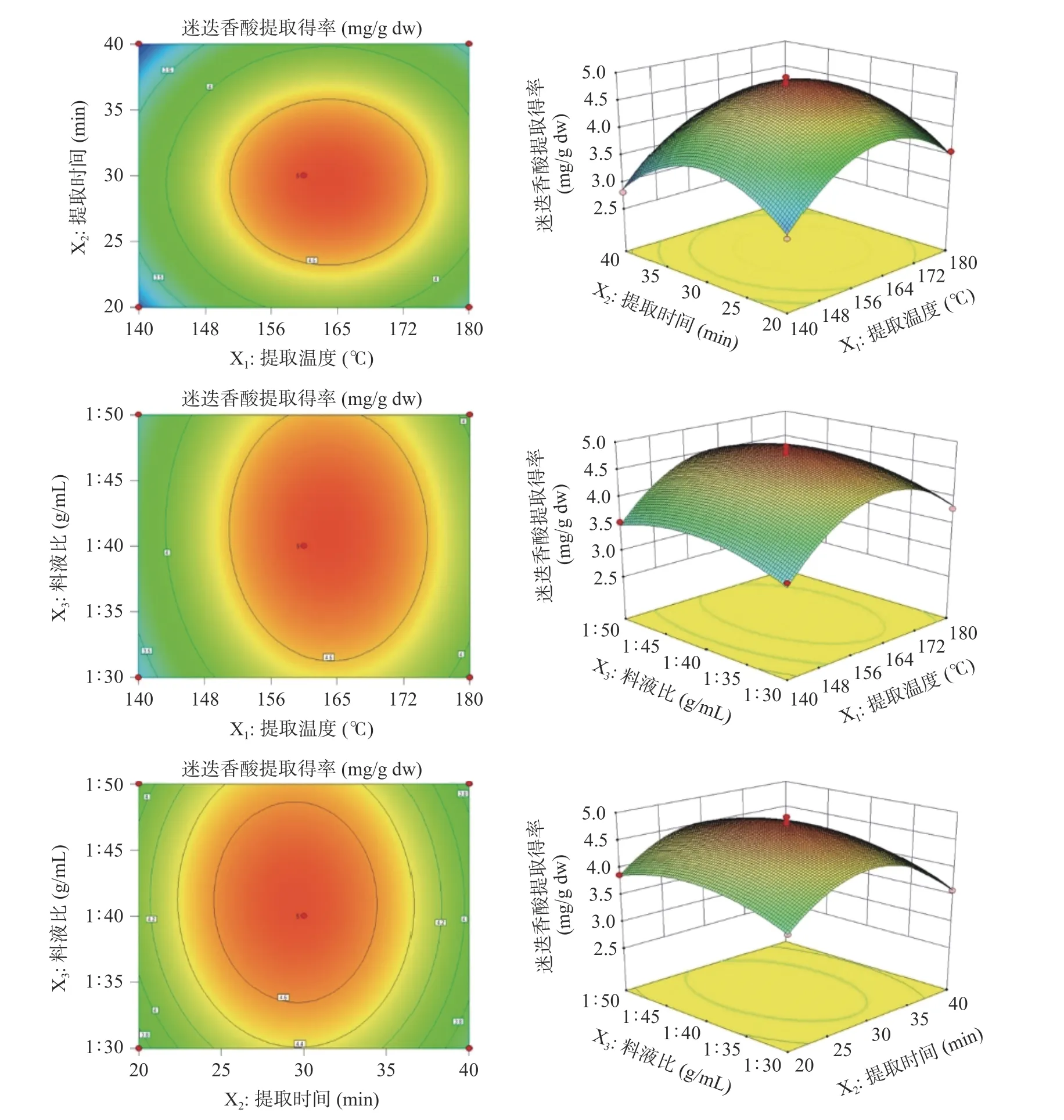
图3 两因素交互作用对响应值的影响Fig.3 Effects of the interaction between two factors on the response value
根据建立的模型进行优化,可得出亚临界水提取紫苏籽粕迷迭香酸的最佳工艺参数为:提取温度162.90 ℃、提取时间29.51 min、料液比1:40.98 g/mL,迷迭香酸提取得率(Y)的理论值为4.80 mg/g dw。为验证响应面法优化的可靠性,根据预测的工艺参数进行验证性实验,考虑到试验的实际操作性将亚临界水提取温度设置为163 ℃、提取时间为30 min、料液比为1:41 g/mL,进行3 次平行实验测得迷迭香酸提取得率为4.91±0.16 mg/g dw,与响应面预测的理论值接近,表明优化后的提取工艺可行。
2.3 不同提取方法的比较
2.3.1 迷迭香酸提取得率的比较 本研究比较了亚临界水提取法与常规溶剂提取法(如甲醇回流、水回流、甲醇超声、水超声)对迷迭香酸提取得率及其抗氧化活性的影响。由图4A 可知,亚临界水提取法的迷迭香酸提取得率最高(4.91±0.16 mg/g dw),其次是甲醇回流提取(3.20±0.09 mg/g dw)、甲醇超声提取(2.95±0.19 mg/g dw)、水回流提取(1.46±0.08 mg/g dw)和水超声提取(0.70±0.03 mg/g dw),且各提取方法存在显著差异(P<0.05)。其中,亚临界水的迷迭香酸提取得率约为甲醇回流提取的1.5 倍,约为甲醇超声提取的1.7 倍。此前,Lee 等[12]采用甲醇浸渍法提取紫苏饼粕中的迷迭香酸的得率为1.72 mg/g;闫拯等[43]采用超声波辅助提取紫苏饼粕中的迷迭香酸,优化工艺参数后迷迭香酸提取得率为0.289%(即2.89 mg/g),梅喜刚等[18]采用硫酸水解法提取紫苏籽粕中迷迭香酸,优化工艺参数后迷迭香酸提取得率为0.541 mg/g,均低于本研究中亚临界水提取法的迷迭香酸得率;而在张玥莉等[50]的研究中,采用超声辅助提取紫苏籽中迷迭香酸的得率为0.59%(即5.9 mg/g),略高于本研究中亚临界水的提取得率,但其提取过程耗时较长,且使用大量乙醇溶剂,提取产品存在溶剂残留等风险。
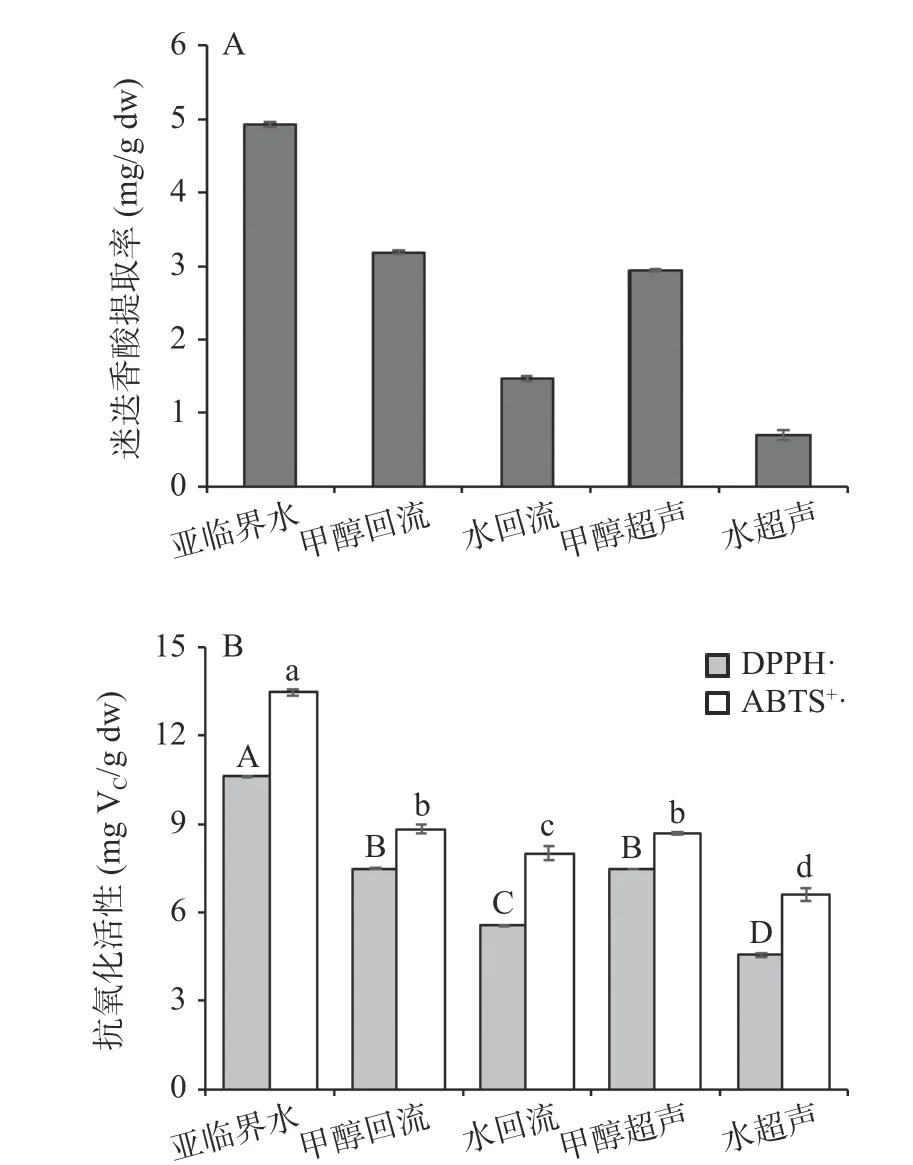
图4 不同提取方法下紫苏籽粕迷迭香酸提取得率及抗氧化活性比较Fig.4 Comparison of rosmarinic acid yields and antioxidant activities of perilla meal extracts obtained by different extraction methods
2.3.2 抗氧化活性比较 比较不同提取方法下紫苏籽粕提取液的抗氧化活性(见图4B)发现,亚临界水提取物的抗氧化活性最高,其清除DPPH 和ABTS自由基能力的VC当量分别为10.62 和13.46 mgVC/g dw;其次是甲醇回流(7.51 和8.84 mgVC/g dw)、甲醇超声(7.49 和8.69 mgVC/g dw)、水回流(5.53 和8.03 mgVC/g dw)和水超声提取(4.56 和6.59 mgVC/g dw)。通过Pearson 相关性分析发现,紫苏籽粕提取物对DPPH 和ABTS 自由基的清除能力与其迷迭香酸的提取得率之间均存在显著的正相关性,相关系数分别是RDPPH=0.991 和RABTS=0.930。换言之,亚临界水提取迷迭香酸的提取得率高,其提取物的抗氧化活性也越强[51]。在前人的研究中也证实了相似的结论,如Park 等[52]比较了亚临界水提取和甲醇提取法对鼠尾藻中活性物质的提取得率及其抗氧化活性的影响,发现不同温度条件下亚临界水的提取效率均显著地高于甲醇提取法,并且亚临界水提取物的抗氧化活性约为甲醇提取物的8~100 倍;Wang 等[38]利用亚临界水提取覆盆子中的花青素,提取得率及其提取物的抗氧化活性均显著地优于常规热水提取和甲醇提取法。综上可知,相比于常规提取法,本研究利用亚临界水提取紫苏籽粕中的迷迭香酸更具优势,不仅可以提高迷迭香酸的提取得率及其提取物的抗氧化活性,还可避免有机溶剂的使用,是一种安全环保、高效的提取方法。
2.3.3 电镜扫描结果 通过扫描电子显微镜(SEM)观察比较不同提取方法处理后紫苏籽粕的微观结构。从图5 可知,未经过提取的紫苏籽粕原料颗粒(见图5A)表面光滑、无气孔、结构相对完整;而提取后的紫苏籽粕残渣颗粒均遭到不同程度破坏,表面结构疏松、有孔隙。并且,亚临界水提取(SWE)的紫苏籽粕颗粒的孔隙呈片状排列,空隙较大,疏松程度远大于其它几种常规提取方法。这可能是因为亚临界水提取过程中,高温和高压条件使紫苏籽粕的结构受到了较大程度的破坏,形成了多孔隙的疏松结构,更有利于目标化合物的释放,从而获得较高的提取得率[53-54]。
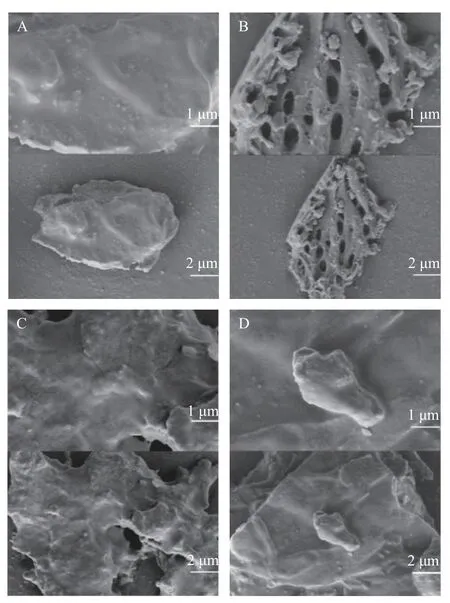

图5 不同提取方法处理后的紫苏籽粕SEM 形貌图Fig.5 SEM morphology of perilla seed meal treated by different extraction methods
3 结论
亚临界水提取技术作为一种绿色环保的新型提取技术,可显著提高多酚、黄酮、多糖等多种天然活性成分的提取效率[31]。本研究中采用亚临界水提取法提取紫苏籽粕中迷迭香酸,优化后的最佳工艺条件为提取温度163 ℃、提取时间30 min、料液比1:41 g/mL。在此条件下,紫苏籽粕中迷迭香酸的提取得率为4.91±0.16 mg/g dw,其清除DPPH 和ABTS自由基能力的VC当量分别为10.62 和13.46 mgVC/g dw。通过比较发现,亚临界水提取法的迷迭香酸提取得率及其抗氧化活性均显著高于几种常规提取法(P<0.05),不仅提高了提取效率,还可避免有机溶剂的使用,节省提取时间。综上,亚临界水提取是一项绿色环保、高效的提取技术,可应用于紫苏籽粕中迷迭香酸的提取,具有良好的开发前景。
