天然酱醪中产β-苯乙醇酵母菌的分离鉴定、发酵条件优化及其应用
2023-08-25蔡伟琪钟武杰周嘉健蹇华丽
蔡伟琪,钟武杰,周嘉健,蹇华丽
(华南农业大学食品学院,广东广州 510642)
酱油的生产工艺主要分为高盐稀态发酵和低盐固态发酵,前者发酵周期长,耐盐微生物能充分发挥作用[1-2],产生大量有机酸类、醇类、酯类等物质,使成品香气更加浓郁、色泽更加鲜艳[3-5]。这与醇类物质在其中发挥的作用密不可分[6],一方面,这类物质在酱油风味成分中占有很大的比重,能为酱油带来协调、柔和的口感;另一方面,又对酯类物质形成具有重要作用[7-8]。
在对高盐稀态发酵酱油香气成分的研究中发现,具有玫瑰型香气的β-苯乙醇常常作为其中一种特征风味物质被检出,且具有较高的香气活性值(odor activity value,OAV)[9-12],此外,Wang 等[13]通过芳香萃取物稀释分析(Aroma extract dilution analysis,AEDA)验证了β-苯乙醇是高盐稀态发酵酱油11 种关键香气化合物之一,说明β-苯乙醇对酱油的香气组成有重要贡献,可为酱油提供花香[14]。彭东等[15]将筛选出的耐盐生香酵母应用到酱油酿造中发现,β-苯乙醇为主要特征香气物质之一。Yao 等[16]研究发现单独接种鲁氏接合酵母能提升β-苯乙醇等醇类物质的含量。此外,阮志强等[17]通过研究发酵过程优势真菌与风味物质相关性分析发现,接合酵母属与β-苯乙醇等多种醇类及酯类物质呈显著正相关。
尽管目前已有许多针对酱油酿造中的耐盐产香微生物进行分离筛选的研究[18-19],但少有以产β-苯乙醇菌株的筛选为目的,并找到与实际生产相适应的工艺,从而提升酱油风味的报道。本研究从高盐稀态发酵酱醪中筛选出一株产β-苯乙醇的耐盐酵母,在对其产β-苯乙醇发酵条件进行优化的基础上,将富含β-苯乙醇的风味液与盐水进行调配,并应用到高盐稀态发酵酱油的酿造中,旨在进一步提升酱油品质。
1 材料与方法
1.1 材料与仪器
发酵50 d 酱醪样品 取自李锦记(新会)食品有限公司;面粉、黄豆、食盐 均为市售;酱油曲精(沪酿3.042 米曲霉) 购于济宁祥园生物科技有限公司;β-苯乙醇 色谱纯,上海阿拉丁生化科技股份有限公司;二氯甲烷 色谱纯,天津市科密欧化学试剂有限公司;果糖、D-半乳糖、L-苯丙氨酸、2,3,5-三苯基氯化四氮唑(TTC) 上海源叶生物科技有限公司;葡萄糖、蔗糖、硫酸铵、氯化钠、氯化铵、麦芽糖及其他生化试剂 分析纯,广州化学试剂厂;尿素、硫酸镁、磷酸氢二钾 分析纯,广州市金华大化学试剂有限公司;三羟甲基氨基甲烷(Tris) 北京酷来搏科技有限公司;酵母浸膏、麦芽汁培养基 广东环凯微生物科技有限公司;DNA 抽提试剂盒(真菌) Omega USA;PCR 引物 擎科生物;TTC 双层培养基:上层:葡萄糖5 g、琼脂粉15 g、TTC 试剂0.5 g,蒸馏水1000 mL;下层:葡萄糖10 g、蛋白胨2 g、酵母膏1.5 g、MgSO4·7H2O 4 g、K2HPO41 g、琼脂粉20 g,蒸馏水1000 mL,调节pH5.6~5.8,121 ℃灭菌15 min;YPD 培养基:酵母膏 10 g,葡萄糖 20 g,蛋白胨20 g,琼脂粉 20 g,115 ℃ 灭菌 20 min;转化培养基:L-苯丙氨酸 4 g、葡萄糖 30 g、蛋白胨 6 g、硫酸镁 0.5 g、磷酸氢二钾 5 g、NaCl 100 g、蒸馏水 1000 mL,121 ℃灭菌 20 min。
TSQ 8000 Evo 三重四级杆气质联用仪(色谱柱TG-WAXMS(60 m×0.25 mm,0.25 μm)) 美国赛默飞世尔科技公司;TGL-16gR 台式高速冷冻离心机上海安亭有限公司;UV-1240 紫外-可见分光光度计 日本岛津公司;ABI GeneAmp® 9700 PCR 仪Applied Biosystems;FR-980A 凝胶成像仪 上海复日科技仪器有限公司;DYCP-31DN DNA 电泳仪北京六一生物科技有限公司。
1.2 实验方法
1.2.1 产β-苯乙醇酵母菌株的筛选 取发酵50 d 酱醪样品,富集培养48 h[20],稀释后涂布TTC 下层平板,28 ℃培养72 h,倒入TTC 上层培养基,28 ℃避光培养2~3 h 后,挑选深色菌落作为初筛菌株,进一步分离纯化并接入麦芽汁培养基进行复筛,28 ℃、180 r/min 培养72 h,用二氯甲烷提取发酵液中β-苯乙醇并通过气质联用仪定量检测其含量,最终得到高产β-苯乙醇的菌株,命名为J13。
1.2.2 菌株鉴定及生物学特性分析
1.2.2.1 细胞形态特征的显微镜观察 将J13 接种于酵母膏胨葡萄糖培养基(YPD)上,28 ℃培养72 h,观察并记录菌落颜色、形状、质地情况等菌落特征。在干净载玻片上滴1 滴蒸馏水,用接种环挑取少量菌体并涂布均匀中,盖上盖玻片,40 倍镜下观察细胞形态特征。
1.2.2.2 生理生化实验 参考《酵母菌的特征与鉴定手册》[21],对J13 进行生理生化试验。其中,糖发酵、碳源同化、氮源同化试验用培养基参照王靖雯等[18]的方法,接种量均为2×107个/mL,30 ℃条件下培养3~7 d,以不含碳源、氮源作为阴性对照。脲酶、产类淀粉化合物、重氮基蓝B(DBB)、高浓度葡萄糖生长试验用培养基均采用YPD 培养基,具体实验方法参照《酵母菌的特征与鉴定手册》[21],尿素培养基、DBB 染色剂的配制方法参照《现代食品微生物学实验技术》[22]。
1.2.2.3 分子生物学鉴定 以J13 的全基因组为模板,以ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)为引物进行PCR 扩增。PCR 反应体系(20 μL):ddH2O 14.7 μL,10×Taq buffer 2.0 μL,Taq DNA 聚合酶0.1 μL,dNTP Mix 1.6 μL,Primer1 0.8 μL,Primer2 0.8 μL,模板1 μL。PCR 反应条件:95 ℃预变性10 min;95 ℃变性0.5 min,58 ℃退火0.5 min,72 ℃延伸35 s,30 个循环;72 ℃延伸10 min。用2%琼脂糖凝胶对10 μL PCR 扩增产物进行电泳检测并送至北京擎科生物科技有限公司进行测序。在NCBI 数据库进行BLAST 比对测序结果,用MEGA 11 的邻位连接法(Neighbor-Joining method)[23]对选择的序列进行1000 次步长计算,构建系统发育树。
1.2.2.4 生物学特性分析 将Z. rouxii13 接入麦芽汁培养基中,在NaCl 质量分数为0、初始pH6、30 ℃、180 r/min 条件下培养72 h。分别改变培养基NaCl 质量分数(0、5%、10%、15%、20%、25%)、初始pH(3、4、5、6、7、8)、培养温度(20、25、30、35、40 ℃),以菌体干重为指标,考察Z. rouxii13 的耐盐性、pH 耐受性、生长温度范围。
1.2.3 酵母菌株产β-苯乙醇发酵工艺的单因素实验
以碳源种类及浓度、氮源种类及浓度、接种量(v/v)、NaCl 质量分数、初始pH、温度作为实验因素,按下述培养条件分别进行单因素实验[24-26]。挑取Z. rouxii13 斜面培养物接入麦芽汁培养基中,30 ℃,180 r/min 培养48 h,得到种子液。发酵条件为培养基初始pH6、NaCl 质量分数10%、L-苯丙氨酸4 g/L、葡萄糖30 g/L、蛋白胨6 g/L、30 ℃、180 r/min、5%接种量、培养96 h。
1.2.3.1 碳源种类及浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 分别以等量的麦芽糖、果糖、葡萄糖、D-半乳糖、蔗糖代替转化培养基中的碳源,其他成分不变,以菌体干重及β-苯乙醇产量为指标筛选最佳碳源种类。确定最佳碳氮源后,分别研究不同碳源浓度(10、30、50、70、90 g/L)对菌株生长及β-苯乙醇产量的影响,筛选出最佳碳源浓度,用于后续实验。
1.2.3.2 氮源种类及浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 分别以等量的蛋白胨、酵母膏、硫酸铵、氯化铵、尿素代替转化培养基中的氮源,其他成分不变,以菌体干重及β-苯乙醇产量为指标筛选最佳氮源种类。确定最佳氮源后,研究不同氮源浓度(2、4、6、8、10 g/L)对菌株生长及β-苯乙醇产量的影响,筛选出最佳氮源浓度,用于后续实验。
1.2.3.3 接种量对Z. rouxii13 生长及β-苯乙醇产量的影响 改变接种量(3%、5%、7%、9%、11%(v/v)),其余条件不变,以菌体干重及β-苯乙醇产量为指标,研究不同接种量对菌株生长及β-苯乙醇产量的影响。
1.2.3.4 NaCl 质量分数对Z. rouxii13 生长及β-苯乙醇产量的影响 改变NaCl 质量分数(0、5%、10%、15%、20%)其余条件不变,以菌体干重及β-苯乙醇产量为指标,研究不同NaCl 质量分数对菌株生长及β-苯乙醇产量的影响。
1.2.3.5 初始pH 对Z. rouxii13 生长及β-苯乙醇产量的影响 改变初始pH(4、5、6、7、8),其余条件不变,以菌体干重及β-苯乙醇产量为指标,研究不同初始pH 对菌株生长及β-苯乙醇产量的影响。
1.2.3.6 温度对Z. rouxii13 生长及β-苯乙醇产量的影响 改变培养温度(18、23、28、33、38 ℃),其余条件不变,以菌体干重及β-苯乙醇产量为指标,研究不同温度对菌株生长及β-苯乙醇产量的影响。
1.2.3.7 L-苯丙氨酸浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 改变L-苯丙氨酸浓度(0、4、8、10、12 g/L),其余条件不变,以菌体干重及β-苯乙醇产量为指标,研究不同L-苯丙氨酸浓度对菌株生长及β-苯乙醇产量的影响。
1.2.4 酵母菌株产β-苯乙醇发酵工艺的正交试验在单因素实验的基础上,选择蛋白胨(A)、NaCl 质量分数(B)、温度(C)作为正交试验变量,设计L9(34)正交试验,以β-苯乙醇产量为考察指标,对发酵条件进行优化。正交试验因素与水平设计见表1。
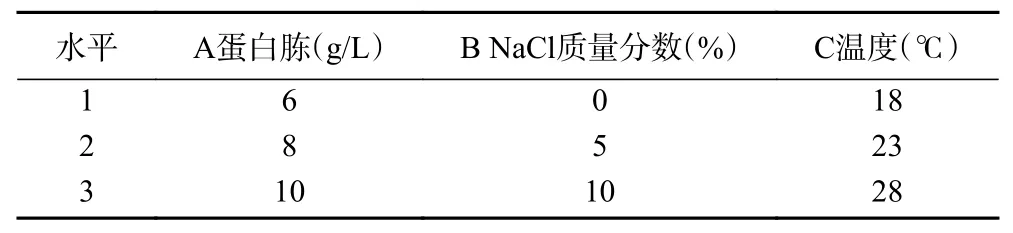
表1 正交试验设计因素与水平Table 1 Factors and levels of orthogonal test design
1.2.5 高盐稀态发酵酱油制作工艺
1.2.5.1 制曲工艺 参考高献礼[27]的酱油酿造工艺。黄豆浸泡3 h,在115 ℃下灭菌30 min,取出冷却。以黄豆:面粉质量比=3:1 的比例混合,以万分之四的接种量接入曲精,31 ℃培养,在制曲的第10、18 及26 h 分别翻曲一次,第40 h 时,曲料表面呈黄绿色,制曲完成。
1.2.5.2 发酵工艺 参考某企业生产参数并稍作修改,采用最优发酵条件培养Z. rouxii13 得到培养液,在6000 r/min,4 ℃,10 min 条件下对培养液进行离心,去除菌体,得到风味液并加入2 倍质量比的盐水,最终配成NaCl 质量分数为18%的调配液,以成曲:调配液质量比=1:2.33 的比例混合,置于3.2 L 发酵罐中常温酿造20 d,每天搅拌一次。酿造结束后用纱布过滤酱醪,得到酱油用于感官评定。
1.2.6.1β-苯乙醇的提取及检测 参考荣绍丰等[28]的方法,提取并检测发酵液中的β-苯乙醇含量。发酵液于6000 r/min、4 ℃条件下离心10 min 后取10 mL 上清液,加入等体积二氯甲烷,萃取30 min 后取有机相,根据浓度用二氯甲烷适当稀释,用0.22 μm有机相滤膜过滤并收集滤液。GC 条件:载气为氦气,流速1.0 mL/min,进样量1.0 μL,分流比为10:1,色谱柱升温程序为:60 ℃,保留1 min;以8 ℃/min升温到180 ℃,保留2 min;再以5 ℃/min 升温到220 ℃,保留10 min。MS 条件:采用电子电离方式,电离能为70 eV,检测器电压为857 V,扫描范围为m/z 50~400,扫描速率为2.00 scans/s;进样口和离子源温度分别为250 ℃和230 ℃。采用SIM 模式,以m/z 91.1 和122.0 两个离子为定量离子进行分析。采用外标法定量检测β-苯乙醇浓度。β-苯乙醇标准曲线绘制方法为:取β-苯乙醇标品梯度稀释到质量浓度5.1、10.2、20.4、30.6、40.8 mg/L,采用上述GC和MS 条件检测不同质量浓度β-苯乙醇标准品,得到标准曲线方程为:y=3E+06x-7E+06(R2=0.9939)。以标准曲线方程计算β-苯乙醇含量。
1.2.6.2 生物量的测定 取9 mL 发酵液,6000 r/min离心10 min,用蒸馏水洗涤三次,105 ℃烘干,称重。
1.2.7 酱油风味的感官评定 由17 名具有感官评定经验的食品专业的人员组成评定小组,参照文献[29-30]中能代表酱油香气轮廓的描述词,对酱油的酱香、醇厚、鲜味、酸味、咸味、色泽、整体评价7 个指标采用10 分制进行评价(1 表示无感觉,10 表示感觉强烈)。评定时成员之间互不交流,样品评定之间用纯净水漱口。
1.3 数据处理
实验均重复3 次,数据均采用平均值±标准差(mean±SD)表示,使用SPSS 24.0 软件进行方差分析,并通过Duncan’s 进行显著性差异分析(P<0.05),使用Origin 2021 进行绘图。
2 结果与分析
2.1 产β-苯乙醇酵母菌株的筛选及鉴定
2.1.1 产β-苯乙醇酵母菌株的筛选 酵母活细胞中的脱氢酶能将无色的氧化态TTC 还原为红色的三苯基甲瓒(TTF),从而将平板上的菌落染成红色[31]。因此可通过呈色的深浅来判断菌株产β-苯乙醇能力的高低。通过呈色反应,选出45 株显色明显的菌株。进一步对比,选出4 株颜色较深的菌株,分别为J5、J7、J13、J15,对这4 株菌株进行复筛。通过GC-MS测定4 株菌在麦芽汁培养基中的β-苯乙醇产量。结果表明,J13 的β-苯乙醇产量最高,达到177.88 mg/L。因此,选择J13 作为进一步研究对象。
2.1.2 酵母的形态特征 通过菌落形态观察(图1a),J13 在YPD 平板上培养的菌落形态呈圆形,乳白色,光滑,中间凸起。通过显微镜观察,J13 细胞为椭圆形,出芽生殖(图1b)。
通常情况下,果树在实际的成长过程当中,经常会出现发育不均衡的现象。因此,在实际的果树培养当中,需要定期对果树进行修剪,适时的调整果树的树枝、树冠等,调整果树的平衡。如果果树的花或者芽等过多的出现在同一枝条上,果树管理人员需要对进行适当的修剪,避免树枝上的营养被过多的果实所吸收,影响果实的成长质量。管理人员在不同情况下,对果树进行适当的修剪与调整,在很大程度上有助于提升果树的结果质量。
2.1.3 酵母的生理生化鉴定 如表2 所示,J13 能发酵葡萄糖、果糖,不能发酵木糖等其他糖类物质。能同化葡萄糖、麦芽糖和果糖,不能同化淀粉等其他碳源。能同化蛋白胨,不能同化尿素、硫酸铵和硝酸钠。其他试验结果表明,J13 脲酶、DBB 及产类淀粉化合物测试均为阴性,能在高葡萄糖浓度下生长。将这些结果与文献中的生理生化结果对比[32],发现J13 与鲁氏接合酵母的描述基本一致。

表2 J13 生理生化鉴定结果Table 2 Physiological and biochemical identification of J13
2.1.4 酵母的ITS 序列测定及系统发育分析 BLAST比对结果显示,J13 与多株鲁氏接合酵母的ITS 序列相似性高达100%,随机挑选几个菌种的ITS 序列构建系统发育树,如图2 所示。结果表明,J13 与OL679475.1 序列的亲缘关系最近,位于系统发育树的同一分支,可信度高达100%。初步确定分离菌株为鲁氏接合酵母。综合《酵母菌的特征与鉴定手册》中鲁氏结接合酵母的生理生化特征描述、ITS 序列比对和系统发育进化树分析,最终鉴定J13 为Z. rouxii。
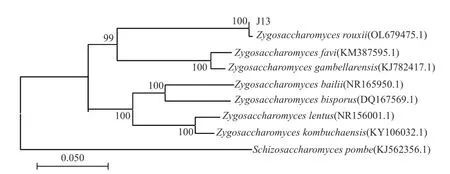
图2 分离菌株ITS 序列系统发育进化树Fig.2 Phylogenetic tree of isolated strain based on its ITS sequence
2.1.5 酵母的生物学特性 如图3A 所示,NaCl 质量分数对Z. rouxii13 的生物量影响显著。在NaCl质量分数为0~10%的范围内,Z. rouxii13 的生物量随着NaCl 质量分数的升高而增加,当超过10%时,生物量随之下降,在NaCl 质量分数为20%时,Z.rouxii13 仍然能生长,说明其具有一定的耐盐性,能在高盐稀态酱油中生长。
如图3B 所示,培养基的初始pH 对Z. rouxii13的生物量影响显著。当培养基初始pH 为3 时,其生长明显受到抑制,当初始pH 为4~7 范围内,其生物量随着pH 的增加而增加。这与酱油发酵过程中的pH 范围相符[33],说明Z. rouxii13 能在高盐稀态酱油发酵过程中生长。
如图3C 所示,在20~35 ℃温度范围内,Z. rouxii13 的生物量先增加后减少,25 ℃时生物量达到最高,当温度升高到40 ℃时,菌株生长明显受到抑制。
2.2 酵母菌株产β-苯乙醇的发酵条件优化
2.2.1 碳源种类及浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 碳源种类对Z. rouxii13 的生长及β-苯乙醇产量的影响如图4A 所示,其影响从大到小排序依次为:麦芽糖>果糖>葡萄糖>D-半乳糖>蔗糖,而前三种碳源对β-苯乙醇产量无显著差异,考虑到葡萄糖廉价易得,因此以葡萄糖作为最优碳源。由图4B 可得,在葡萄糖添加量为10~90 g/L 范围内,Z. rouxii13 的生物量及β-苯乙醇产量均无显著性变化(P>0.05)。结合本研究L-苯丙氨酸浓度优化结果,分析可能是由于L-苯丙氨酸的存在使Z. rouxii13 的生长受到抑制[24],在这种条件下碳源浓度的改变对Z. rouxii13 的生物量影响不大。从经济成本的角度考虑,选择葡萄糖用量较少的浓度即30 g/L 的水平进行正交试验优化。
2.2.2 氮源种类及浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 氮源种类对Z. rouxii13 的生长及β-苯乙醇产量的影响如图4C 所示,其影响从大到小排序依次为:蛋白胨>酵母膏>氯化铵>硫酸铵>尿素,因此以蛋白胨作为最优氮源。由图4D 可得,在蛋白胨添加量为2~10 g/L 范围内,随着蛋白胨浓度的增加,Z. rouxii13 的生物量及β-苯乙醇产量均先增加后减少,当蛋白胨浓度为8 g/L 时,生物量达最大值3.7 g/L,β-苯乙醇产量为1002.8 mg/L。在蛋白胨浓度为4~10 g/L 的范围内,β-苯乙醇产量无显著性差异(P>0.05),但在蛋白胨浓度分别为10 g/L 和4 g/L时,生物量分别为3.15 g/L 和1.92 g/L,前者的生物量显著高于后者(P<0.05),因此选择6~10 g/L 水平进行正交试验。
2.2.3 接种量对Z. rouxii13 生长及β-苯乙醇产量的影响 由图5A 可得,在接种量为3%~11%范围内,随着接种量的增加,Z. rouxii13 的生物量先增加后不变,β-苯乙醇产量无显著差异(P>0.05),参考史荣超等[25]对发酵过程中接种量对β-苯乙醇产量影响的研究,接种量的改变对最终β-苯乙醇产量的影响并不显著(P>0.05),因此选择5%作为接种量。
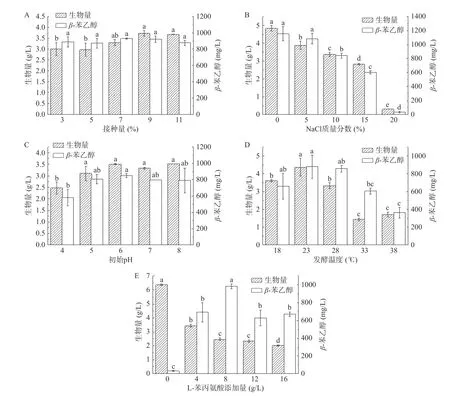
图5 接种量(A)、NaCl 质量分数(B)、初始pH(C)、发酵温度(D)、L-苯丙氨酸浓度(E)对Z. rouxii 13 生长及转化合成β-苯乙醇能力高低的影响Fig.5 Effects of inoculation (A), NaCl concentration (B), initial pH (C), fermentation temperature (D) and L-phenylalanine (E)on the growth and transformation synthesis of β-phenylethanol of Z. rouxii 13
2.2.4 NaCl 质量分数对Z. rouxii13 生长及β-苯乙醇产量的影响 由图5B 可得,在NaCl 质量分数为0~20%范围内,随着NaCl 质量分数的升高,Z. rouxii13 的生物量及β-苯乙醇产量均显著性下降(P<0.05)。结合本研究L-苯丙氨酸浓度优化结果,分析可能是由于在L-苯丙氨酸的存在下,Z. rouxii13 的生长受到抑制[24],在这种条件下再去适当增加NaCl 质量分数,反而会抑制其生长。当NaCl 质量分数为20%时,Z. rouxii13 仍能生长,说明其具有一定的耐盐性,能在高盐稀态酱油中生长。在NaCl 质量分数为0~10%的水平范围内,β-苯乙醇产量显著高于其他水平(P<0.05),因此选择这三个水平进行正交试验。
2.2.5 初始pH 对Z. rouxii13 生长及β-苯乙醇产量的影响 由图5C 可得,在初始pH 为4~8 范围内,随着初始pH 的增加,Z. rouxii13 的生物量及β-苯乙醇产量均先增加后不变。研究表明pH 也会通过影响艾氏途径中的关键酶活性从而影响芳香醇的产量,而这种影响既有正相关的也有负相关的[34],因此需要采用折中的pH 来平衡整个艾氏途径,故选择pH6 水平进行正交试验。
2.2.6 温度对Z. rouxii13 生长及β-苯乙醇产量的影响 由图5D 可得,在发酵温度为18~38 ℃范围内,随着温度的升高,Z. rouxii13 的生物量及β-苯乙醇产量均先增加后减少,当温度为23 ℃时,生物量达最大值4.36 g/L,β-苯乙醇产量为878.38 mg/L。结果表明,在温度为18~28 ℃范围内,菌株生物量及β-苯乙醇产量均高于其他水平,因此选择这三个水平进行正交试验。
2.2.7 L-苯丙氨酸浓度对Z. rouxii13 生长及β-苯乙醇产量的影响 由图5E 可得,随着L-苯丙氨酸浓度的增加,Z. rouxii13 的生物量逐渐减少,β-苯乙醇含量先增加后减少,当L-苯丙氨酸浓度为0 g/L 时,有利于Z. rouxii13 生长,但由于缺少前体物质L-苯丙氨酸,Z. rouxii13 几乎不产β-苯乙醇,当L-苯丙氨酸浓度为4 g/L 时,Z. rouxii13 的生长已明显受到抑制,但β-苯乙醇含量显著增加,说明L-苯丙氨酸的存在可以促进β-苯乙醇的合成,且抑制Z. rouxii13 生长。当继续增加L-苯丙氨酸浓度,Z. rouxii13 的生长受到严重抑制,因此选择L-苯丙氨酸浓度为4 g/L 进行正交试验。
2.2.8 正交试验 正交试验结果与分析见表3 及表4。由极差分析可知,影响Z.rouxii13 产β-苯乙醇含量的主次因素依次为温度、蛋白胨、NaCl 质量分数。由方差分析可知,温度、蛋白胨达到了显著水平,分析可知理论最佳优化组合是A3B2C3。通过最佳组合验证性试验,结果表明最优组合为A3B2C3,即蛋白胨10 g/L、NaCl 5%、温度28 ℃,此条件下的β-苯乙醇含量为1.40 g/L。
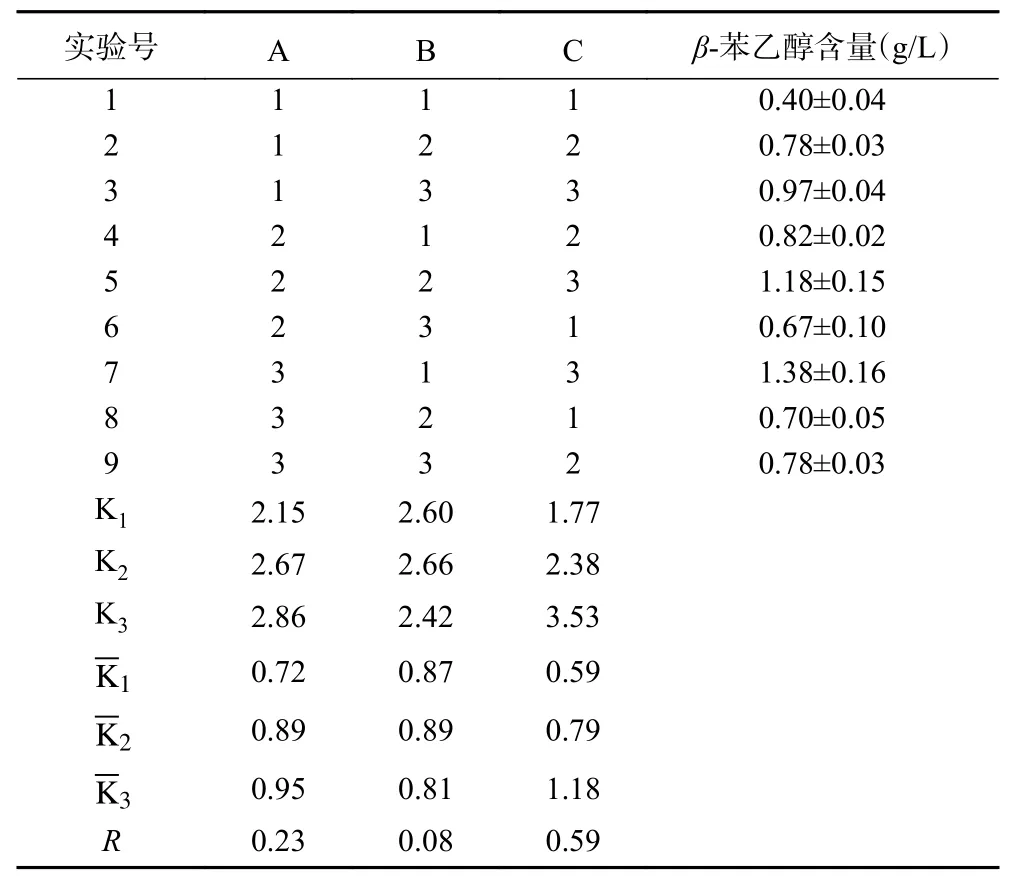
表3 正交试验设计与结果Table 3 Orthogonal experimental design and results
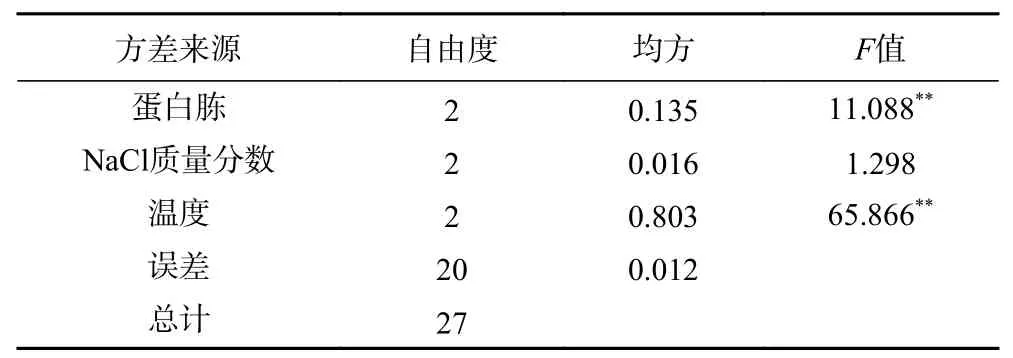
表4 试验结果方差分析Table 4 Analysis of variance of test results
2.3 风味液对酱油感官品质的影响
对2 个不同处理的样品进行感官评价,绘制雷达图,由图6 可知,风味液组与对照组的整体评分分别为7.01 分和6.22 分,显示出风味液组具有更高的可接受度。在酱香、醇厚感和鲜味方面,风味液组得分分别为7.05 分、7.02 分、6.47 分,对照组得分分别为5.62 分、5.52 分、5.77 分。在色泽、酸味和咸味方面,两组差异不明显。综上分析,添加富含β-苯乙醇的风味液赋予酱油更加浓郁的酱香及醇厚的口感,且提升了酱油的鲜味。
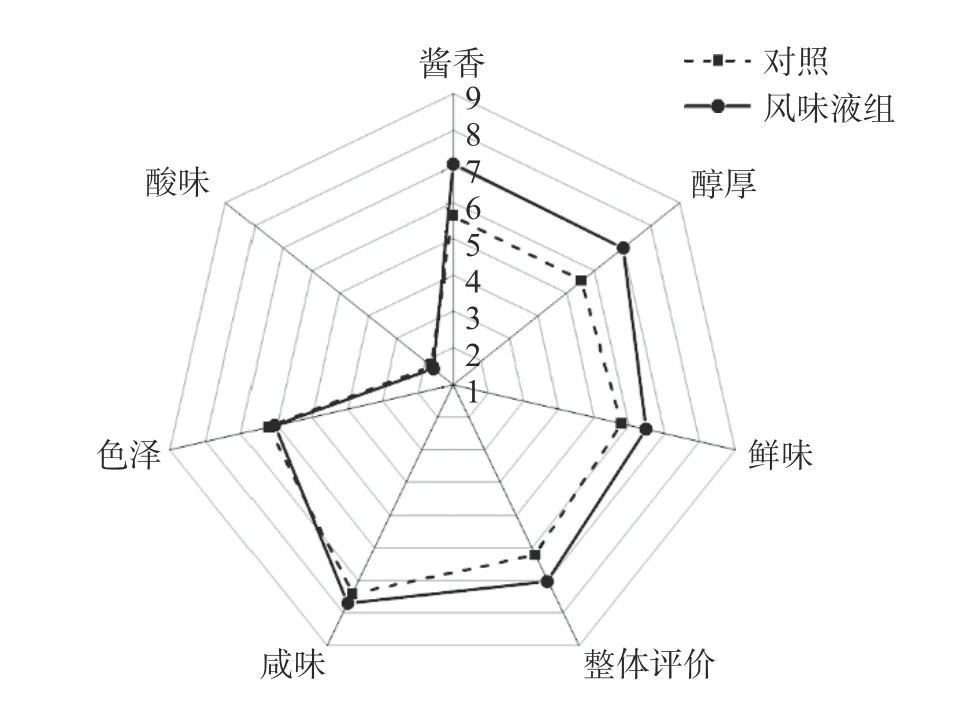
图6 风味液组与对照组感官分析雷达图Fig.6 Radar chart of sensory analysis of flavoring group and control group
3 结论
本研究从天然酱醪中筛选出一株产β-苯乙醇的酵母,经形态学观察、生理生化实验及分子生物学方法鉴定并命名为Z. rouxii13。其耐受20% NaCl,能适应宽广的pH 环境及温度范围,具有优良的生物学特性。通过单因素和正交试验,对Z. rouxii13 产β-苯乙醇的培养基成分及发酵条件进行优化,最终得到的最优发酵条件为:L-苯丙氨酸4 g/L、葡萄糖30 g/L、蛋白胨10 g/L、硫酸镁0.5 g/L、磷酸氢二钾5 g/L、NaCl 50 g/L、pH6.0,温度28 ℃,β-苯乙醇含量达到1.40 g/L。通过发酵条件优化,得到富含β-苯乙醇的风味液,将其应用到高盐稀态发酵酱油的酿造工艺中发现,相比对照组,酱油的酱香及醇厚感明显提升。这一结果进一步说明β-苯乙醇对酱油香气组成有重要贡献,这与许多前期研究的结果一致[13,35],此外,本研究将富含β-苯乙醇的风味液应用于酱油酿造中以此提升酱油整体风味,这为企业改善酱油整体香气提供了一定的思路和方法。由于风味液在整体工艺中的添加时机及添加量对酱油的风味有至关重要的影响,本研究将进一步开展该方面的研究;同时,直接将高产β-苯乙醇的菌株选择合适的时机及接种量接种至酱醪中,同时优化发酵条件,使其适应并融入多菌种发酵体系,从而强化酱油酿造工艺也将是另一个可行的研究方向。
