2型糖尿病患者LCN2、OPG/RANKL信号通路关键因子相关性及对骨质疏松的预测效能
2023-08-25徐云白立炜王迪耿锐娜刘北彦
徐云,白立炜,王迪,耿锐娜,刘北彦
(新乡医学院第一附属医院 内分泌科,河南 新乡 453100)
2型糖尿病(type 2 diabetes,T2DM)属全身代谢内分泌系统疾病,长期高血糖状态可破坏正常骨代谢平衡,诱发骨质疏松。据统计,T2DM患者骨质疏松发病率为37.80%,随着时间推移可引起骨质疏松骨折,增加残疾及死亡风险[1-2]。资料显示,成骨细胞与破骨细胞间失衡是引起骨质疏松的关键环节[3]。脂质运载蛋白-2(lipocalin-2,LCN2)主要由成骨细胞合成,除参与糖脂代谢过程外,还可抑制干细胞骨化,参与骨质疏松发病过程[4]。护骨素/核因子κB受体活化因子配体(osteoprotegerin/receptoractivator of nuclear factor-κB ligand,OPG/RANKL)信号通路是迄今发现的最重要的骨代谢调节机制,其中OPG可抑制骨吸收,RANKL可刺激破骨细胞分化、成熟,抑制破骨细胞凋亡。动物实验证实,OPG/RANKL信号通路可通过调控骨代谢参与骨质疏松发生发展过程[5]。本研究通过检测T2DM患者LCN2、OPG/RANKL信号通路关键因子表达,分析其间关系,指导临床防治。
1 对象与方法
1.1 临床资料
选取2020年1月至2022年12月新乡医学院第一附属医院收治的140例T2DM患者作为研究组,男80例,女60例;年龄60~85(72.51±3.38)岁;另按照1∶1比例纳入140例同期健康体检者作为对照组,男75例,女65例;年龄60~83(71.68±3.76)岁。本研究经医院医学伦理委员会审核批准(审批号2023312)。
1.2 选取标准
(1)纳入标准:符合T2DM诊断标准[6],表现为多食、多饮、多尿、原因不明的体重下降,任意时间随机血糖≥11.1 mmol·L-1;签署知情同意书。(2)排除标准:肝、肾异常;伴影响骨代谢疾病;近3个月内骨折;1型糖尿病;近3个月内服用骨代谢药物。
1.3 研究方法
1.3.1LCN2、OPG/RANKL信号通路关键因子
(1)两组患者至少禁食8 h,采集入院当天清晨空腹肘静脉血4 mL,均分为2份(各2 mL)。(2)LCN2测定:取2 mL血液标本行离心处理(2 500 r·min-1,15 min),采用酶联免疫吸附法测定血清LCN2水平。(3)OPG/RANKL信号通路关键因子测定:取2 mL血液标本行离心处理(1 500 r·min-1,10 min),取上清液,加入等体积磷酸盐缓冲液(phosphate buffer solution,PBS)及淋巴细胞分离液,低温离心20 min,吸出单个核细胞层,置于离心管,加3倍体积PBS洗涤,离心取上清液,加入PBS悬浮沉淀,获得外周血单个核细胞,提取RNA,配置反应体系,以GAPDH作内参进行实时荧光定量聚合酶链反应(real-time reverse transcription-polymerase chain reaction,RT-PCR),反应体系:cDNA 2 μL,上游和下游引物各0.8 μL,灭菌蒸馏水6.4 μL,SYBR Green Master Mix 10 μL。引物序列:OPG上游5’GCTGTTCCTACCAAGATTATAC-3’,下游5’GAATCAGAACACAAGTCAGT-3’;RANKL上游5’GCGTACCTACAGACTATC-3’,下游5’GGACACCTGAATGCTAAT-3’;GAPDH上游5’AGGCCGGTGTGAGTATGTC-3’,下游5’TGCCTGCTTCACCACCTTGT-3’。反应条件:95 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,共40个循环,重复3次后取OPG和RANKLmRNA均值,绘制熔曲线。采用酶联免疫吸附法测定OPG和RANKL蛋白水平。
1.3.2分组标准[7]
根据双能X线骨密度仪测定骨密度T值,当骨密度T值≥-1提示骨量正常,-2.5<骨密度T值<-1提示骨量减少,骨密度T值≤-2.5提示骨质疏松。
1.3.3试剂与仪器
Microfuge 16台式微量离心机购自贝克曼库尔特国际贸易(上海)有限公司,酶联免疫吸附法试剂盒购自北京力波生物科技有限公司,双能X线骨密度仪购自淮安辛宇弘医疗科技有限公司,离心管购自美国Corning公司,RT-PCR试剂盒购自上海西格生物科技有限公司,PCR仪购自南京贝登医疗股份有限公司。
1.4 统计学处理
2 结果
2.1 LCN2、OPG/RANKL信号通路关键因子
骨质疏松亚组LCN2、RANKLmRNA和LCN2、RANKL蛋白>骨量减少亚组>骨量正常亚组>对照组,OPGmRNA和OPG蛋白<骨量减少亚组<骨量正常亚组<对照组(P<0.05)。见表1。
表1 两组LCN2、OPG/RANKL信号通路关键因子
2.2 LCN2与OPG/RANKL信号通路关键因子相关性
Pearson结果显示,T2DM骨质疏松患者LCN2、RANKLmRNA和LCN2、RANKL蛋白呈正相关,与OPGmRNA和OPG蛋白呈负相关(P<0.05)。见表2。
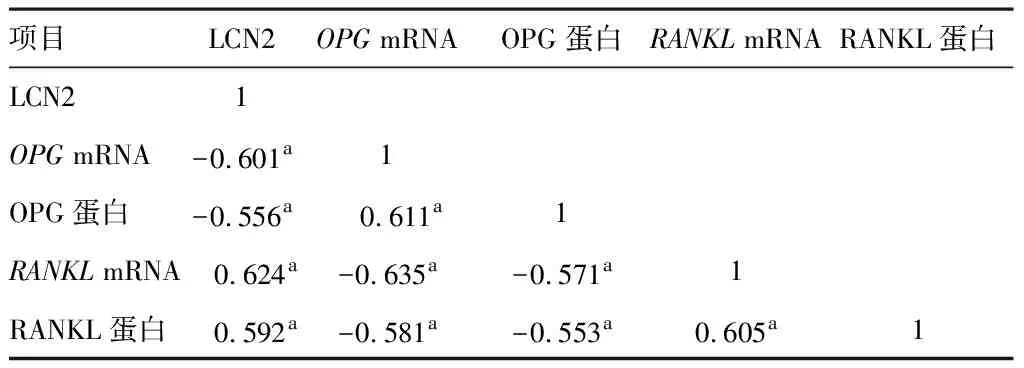
表2 LCN2与OPG/RANKL信号通路关键因子相关性(r)
2.3 LCN2与OPG/RANKL信号通路关键因子交互作用
参照2.1中各指标平均值分层,LCN2、RANKLmRNA和LCN2、RANKL蛋白≥平均值、OPGmRNA和OPG蛋白≤平均值为暴露(﹢),反之为非暴露(-)。当LCN2、RANKLmRNA和LCN2、RANKL蛋白同时暴露,T2DM患者骨质疏松发生风险是非暴露的4.875、1.462倍;当LCN2、OPGmRNA和LCN2、OPG蛋白同时暴露,T2DM患者骨质疏松发生风险是非暴露的4.643、6.734倍。见表3。

表3 LCN2与OPG/RANKL信号通路关键因子交互作用
2.4 LCN2、OPG/RANKL信号通路关键因子联合预测T2DM骨质疏松效能
以T2DM骨质疏松为阳性标本,骨量减少为阴性标本绘制ROC曲线,结果显示LCN2联合OPG/RANKL信号通路关键因子预测T2DM患者继发骨质疏松的AUC为0.943(95% CI:0.877~0.980),优于单纯LCN2、OPGmRNA及OPG蛋白、RANKLmRNA、RANKL蛋白预测效能[AUC=0.753(95% CI:0.655~0.834),AUC=0.733(95% CI:0.634~0.817),AUC=0.750(95% CI:0.652~0.832),AUC=0.830(95% CI:0.741~0.898),AUC=0.747(95% CI:0.649~0.829)]。见表4。

表4 LCN2、OPG/RANKL信号通路关键因子预测T2DM骨质疏松效能比较
3 讨论
T2DM患者受糖代谢异常、高龄因素双重影响,骨质量受损,骨折风险高。文献报道,相同骨密度下,T2DM患者骨折风险远高于非T2DM人群,给其正常生活与工作带来严重困扰[8-9]。骨密度测定是骨质疏松诊断的金标准,但骨密度数值仅能反映一种病理状态,临床医生需综合分析全身状况方能确诊,在此基础上寻求特异性强、灵敏度高的血清学指标更具现实意义。
3.1 LCN2与T2DM骨质疏松关系
研究证实T2DM患者血清LCN2表达高于健康体检者[10-11],与本研究观点相符,考虑原因与T2DM患者存在糖脂代谢异常、胰岛素抵抗、肥胖、微炎症状态有关,下调LCN2有望维持葡萄糖稳定,控制T2DM病情。动物实验发现,小鼠成骨细胞中LCN2表达量高于其他组织数倍,可通过影响骨吸收与骨形成之间平衡诱发骨质疏松[12]。国外研究表明,上调破骨细胞中LCN2表达可负向调控破骨细胞增殖、分化,增加骨质疏松发生风险[13]。吴静等[14]研究发现,高LCN2是老年T2DM合并骨质疏松的独立危险因素。本研究结果显示,骨质疏松亚组血清LCN2水平>骨量减少亚组>骨量正常亚组,且与骨密度呈正相关。可能机制为:高LCN2可通过下丘脑调控摄食行为,影响能量代谢和脂肪增长,间接激活成骨细胞分化成熟;高LCN2可削弱巨噬细胞集落刺激因子作用,加快骨钙磷丢失,增加骨质疏松发生风险。ROC曲线显示,LCN2单独预测T2DM骨质疏松的AUC为0.75,说明LCN2在T2DM骨质疏松预测方面具有一定价值。需注意的是,不同生理病理状态下,LCN2表达和功能存在一定差异,可能会引起部分数据偏倚,故建议与其他指标联合应用。
3.2 OPG/RANKL信号通路关键因子与T2DMG骨质疏松关系
随着分子生物学技术不断提高,越来越多研究发现细胞信号转导通路途径参与T2DM、骨质疏松发生发展[15]。证据表明,OPG/RANKL信号通路与Notch信号通路交叉作用可共同影响胰岛β细胞活性与功能,增加血糖水平,促进T2DM病情进展[16]。以往研究指出,糖尿病患者血清OPG、RANKL表达异常,且与胰岛素抵抗指数、糖化血红蛋白相关[17]。基于此,本研究初步分析T2DM患者和健康体检人群外周血单个核细胞中OPG、RANKLmRNA和OPG、RANKL蛋白表达,发现研究组RANKLmRNA和RANKL蛋白高于对照组,OPGmRNA和OPG蛋白低于对照组,这一结果提示T2DM发生与OPG/RANKL信号通路激活密切相关。另有研究表明,OPG/RANKL信号通路激活是骨质疏松发生的重要分子生物学机制[18]。RANKL是迄今唯一能直接刺激破骨细胞发育的细胞因子,OPG是RANKL天然诱导受体,生理状态下呈动态平衡,一旦两者间平衡被打破,可造成进行性骨量丢失、骨强度降低,从而导致骨质疏松。研究证实,高糖状态可下调OPG,上调RANKL,影响骨化,但当前研究集中于小鼠实验[19-20],鲜见其在T2DM骨质疏松患者中研究报道。本研究对此展开讨论分析发现,骨质疏松亚组RANKLmRNA和RANKL蛋白>骨量减少亚组>骨量正常亚组,OPGmRNA和OPG蛋白<骨量减少亚组<骨量正常亚组,这一结果为解释OPG/RANKL信号通路可能存在的调控机制提供依据,有利于深入研究T2DM骨质疏松发病机制。长期高血糖及老龄化可引起免疫系统功能持续低度活化,生成过量炎症细胞,增加RANKL含量,刺激OPG/RANKL信号通路,作用于破骨细胞,减少骨形成,最终形成骨质疏松。ROC曲线显示,RANKL、OPGmRNA和RANKL、OPG蛋白均具有T2DM骨质疏松预测效能,但仍存在提升空间。
3.3 LCN2、OPG/RANKL信号通路关键因子联合预测T2DM骨质疏松效能
本研究拟分析LCN2、RANKLmRNA和LCN2、RANKL蛋白、OPGmRNA和OPG蛋白联合预测T2DM骨质疏松效能,AUC为0.943,高于单一指标预测效能,可帮助准确有效识别T2DM骨质疏松,指导临床防治,延缓病情进展。进一步研究发现,LCN2不仅与OPG/RANKL信号通路关键因子存在相关性,还存在交互作用,该结果说明两者存在协同效应,可共同促进骨质疏松发生发展,密切监测LCN2及OPG/RANKL信号通路关键因子变化有助于协同预防骨质疏松发生,提高骨质疏松防治水平。
4 结论
T2DM患者LCN2、OPG、RANKLmRNA和LCN2、OPG、RANKL蛋白呈异常表达,且LCN2与OPG、RANKLmRNA和OPG、RANKL蛋白存在交互作用,联合检测有助于提高T2DM骨质疏松预测效能,为临床诊治提供有利依据。但本研究属单中心、小样本量研究,可能限制研究结果泛化,仍需进一步研究证实。
