脑胶质瘤相关癫痫的影响因素分析
2023-08-25詹文刚张志强
王 超 李 聪 詹文刚 张志强
1)广州中医药大学第二临床医学院,广东 广州 510006 2)广东省中医院大学城医院,广东 广州 510120
脑胶质瘤是起源于脑神经胶质细胞最常见的原发性颅内恶性肿瘤,在中国其年发病率(5~8)/10万,全身肿瘤中其5 a病死率仅次于胰腺癌和肺癌[1]。脑胶质瘤相关癫痫(glioma-related epilepsy,GRE)的发生率为30%~80%,是脑胶质瘤患者最主要的就诊症状之一,以抽搐、意识丧失、全身强直等为临床表现[2]。本文回顾性分析广东省中医院2018—2021年收治的112 例脑胶质瘤手术患者的临床、影像学和病理资料,旨在探讨导致脑胶质瘤相关癫痫发作的主要危险因素。
1 资料和方法
1.1 研究对象回顾性收集广东省中医院2018—2021年收治的临床资料完整的胶质瘤手术患者的临床、影像学和病理资料。入选标准:(1)术前MRI 提示脑胶质瘤;(2)术后经病理诊断为胶质瘤;(3)排除复发病例。根据以上条件共112例符合要求,其中男75 例,女37 例;年龄2~91 岁,平均46.5 岁。术前合并癫痫46 例,男31 例,女15 例。本研究通过广东省中医院伦理委员会审批(批号:YE2022-283-01)。
1.2 研究方法
1.2.1 一般资料:①性别:分为男性组和女性组。②年龄:分别统计脑胶质瘤无癫痫患者年龄分布和脑胶质瘤有癫痫患者年龄分布。
1.2.2 病理诊断:采用2016 WHO标准分为低级别胶质瘤组和高级别胶质瘤组。
1.2.3 影像学分析:根据术前MRI 资料将肿瘤主体部位位于额颞部为一组,其他部位为一组;根据术前MRI 资料将影像学报告中肿瘤最大径>4 cm 为一组,肿瘤最大径≤4 cm 为一组;其中100 例有明确说明肿瘤主体最大径,12例仅报告肿瘤呈浸润性、弥漫性或片状分布,未能测得具体数值。
1.2.4 基因检测:根据术后病理基因检测结果分为IDH基因突变组和IDH基因未突变组,其中112 例患者中105 例行IDH基因检测,7 例未行IDH基因检测;TERT基因突变组和TERT基因未突变组,其中112 例 患 者 中97 例 行TERT基 因 检 测,15 例 未 行TERT基因检测;BRAF基因突变组和BRAF基因未突变组,其中112 例患者中104 例行BRAF基因检测,8 例未行BRAF基因检测;1p/19q 染色体有缺失组和1p/19q 染色体无缺失组,其中96 例报告1p/19q染色体检测结果,16 例未报告1p/19q 染色体检测结果。
1.2.5 免疫组化:根据术后病理免疫组化检测结果分为P53 高表达组和P53 低表达组,其中109 例行P53 检测,3 例未行P53 检测;根据中位Ki-67 表达水平分为Ki-67 表达>19.5 组和Ki-67 表达<19.5 组。
1.3 统计学分析采用SPSS 25.0统计软件,经正态性检验年龄符合正态分布,采用t检验,余分类变量选用χ2检验分析单一因素与胶质瘤癫痫发生的关系,危险因素分析采用多因素Logistic 回归法。以P<0.05为差异存在统计学意义。
2 结果
单因素分析显示胶质瘤患者年龄分布、肿瘤WHO 病理级别、肿瘤的主体部位及BRAF基因是否突变、Ki-67表达水平均可影响胶质瘤相关癫痫的发生,差异有统计学意义(P<0.05);性别、肿瘤的大小、IDH基因和TERT基因是否突变、1p/19q 是否存在缺失、P53表达水平等对胶质瘤相关癫痫是否发生无影响,差异无统计学意义(P>0.05)。见表1。多因素Logistic回归分析显示胶质瘤患者发病年龄及肿瘤主体部位对胶质瘤相关癫痫有直接影响(P<0.05),而肿瘤WHO病理分级、BRAF基因是否突变以及Ki-67表达水平并非胶质瘤相关癫痫的直接影响因素(P>0.05)。见表2。
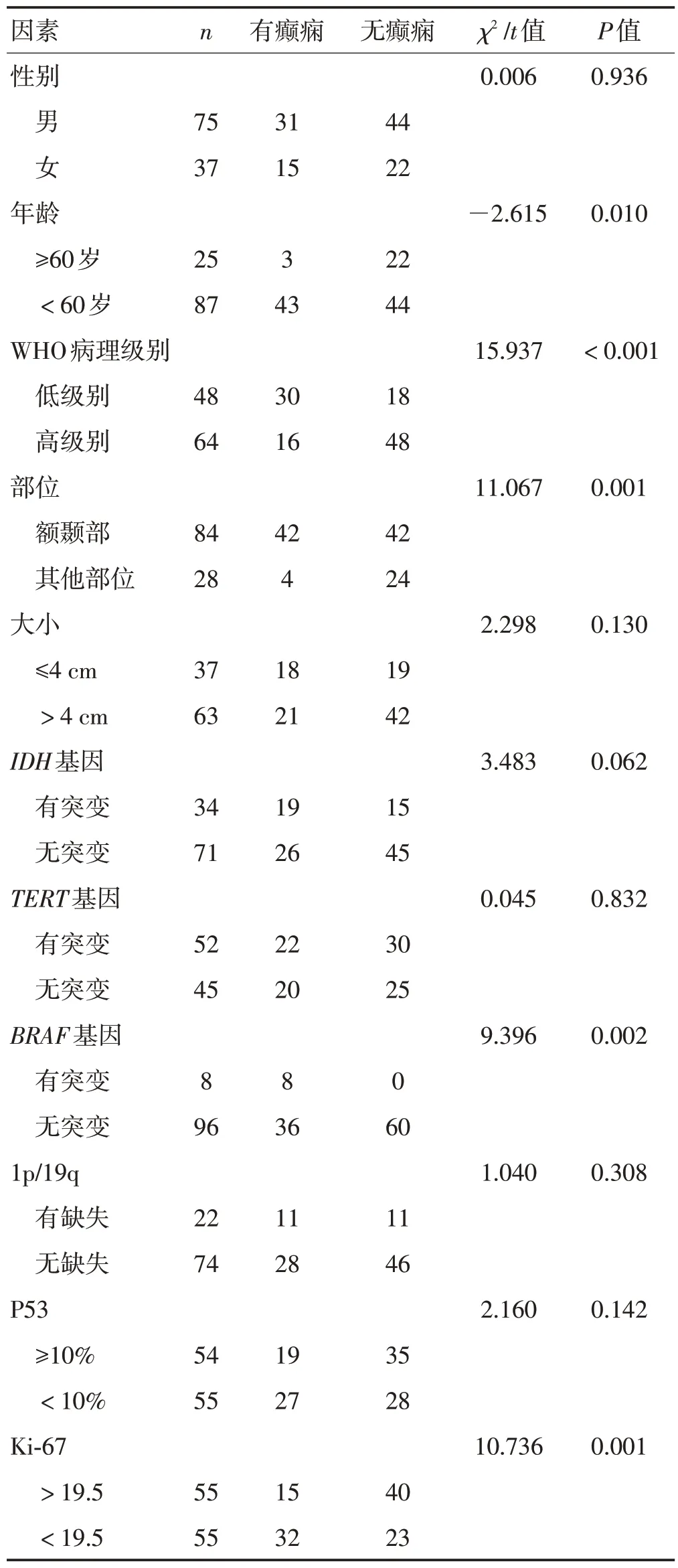
表1 脑胶质瘤相关癫痫发生的单因素分析Table 1 Single factor analysis of glioma-associated epilepsy
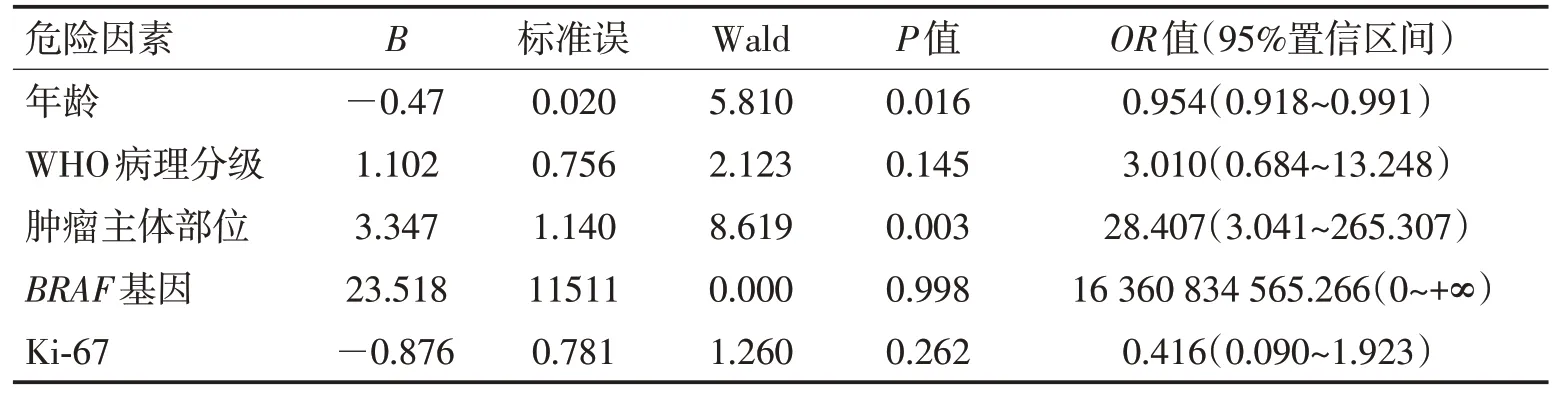
表2 脑胶质瘤相关癫痫发生的多因素Logistic回归分析Table 2 Logistic regression analysis of glioma-associated epilepsy
3 讨论
癫痫是胶质瘤患者常见的症状之一,也是部分病人的首发症状和主要就诊原因,基本机制是过度兴奋或未充分抑制的神经元电活动。胶质瘤相关癫痫机制尚不明确,各家学说云集,目前大部分研究认为是由多因素联合所致[4]。
单因素分析显示,胶质瘤相关癫痫的发生可能与患者年龄、肿瘤WHO病理学分级、肿瘤主体部位、BRAF基因是否突变以及Ki-67 蛋白表达水平等有关。多因素Logistic 回归分析显示年龄及肿瘤主体部位对胶质瘤患者是否发生癫痫有影响,且肿瘤主体位于额颞部相关癫痫的发生概率远高于其他部位。
3.1 年龄对胶质瘤相关癫痫的影响通过比较胶质瘤有癫痫和胶质瘤无癫痫2 组患者的年龄分布及多因素回归分析可知,胶质瘤相关癫痫的发生在年龄分布方面存在差异,且随着胶质瘤患者年龄的递增,发生癫痫的概率逐步降低。有癫痫的46例胶质瘤患者中,年龄<60 岁43 例(93.48%),而无癫痫的66 例胶质瘤患者中,年龄<60岁44例(66.67%)。一项纳入449例高级别胶质瘤患者的回顾性分析显示,较年轻的患者更有可能出现术前胶质瘤相关癫痫[5],这与本研究结果一致。一方面,癫痫的发生需要复杂的神经功能网络,异常电信号通过网络广泛传播以诱发癫痫发作。随着年龄的增长,脑内神经功能网络可能存在逐渐退化的可能,从而降低胶质瘤相关癫痫的发生率。另一方面,老年患者更有可能患恶性程度较高的肿瘤,而恶性肿瘤引起癫痫的可能性较小。
3.2 肿瘤WHO 病理分级对胶质瘤相关癫痫的影响 单因素分析显示,低级别胶质瘤患者更易发生胶质瘤相关癫痫,这一结论已在诸多临床研究中得到证实[6-7]。究其原因,癫痫的基本机制是过度兴奋或未充分抑制的神经元电活动,而脑胶质瘤相关癫痫更容易发生在低级别胶质瘤患者中,可能是因高级别胶质瘤生长或复发迅速,对脑组织的侵蚀能力相对较强,而低级别胶质瘤相对生长缓慢,对脑神经功能网络的侵蚀能力相对较弱,残余的脑组织可发出部分神经元电活动造成癫痫[8-9]。多因素回归分析表明肿瘤病理分级并非对胶质瘤相关癫痫存在显著影响,说明肿瘤的病理学分级可能对胶质瘤相关癫痫存在间接而非直接影响。研究显示低级别胶质瘤组织中人脑胶质瘤组织高迁移率族蛋白B1(high-mo⁃bility group box-1,HMGB1)表达较高[10],而此类蛋白进入脑细胞外环境可促进炎症反应,形成致痫灶导致癫痫[11-14]。
3.3 肿瘤主体部位对胶质瘤相关癫痫的影响单因素及多因素分析均显示额颞部胶质瘤相关癫痫发生率远高于其他部位,与诸多临床研究结果相符[15-16]。关于额叶癫痫和颞叶癫痫的发病机制众说纷纭,目前普遍被接受的学说包括再发性兴奋学说、返回抑制学说及胆碱能系统学说[17],同时也有研究表明神经胶质增生及基因表达模式改变均与癫痫发生存在密切联系。胶质瘤新生的胶质细胞,尤其是星形胶质细胞在胶质瘤相关癫痫的发生、发展过程中存在显著影响[18],而星形胶质细胞瘤在额颞部发生率远高于其他部位,故发生在额颞部的胶质瘤容易导致神经电通路改变,进而产生高兴奋性,引发癫痫。
3.4 BRAF 基因是否突变对胶质瘤相关癫痫的影响BRAF基因定位于人染色体7q34,含18 个外显子,参与调控细胞的生长、分化和凋亡等。单因素分析提示BRAF基因发生突变的8 例患者均出现胶质瘤相关癫痫,BRAF基因突变极有可能与胶质瘤相关癫痫之间存在复杂的相互作用,这在有关研究中也得到证实[19-20]。研究表明BRAF基因突变可在大脑发育过程中促使神经细胞获得内在致痫性,并发现在BRAF基因突变患者脑室内注射一种BRAF选择性抑制剂维罗非尼可显著减轻癫痫发作,从而提出BRAF基因可能是难治性癫痫的治疗靶点[21]。
3.5 Ki-67表达水平对胶质瘤相关癫痫的影响Ki-67是一种原癌基因,阳性率越高,说明处于增殖期的细胞比例越高,肿瘤生长越快。本研究单因素分析证实了Ki-67 表达水平低于中位表达水平的胶质瘤患者更易出现胶质瘤相关癫痫,这与一项国内临床研究报告的结果类似,并同样指出Ki-67可能成为未来肿瘤相关癫痫的新诊断或治疗靶点[22],然而,多因素回归分析显示Ki-67 表达水平与胶质瘤相关癫痫无显著相关性。Ki-67阳性表达水平越高,相应肿瘤的恶性程度越高,侵袭力越强,不利于胶质瘤瘤旁神经元电通路形成;相反,Ki-67 阳性表达水平相对较低的胶质瘤恶性程度稍低,侵袭力稍弱,瘤旁更易形成致痫灶及异常神经电通路,从而引发癫痫。
胶质瘤发病年龄及肿瘤主体部位可直接影响胶质瘤相关癫痫的发生,且肿瘤主体位于额颞部应尤其注意癫痫的发生。肿瘤WHO 病理分级、BRAF基因是否突变以及Ki-67 表达水平可能是胶质瘤相关癫痫发作的间接危险因素,在脑内经过一系列复杂的神经功能网络作用导致癫痫的发生,在今后的临床工作中,可以根据这些因素对胶质瘤患者作出正确的评估,尽早给予相应治疗。
