硫代半乳糖苷通过抑制半乳糖凝集素-8的糖结合活性改善脑出血继发性脑损伤
2023-08-25宋晶晶白宏英邢媛媛
宋晶晶 白宏英 徐 辉 陈 思 邢媛媛
郑州大学第二附属医院,河南 郑州 450003
脑出血(intracerebral hemorrhage,ICH)又称出血性脑卒中,是最致命的脑卒中形式,一般是指非外伤因素导致的脑血管破裂引起的脑实质出血,占脑卒中的10%~15%,具有高发病率和高病死率等特点[1]。尽管目前显微外科技术已取得较大进步,但对脑出血发生后炎症级联反应与其引起的继发性脑损伤的研究仍进展甚微。
免疫系统被认为是脑出血引起继发性脑损伤的关键因素,免疫炎症反应参与出血性脑损伤的全过程[2]。半乳糖凝集素家族被认为是脑小胶质细胞极化、免疫监视、神经炎症和神经保护的潜在调节剂,是免疫反应的关键调节因子[3]。半乳糖凝集素-8(Galectins-8,Gal-8)来自半乳糖凝集素家族的串联重复序列[4],参与调节免疫炎症。既往研究发现,Gal-8在脑组织的脉络丛、侧脑室、第3脑室及脑脊液中均有表达[5]。Gal-8 在海马部位也有表达,主要定位在小胶质细胞[6]。硫代半乳糖苷(thiodigalactoside,TDG)是Gal-8 的广谱抑制剂,能够抑制Gal-8 的糖结合活性[7]。本研究从免疫炎症细胞和组织形态学两个方面观察脑出血后Gal-8 对继发性脑损伤程度的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组:选取无特定病原体(specific pathogen free,SPF)级雄性C57BL/6 小鼠,10~12 月龄,体质量25~30 g,共88 只,购自郑州大学实验动物中心,饲养于郑州大学第二附属医院SPF 级动物房,恒温,自由饮食,人工昼夜节律。该试验通过本院伦理委员会批准,且所有操作遵循郑州大学医学院动物伦理委员会制定的规章制度。
1.1.2 仪器与试剂:试剂:Ⅶ型胶原酶(Sigma-Aldrich),OCT 生物组织包埋剂(北京索莱宝科技有限公司),Iba-1 抗兔抗体(Dako,019-19741),MPO 抗兔抗体(Abcam,Ab9535),GFAP抗兔抗体(武汉三鹰生物技术有限公司,16 825-1-AP),Alexa Fluor 488 donkey anti-rabbit Ig G(Jackson 公司,016-540-084),Alexa Fluor cy3 donkey anti-rabbit Ig G(Jackson 公司)。仪器:冰冻切片机(Leica,CM1860),免疫荧光显微镜(卡尔蔡司显微镜有限公司,AXIO OBSERVER 3),恒温摇床(杭州米欧,ES60),多功能图像工作站(广州博鹭腾生物科技有限公司),轻便小鼠脑立体定位仪(瑞沃德生命科技有限公司),小动物麻醉机,小动物呼吸机。
1.2 方法
1.2.1 胶原酶注入法建立小鼠脑出血模型:采用立体定位注射法向左侧尾状核注射0.075 U Ⅶ型胶原酶,尾状核定位为:前囟前0.6 mm,向左2.0 mm,进针深度3.2 mm。脑出血模型建立24 h后应用改良神经功能缺损评分(neurological deficit scores,NDS)[8]进行神经功能评价,总分≥12分选择入组。造模不成功小鼠给予腹腔注射过量的0.3%戊巴比妥钠进行安乐死。
1.2.2 分组:将小鼠随机分成4组,每组22只。假手术组:除微量注射器只进针不泵入胶原酶外,其他操作与脑出血组相同;假手术组+硫代半乳糖苷组(假手术+TDG 组):操作同假手术组,2 h 后腹腔注射TDG 5 mg/kg,隔 天1 次;脑 出 血(intracranial hemorrhage,ICH)组:术中在纹状体注射0.5 μL 含0.075 U Ⅶ型胶原酶的无菌生理盐水;脑出血+硫代半乳糖苷组(ICH+TDG组):术中在纹状体注射0.5 μL含0.075 U Ⅶ型胶原酶的无菌生理盐水,2 h 后腹腔注射TDG 5 mg/kg,隔天1次。
1.3 冰冻切片免疫荧光染色将灌注的脑组织置于4%多聚甲醛溶液中,4 ℃冰箱过夜,之后依次放入20%、30%蔗糖溶液中进行梯度脱水,待脑组织完全下沉后,OCT 包埋脑组织,用冰冻切片机制备30 μm冰冻切片。每个脑组织标本选取4 张相近层面的切片,进行免疫荧光染色。
1.4 脑含水量(brain water Content, BWC)测量小鼠造模成功后72 h 用0.3%戊巴比妥钠腹腔麻醉,颈椎脱臼法处死小鼠,迅速断头取脑,于中脑水平切断获取双侧大脑半球及小脑,沿纵裂将大脑半球切为左右半球放置在已称重后的锡箔纸上。立即用电子分子天平对同侧大脑半球、对侧大脑半球及小脑进行称质量,此为湿质量,然后迅速放入100 ℃烤箱中烘烤24 h,当重量不再发生变化时取出再次称重的干质量,BWC=(湿质量-干质量)/湿质量×100%。
1.5 脑血肿体积和脑肿胀程度选取造模成功后72 h 小鼠的50 μm 的脑组织冰冻切片贴片后烘干,进 行 劳 克 坚 牢 蓝(luxol fast blue, LFB)/焦 油 紫(cresyl violet acetate, CV)染色。LFB/CV染色后计算脑血肿体积、脑肿胀程度。脑血肿体积=各个层面出血面积之和×切片厚度;脑肿胀程度=(出血侧大脑半球体积—对侧大脑半球体积)/出血侧体积×100%。
1.6 统计学处理采用GraphPad Prism 9.51软件进行统计学分析及作图。计量数据用均数±标准差(±s)表示。对于2 组间差异性比较,若数据服从正态分布,且方差齐,用t检验进行统计分析;若数据服从正态分布,但方差不齐,用校正t检验进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 TDG 对脑出血后血肿周边的活化免疫炎症细胞数量的影响不同脑组织挑选大致相同层面4 张30 μm 的冰冻切片进行免疫荧光染色,Image J 软件定量统计血肿周围每个视野中GFAP(绿色)、Iba-1(绿色)及MPO(红色)阳性细胞数量(GFAP 是星形胶质细胞的表面标志物,Iba-1 是小胶质细胞的表面标志物,MPO 是中性粒细胞的表面标志物)见图1。统计分析发现ICH+TDG 组小鼠血肿周围小胶质细胞、中性粒细胞阳性细胞数量明显低于ICH组,差异具有统计学意义(Iba1:P=0.027 2,t=2.904;MPO:P=0.012 8,t=3.503),而对于星形胶质细胞的阳性细胞数而言,2 组差异无统计学意义(GFAP:P=0.141 6,t=1.51)。上述结果提示脑出血后,TDG 一定程度上降低了血肿周边小胶质细胞的活化及中性粒细胞的浸润。

图1 TDG减少了脑出血后血肿周边的活化的免疫炎症细胞数量(免疫荧光染色×200)Figure 1 TDG reduces the number of activated immune inflammatory cells around the hematoma after cerebral hemorrhage (immunofluorescent staining×200)
2.2 TDG对小鼠脑出血后急性期脑损伤程度的影响
2.2.1TDG对脑出血小鼠急性期脑肿胀程度及脑血肿体积的影响:LFB/CV 染色后,应用体式显微镜进行拍照,发现ICH 组与ICH+TDG 组2 组小鼠均有不同程度的脑损伤,脑损伤区域脑组织缺失、未被染色,结果见图2A。ICH+TDG 组小鼠脑血肿体积较ICH 组明显减小(P=0.048 6,t=2.486)(图2B),提示TDG抑制了脑出血小鼠脑血肿体积的扩大。LFB/CV 染色后,对脑出血术后72 h 脑肿胀程度进行评估后发现ICH 组与ICH+TDG 2组小鼠脑出血术后72 h 出血侧脑组织均有不同程度的脑肿胀,结果显示ICH+TDG组小鼠脑肿胀程度较ICH 组明显减轻,差异有统计学意义(P=0.012 6,t=5.369)(图2C),说明TDG 减轻了脑出血后急性期的脑水肿。
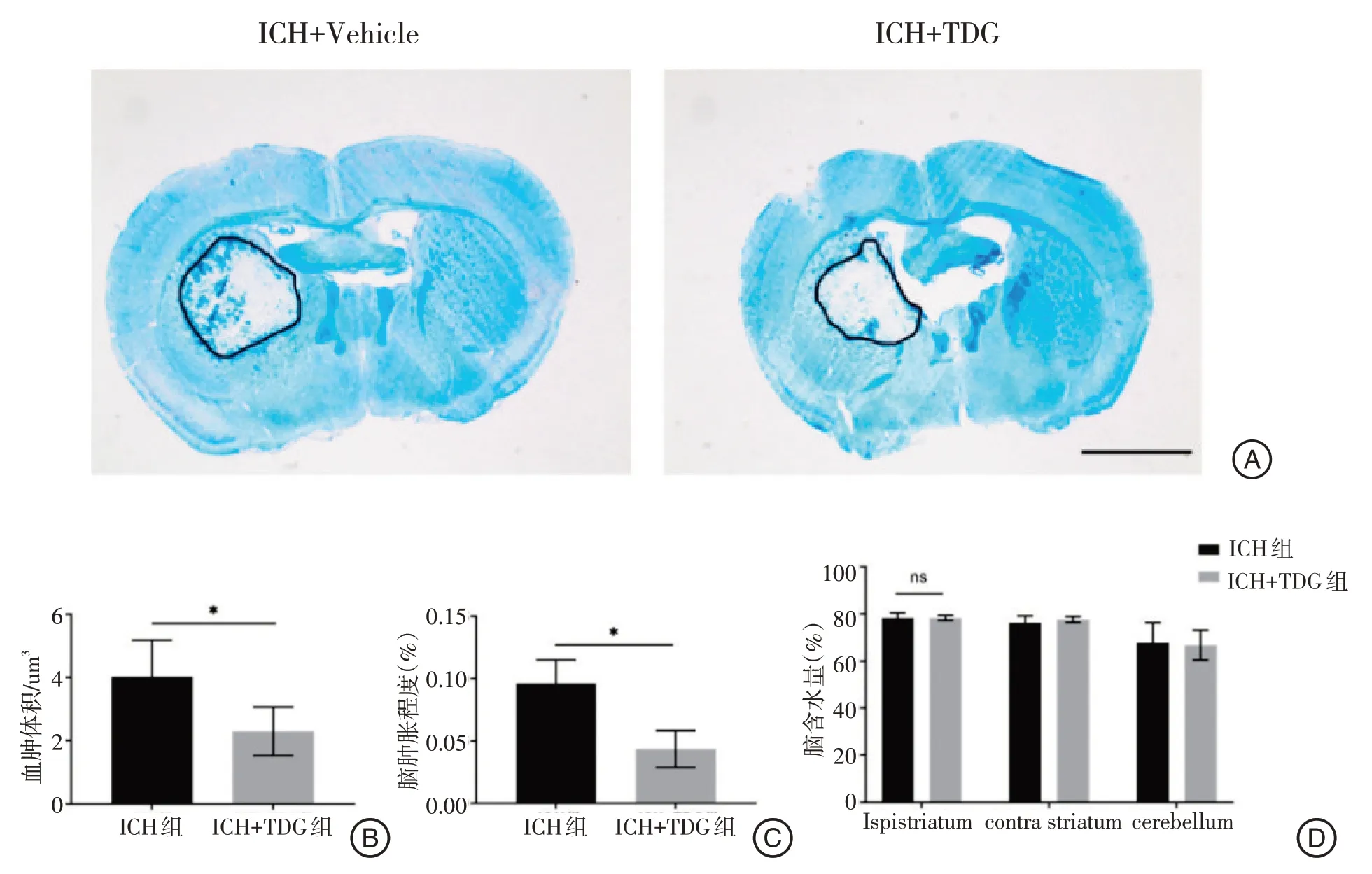
图2 Gal-8对小鼠脑出血后血肿体积、脑肿胀程度和脑含水量的影响Figure 2 Effects of Gal-8 on hematoma volume,brain swelling degree and cerebral water content after cerebral hemorrhage in mice
2.2.2 TDG 对血肿侧脑组织含水量的影响:实验采用干湿质量法检测ICH组和ICH+TDG组小鼠血肿同侧大脑半球、血肿对侧大脑半球及小脑三个部分的脑含水量,结果显示2组小鼠血肿同侧大脑半球脑含水量相比较差异无统计学意义(P=0.764)(图2D)。
3 讨论
Galectins 家族目前受到越来越多的关注,其特异性结构存在保守的碳水化合物识别结构域(carbohydrate- recognition domain,CRD),以不同的特异性和亲和力与β-半乳糖苷结合,发挥多种生物学效 应[9]。Gal-8 首 先 在 大 鼠 肝 脏cDNA 文库中被鉴定为小鼠串联重复型Galectin家族的第三个成员[10],之前认为与肿瘤有关,调节肿瘤的增长或迁移[11]。随着对Gal-8 研究的深入,发现其在脑组织中也有表达,并认为Gal-8在中枢神经系统中参与获得性免疫反应和先天免疫反应[12]。Gal-8对脑出血疾病的作用如何,目前研究尚少。
Gal-8因其独特的CRD结构可以介导细胞-细胞和细胞-基质的相互作用[13],并认为其发挥促炎和抗炎的双重调节作用[12],即在适应性免疫应答的初发阶段起促炎作用,而在反应加剧的效应器阶段起抗炎作用[12]。还有研究发现Gal-8 可以促进血小板活化,促进血栓的形成和炎症反应,提示其在促进炎症反应方面具有潜在的意义[14-15],对其相关机制的研究认为Gal-8 以旁分泌的方式将炎症信号放大到邻近细胞[16]。根据组织形态学的观察发现TDG抑制Gal-8的糖结合活性后,显著降低了脑血肿体积和脑肿胀程度,提示Gal-8 在脑出血后发挥神经毒性作用,一定程度上加重了脑出血的继发性脑损伤。
在对多发性硬化患者的活动期和缓解期脑组织的研究中发现,在活动期脑组织中Gal-8的表达较慢性期增加[17],且发现与活化的小胶质细胞数量呈正相关。由此可以推测Gal-8 的表达和小胶质细胞的活化联系密切。小胶质细胞作为中枢神经系统内的常驻细胞,在脑出血后的免疫炎症反应中发挥重要作用,脑出血后激活的小胶质细胞能够唤起先天性免疫反应,并在感知危险信号时促进炎症介质的产生[18-19]。小胶质细胞激活后能够驱动神经炎症、氧化应激和细胞毒性级联反应,导致细胞死亡和功能障碍[20]。通过对血肿周边区域活化的小胶质细胞数量的统计分析,发现抑制Gal-8的糖结合活性后血肿周边活化的小胶质细胞数量减少,由此更是证实了Gal-8 促进了小胶质细胞活化的观点。小胶质细胞和星形胶质细胞、中性粒细胞之间相互作用,共同调节了脑出血后的免疫炎症反应[21]。在体外和体内试验中发现小胶质细胞激活后释放一些细胞因子如IL-1α、TNF-α 和补体成分亚单位1q(C1q)诱导A1 型反应性星形胶质细胞的产生[22-23]。另外小胶质细胞在脑出血后活化可以分泌趋化因子CXCL1、CCL2等来趋化中性粒细胞、单核细胞向脑内迁移[24],加重脑出血后继发性脑损伤。本研究结果发现TDG 抑制Gal-8 的糖结合活性显著减少血肿周边中性粒细胞的数量,星形胶质细胞的数量无明显改变,提示Gal-8 在一定程度上通过小胶质细胞的活化促进中性粒细胞向血肿周边浸润,加重继发性脑损伤。脑出血后,TDG 抑制Gal-8 的糖结合活性,通过减少血肿周围活化的小胶质细胞及中性粒细胞的数量而有效地防止了脑血肿体积的扩大,提示Gal-8有可能成为改善脑出血继发性脑损伤的潜在的治疗靶点。但其具体机制如何,目前尚不清楚。研究提示Gal-8可以调节细胞因子的释放[25],Gal-8与小胶质细胞关系密切,推测Gal-8通过促进小胶质细胞的活化来调节细胞因子的释放,上述猜想还需更深一步研究验证。
