YKL-40与视神经脊髓炎谱系障碍患者神经功能的相关性
2023-08-25李东瑞邓文静滕军放
李东瑞 何 霞 邓文静 滕军放
郑州大学第一附属医院,河南 郑州 450052
视神经脊髓炎谱系障碍(neuromyelitis optica spectrum disorder,NMOSD)是中枢神经系统(central nervous system,CNS)的自身免疫性炎症性脱髓鞘疾病。NMOSD主要累及视神经和脊髓[1-3],其病变多累及脑干和大脑,反复发作,表现为视神经炎、脊髓炎和某些脑、脑干综合征。水通道蛋白-4(aquaporin-4,AQP4)是于2004年发现的一种在血管周围星形胶质细胞的足突上有较高的表达特异性抗体[4-5],这一里程碑式的发现标志着视神经脊髓炎的新纪元。随着对视神经脊髓炎病理生理学机制的深入研究,AQP-4对NMOSD早期诊断有较高的敏感性和特异性,同时新的治疗策略被提出来[6]。星形胶质细胞对血脑屏障的完整性、神经可塑性和神经递质调节都很重要,据报道AQP4-IgG 诱导的星形胶质细胞激活可增加促炎因子、趋化因子和其他炎症和氧化应激介质的产生和分泌[7]。
人软骨糖蛋白-39(YKL-40)是一种炎症生物标志物,氨基酸序列与几丁质酶蛋白家族相关,其氨基酸序列与几丁质酶家族相关,却无几丁质酶活性[8]。YKL-40 可由包括星形胶质细胞在内的多种细胞进行表达和分泌[9],目前越来越多的证据表明其可能参与急性神经炎性反应[10-11]。研究指出,临床孤立综合征(clinical isolated syndrome,CIS)和多发性硬化症(multiple sclerosis,MS)以及阿尔茨海默病(Alzheimer’s disease,AD)、卒中患者的脑脊液YKL40水平升高[12-14]。
本研究目的是探索血清和脑脊液YKL-40 水平及其与AQP-4阳性NMOSD患者的临床表现、病情程度是否存在相关性。
1 资料与方法
1.1 一般资料搜集郑州大学第一附属医院AQP-4阳性的视神经脊髓炎谱系障碍患者,样本收集时间2022-01—12,共纳入30 例NMOSD 患者及24 例年龄、性别相匹配的非炎性神经系统疾病患者(noninflammatory neurological disorders,ONND),其中亚急性联合变性14例,抑郁症7例,焦虑症3例。对30例NMOSD 患者、24 例ONND 患者和24 例健康对照者(health control,HC)进行初步研究,各组间性别和年龄等方面无统计学差异(P>0.05)。见表1。本次研究在参考临床数据与样本资源库标准操作规程以及国际生物和环境知识库学会最佳实践后,制定样本收集、储存的标准化操作规范。本研究经郑州大学第一附属医院医学伦理委员会审核批准,伦理审查编号:2019-KY-123,并获得所有研究对象的知情同意,签署知情同意书。

表1 不同组间人口学和临床特征比较Table 1 Comparison of demographic and clinical characteristics among different groups
1.2 入组及排除标准
1.2.1 纳入标准:①符合NMOSD 诊断标准[3],且AQP-4检测阳性;②年龄>18岁;③均为首次发作。1.2.2 排除标准:①拒绝参与研究者;②有肾脏病史及传染病、代谢性疾病、血管疾病或癌症者;③髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体或其他抗体阳性者;④合并可能影响YKL-40水平的疾病者。
1.3 数据收集和分组详细记录每份病例的临床资料,包括年龄、性别、临床症状和实验室指标等。由两名神经内科医师对NMOSD 组患者采用神经功能状况评估量表(expanded disability status scale,EDSS)评估。
1.4 YKL-40 测定入组患者标本的取样时间在发病7 d 内及任何免疫抑制治疗前。所有合格样本保存在—80 ℃冰箱内,最后利用酶联免疫吸附试验盒(英国Abcam公司)测定YKL-40水平。
1.5 统计学分析采用SPSS 26.0 软件对所有数据进行统计学分析,使用GraphPad Prism 9.0 制图。符合正态分布的计量资料以均值±标准差(±s)表示,服从正态分布采用两样本独立t检验;定性资料的比较采用卡方检验;非正态分布资料的相关性分析采用Spearman 的秩相关。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清和脑脊液YKL-40水平比较NMOSD组脑脊液YKL-40 水平[(314.3±42.9)μg/L]明显高于ONND 组[(127.2±19.9)μg/L],P<0.000 1;NMOSD 组血清YKL-40 水平[(37±6.6)μg/L]与HC组血清[(36.5±5.7)μg/L]比较差异无统计学意义(P=0.750 5)。见图1。

图1 A:NMOSD 组患者和ONND 组患者脑脊液YKL-40 水平比较;B:NMOSD组患者和HC组血清YKL-40水平比较Figure 1 A:Comparison of YKL- 40 levels in cerebrospinal fluid between NMOSD group and ONND group;B:Comparison of serum YKL-40 levels between patients in NMOSD group and HC group
2.2 NMOSD患者亚组比较及相关性分析NMOSD患者影像学提示病灶常累及脊髓中央,且急性病灶可被钆强化,出现片状、不规则形状。图2 显示强化和不强化病灶。MRI 增强病变患者脑脊液YKL-40水平(324.7±43.7)μg/L,明显高于未出现MRI增强病变患者(290±31.3)μg/L,P=0.041,见图3A。NMOSD患者入院时EDSS评分与脑脊液YKL-40水平呈正相关(r=0.372,P=0.043,图3B)。
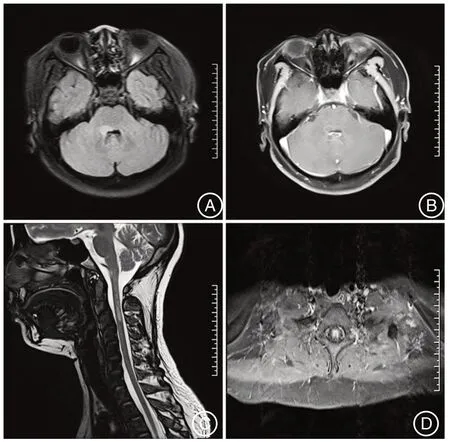
图2 MRI 增强病变患者和未出现MRI 增强病变患者影像学表现A:脑桥右份异常信号,考虑炎症;B:与A 图同一病人,增强可见轻微环形强化;C:延髓-C3椎体水平可见异常信号,增强未强化;D:脊髓可见异常强化信号Figure 2 Imaging findings of patients with MRI enhanced lesions and patients without MRI enhanced lesions.A:Abnormal signals in the right part of the pontine,considering inflammation;B:In the same patient as in figure A,slight circular enhancement can be seen;C:Abnormal signals can be seen at the level of medulla bulbar- C3 vertebrae,which are enhanced but not strengthened;D:Abnormal intensification is seen in the spinal cord

图3 A:NMOSD 患者中,MRI 增强病变患者和未出现MRI增强病变患者比较;B:NMOSD 患者脑脊液YKL-40 水平与病情严重程度的相关性Figure 3 A:Comparison between patients with MRI enhanced lesions and those without MRI enhanced lesions in NMOSD patients;B:Correlation between cerebrospinal fluid YKL-40 level and severity of NMOSD patients
3 讨论
视神经脊髓炎谱系障碍是一种严重的中枢神经系统炎症性疾病,多数累及视神经和脊髓,可导致严重的后遗症,如永久性失明、瘫痪甚至死亡[15]。NMOSD患者可并发严重的持续性神经性疼痛,约50%的患者出现剧烈疼痛,严重影响其生活质量[16-17]。大多数AQP4-IgG 在外周淋巴组织中产生,因此血清AQP4-IgG 水平远高于脑脊液。AQP4-IgG 通过激活补体和促进星形胶质细胞膜和血脑屏障(blood brain barrier,BBB)的破坏,导致水转运功能障碍,从而出现一系列病理生理变化,这可能是导致NMOSD的病理机制[18]。由于NMOSD损伤的部位不同,相应的临床表现不尽相同,由于该病好发于女性,对于疑似患者应积极行头颅及脊髓影像学检查,并进行AQP-4抗体检测,避免出现漏诊及误诊[19]。
神经炎性反应发生时,YKL-40 由激活的星形胶质细胞合成并释放,作为分泌型糖蛋白参与一系列炎症反应[20]。在多发性硬化症患者脑样本的白质斑块中的星形胶质细胞和CD68+(小胶质细胞和浸润性巨噬细胞)以及脑脊液中的CD14+细胞中检测到YKL-40 的表达[21-22],这一发现表明神经炎症过程中糖蛋白在神经胶质细胞相互作用中的潜在作用。与对照组相比,多发性硬化症患者脑脊液YKL-40水平升高[23]。YKL-40水平与疾病进展、脑损伤程度以及神经元死亡或星形细胞活化的标志物有关[24-25]。CORREALE 等[26]报告了12 例NMO 患者的脑脊液YKL-40水平升高,但其报告未提及患者的人口学和临床特征。
与健康受试者相比,早发性痴呆前期患者的YKL-40 浓度较高[27]。与主观认知能力下降的患者相比,轻度认知障碍(mild cognitive impairment,MCI)患者的YKL-40 水平更高[28]。此外,脑脊液YKL-40水平已被证明受ApoE 基因型的显著影响,ApoE 是AD的最强遗传风险因素。ApoE ε 4携带者的脑脊液YKL-40水平增加,特别是在MCI和AD前期。ApoE ε 4状态已显示可调节脑区脑脊液YKL-40 水平和灰质体积之间的相关性[29],提示YKL-40是中枢神经系统神经退行性疾病发病机制中的重要环节,同时提示该蛋白可能在伴炎症的神经退行性疾病中作为有前景的生物标志物具有相对价值,反映了神经炎症和神经退行性变的病理生理学过程,YKL-40更显著的表达模式可用神经胶质细胞更明显地参与伴随神经退行性疾病的病理过程来解释。本次研究表明,NMOSD 患者的脑脊液YKL-40 水平高于ONND 组患者,在NMOSD 患者中进行亚组分析,MRI 检查中强化病变患者的脑脊液YKL-40 水平高于MRI 无增强病变患者,表明YKL-40可能参与该病的炎症发生和发展过程。此外,NMOSD 患者的脑脊液YKL-40 水平与EDSS 评分呈正相关,表明脑脊液YKL-40 水平可反映NMOSD患者病情的严重程度。
目前对于NMOSD的治疗手段在逐步增加,急性期从糖皮质激素到血浆置换和免疫吸附,以及其他新技术手段,如淋巴细胞单采术和血浆置换相结合。序贯治疗即为免疫抑制剂治疗,可有效减少神经功能障碍的累积和预防复发[30]。
本研究存在局限性,首先,检验的指标单一,仅显示脑脊液YKL-40 浓度水平与神经功能损害程度的相关性分析,未对YKL-40的相关基因及其他神经炎症因子的相互验证和对比分析。其次,未对患者整个病程中的YKL-40进行分析,同时未进一步追踪其预后情况。本研究是一项单一中心临床观察研究,样本量小,偏倚不可避免,未来需要更多中心,大样本量检测,前瞻性且需要长期随访的对照试验。
AQP-4 阳性的NMOSD 是一种涉及星形胶质细胞损伤和炎性因子的自身免疫性疾病,YKL-40可能在炎症过程及发病机制中发挥重要作用。虽本次研究是一项样本量较小的临床观察,但提供了有关YKL-40 在AQP-4 阳性NMOSD 中的作用的重要证据。YKL-40 在神经系统疾病中的作用需进一步阐明,需深层次研究该类患者YKL-40水平升高的潜在机制。
利益冲突 所有作者声明互相之间不存在利益冲突
作者贡献声明 李东瑞:论文构思撰写;李东瑞、何霞:数据采集及整理;李东瑞:统计分析;邓文静、滕军放:论文写作指导
