格特隐球菌致非免疫功能低下者多系统感染一例
2023-08-24廖巍孙龙
廖巍?孙龙

廖巍 孙龙
【摘要】隐球菌是一种二型态机会致病真菌。隐球菌感染多发生于感染HIV、器官移植、长期使用糖皮质激素、化学治疗、慢性白血病、淋巴瘤等免疫功能低下患者中,非免疫功能低下患者多系统感染隐球菌则很少。该文报道了一例格特隐球菌性脑膜炎合并格特隐球菌性肺炎的成年男性患者,其免疫功能正常,以脑膜炎为首发表现,呼吸系统同时受累,行鞘内注射+静脉滴注抗真菌治疗及脑室-腹腔分流术(VPS)治疗,治疗后未诉发热、头痛、咳嗽、咳痰等不适,出院后长期口服氟康唑+氟胞嘧啶,并定期随访。该例患者的诊治过程提示,医务工作者在临床工作中要考虑免疫功能正常人群也可感染隐球菌,在神经系统感染的同时要注意呼吸系统也可能受累,在隐球菌性脑膜炎治疗中除了常规静脉滴注抗真菌治疗外,也可考虑鞘内注射抗真菌药物以及VPS。
【关键词】格特隐球菌;隐球菌性脑膜炎;隐球菌性肺炎;免疫功能;感染
Multi-system infection caused by Cryptococcus gattii in a non-immunocompromised patient: a case report Liao Wei, Sun Long. Department of Infectious Disease, the First Affiliated Hospital of Hainan Medical College, Haikou 570102, China
Corresponding author,Sun Long, E-mail: hysunlong@163.com
【Abstract】Cryptococcus is a dimorphic opportunistic pathogenic fungus. Cryptococcal infection mostly occurs in immunocompromised patients infected with HIV, organ transplantation, long-term use of cortisol hormone, chemotherapy, chronic leukemia and lymphoma, etc. Multi-system cryptococcal infection is rare in non-immunocompromised patients. In this article, one male adult case of Cryptococcus gattii meningitis complicated with Cryptococcus gattii pneumonia was reported. He had normal immune function and presented with meningitis as the initial manifestation and the respiratory system was involved. The patient underwent intrathecal injection + antifungal therapy via intravenous drip and ventriculoperitoneal shunt (VPS). After corresponding interventions, he did not complain of fever, headache, cough, sputum and other discomforts. He received long-term oral intake of fluconazole + flucytosine after discharge, and was subject regular follow-up. The diagnosis and treatment of this case prompt that medical practitioners should consider the possibility that the population with normal immune function can also be infected with Cryptococcus in clinical practice. Both the nervous system and respiratory system can be infected. Besides conventional antifungal therapy via intravenous drip, intrathecal injection of antifungal drugs and VPS can also be considered in the treatment of Cryptococcal meningitis.
【Key words】Cryptococcus gattii; Cryptococcal meningitis; Cryptococcal pneumonia; Immunity; Infection
隱球菌是一种二型态机会致病真菌[1],为需氧、嗜温真菌,属担子菌门。目前共有30多种隐球菌分布于自然环境中,仅有新型隐球菌复合群和格特隐球菌复合群对人类有致病性,大约95%的隐球菌感染是由新型隐球菌A血清型引起,约5%是由新型隐球菌D血清型或者格特隐球菌B/C血清型引起[2]。隐球菌通常存在于鸟类粪便、土壤、树木等环境,一般情况下对于免疫功能正常人群并不会致病,但其能在人体内休眠数十年,当人体免疫功能低下时隐球菌可被激活而致病[3]。有关隐球菌被激活致病的机制目前仍在研究中。笔者近年收治一例非免疫功能低下的成年男性,由格特隐球菌导致脑膜炎合并肺炎,现将其诊治过程总结如下,供临床同道参考。
病例资料
一、主诉及病史
患者男,33岁。因发热、头痛14 d,加重伴视物重影1 d于2022年6月21日入院。2022年6月初患者无明显诱因下出现发热,最高体温达39 ℃,
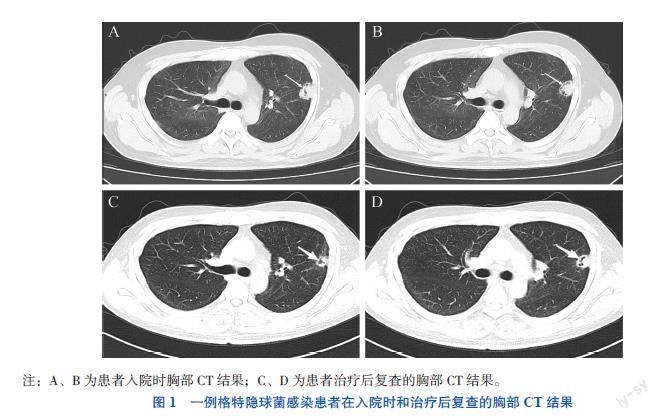
热型无特殊,伴有头痛,表现为全脑弥漫性胀痛,伴有非喷射状呕吐、食欲减退、头晕,无抽搐、精神行为异常,无记忆力减退、言语障碍、肢体无力、大小便失禁等。于当地医院就诊,完善头颅CT未见明显异常,予药物退热处理后体温下降,次日离院后在当地诊所输头孢类抗菌药物治疗数日(具体不详),效果欠佳,体温反复波动于38~39 ℃。遂至外院住院治疗,查头颅CT未见异常;胸部CT示双肺散在炎症,左上肺结节灶,性质不明(图1A、B),给予抗感染、退热、纠正电解质紊乱等综合治疗后无明显好转(具体不详)。2022年6月20日患者再次出现高热,伴视物重影,遂入我院就诊。患者既往体健,否认鸽子等鸟类接触史,无传染病、慢性病史,无药物、食物过敏史,无手术、外伤史,否认家族遗传性疾病史。
二、体格检查及辅助检查
入院体格检查:体温39 ℃,脉搏97次/分,呼吸18次/分,血压126/86 mmHg (1 mmHg =0.133 kPa)。
急性发热面容,心、肺、腹未见明显异常。颈项强直,颏胸距4横指,克尼格征可疑阳性。
血红蛋白135 g/L,红细胞4.89×1012/L,白细胞7.5×109/L,中性粒细胞0.785,淋巴细胞0.152,单核细胞0.058,嗜酸性粒细胞0.001,嗜碱性粒细胞0.004,血小板335×109/L。纤维蛋白原 3.88 g/L。ESR 16 mm/h,超敏CRP 5.82 mg/L,降钙素原0.064 ng/mL。
血钾 3.2 mmol/L,血钠127.7 mmol/L,血氯89.2 mmol/L。
心电图及血培养未见异常。痰涂片可见孢子,未见抗酸杆菌。痰培养回报培养5 d可见隐球菌生长。血细菌内毒素0.03 EU/mL,血1-3-β-D葡聚糖
20.4 ng/L。血清中毒颗粒无异常;头颅MRI平扫+
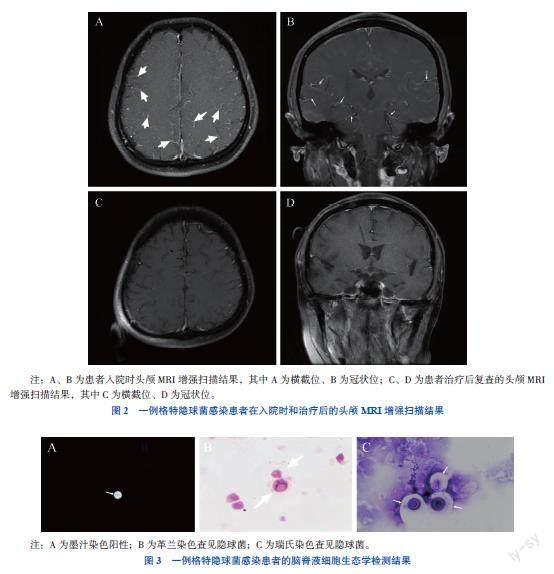
增强扫描中,T2-液体抑制反转恢复序列示双侧脑沟裂池线样和点状高信号灶,增强显示软脑膜多发明显强化,考虑颅内感染伴脑膜炎可能(图2A、B)。腰椎穿刺术示淡黄色透明脑脊液,压力>
330 mmH2O(1 mmH2O=0.009 8 kPa)。送检脑脊液常规:白细胞计数32×106/L[参考值(0~8)×106/L],蛋白定性(±),单个核细胞0.80,氯107.8 mmol/L,乳酸脱氢酶(LDH)27 U/L,微蛋白定量732 mg/L,脑脊液涂片未见抗酸杆菌、细菌、真菌,墨汁染色未找到隐球菌。脑脊液细胞生态学回报:有核细胞计数21×106/L,红细胞2×106/L,隐球菌2×106/L,
墨汁染色阳性,革兰染色、瑞氏染色查见隐球菌(图3)。脑脊液培养回报:隐球菌;脑脊液宏基因组新一代测序(mNGS)提示格特隐球菌感染(图4)。
三、诊 断
患者急性起病,高热、头痛、视物重影,脑膜刺激征阳性,外院胸部CT提示双肺炎症,左上肺结节灶,予抗菌治疗无好转,查血常规示白细胞计数正常,中性粒细胞比例、降钙素原、超敏CRP略升高,痰涂片可见孢子,未找到抗酸杆菌,痰培养可见隐球菌,头颅MRI增强提示软脑膜多发强化,考虑颅内感染伴脑膜炎,患者脑脊液压力升高明显,脑脊液细胞生态学回报墨汁染色阳性,革兰染色、瑞氏染色查见隐球菌,脑脊液培养为隐球菌,脑脊液mNGS回报格特隐球菌,最终诊断:隐球菌性脑膜炎、隐球菌性肺炎。
四、治疗经过
入院当日经验性予头孢曲松钠、阿昔洛韦抗感染,维持电解质平衡及其他对症支持治疗等。次日确诊隐球菌性脑膜炎后开始诱导期给予两性霉素B 5 mg/d静脉滴注,每日增加5 mg,并增加至50 mg/d静脉滴注维持,同时长期加用氟胞嘧啶1.5 g口服,每6 h 1次。2022年6月29日开始鞘内注射两性霉素B 0.1 mg +地塞米松5 mg,每隔1 d鞘内注射两性霉素B增加0.1 mg,直至0.5 mg
维持。8月20日,患者两性霉素B静脉总用量
2 050 mg,鞘内注射总用量10 mg,患者症状明显缓解,其间复查脑脊液墨汁染色仍可见隐球菌,但血清肌酐进行性升高,考虑患者急性肾损伤,遂停用两性霉素B,加用口服氟康唑600 mg/d。次日患者再次出现发热、头痛。8月22日至9月10日继续静脉滴注两性霉素B 25 mg/d+隔日鞘内注射两性霉素B 0.5 mg。9月11日开始停用两性霉素B,同时加大口服氟康唑剂量至800 mg/d。9月23日出院继续长期口服氟康唑800 mg/d+氟胞嘧啶1.5 g 口服,每6 h 1次。9月30日至10月17日,患者于中山大学第三附属医院行腹腔镜下脑室-腹腔分流术(VPS),其间予氟康唑800 mg 静脉滴注每日1次+氟胞嘧啶1.5 g口服每6 h 1次,出院后继续上述用藥方案。
五、随 访
11月20日患者返院复查,生命体征平稳,无异常面容,心、肺、腹未见明显异常体征,脑膜刺激征阴性。血红细胞稍减少(3.9×1012/L),中性粒细胞稍升高(0.741),淋巴细胞(0.174)、嗜酸性粒细胞(0.003)稍低,嗜酸性粒细胞减少(0.02×109/L)。
纤维蛋白原降解产物(9.2 mg/L)、纤维蛋白原(5.38 g/L)、D-二聚体(5.63 mg/L)均升高。血钾(3.47 mmol/L)降低,血清肌酐(127.4 μmol/L)、LDH(378 U/L)、血清淀粉样蛋白A(176 mg/L)、超敏CRP(79.55 mg/L)均升高,其余指标未见明显异常。痰涂片及痰培养均未见真菌。脑脊液常规:白细胞60×106/L,单个核细胞0.98,多核细胞0.02,蛋白定性(±),LDH 72 U/L,微蛋白定量 1 310.7 mg/L。脑脊液细胞生态学回报:有核细胞计数55×106/L(淋巴细胞0.91,单核细胞0.07,中性粒细胞0.02),红细胞计数(显微镜法)0,隐球菌计数(显微镜法)0,墨汁染色阳性,革兰染色查见酵母样真菌孢子;胸部CT(图1C、D):左肺上叶胸膜下结节,考虑隐球菌可能性大,双肺间质增厚,双肺肺气肿,右肺下叶少许纤维灶,右肺中叶少许炎症,右侧颈部-腹腔内置管;头颅MRI增强(图2C、D):脑实质及脑膜未见明显异常强化灶,右侧顶叶少许白质变性灶。经过5个月的治疗,患者头痛、发热症状消失,偶有恶心,无其他不适,第2次复查脑脊液发现白细胞增多及微量蛋白增多,考虑VPS术后引起,复查脑脊液墨汁染色仍阳性,复查痰涂片及痰培养阴性,治疗有效,继续抗真菌治疗直至疗程满1年。至撰稿日已随访2个月,患者未再诉头痛、发热及其他不适,嘱每月复查肝、肾功能,3个月复查脑脊液指标。
讨论
隐球菌细胞壁外面有一层厚厚的多糖荚膜,在外界环境中,这层荚膜使其免受干燥及噬菌者的侵害,在动物宿主中,荚膜既能抗吞噬细胞的吞噬,又能抗吞噬细胞的活性氧攻击,对其躲避宿主免疫系统监视、抑制宿主免疫功能也具有重要作用[4]。近年研究显示,新型隐球菌与格特隐球菌分布及环境有所不同,新型隐球菌在世界范围内分布,通常从鸟类尤其是鸽子排泄物中分离出来,而格特隐球菌主要在热带和亚热带地区分布,其生长与桉树、榕树等树木相关[5]。Baddley等[6]研究发现,格特隱球菌引起的隐球菌病中12个月的全因死亡率较新型隐球菌更低,但是格特隐球菌的白细胞计数较新型隐球菌更高,而葡萄糖含量较新型隐球菌低;治疗时间较新型隐球菌更长,肺部感染的发生率也高于新型隐球菌。
目前,隐球菌病的诊断除了依靠患者的症状、体征等非特异性方式外,还需依靠实验室检查,如脑脊液的直接镜检、脑脊液培养、荚膜抗原检测、mNGS及组织病理学[7-10]。本例使用多种方法染色均能检出隐球菌,推测患者脑脊液中的隐球菌滴度较高。mNGS技术费用较高,阳性率较低,但对鉴定菌种有优势,本例就是经mNGS鉴定为格特隐球菌。
目前关于隐球菌引起脑膜炎的机制大致分为细胞旁转运机制、跨细胞转运机制、特洛伊木马机制[11]。本例患者以脑膜炎起病,而肺部无症状,但是初始查胸部CT就提示左上肺结节性质待查,推测患者由肺部感染格特隐球菌开始,格特隐球菌通过其荚膜和细胞壁的黑色素等逃避肺部免疫系统的攻击,在患者体内繁殖的同时抑制肺中性粒细胞募集和炎性细胞因子的产生,这或许是导致患者无肺部症状的原因。格特隐球菌繁殖到一定阶段后经血行播散穿过血脑屏障进入中枢系统引起患者发病,然而其血培养未见隐球菌,考虑可能与滴度太低有关。本例患者的临床表现与Xue等[12]报道的2例格特隐球菌感染高度相似。
隐球菌病的治疗药物主要有3类:多烯类如两性霉素B,唑类如氟康唑、伊曲康唑、伏立康唑、泊沙康唑,嘧啶类似物如氟胞嘧啶等。本例患者的隐球菌脑膜炎以静脉滴注+鞘内注射两性霉素B同时口服氟胞嘧啶作为诱导期治疗方案,为使患者耐受两性霉素B,逐日加量,诱导期超过8周,之后以氟康唑+氟胞嘧啶行巩固期治疗,但在停用两性霉素B期间,患者症状反复,为解决患者颅内压较高的问题,患者曾至外院行VPS,从疗效上看,VPS改善颅内压升高的效果确切。有学者报道,对艾滋病合并新型隐球菌性脑膜炎患者行VPS,能降低治疗无效率或病死率并改善预后[13]。但对于免疫功能正常者发生格特隐球菌感染引起的脑膜炎,笔者尚未查及相关报道。目前该患者仍在随访,治疗结局不明。无论如何,VPS在难治性隐球菌性脑膜炎患者颅内压升高明显时仍是一种较好的选择,但要注意脑脊液过度引流可能是VPS后新的神经症状来源,该类神经症状包括共济失调、四肢瘫痪和精神状态改变等[14]。本例患者经历超过8周的诱导期治疗及数月的巩固期治疗,返院复查时症状减轻明显,但仍可在脑脊液中查到隐球菌,提示隐球菌持续感染,一方面考虑脑脊液的隐球菌滴度较高,两性霉素B的初始治疗量不足[逐日加量至50 mg/d而非0.5~0.7 mg/(kg·d)]引起;另一方面也考虑诱导期不足引起。针对使用两性霉素B时高达33.2%的肾损伤发生率,可考虑用两性霉素B的脂质体代替,也可考虑用泊沙康唑、伏立康唑、伊曲康唑代替[14]。日本曾有报道口服伏立康唑较长时间控制格特隐球菌的难治性病例[15]。总之,目前大多数非免疫功能低下隐球菌病患者的管理建议都是从HIV感染隐球菌的研究中推断出来的,因此有必要根据患者类型、免疫功能状态、抗真菌反应以及是否存在神经系统并发症,对隐球菌持续性感染进行个性化治疗,制定个性化的诱导期及巩固期方案。另外,需要注意的是隐球菌脑膜炎后长期神经功能缺损的发生率高达45%,包括听力受损、认知障碍、视力丧失、共济失调、耳聋和癫痫发作等[16]。因此,临床工作者不仅要注重隐球菌病的抗真菌治疗,也要关注其后遗症。
参 考 文 献
[1] Zhao Y, Lin X. Cryptococcus neoformans: sex, morphogenesis, and virulence. Infect Genet Evol, 2021, 89: 104731.
[2] Maziarz E K, Perfect J R. Cryptococcosis. Infect Dis Clin North Am, 2016, 30(1): 179-206.
[3] Bahn Y S, Sun S, Heitman J, et al. Microbe Profile: Cryptococcus neoformans species complex. Microbiology (Reading), 2020, 166(9): 797-799.
[4] Casadevall A, Coelho C, Cordero R J B, et al. The capsule of Cryptococcus neoformans. Virulence, 2019, 10(1): 822-831.
[5] Serna-Espinosa B N, Guzmán-Sanabria D, Forero-Castro M, et al. Environmental status of Cryptococcus neoformans and Cryptococcus gattii in Colombia. J Fungi (Basel), 2021, 7(6): 410.
[6] Baddley J W, Chen S C A, Huisingh C, et al. MSG07: an international cohort study comparing epidemiology and outcomes of patients with Cryptococcus neoformans or Cryptococcus gattii infections. Clin Infect Dis, 2021, 73(7): 1133-1141.
[7] 邢小微, 张家堂. 隐球菌性脑膜炎的诊断进展. 中国真菌学杂志, 2020, 15(6): 378-380.
[8] 中华医学会感染病学分会. 隐球菌性脑膜炎诊治专家共识. 中华传染病杂志, 2018, 36(4): 193-199.
[9] 劉正印, 王贵强, 朱利平, 等. 隐球菌性脑膜炎诊治专家共识. 中华内科杂志, 2018, 57(5)317-323.
[10] Xing X W, Zhang J T, Ma Y B, et al. Apparent performance of metagenomic next-generation sequencing in the diagnosis of cryptococcal meningitis: a descriptive study. J Med Microbiol, 2019, 68(8): 1204-1210.
[11] 杨颖茵, 李凌华. 隐球菌感染中枢神经系统的致病机制. 国际流行病学传染病学杂志, 2022, 49(3)157-161.
[12] Xue X, Deng H, Zhao L, et al. Cryptococcosis caused by Cryptococcus gattii. Medicine, 2020, 99(50): e23213.
[13] 柯迎春, 林梓梁, 李凌华, 等. 脑室-腹腔分流术治疗艾滋病合并新型隐球菌性脑膜炎的临床疗效. 中华传染病杂志, 2022, 40(5): 270-274.
[14] Henao-Martínez A F, Chastain D B, Franco-Paredes C. Treatment of cryptococcosis in non-HIV immunocompromised patients. Curr Opin Infect Dis, 2018, 31(4): 278-285.
[15] Nakao M, Fujita K, Arakawa S, et al. Treatment of Cryptococcus gattii infection using voriconazole. Intern Med, 2021, 60(22): 3635-3638.
[16] Aye C, Henderson A, Yu H, et al. Cryptococcosis-the impact of delay to diagnosis. Clin Microbiol Infect, 2016, 22(7): 632-635.
(收稿日期:2023-05-19)
(本文编辑:林燕薇)
