4种饵料对玉足海参幼体生长和发育的影响
2023-08-23严俊贤赵旺于刚温为庚张钰伟黄星美邓正华董义超
严俊贤 赵旺 于刚 温为庚 张钰伟 黄星美 邓正华 董义超


摘 要:为了解单一饵料或混合投喂对玉足海参(Holothuria leucospilota)幼体生长的影响,采用2种单胞藻(牟氏角毛藻、球等鞭金藻)和2种酵母(酿酒酵母、海洋红酵母)单一或组合搭配投喂玉足海参耳状幼体,测定并比较海参幼体的体长、胃宽、水体腔长、变态成活率等指标。试验结果显示:单一饵料组中,牟氏角毛藻对玉足海参幼体体长的生长及变态存活最有利,而球等鞭金藻对其脏器(胃、水体腔)的发育最有利;综合所有处理组的投喂效果看,混合投喂组比单一饵料组更有利于玉足海参幼体的生长和存活,其中酿酒酵母+海洋红酵母的混合投喂组合得到了最高的体长、胃宽和水体腔长特定生长率,牟氏角毛藻+海洋红酵母投喂组的变态成活率最高,变态发育速度最快。结果表明,在玉足海参幼体培养早期适合以混合酵母为主投喂,后期则可较多投喂牟氏角毛藻和海洋红酵母。
关键词:玉足海参;幼体;饵料;生长;发育
玉足海参(Holothuria leucospilota)又称荡皮参、乌虫参,隶属于海参纲、楯手目、海参科、海参属,是热带、亚热带的常见海参种类,其分布范围广,在我国福建、广东和海南等南方沿海省份均有分布。玉足海参体壁柔软,体表呈暗褐色或紫褐色,生活于潮间带的石缝和水草繁茂的海床中,以海底泥沙、有机碎屑和底栖硅藻等为食[1],有“海底清道夫”的美誉。因其具有清洁海底底质的特性,我国已有利用玉足海参进行生态养殖以改善养殖环境、提高主要养殖对象成活率的报道,如利用玉足海参和半叶马尾藻(Sargassum hemiphyllum)之间的生态互补性进行网箱养殖沉积物的净化,可以减少沉积物中氮、磷的积累[2];将玉足海参与凡纳滨对虾(Litopenaeus vannamei)进行混养,能有效降低虾塘底质中的硫化物,并能对对虾的生长起到一定的促进作用,在养殖环境得到改善的同时,也增加了经济收入[3-4]。因此,对玉足海参进行规模化繁育开发并为养殖户提供参苗,对促进养殖业可持续发展、提高养殖效益有重要意义。
饵料的选择对于海参育苗的成败起到关键作用,选择优质、合适的海参耳状幼体饵料对其生长、存活起到积极作用。目前,国内对仿刺参(Apostichopus japonicas)育苗的研究较多。研究发现,牟氏角毛藻(Chaetoceros muelleri)和小新月菱形藻(Nitzschia closterium)对刺参幼体的生长和存活最有利[5-6];藻粉+干酵母对刺参幼体的生长、存活以及变态也具有较好的效果[7]。国外则对其他种类海参幼虫的饵料筛选研究较多,如对糙海参(H. scabra)[8]和美国红参(Parastichopus californicus)[9]饵料优选的研究报道。综合以上研究发现,在不同的海参耳状幼体阶段,其最佳饵料品种存在一定的差异。本文采用南方海参育苗中常用的牟氏角毛藻、球等鞭金藻(Isochrysis galbana)[10],以及水产育苗常用的酿酒酵母(Saccharomyces cerevisiae)和海洋红酵母(Rhodotorula sp.)4种饵料,研究单一饵料投喂和搭配组合投喂对玉足海参耳状幼体生长发育和存活的影响,以探索玉足海参浮游幼体的最佳饵料选择,为玉足海参的规模化繁育开发提供参考。
1 材料和方法
1.1 试验材料
球等鞭金藻和牟氏角毛藻的藻种取自南海水产研究所的单胞藻培养室;海洋红酵母浓缩液(酵母含量约8×109 cell/mL)购自无锡中顺海得生物科技公司,4 ℃冷藏保存;酿酒酵母为安琪酵母股份有限公司的酿酒酵母Ⅰ型(水产专用,酵母含量约2×1010 cell/g)。
2016年4月从三亚市海区采集玉足海参亲本,将其暂养于海南省陵水黎族自治县新村镇,暂养1~2 d后对亲参进行催产。海參亲本经阴干、升温刺激后释放配子,待配子受精后,洗卵并将其移至容积为5 m3的育苗池中进行孵化。34 h后完成孵化,停止充气,用虹吸法收集上层优质耳状幼体进行试验。
1.2 试验方法
试验场地设置在中国水产科学研究院南海水产研究所热带水产研究开发中心的空调控温室内。试验容器为容积6 L的小水桶,每桶盛放5 L水。试验用海水取自新村港海域,海水盐度为33,经24 h暗沉淀、砂滤、精密过滤器过滤和紫外线消毒后使用,试验水温保持在27.8 ℃。试验桶内放置气石,24 h不间断微充气,以保持足够的溶解氧。试验桶上方用黑色遮阳网覆盖,保持光照强度在500 lx以下。
4种饵料的分组方案见表1。试验共分8个试验组和1个对照组(即不投饵组),每组设置3个重复。幼体培养密度为0.2个/mL。海洋红酵母个体较小,仅为1~2 μm,投喂密度为每天40 000 cell/mL,其他3种饵料的投喂密度为每天20 000 cell/mL,每天投喂2次,早晚各1次(8:00和20:00)。由2种饵料搭配混合投喂的试验组,2种饵料的细胞个数比例基本上为1∶1(含海洋红酵母组则将相应细胞数目调整为1∶2,见表1)。每天换水1次,换水量为试验水体的50%。试验为期15 d。
1.3 试验数据处理和分析
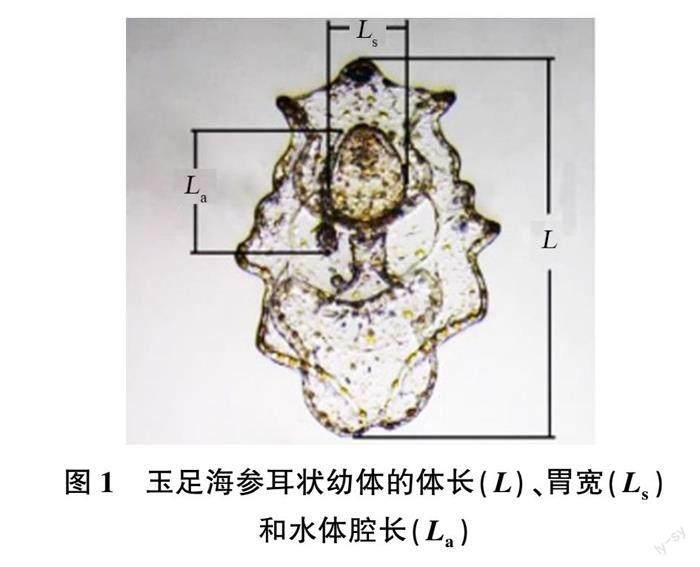
试验过程中,每2 d取样1次,测量玉足海参的体长等指标,每个重复的取样量为20个。通过普通光学显微镜观察玉足海参各性状指标(见图1)。使用ImageView软件在显微镜4倍镜下进行拍照统计测量。在小耳状幼体至大耳状幼体阶段增加2项脏器测量指标,即胃宽和水体腔长,并统计特定生长率(RSG,%/d)。同时观察大耳状幼体间的形态变化及差异。樽形幼体完成变态发育后,统计其变态成活率(RAS,%)。
RSG=100×(ln Lt- ln L0)/t (1)
RAS=100×Q终/Q始(2)
公式(1)~(2)中,Lt为大耳状幼体时的体长(μm),L0为初始体长(μm),t为试验天数(d)。Q终为最终存活数,Q始为初始幼体个数。
采用SPSS 19.0统计软件进行各组间的单因素方差检验和显著性t检验,设P<0.05为差异显著,采用Sigmaplot 12.0软件作图。
2 结果
2.1 饵料对玉足海参幼体体长变化及变态成活率的影响
投喂不同饵料对玉足海参幼体体长的影响见图2。由于缺乏营养,试验3 d后,对照组(9组)玉足海参幼体的身体即开始萎缩,其他组的幼体则在试验第5天才开始随着变态发育而缩小。试验第5天时,投喂酿酒酵母+海洋红酵母组(7组)幼体体长达到最大,第7天则迅速缩小至最小(除对照组外),该组幼体体长收缩的差值最大,说明此阶段幼体身体发育收缩较快,从大耳状幼体变态至樽形幼体的速度也较快。在试验后期,单一投喂牟氏角毛藻组(1组)幼体体长收缩所需时间较长,且体长收缩差值较小;而搭配海洋红酵母投喂后(8组),幼体体长收缩最快,从樽形幼体变态发育至五触手幼体的速度也较快。
不同饵料对玉足海参幼体变态成活率的影响见图3。由图3可见,混合投喂组幼体的变态成活率整体高于单一饵料组,其中尤以8组(牟氏角毛藻+海洋红酵母)成活率最高,达到14.77%;投喂牟氏角毛藻+酿酒酵母(6组)和海洋红酵母+酿酒酵母(7组)的变态成活率稍低,但3组间差异不显著(P>0.05)。混合投喂的5、6、7组间变态成活率也无显著性差异(P>0.05)。投喂单一饵料的组别中,投喂牟氏角毛藻的1组变态成活率最高,显著高于投喂球等鞭金藻组(2组)和酿酒酵母组(3组)(P<0.05)。
2.2 饵料对玉足海参大耳幼体的体长、胃宽和水体腔长的影响
玉足海参大耳状幼体后期消化系统萎缩,停止摄食,整体向樽形收缩,因此,幼体生长至大耳状幼体时,其体长、胃宽和水体腔长的特定生长率达到最大值。由图4可见,对照组(9组)的3个指标均显著低于各试验组(P<0.05)。
不同饵料种类对玉足海参体长特定生长率的影响见图4-a。其中,海洋红酵母与酿酒酵母搭配投喂的7组的特定生长率显著高于单一投喂酿酒酵母的3组(P<0.05),除7、9组外,其他各组间的差异均不显著(P>0.05)。玉足海参幼体胃宽特定生长率的情况见图4-b。球等鞭金藻组(2组)在单一饵料投喂组中胃宽特定生长率是最高的(P<0.05),海洋红酵母与酿酒酵母搭配投喂的7组,其胃宽特定生长率与2、5、6组无显著差异(P>0.05),但显著高于除此之外的其他各组(P<0.05),可见2、7组两组饵料对玉足海参幼体的胃部生长均较有利。水体腔与胃部一样同属于幼体的内脏,在不同投饵条件下,水体腔长特定生长率的差异与胃部的基本一致(见图4-c)。投喂单一饵料的组(1、2、3、4组)间水体腔长特定生长率无显著差异(P>0.05),但投喂酿酒酵母的3组均值较低。海洋红酵母分别与酿酒酵母和牟氏角毛藻搭配混合投喂(7、8组),幼体脏器的特定生长率均高于3组,可见海洋红酵母与其他饵料混合投喂更有利于促进海参幼体脏器的生长发育。
2.3 不同饵料对玉足海参幼体形态的影响
试验发现,摄食不同类别饵料的玉足海参耳状幼体,其体形存在显著差异(见图5)。在玉足海参幼体发育同一阶段,单一投喂单胞藻类(牟氏角毛藻、球等鞭金藻)的幼体与单一投喂酵母类(酿酒酵母、海洋红酵母)的幼体相比,前者发育较快且更健康。单一投喂单胞藻类的玉足海参幼体(见图5-a),其幼虫臂较强壮、突出,轮廓清晰,整体显得更为健壮。单一投喂酵母类的玉足海参幼体(见图5-b),其幼虫臂则较小,轮廓不清晰,整体较圆润。
3 讨论
牟氏角毛藻和球等鞭金藻广泛应用于水产苗种培育,其中前者属于硅藻门,后者则属于金藻门。不同纲的单胞藻种类,其营养组成存在一定的差异,其中碳水化合物和蛋白质含量差异较小,而总脂含量差异则较大[11]。如金藻的总脂含量高于硅藻,其含有丰富的二十二碳六烯酸(DHA),而硅藻的二十碳五烯酸(EPA)含量明显高于金藻[12-13]。本试验所用牟氏角毛藻和球等鞭金藻的多不饱和脂肪酸(PUFA)质量分数分别为21.40%和44.78%[13]。酵母中高度不饱和脂肪酸(HUFA)含量极低,但含有丰富的蛋白质(47%~56%)、碳水化合物(26%~36%)和多种B族维生素,另外,酵母细胞壁中含有的多糖物质和海洋红酵母中富含的胡萝卜素和虾青素都可提高生物的免疫能力[14-18]。本试验结果显示,球等鞭金藻更有利于参苗脏器的发育,而牟氏角毛藻则有利于其幼体存活;在投喂的两种酵母中,海洋红酵母更有利于参苗的生长和存活。但本试验中通过饵料的组合搭配后发现,两种酵母配合使用更有利于参苗的生长发育,且幼体变态成活率也较高。这可能是因为两种酵母的营养成分形成互补,且多不饱和脂肪酸对玉足海参幼体的生长存活影响不大。这一观点与Knauer[8]的研究结果一致。类似的研究表明,在海参幼体培育中使用代用饵料(海洋红酵母)可完全替代单胞藻[19]。本试验中,牟氏角毛藻和海洋红酵母配合投喂组获得了最高的变态成活率。然而,分别投喂单胞藻类和酵母类导致玉足海参幼体的形态产生了较大差异,表现为摄食单胞藻的玉足海参耳状幼体具有更健壮的体形,这可能是两类饵料间的营养差异造成的。一般认为,不同饵料种类的营养特性各有优劣,通过多种饵料配合使用可达到营养互补的目的[20-22],有利于参苗的生长发育和提高成活率。在本試验中,混合投喂组在幼体生长和变态存活率上均获得了较好的结果。
由于种类及地理位置的不同,海参幼体的最适饵料也会有所差异,例如牟氏角毛藻、球等鞭金藻、盐生巴夫藻(Pavlova salina)、红酵母、骨条藻和杜氏盐藻(Dunaliella salina)等均可被应用于海参苗种培育[23-28]。生活于较深海底的棘辐肛参(Actinopyga echinites),其最适饵料是球等鞭金藻[29];我国北方的仿刺参育苗则主要使用牟氏角毛藻和杜氏盐藻作为浮游幼体的单胞藻饵料进行投喂[28];单独投喂海洋红酵母也可获得较好的效果[19];培养糙海参浮游幼体的最适单胞藻饵料为牟氏角毛藻[8],美国红参、尖塔海参(H. spinifera)的最适饵料则均为钙质角毛藻(C. calcitrans)[9,30]。综合本试验结果,单一饵料试验组中,投喂牟氏角毛藻对玉足海参浮游幼体的效果最好,幼体体长和脏器的特定生长率均较高,变态成活率也是4种单一饵料中最高的。饵料适合与否,除了其营养成分外,还与其细胞的大小、细胞壁的易消化程度等有关。本试验中,单一投喂酿酒酵母的幼体,其生长率和成活率均最低,这可能是由于酿酒酵母的细胞壁较难消化,细胞内丰富的营养物质难以被吸收,因而不利于玉足海参幼体的生长和存活。
配合使用2种或2种以上饵料可以避免营养单一的缺点,更有利于海参幼体的生长存活。Asha等[30]发现,投喂球等鞭金藻+钙质角毛藻可使尖塔海参获得43 μm/d的生长速度,且其变态成活率达100%。Battaglene[31]关于糙海参饵料的试验表明,混合投喂红酵母R. salina+牟氏角毛藻的效果较其他单一单胞藻饵料好。在刺参幼体培育中,以适当比例的单胞藻搭配海洋红酵母进行投喂能提高幼体的生长速度[5]。本试验中,玉足海参幼体的最佳饵料搭配是海洋红酵母+牟氏角毛藻,该饵料搭配能使幼体获得较快的生长发育速度,且变态成活率最高,说明营养互补的2种饵料对幼体的存活率有明显的促进作用。然而,于宗赫等[32]利用牟氏角毛藻和海洋红酵母单独投喂或按照一定比例混合投喂,结果发现,随着饵料中海洋红酵母比例的增加,玉足海参浮游幼体的生长、发育及成活率均受到不利影响。该结论与本试验结果差异较大,可能与海参幼体所处的育苗环境有关。玉足海参幼体的发育不仅受饵料的影响,同时也受水体环境多种因子的控制。例如,水质因子可影响玉足海参的生长发育进度,在水温29 ℃、盐度40的条件下,幼体发育到樽形幼体需要22~27 d[33],而在水温29~33℃、盐度27~30条件下只需要17~20 d[32,34]。
4 小结
玉足海参生活于热带、亚热带浅海区域,其育苗水温相对较高,残饵和粪便容易造成水质恶化,因此在饵料的选择上更偏向于对水质不会造成污染的活体饵料。在实际生产中,由于对饵料的需求量较大,因此要求活体饵料具有生长快、易培养且与参苗培育同步性的特点,从这一点看,培养鲜活单胞藻则好。酿酒酵母干粉具有一定的自溶性,容易污染育苗水体,应避免单一大量使用,替而代之的是具有高活性的海洋红酵母浓缩液。一方面海洋红酵母富含氨基酸、维生素及胡萝卜素等营养物质,另一方面可改善水质,加速有机污染物分解,更有利于海参幼体的生长存活。
综合本试验的结果可知,本试验4种饵料均可用于玉足海参的幼体培育,相比投喂单一饵料,2种酵母混合投喂对早期幼体体长和脏器的生长发育更有利,其中投喂牟氏角毛藻+海洋红酵母获得的变态成活率最高。因此建议,在玉足海参幼体培养早期可以混合酵母为主投喂,后期则可较多投喂牟氏角毛藻和海洋红酵母。
参考文献
[1]廖玉麟.中国动物志:棘皮动物门:海参纲[M]北京:科学出版社,1997.
[2]彭鹏飞,胡超群,于宗赫,等.玉足海参和半叶马尾藻净化网箱养殖沉积物的初步研究[J].海洋环境科学,2012,31(3):316-322.
[3]于宗赫,胡超群,齊占会,等.玉足海参与凡纳滨对虾的混养效果[J].水产学报,2012,36(7):1081-1087.
[4]常亚青,隋锡林,李俊.刺参增养殖业现状、存在问题与展望[J].水产科学,2006,25(4):198-201.
[5]张萍萍,李琪,孔令锋,等.四种单胞藻和海洋红酵母对刺参浮游幼虫生长与变态成活的影响[J].中国海洋大学学报(自然科学版),2011,41(10):30-34.
[6]朱嘉程,栗才红.饵料的种类和密度对红刺参幼体生长发育和存活率的影响[J].黑龙江水产,2015(6):28-31.
[7]陈书秀,刘学迁,王青岩,等.微绿球藻作为刺参幼体饵料的可行性研究[J].河北渔业,2014(7):53-55.
[8]KNAUER J.Growth and survival of larval sandfish,Holothuria scabra (Echinodermata:Holothuroidea),fed different microalgae[J].Journal of the World Aquaculture Society,2011,42:880-887.
[9]REN Y,LIU W,DONG S,et al.Effects of mono-species and bi-species microalgal diets on the growth,survival and metamorphosis of Auricularia larvae of the California Sea cucumber,Parastichopus californicus(Stimpson,1857)[J].Aquaculture Nutrition,2016,22(2):304-314.
[10]严俊贤,王世锋,周永灿,等.糙海参胚胎和幼体发育的形态观察[J].水产学报,2012,36(7):1073-1080.
[11]BROWN M R.Nutritional properties of microalgae for mariculture[J].Aquaculture,1997,151(1/2/3/4):315-331.
[12]MARSHALL R,MCKINLEY S,PEARCE C M.Effects of nutrition on larval growth and survival in bivalves[J].Reviews in Aquaculture,2010,2:33-55.
[13]蒋霞敏,郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报,2003,27(3):243-247.
[14]吴格天,马悦欣,童圣英,等.培养基对海洋酵母脂肪酸组成的影响[J].大连水产学院学报,2000,15(1):17-22.
[15]黄玲.食用酵母蛋白质的研究进展[J].食品与发酵工业,1992,18(1):56-62.
[16]岳支华,曾箭民.酵母细胞壁(PR-500)及其在养殖生产中的应用[J].中国水产,2000(5):68-69.
[17]韩梅,翟玉贵,王小波,等.锁掷酵母与海洋红酵母的营养成分分析[J].食品与发酵工业,2013,39(1):11-15.
[18]JAMES C M,DIAS P,SALMAN A E.The use of marine yeast (Candida sp.) and bakers yeast (Saccharomyces cerevisiae) in combination with Chlorella sp.for mass culture of the rotifer Brachionus plicatilis[J].Hydrobiologia,1987,147(1):263-268.
[19]趙玉明,毛玉泽.海洋酵母培育仿刺参Apostichopus japonicus浮游幼体研究[J].中国农业科技导报,2009,11(3):71-75.
[20]雷西娟,郭文,刘恩孚,等.不同饵料投喂对魁蚶幼体生长的影响[J].广西科学院学报,2017,33(3):164-170.
[21]蒋湘,曹家辉,文赵明,等.不同饵料对日本囊对虾的生长与存活的影响[J].水产养殖,2018,39(1):8-12.
[22]李敏,张汉华,朱长波,等.不同饵料及其组合对黑鲍幼鲍生长及存活的影响[J].南方水产,2007,3(6):40-46.
[23]BATTAGLENE S C,SEYMOUR J E,RAMOFAFIA C.Survival and growth of cultured juvenile sea cucumbers,Holothuria scabra[J].Aquaculture,1999,178(3/4):293-322.
[24]PITT R.Review of sandfish breeding and rearing methods[J].SPC Beche-de-mer Information Bulletin,2001,14:14-21.
[25]RAMOFAFIA C,BYRNE M,BATTAGLENE S C.Development of three commercial sea cucumbers,Holothuria scabra,H. fuscogilva and Actinopyga mauritiana:larval structure and growth[J].Marine and Freshwater Research,2003,54(5):657-667.
[26]JAMES B D.Captive breeding of the sea cucumber,Holothuria scabra,from India[J].Advances in Sea Cucumber Aquaculture and Management,2004,463:385-395.
[27]PITT R,DUY N D Q. Breeding and rearing of the sea cucumber Holothuria scabra in Vietnam[J].Advances in Sea Cucumber Aquaculture and Management,2004,463:333-346.
[28]SUI X L.The progress and prospects of studies on artificial propagation and culture of the sea cucumber,Apostichopus japonicus[J].Advances in Sea Cucumber Aquaculture and Management,2004,463:273-276.
[29]CHEN C P,CHIAN C S.Larval development of sea cucumber,Actinopyga echinites(Echinodermata:Holothuroidea)[J].Bulletin of Institute of Zoological Academic Sinica,1990,29(2):127-133.
[30]ASHA P S,MUTHIAH P.Effects of single and combined microalgae on larval growth,development and survival of the commercial sea cucumber Holothuria spinifera Theel[J].Aquaculture Research,2006,37(2):113-118.
[31]BATTAGLENE S C.Culture of tropical sea cucumbers for stock restoration and enhancement[J].NAGA,The World Fish Center,1999,22(4):4-11.
[32]于宗赫,黄文,马文刚,等.牟氏角毛藻和海洋红酵母对玉足海参浮游幼体发育、生长及成活率的影响[J].水产学报,2021,45(12):2003-2010.
[33]DABBAGH A R,SEDAGHAT M R,RAMESHI H,et al.Breeding and larval rearing of the sea cucumber Holothuria leucospilota Brandt(Holothuria vegabunda Selenka) from the northern Persian Gulf,Iran[J].SPC Beche-de-Mer Information Bulletin,2011,31:35-38.
[34]HUANG W,HUO D, YU Z H, et al.Spawning,larval development and juvenile growth of the tropical sea cucumber Holothuria leucospilota[J].Aquaculture,2018,488:22-29.
Effect of four different diets on larval growth and development of sea cucumber Holothuria leucospilota
YAN Junxian1,2, ZHAO Wang1,2,3, YU Gang1,2, WEN Weigeng1,2,3, ZHANG Yuwei1,2,3, HUANG Xingmei1,2,3, DENG Zhenghua1,2,3, DONG Yichao4
(1. South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization,Ministry of Agriculture and Rural Affairs,Guangzhou 510300,China; 2. Sanya Tropical Fisheries Research Institute,Sanya 572018,China; 3. Key Laboratory of Efficient Utilization and Processing of Marine Fishery Resources of Hainan Province,Sanya 572018,China; 4. Shandong Vocational College of Science and Technology,Weifang 261053,China)
Abstract: To study the effect of single or combined 4 different diets on larval growth of the sea cucumber Holothuria leucospilota,the larvae of H. leucospilota were fed with single or mixed diets,and the effects of different diets on its growth were compared by measuring and recording the body length,stomach width and axohydrocoel length of the larvae.Results demonstrated that the specific growth rate(SGR) of larval body length,stomach width and axohydrocoel length presented differentiation by feeding different diets.In the single diet groups,Chaetoceros muelleri was the best for the larval body growth and metamorphosis,and Isochrysis galbana was the best for the development of larval internal organs including stomach and axohydrocoel.Over all of the treatment,the combined diets were better than the single diets to the larval growth and survival.Larvae fed with combining Saccharomyces cerevisiae and Rhodomonas sp. had the highest SGR of body length,stomach width and axohydrocoel length.Larvae fed with combining C. muelleri and Rhodomonas sp. obtained the highest metamorphosis survival and metamorphosis developmental speed.This research could provide the reliable data for enhancing the artificial breeding technology of H. leucospilota.
Key words: Holothuria leucospilota; larval; bait; growth; development
收稿日期:2022-08-23
作者簡介:严俊贤(1987—),男,助理研究员,研究方向为热带海洋特色经济品种生理生化与养殖开发。E-mail:yanjunxianjjj@163.com
通信作者:于刚(1972—),男,研究员,研究方向为热带海洋特色经济品种养殖开发。E-mail:gyu0928@163.com
项目资助:国家重点研发计划项目(2019YFD0900905);三亚市院地科技合作项目(2018YD05);农业农村部财政专项(NHYYSWZZZYKZX2020); 中国水产科学研究院中央级公益性科研院所基本科研业务费专项资金(2020TD55);现代农业产业技术体系专项资金(CARS-49);国 家星火计划项目(2013GA740016)。
