电针心包经穴对脑缺血大鼠不同时点脑组织Nogo-A及NgR1蛋白表达的影响
2023-08-23肖豆马文娟唐雅妮谢峥嵘潘江刘民权章薇陈成
肖豆 ,马文娟 ,唐雅妮 ,谢峥嵘 ,潘江 ,刘民权 ,章薇 ,陈成
1.同济大学附属杨浦医院,上海 200090; 2.长沙市中医医院,长沙市第八医院,湖南 长沙 410100;3.长沙民政职业技术学院,湖南 长沙 410004; 4.湖南中医药大学第一附属医院,湖南 长沙 410007
脑缺血是因大脑血液循环受阻,缺血、缺氧导致局限性脑组织缺血性坏死或软化,进而引起相应神经系统功能缺损的一种疾病。患者脑缺血后多伴有肢体功能障碍,甚至造成终身残疾。神经修复是促进脑缺血患者神经功能康复的重要途径[1]。研究认为,神经功能因子及炎症介质的相互作用是影响神经修复的关键因素[2]。其中髓鞘相关生长抑制因子A(Nogo-A)与Nogo 受体1(NgR1)均具有抑制神经细胞迁移和扩散、阻碍轴突再生的作用[3-4],通过消除或减少上述抑制因子,能达到促进神经再生及脑缺血后中枢神经修复的作用[5-6]。本研究基于Nogo-A/NgR1信号通路观察电针心包经穴对大脑中动脉栓塞(MCAO)模型大鼠不同时点脑组织Nogo-A及NgR1蛋白表达的影响,探讨电针对脑缺血损伤后神经修复的作用机制。
1 材料与方法
1.1 动物
SPF 级雄性SD大鼠150只,体质量220~250 g,3~4月龄,湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK(湘)2016-0002。饲养于温度22 ℃、湿度55%~70%环境。实验过程遵守实验动物管理和使用规定。
1.2 主要试剂与仪器
Nogo-A抗体(美国Proteintech公司,货号10740-1-Ap),NgR1 抗体(博奥森公司,货号bs-0129R),β-actin抗体(美国Proteintech公司,货号66009-1-Ig),二抗鼠抗体(美国Proteintech公司,货号SA00001-1),二抗兔抗体(美国Proteintech公司,货号SA00001-2),RIPA裂解液(上海碧云天公司,货号P0013B)。
0.30 mm×15 mm华佗牌毫针、SDZ-Ⅱ华佗电针治疗仪(苏州医疗用品厂有限公司),DYY-6C 电泳仪(北京六一仪器厂),YD-315切片机(浙江金华益迪试验器材),DYCZ-40D转膜仪(北京六一仪器厂)。
1.3 分组与造模
将150只SD大鼠随机分为正常组、假手术组、模型组、心包经组和肺经组,每组30只,各组再分为3、7、14、21、28 d 5个时间点,每个时间点各6只。
造模前禁食1 d,参照Longa[7]和Koizumi[8]造模方法,以颈外动脉插入线栓法制备MCAO大鼠模型。正常组不做任何处理,假手术组仅暴露血管。造模后次日,采用Longa 5级4分制评分法[7]评分:无神经功能缺损计0分,缺血对侧伸直障碍、前爪内收计1分,行走向偏瘫侧转圈计2分,行走向偏瘫侧倾倒计3分,完全丧失意识、不能行走计4分。选取评分1~3分大鼠纳入实验。
1.4 干预
造模成功次日开始电针干预,参照《实验针灸学》[9]动物穴位图谱取穴。心包经组选取“天泉”“曲泽”“内关”“大陵”,肺经组选取“天府”“尺泽”“列缺”“太渊”,用毫针刺入缺血对侧穴位3~4 mm,接通电针治疗仪,心包经组“天泉”“曲泽”相连、“内关”“大陵”相连,肺经组“天府”“尺泽”相连、“列缺”“太渊”相连,选用连续波,电压2~4 V,电流4~6 mA,强度以局部组织轻颤为度。每次30 min,每日1次,连续6 d,休息1 d,继续干预至28 d。
1.5 HE染色
分别于电针3、7、14、21、28 d取相应大鼠,颈椎脱臼处死,断头取脑,参照《大鼠脑立体定位图谱》[10],模型组、心包经组和肺经组切取左侧视交叉至脑桥属大脑中动脉供血区域,正常组和假手术组参照上述部位取材。脱水、包埋、切片后,60 ℃烤片1~2 h,切片置于二甲苯中10 min×2 次。100%、100%、95%、85%、75%乙醇依次放置5 min,蒸馏水洗5 min,苏木素染色5~10 min,蒸馏水冲洗,PBS返蓝,伊红染3~5 min,蒸馏水冲洗,梯度乙醇脱水,置于二甲苯中10 min×2次,中性树胶封片,显微镜下观察。
1.6 免疫组化染色
取大鼠缺血侧脑组织,用4%多聚甲醛固定,常规制作石蜡切片,切片脱蜡至水,浸入柠檬酸盐缓冲液,微波炉加热至沸腾,连续煮25 min,冷却至室温,PBS洗涤3 min×3次进行热修复抗原,灭活内源性酶后,滴加Nogo-A、NgR1 一抗(1∶200),4 ℃孵育过夜。PBS冲洗5 min×3次,加二抗,37 ℃孵育30 min,PBS冲洗5 min×3次,DAB显色,苏木素复染5~10 min,蒸馏水冲洗,PBS返蓝后显微镜下观察,随机选择5个不重叠视野采集图像,Image-Pro Plus 6.0软件分析每个视野阳性表达的平均光密度(阳性染色为棕黄色)。
1.7 Western blot检测
取缺血侧脑组织,每100 mg组织加入RIPA裂解液1 mL研磨,冰上裂解10 min,4 ℃、12 000 r/min离心15 min,吸取上清液,BCA法测定蛋白浓度。加入上样缓冲液加热变性后,电泳,转移至NC膜,用5%脱脂奶粉室温封闭60 min,分别加入Nogo-A一抗(1∶800)、NgR1一抗(1∶1 500)、β-actin一抗(1∶5 000),4 ℃孵育过夜,加入相应二抗(1∶5 000),室温孵育90 min。使用ECL化学发光液显影,用Quantity One软件分析蛋白条带灰度值。以β-actin为内参,计算目的蛋白相对表达量(目的蛋白灰度值/β-actin灰度值)。
1.8 统计学方法
2 结果
2.1 电针对模型大鼠缺血侧脑组织病理变化的影响
正常组、假手术组大鼠各时点脑组织结构完整、清晰致密,神经元细胞胞质丰富,可见较大清晰核仁;模型组大鼠各时点脑组织可见大片梗死灶,神经细胞消失或皱缩,细胞核固缩,核边集严重,细胞间距增大,间质染色稀疏;心包经组和肺经组大鼠各时点缺血脑组织细胞排列相对规则,较模型组结构紧密。心包经组脑组织结构较同时点肺经组稍紧密、细胞排列稍规则。结果见图1。

图1 各组大鼠缺血侧脑组织形态(HE染色,×400)
2.2 电针对模型大鼠缺血侧脑组织髓鞘相关生长抑制因子A、Nogo受体1表达的影响
免疫组化结果显示,与正常组、假手术组比较,模型组大鼠各时点脑组织Nogo-A、NgR1表达明显升高(P<0.01);与模型组比较,心包经组和肺经组大鼠各时点脑组织Nogo-A、NgR1表达明显降低(P<0.05,P<0.01);与肺经组比较,心包经组大鼠7、28 d脑组织Nogo-A表达明显降低(P<0.05,P<0.01),各时点NgR1表达明显降低(P<0.05,P<0.01)。见图2、图3、表1、表2。
表1 各组大鼠缺血侧脑组织不同时点Nogo-A表达比较(±s,平均光密度)
注:与正常组、假手术组比较,★★P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与肺经组比较,●P<0.05,●●P<0.01
?
表2 各组大鼠缺血侧脑组织不同时点NgR1表达比较(±s,平均光密度)

表2 各组大鼠缺血侧脑组织不同时点NgR1表达比较(±s,平均光密度)
注:与正常组、假手术组比较,★★P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与肺经组比较,●P<0.05,●●P<0.01
?
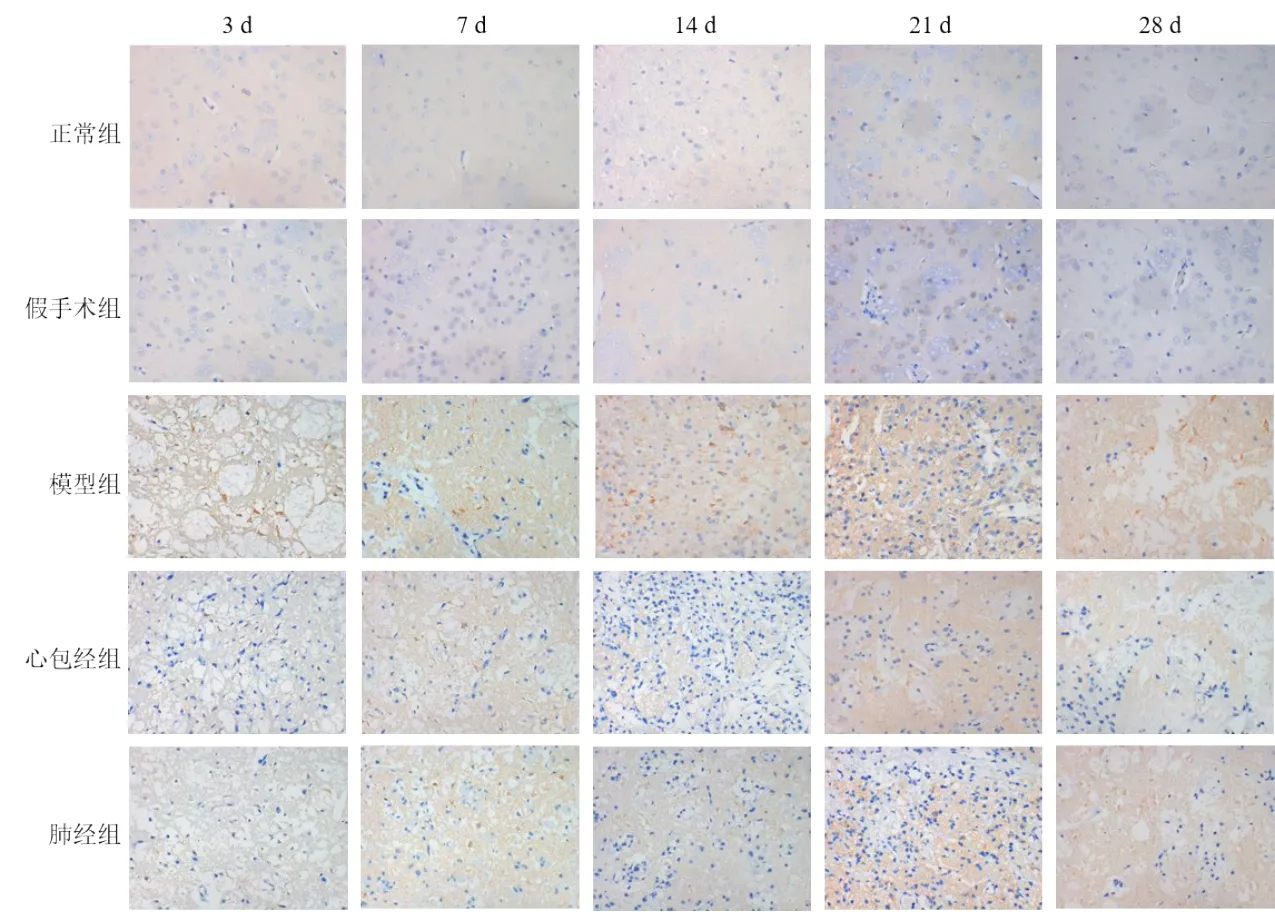
图2 各组大鼠缺血侧脑组织Nogo-A阳性表达(免疫组化染色,×400)

图3 各组大鼠缺血侧脑组织NgR1阳性表达(免疫组化染色,×400)
Western blot结果显示,与正常组、假手术组比较,模型组大鼠各时点脑组织Nogo-A、NgR1蛋白表达明显升高(P<0.01);与模型组比较,除14 d外,心包经组大鼠脑组织Nogo-A蛋白表达明显降低(P<0.05,P<0.01),各时点NgR1蛋白表达明显降低(P<0.01);与肺经组比较,心包经组大鼠3、7 d脑组织Nogo-A蛋白表达明显降低(P<0.01,P<0.05),各时点NgR1蛋白表达明显降低(P<0.01)。见图4、表3、表4。
表3 各组大鼠缺血侧脑组织不同时点Nogo-A蛋白表达比较(±s,相对表达量)

表3 各组大鼠缺血侧脑组织不同时点Nogo-A蛋白表达比较(±s,相对表达量)
注:与正常组、假手术组比较,★★P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与肺经组比较,●P<0.05,●●P<0.01
?
表4 各组大鼠缺血侧脑组织不同时点NgR1蛋白表达比较(±s,相对表达量)

表4 各组大鼠缺血侧脑组织不同时点NgR1蛋白表达比较(±s,相对表达量)
注:与正常组、假手术组比较,★★P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与肺经组比较,●P<0.05,●●P<0.01
?

图4 各组大鼠缺血侧脑组织Nogo-A、NgR1蛋白免疫印迹
3 讨论
脑缺血是危害人类健康的主要疾病之一,且发病年龄呈现年轻化趋势[11-12]。研究发现,脑缺血后,因脑部缺血、缺氧和系列炎症反应导致神经细胞损伤,使患者出现严重的神经功能障碍[13]。促进神经修复成为脑缺血患者后期康复的重点和难点。电针作为中医传统针刺疗法与现代电刺激相结合的治疗方式,在脑缺血康复治疗中疗效显著,其作用机理是目前研究的热点。
电针能有效调控内环境中神经生长因子和神经生长抑制因子含量[14],改善脑组织血液循环[15]和能量代谢[16],抑制细胞凋亡[17-18]和炎症反应[19]。但目前对于脑缺血的研究大多基于“通督调神”“治痿独取阳明”等理论开展,电针心包经与其他经脉对照的研究报道较少。从经脉循行来看,心包经可通过其络脉、阴维脉、任脉与脑间接联系。且《针灸甲乙经》《针灸大成》《外台秘要》《铜人腧穴针灸图经》等古籍皆记载心包经腧穴可治疗中风诸症[20]。临床研究表明,针刺心包经腧穴不仅能有效增加脑缺血患者脑血流量[21],调节自主神经平衡[22],还能有效缩短中风患者康复时间,防止肌肉萎缩和痉挛[23-24]。本研究团队长期从事电针心包经穴治疗脑缺血损伤相关研究,从抗炎、抗凋亡、促血管新生、神经递质与神经营养因子分泌、促进神经元突触发生、神经修复等多角度验证电针心包经穴对脑缺血损伤的效应机制[25-29]。基于前期研究成果,本研究从神经修复角度出发,观察电针心包经穴对MCAO大鼠脑组织Nogo-A及NgR1蛋白表达的影响,探讨其可能的作用机制,为“从心治脑”理论提供实验依据。
研究表明,大鼠急性脑缺血后,缺血脑组织Nogo-A和NgR1蛋白表达明显升高[30-31],针刺干预在促进大鼠神经功能恢复的同时可明显降低脑组织Nogo-A 与NgR1蛋白表达[32]。而Nogo-A抗体和/或NgR1拮抗剂在降低Nogo-A和/或NgR1表达同时,还能保护缺血后脑组织,在一定程度上促进神经修复及轴突再生[33-34]。由此推测,脑缺血损伤后,Nogo-A、NgR1含量增加,二者相互作用,激活下游相关通路,从而抑制轴突再生。
脑缺血发展是一个复杂动态变化的过程,其病理损害随着时间发展而变化。而神经轴突再生需要分化完全的神经元重新接受出芽信号,激活分子生长程序,然后成长为轴突。有研究者认为,整个过程需要耗时2个月以上[35-36]。目前研究大多认为Nogo-A和NgR1表达在脑缺血后第7、14或21日达到峰值[37-38],但尚无定论。故本实验设置多个时点观察脑缺血损伤后Nogo-A和NgR1表达变化及电针干预效应。
本研究结果显示,模型组大鼠各时点缺血侧脑组织神经细胞大量凋亡,细胞间距增大、组织结构紊乱,脑组织Nogo-A和NgR1蛋白表达升高。电针心包经穴能改善大鼠缺血侧脑组织神经细胞形态,同时下调不同时点脑组织Nogo-A和NgR1蛋白表达,且在不同程度上优于肺经组。考虑可能是电针心包经穴能改善脑的血液循环,促进大脑侧支循环建立,使缺血脑组织Nogo-A和NgR1蛋白表达降低,从而促进神经修复、改善组织形态结构,也有可能随着大鼠脑缺血时间的延长,内环境发生改变,抑制Nogo-A和NgR1蛋白表达,使神经自我再生和修复能力增强,进行发芽重塑形成新的轴突。此外,电针肺经穴也能抑制部分时点Nogo-A 和NgR1 蛋白表达,考虑肺“朝百脉,主治节”,同时有“主一身之气”的生理功能,能促进血液中浊气与清气互换,并将富含清气的血液输送到脑及全身各处[39],具体原因还需进一步扩大实验样本量研究。本实验显示,不同检测方法和不同指标所表现的有效时间点不同,通过结果分析,7 d和14 d可能为最优干预时间点,但仍需要进一步实验验证。
综上所述,电针心包经穴能抑制MCAO模型大鼠不同时点缺血脑组织Nogo-A和NgR1蛋白表达,调节轴突发芽和再生微环境,从而保护受损的神经细胞,起到神经修复作用。
