基于生物信息学与实验验证探讨凉膈散通过GSK-3β调控内毒素致急性肺损伤分子机制
2023-08-23谭炜富晏丽君杨丽玲余景滔卢子滨周湘君杨广丽李薇余林中
谭炜富 ,晏丽君 ,杨丽玲, ,余景滔 ,卢子滨 ,周湘君 ,杨广丽 ,李薇 ,余林中
1.暨南大学附属东莞医院,广东 东莞 523900;2.南方医科大学中医药学院国家中医药管理局科研三级实验室中药药理实验室,广东 广州 510515;3.广东医科大学广东天然药物研究与开发重点实验室,广东 东莞 523808
急性肺损伤(acute lung injury,ALI)是一种以急性低氧性呼吸衰竭、肺泡通透性增加和严重肺泡水肿为病理表现的呼吸道急症,可进一步发展为急性呼吸窘迫综合征(ARDS)。据报道,美国ARDS年发病率为78.9/10万例,病死率为40%[1]。上海的ICU监护数据显示,15岁以上患者ARDS发病率为2%,病死率为70%[2]。中国台湾ARDS年患病率由1997年的2.53/10万例增加到2011年的19.26/10万例[3]。ALI的原因包括败血症、肺炎、多发创伤、溺水、胃内容物误吸、肺挫伤、药物作用和休克等[4],其基本病理机制是炎症反应失控,涉及PI3K/Akt、TLR4/NF-κB、AMPK-Nrf2等多条信号通路[5-7]。目前,ALI 尚无有效治疗策略[8]。中医药调控炎症反应具有优势与特色,在脓毒症、甲型流感、严重急性呼吸综合征及新型冠状病毒感染的治疗中备受关注,对相关方药的作用与机制研究已成为当前关注的热点。
凉膈散出自《太平惠民和剂局方》,由黄芩、连翘、栀子、薄荷、大黄、芒硝、淡竹叶和甘草组成。相关临床研究[9-10]及本团队前期实验研究[11-12]均表明,以凉膈散作为主方治疗严重感染致ALI疗效确切,但其作用机制尚未完全阐明。前期网络药理学分析显示,凉膈散的作用靶点主要富集于PI3K/Akt通路[13]。基于此,本研究通过生物信息学方法从所富集的PI3K/Akt通路进一步识别凉膈散治疗ALI的关键作用靶分子,并通过建立ALI小鼠模型进行验证,为凉膈散防治ALI的临床应用与开发提供依据。
1 材料与方法
1.1 凉膈散-PI3K/Akt通路相关急性肺损伤疾病基因分析
检索GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)建库至2022年11月1日收录的ALI基因表达谱芯片: ①疾病为“Acute lung injury”“Sepsisassociated acute lung injury”“Sepsis-associated acute respiratory distress syndrome”;②组织来源为血液;③条目类型为“Sereies”;④研究类型为“Expression profiling by array”;⑤Top Organisms 选择“Homo sapiens”;⑥样本集包含疾病组与对照组。通过R语言ComBat包去除批次效应后,用limma包进行差异表达分析,筛选P<0.05且|logFC|>0.2的疾病基因,为ALI特征表达基因。
通过TCMSP(https://www.tcmsp-e.com/)和中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/)检索凉膈散组方药物大黄、连翘、黄芩、甘草、栀子、薄荷、芒硝、淡竹叶的化学成分,以口服生物利用度(OB)≥30%且类药性(DL)≥0.18为条件筛选活性成分,并提取其作用靶点。通过KEGG(https://www.kegg.jp/)检索“PI3K-Akt”通路,提取通路相关基因。
将ALI 疾病特征表达基因、凉膈散潜在靶点及PI3K/Akt通路相关基因取交集,得到凉膈散-PI3K/Akt通路相关ALI疾病基因,通过R语言Venn包生成交集图。提取矫正后交集基因的表达量数据,采用RevMan5.3进行单基因Meta分析并绘制森林图。
1.2 实验验证
1.2.1 动物、试药与仪器
清洁级雄性BALB/c小鼠,5~6周龄,体质量18~22 g,购自南方医科大学实验动物中心,动物生产许可证号SCXK(粤)2021-0041,动物使用许可证号SYXK(粤)2021-0167。饲养于SPF级实验室,温度22~26 ℃,湿度40%~70%,12 h/12 h昼夜循环,每笼4只,自由饮水进食。本实验经南方医科大学实验动物福利与伦理委员会批准(L2021064),根据实验动物护理和使用指南进行操作。
中药饮片黄芩(批号211002401)、连翘(批号211201101)、栀子(批号211002521)、薄荷(批号211000191)、大黄(批号211100199)、芒硝(批号210902001)、甘草(210902241)、淡竹叶(批号211003072),广东康美药业有限公司(中国广州);TRIzol(批号15596018),Invitrogen 公司;TWS119(批号M2304)、Wortmannin(批号M2053),Abmole公司;PrimeScript Tyragent Kit with gDNA Eraser(批号AL62453A)、SYBR®Premix Ex TaqTMⅡ(批号ALE2949A),日本Takara公司;3-(4,5-二甲基噻唑-2-yl)-2,5-二苯基四溴化铵(MTT,批号M5655)、脂多糖(大肠杆菌055:B5,批号110M4086V),Sigma-Aldrich公司;胎牛血清(批号2166451)、高糖培养基(批号8118328)、青霉素/链霉素(批号R001100、15070-054),GIBCO公司;小鼠辅助性T细胞(Th17,批号KTH217)、调节性T细胞(Treg,批号KTR201)检测试剂盒、红细胞裂解溶液(批号LSC01、LSC02),杭州联科生物技术股份有限公司;小鼠白细胞介素-17(IL-17)ELISA试剂盒(批号CSB-E12819h)、转化生长因子-β(TGF-β)ELISA 试剂盒(批号CSBE04725h),武汉华美生物工程股份有限公司。
N-1200B型旋转蒸发仪(海门市其林贝尔仪器制造有限公司),DGX-9243BC-1型冷冻干燥器(中国上海福玛实验设备有限公司),YP10002型分析天平(上海佑科仪器仪表有限公司),BA 110S 型电子天平(Sartorius公司),QL-901型涡旋振荡器(海门市其林贝尔仪器制造有限公司),Thermo FC 型酶标仪(Thermo Fisher Scientific公司),CytoFLEX型流式细胞仪(Beckman Coulter公司),DS-11+型超微量分光光度计(Denovix公司),LightCycler®96型实时PCR系统(Roche公司)。
1.2.2 实验方法
1.2.2.1 凉膈散药液制备
按凉膈散原方比例称取连翘24 g、栀子6 g、黄芩6 g、甘草12 g,加10倍体积蒸馏水浸泡30 min后加热,煮沸20 min,然后加入大黄12 g、薄荷6 g、淡竹叶6 g,继续煎煮,煮沸10 min后倒出煎煮液;向药渣中加入6倍体积蒸馏水继续煮沸10 min,合并2次煎液后3层纱布过滤,趁热加入芒硝12 g,搅拌溶解后用3层滤纸抽滤得到药液。用旋转蒸发仪蒸发浓缩至稠液后,冷冻干燥12 h使其形成干粉。准确称取干粉,溶于PBS中,配制成20 mg/mL药液,涡旋振荡器上涡旋,微孔滤膜过滤除菌,-20 ℃冰箱保存备用。
1.2.2.2 分组、给药及取材
小鼠适应性饲养1周后,随机分为空白组、模型组、凉膈散组、TWS119组、凉膈散+Wortmannin组,每组8只。凉膈散组予凉膈散药液(60 g/kg)灌胃,每日分早晚2次;TWS119组予GSK-3β抑制剂TWS119(50 mg/kg)腹腔注射,每日1次;凉膈散+Wortmannin组予凉膈散药液(60 g/kg)灌胃,每日分早晚2次,以及GSK-3β激动剂Wortmannin(0.7 mg/kg)腹腔注射,每日1次;空白组和模型组予等量生理盐水灌胃或腹腔注射。连续给药7 d后,除空白组外,各组小鼠气管滴注脂多糖(3 mg/kg)建立ALI模型,空白组小鼠气管滴注等量生理盐水。12 h后,各组小鼠用1.5%(W/V)戊巴比妥钠溶液麻醉后心脏采血,脱颈处死,分离气管,打开胸腔,采集肺组织。
1.2.2.3 指标检测
取新鲜肺组织,称取湿重(W),于烤箱60 ℃烘干至质量不再改变,称取干重(D),计算肺湿/干重比值(W/D),评估肺水肿程度。
使用肝素钠抗凝管收集血液,检测全血Th17、Treg细胞含量。Th17细胞抗体标记为FITC-抗CD4和PE-抗IL-17A,CD4+IL-17+为Th17细胞;Treg细胞抗体标记为PE-抗CD25和APC-抗Foxp3,CD25+Foxp3+为Treg细胞,按试剂盒说明书步骤处理后,采用流式细胞仪进行检测。
取小鼠肺组织,用眼科剪刀剪碎,组织匀浆后,2 000 r/min离心10 min,取上清液,采用ELISA试剂盒检测IL-17、TGF-β含量。
取小鼠肺组织,用眼科剪刀剪碎,组织匀浆后,使用miRcute miRNA试剂盒提取总RNA后,采用超微量分光光度计检测RNA 的质量和浓度。使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒反转录RNA 后,采用SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)检测GSK-3β表达水平,以β-actin为内参,采用2-ΔΔCt法计算基因相对表达量。所用引物由华大基因公司提供,序列信息见表1。
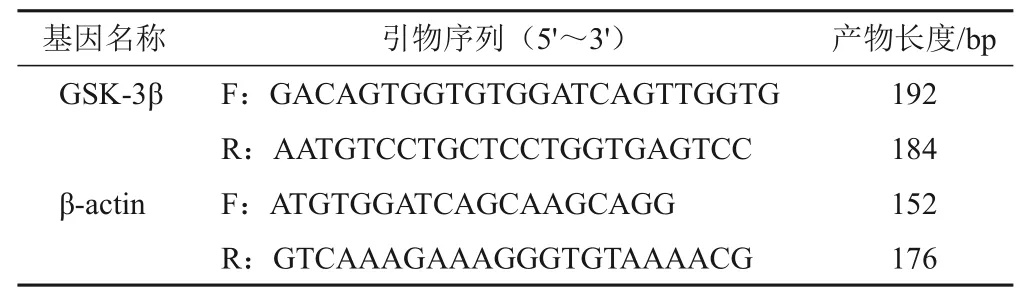
表1 基因PCR引物序列
1.3 统计学方法
采用SPSS20.0统计软件进行分析。采用标准化均数差(SMD)作为合并统计量进行单基因Meta分析,分析前进行异质性检验,不存在异质性(P≥0.1,I2=0%)采用固定效应模型分析数据,存在异质性(P<0.1,I2>0%)采用随机效应模型。计量资料用±s表示。采用方差分析评估多组间差异,事后检验采用图基(Tukey)检验法。P<0.05表示差异有统计学意义。
2 结果
2.1 凉膈散-PI3K/Akt通路相关ALI疾病基因筛选及单基因Meta分析
从GEO 数据库得到3 个基因表达芯片数据集GSE10474、GSE2322和GSE32707,获得189份样品(包括50例ALI/ARDS患者和139例脓毒症患者对照),行批次处理后样本间批次效应被消除,进行基因表达差异分析,筛选出764个ALI疾病特征表达基因(见图1A~图1C)。通过TCMSP和TCMIP数据库收集到凉膈散组方药物候选活性化合物274个,其中来源于大黄81个、连翘23个、黄芩36个、甘草92个、栀子15个、薄荷22个、芒硝1个、淡竹叶4个,删除重复成分并提取其相应靶点共330 个。通过KEGG 检索提取PI3K/Akt通路(ID:HSA04151)相关基因354个。将764个ALI特征表达基因、330个凉膈散作用靶点及354个PI3K/Akt通路相关基因取交集,得到凉膈散-PI3K/Akt 通路相关ALI 疾病基因4 个,分别为GSK3β、CDKN1A、NFKB1和MCL1(见图1D),多表达数据集差异分析结果见表2。单基因Meta 分析发现,CDKN1A、MCL1和GSK3β这3个基因表达差异有统计学意义(P<0.05),见图2。其中,CDKN1A基因在ALI患者体内低表达(SMD=-0.80,P<0.001),MCL1基因在ALI 患者体内高表达(SMD=0.41,P=0.02),GSK3β基因在ALI患者体内高表达(SMD=0.66,P<0.001)。前期研究表明,凉膈散中多个有效成分与GSK-3β对接良好[12],故选择GSK-3β为作用靶点进行后续实验验证。

图1 凉膈散-PI3K/Akt通路相关ALI疾病基因的生物信息学筛选

图2 凉膈散-PI3K/Akt通路相关ALI疾病基因Meta分析森林图

表2 凉膈散-PIK3/Akt通路相关ALI疾病基因多表达数据集差异分析
2.2 实验验证结果
2.2.1 凉膈散通过抑制GSK-3β表达降低急性肺损伤小鼠肺湿/干重比值
凉膈散能显著降低ALI小鼠肺W/D比值,减轻肺水肿;TWS119与凉膈散作用相似;加入Wortmannin处理后,小鼠肺W/D比值升高,提示Wortmannin可拮抗凉膈散降低肺组织毛细血管通透性以减轻肺水肿的作用。见图3a。与空白组比较,模型组小鼠肺组织GSK-3β基因表达显著升高,凉膈散或TWS119能显著下调ALI小鼠GSK-3β基因表达,但Wortmannin处理可拮抗凉膈散对GSK-3β的下调作用。见图3b。

图3 各组小鼠肺W/D比值及肺组织GSK-3β表达比较(±s,每组8只)
2.2.2 凉膈散改善急性肺损伤小鼠Th17/Treg失衡
凉膈散和TWS119均能显著降低ALI小鼠外周血Th17细胞比例和Th17/Treg比值,提高Treg细胞比例,表明凉膈散可改善Th17/Treg 比例失衡。加入Wortmannin处理后,Treg细胞比例显著降低,Th17/Treg比值显著升高,表明Wortmannin可抵消凉膈散改善Th17/Treg失衡的作用。见图4。

图4 各组小鼠外周血Th17、Treg细胞比例及Th7/Treg比值比较(±s,每组8只)
2.2.3 凉膈散降低急性肺损伤小鼠细胞因子含量
与空白组比较,模型组IL-17A 含量显著升高,TGF-β含量下降。凉膈散和TWS119均能显著升高ALI小鼠肺组织TGF-β含量,且凉膈散能显著降低ALI小鼠IL-17A 含量。Wortmannin 处理可抑制凉膈散对IL-17A的下调及对TGF-β的上调作用。见图5。

图5 各组小鼠肺组织IL-17A、TGF-β含量比较(±s,每组8只)
3 讨论
ALI/ARDS是危及生命的急重症,由于无特效药,病死率居高不下,成为重症医学难点[1,14]。临床研究表明,以凉膈散为主方治疗因严重感染及炎症反应失控所致的ALI具有确切疗效,本团队前期研究发现,凉膈散通过抑制NF-κB、p38MAPK等信号通路降低脂多糖温热病家兔血浆肿瘤坏死因子(TNF)-α水平,抑制内毒素血症小鼠炎症因子TNF-α及IL-6表达,下调小鼠巨噬细胞CD14表达,减轻肺组织损伤,提示凉膈散可在血液、肺等多部位、多靶点、多机制发挥治疗作用[10,15-17]。研究表明,PI3K/Akt 信号通路参与ALI/ARDS的发生发展过程[18]。本团队近期研究发现,凉膈散作用靶点主要富集于PI3K/Akt通路[11,13-14]。本研究利用基因表达谱芯片、单基因Meta分析进一步预测凉膈散的具体作用靶点,并通过动物实验进行验证。
网络药理学结合基因表达谱芯片分析显示,在PI3K/Akt通路相关的ALI疾病特征基因中,GSK3β、CDKN1A、NFKB1和MCL1可受凉膈散调节。研究表明,GSK-3β 作为炎症反应的中枢激酶,是NF-κB、p38等多条炎症信号通路的共同靶分子,GSK-3β的激活是协同放大炎症级联反应、推动ALI向ARDS进展的关键性因素。而CDKN1A则通过p53/p21途径参与抵抗肺泡上皮凋亡[19]。研究表明,MCL1影响ALI的疾病进程,下调MCL1水平可促使ALI小鼠中性粒细胞凋亡及巨噬细胞清除凋亡细胞,从而加速肺部炎症的缓解[20]。对上述4个基因进行单基因Meta分析以进一步筛选最佳靶点,结果发现,GSK-3β在ALI中表达显著上调,推测凉膈散可能通过抑制GSK-3β表达而发挥抗ALI作用。
GSK-3β是一种丝氨酸苏氨酸蛋白激酶,广泛存在于真核生物细胞内,可调控多种生理病理功能,如糖原合成,细胞分化、增殖、死亡等。GSK-3β在肺部不仅可与TRIB3相互作用促进炎症纤维化,还可调控血液中T细胞的迁移运动[21]。近年研究发现,GSK-3β参与调控机体的获得性免疫:生理状态下,Th17细胞及Treg细胞在体内处于动态平衡,激活GSK-3β可促进CD4+T细胞向Th17细胞亚型分化、减少Treg细胞亚型分化,抑制Treg细胞活性,进而影响Th17/Treg平衡。Th17/Treg保持平衡则内环境稳定,反之内环境失衡,免疫功能紊乱,炎症反应失控,释放过量炎症因子导致肺泡毛细血管膜损伤、通透性增加,最终造成肺水肿、损伤[22-24]。
GSK-3β抑制剂在治疗ALI/ARDS中表现出显著抗炎作用,可通过抑制小鼠炎症细胞浸润和降低促炎症细胞因子水平而减轻肺部急性炎症损伤[25]。TWS119是一种GSK-3β抑制剂,可通过抑制GSK-3β的磷酸化而影响机体某些免疫细胞的增殖、分化和控制炎症发展[26-27]。尽管目前尚无针对GSK-3β的特异性激活剂,但是可通过影响其他途径而激活GSK-3β。Wortmannin是PI3K抑制剂,因其阻断了MAPK和p90 S6激酶的级联反应过程而保护GSK-3β的活性不受抑制[28]。本研究利用脂多糖诱导小鼠ALI发现,模型组肺水肿明显,GSK-3β基因表达显著升高,经凉膈散或TWS119治疗后小鼠肺水肿显著减轻,GSK-3β基因表达下调,但Wortmannin可逆转凉膈散的上述作用,表明凉膈散可能通过GSK-3β抑制剂形式发挥抗ALI作用。
本研究发现,模型组小鼠外周血Th17细胞比例、Thl7/Treg比值明显升高,Treg细胞明显减少,提示存在Th17/Treg 失衡。凉膈散或TWS119 能明显下调Th17细胞比例和Th17/Treg比值,增加Treg细胞比例,促使Th17/Treg 平衡从Th17 向Treg 侧偏移。但Wortmannin可部分逆转凉膈散改善Th17/Treg失衡作用,提示凉膈散具有类似GSK-3β抑制剂的效应,可以调控Th17/Treg平衡。
相关研究表明,Th17细胞主要分泌促炎细胞因子IL-17A,诱导炎症反应或自身免疫性疾病,Treg细胞则主要分泌抗炎细胞因子TGF-β,以维持机体免疫稳态[29]。本研究ELISA结果显示,凉膈散或TWS119能明显下调IL-17A水平,上调TGF-β水平,Wortmannin可逆转凉膈散的上述作用,表明凉膈散可通过抑制GSK-3β表达调节IL-17A、TGF-β水平,从而发挥治疗ALI作用。
综上所述,本研究通过生物信息学分析预测GSK-3β是凉膈散治疗ALI的关键作用靶点,并通过小鼠模型验证了凉膈散可通过抑制GSK-3β表达调控Th17/Treg平衡,调节IL-17A、TGF-β分泌,进而发挥抗ALI的作用。可为中药防治ALI作用机理研究提供新思路,亦为凉膈散的临床应用提供依据。
