萝卜春化响应相关基因鉴定及表达模式分析
2023-08-22陈国户温宏伟吴思文刘雪晴赵龙龙KHANAfrasyab桂尚枝唐小燕汪承刚
陈国户,李 广,温宏伟,尹 倩,吴思文,王 英,刘雪晴,赵龙龙,KHAN Afrasyab,桂尚枝,唐小燕,汪承刚,2,*
(1.安徽省园艺作物育种工程实验室,安徽农业大学 园艺学院,安徽 合肥 230036; 2.安徽省皖江蔬菜产业技术研究院,安徽 马鞍山 238253)
抽薹开花是十字花科植物生命周期中最重要的阶段之一[1],受多种环境和内源发育信号共同控制,其精确的抽薹开花时间机制可确保植物种子在各种环境中发育与传播[2-3]。拟南芥中超过180个抽薹开花相关基因已被确定,参与春化与温度、光周期与赤霉素、年龄与自主开花、脱落酸与油菜素甾醇等途径中[4-5],并且各途径相互交织,通过控制FLC(FLOWERINGLOCUSC)、SMZ(SCHLAFMÜTZE)及TOEs(TARGETOFEATs)等开花抑制因子或SOC1(SUPPRESSOROFOVEREXPRESSIONOFCO1)、FT(FLOWERINGTIME)及FD(FLOWERINGLOCUSD)等开花促进因子的表达强度,精确调节下游花序分生组织和花器官特异基因的表达,从而确定抽薹开花时间[1,4]。
春化途径是十字花科植物抽薹开花诱导的重要途径之一。春化途径依赖于两个显性基因:FRI(FRIGIDA)和FLC[6]。甘蓝(Brassicaoleraca)、油菜(B.napus)、大白菜(B.rapa)等作物FLC与FRI基因家族的表达具有组织特异性和生长发育阶段特异性,在抽薹开花发育过程中发挥关键的调控作用[7]。植物春化前,FRI通过与mRNA结合蛋白(mRNA binding protein)的相互作用,增强FLC转录水平,直接或形成复合体结合到FT、FD、SOC1基因位点并抑制其转录,从而减少光周期信号和其他调控途径对这些基因的激活作用[8]。植物经历低温春化后,VIVIPAROUSI/ABI3-LIKEfactor1(VAL1)等转录因子抑制FLC的表达,从而促使植物在春季的有利条件下抽薹开花[9-10]。
在实际生产中,十字花科蔬菜过早抽薹可导致严重问题,降低其产量和经济价值。因此,开花时间是十字花科蔬菜育种中一个重要性状和选择目标。萝卜(RaphanussativusL.)是十字花科重要的根茎类作物,肉质直根,含有丰富的碳水化合物和多种维生素[11],在世界范围内广泛种植,尤其是在中国、日本、韩国和东南亚等国种植面积较大。在秋冬季生产中,萝卜完成春化过早抽薹,导致根系发育不良,从而影响产量、降低品质[12-13]。近年来,对白菜等芸薹属蔬菜开花相关基因功能研究取得了进展,但在萝卜中研究较少。本研究利用生物信息学技术全基因组鉴定萝卜抽薹开花相关基因;利用比较转录组学及META分析技术,筛选鉴定春化响应关键基因;利用实时荧光定量PCR(qRT-PCR)技术,分析关键基因的表达模式。研究结果将为进一步探明萝卜抽薹开花分子机理奠定基础。
1 材料与方法
1.1 数据来源
从芸薹属基因组数据库(http://brassicadb.cn)下载萝卜全基因组序列及其注释文件(Rapsa_Xiang_V1.0/)。从TAIR数据库(https://arabidopsis.org/)下载拟南芥全基因组氨基酸序列文件(TAIR10)。在NCBI数据库(https://ncbi.nlm.nih.gov/)下载萝卜不同春化时间及不同组织器官RNA-Seq原始数据(PRJNA355048、PRJNA325876、PRJNA413464)[12,14-15]。RNA-Seq测序数据质控后,获得clean reads再比对到萝卜参考基因组;基因表达丰度采用FPKM(fragments per kilobase of exon per million mapped reads)表示。利用DESeq2软件包进行差异表达基因分析,并利用omicshare(https://omicshare.com)在线工具进行Kyoto Encyclopedia of Genes and Genomes(KEGG)与Gene Ontology(GO)富集注释。
1.2 萝卜开花相关基因鉴定
以拟南芥开花基因[4]蛋白序列为种子序列,通过BLASTP工具全基因组搜索萝卜基因组;筛选的候选序列比对至SWISS-PROT数据库,鉴定目标序列(匹配度大于65%且E-value<1×10-20)[15];对每条目标序列再利用MEGA7.0工具,采用邻接法构建进化树,确定目的序列(置信度高于60%且位于同一主支不同分支上的基因[15])。利用TBtools工具[16]进行基因密度统计(BinSize:100 kb)及基因染色体定位分析。
1.3 萝卜春化响应关键基因筛选
利用NetworkAnalyst(https://networkanalyst.ca/NetworkAnalyst/home.xhtml)对萝卜每个春化RNA-Seq数据集进行质检、标准化处理[log2(counts)/million]以及春化前后差异表达基因分析(P<0.05);通过ComBat程序[17]消除批次差异。选择Fisher’s method[-2×∑log(p)]进行META分析(P_meta<0.05),获得春化前后差异表达基因。结合比较转录组分析,筛选出萝卜春化响应关键基因[17]。
1.4 萝卜春化响应关键基因互作网络分析
利用STRING(https://cn.string-db.org/)数据库,进行蛋白质互作网络(PPI)分析;再利用Cytoscape工具及MCODE插件进行子网络分析[18]。
1.5 萝卜春化响应关键基因表达分析
以萝卜NHFJ为试材(晚抽薹高代自交系,本实验室保存),1月苗龄时低温春化0、15、30 d取幼嫩叶片组织用于RNA提取及cDNA反转录。采用Bio-Rad CFX96 RT-PCR仪(Bio-Rad, Hercules, USA)及ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司,南京),以actin为内参,对富集在春化与冷响应、赤霉素生物合成以及信号转导等途径上的春化响应关键基因,利用表1中的引物进行qRT-PCR分析。

表1 qRT-PCR引物
2 结果与分析
2.1 萝卜抽薹开花相关基因全基因组鉴定
根据拟南芥开花相关基因蛋白序列,对萝卜基因组序列进行全基因组BLASTP搜索,并经多重筛选鉴定,共鉴定出272个开花相关基因;染色体分布分析(图1),发现1号染色体上基因数量最多(53个)、6号染色体上最少(15个),另有7个基因(Rsa10000547、Rsa10000811、Rsa10000900、Rsa10003029、Rsa10001141、Rsa10001984、Rsa10003234)定位在不同的scaffold结构中。
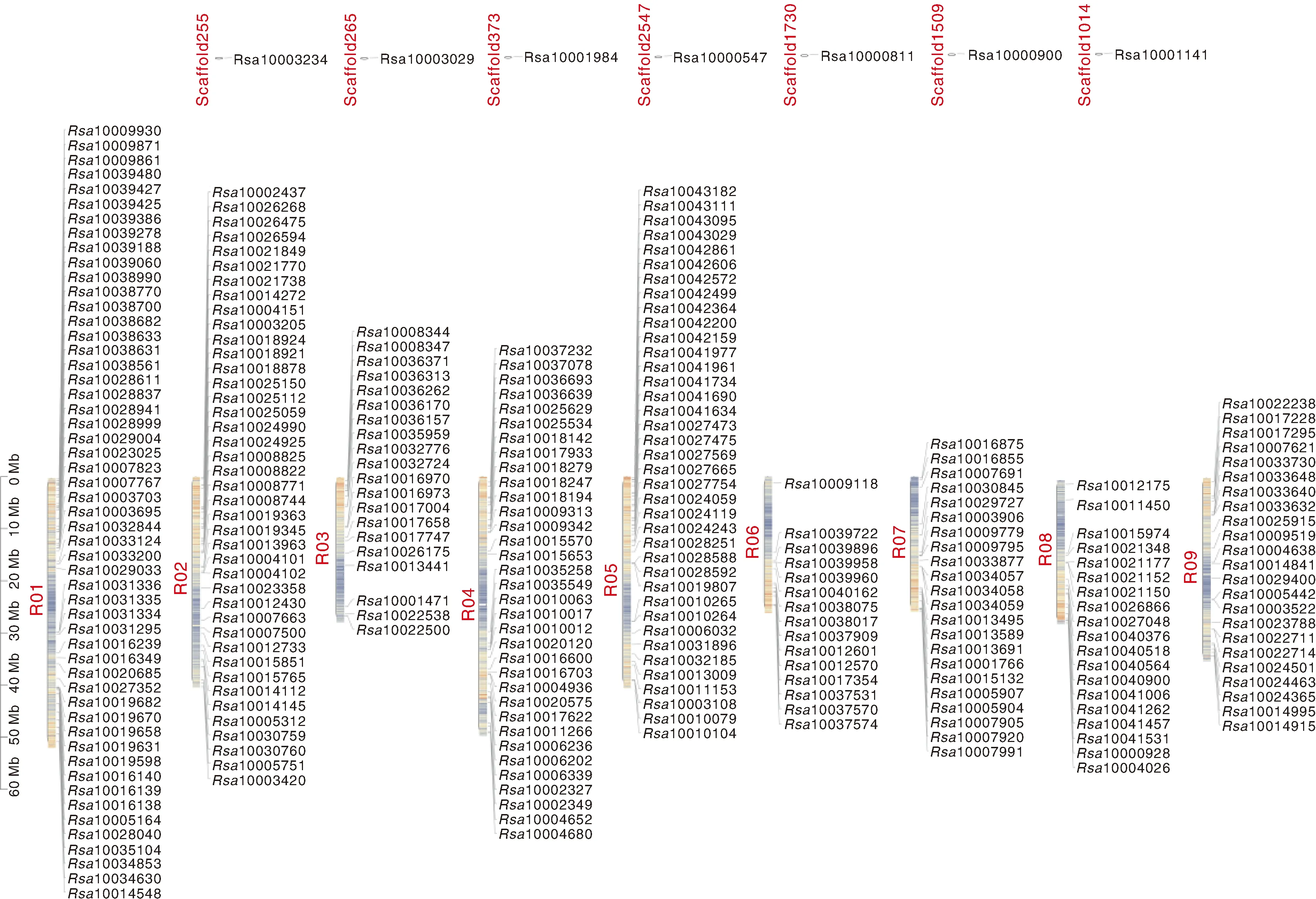
图1 萝卜开花相关基因染色体定位
2.2 萝卜开花相关基因表达模式分析
利用不同组织转录组数据,分析开花相关基因在根、茎、叶、花、角果及愈伤组织等组织中的表达特征(图2)。结果显示:大部分萝卜抽薹开花相关基因在各组织中表达量不高;共有26个基因在不同组织中均高表达(FPKM>500[19],根中14个、茎中18个、叶中8个、花中15个、角果中12个、愈伤中11个),其中Rsa10007621(UBC2a)、Rsa10015570(UBC2b)、Rsa10007767(CDF3)、Rsa10028941(GRP7)、Rsa10021738(SLY1)在各组织中均高表达。
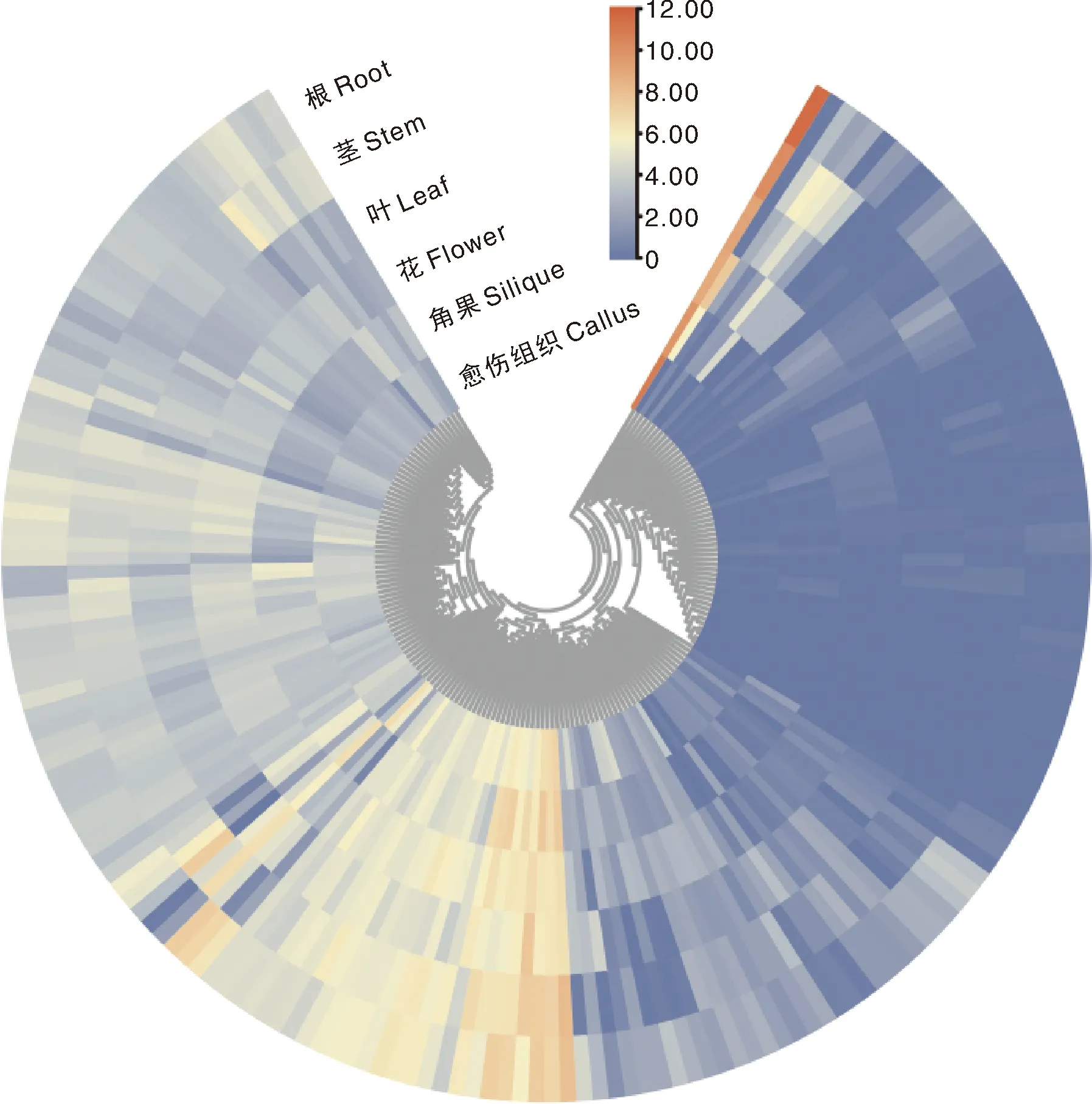
图中的色标表示log2(FPKM)值。
2.3 萝卜春化转录组数据相关性分析
对萝卜材料NHJS1、NHJS2和2#的不同春化时间转录组数据进行相关性分析(图3)。结果显示,同一材料各生物学重复组之间相关系数于0.90,不同春化阶段之间相关系数高于0.82,不同材料同一春化阶段相关系数均高于0.80,表明这些RNA-Seq数据可靠性较高,且不同材料基因对春化响应趋势类似。

图3 萝卜不同材料、不同春化时间转录组数据相关性分析
2.4 萝卜春化关键基因鉴定及其表达模式分析
对萝卜不同材料及不同春化时间转录组数据进行重分析,共获得上调基因5 803个、下调基因5 649个(图4-A),共有差异表达基因(DEG)3 839个(图4-B)。在这些DEG中,共筛选出26个开花相关基因(图4-C);利用转录组数据分析其表达趋势,发现这些基因随着春化时间的延长,其表达量呈现显著的差异(图4-D);并且这些基因在3个材料中的表达趋势相似。表明这些差异表达开花相关基因可能响应春化反应,参与春化调控途径。
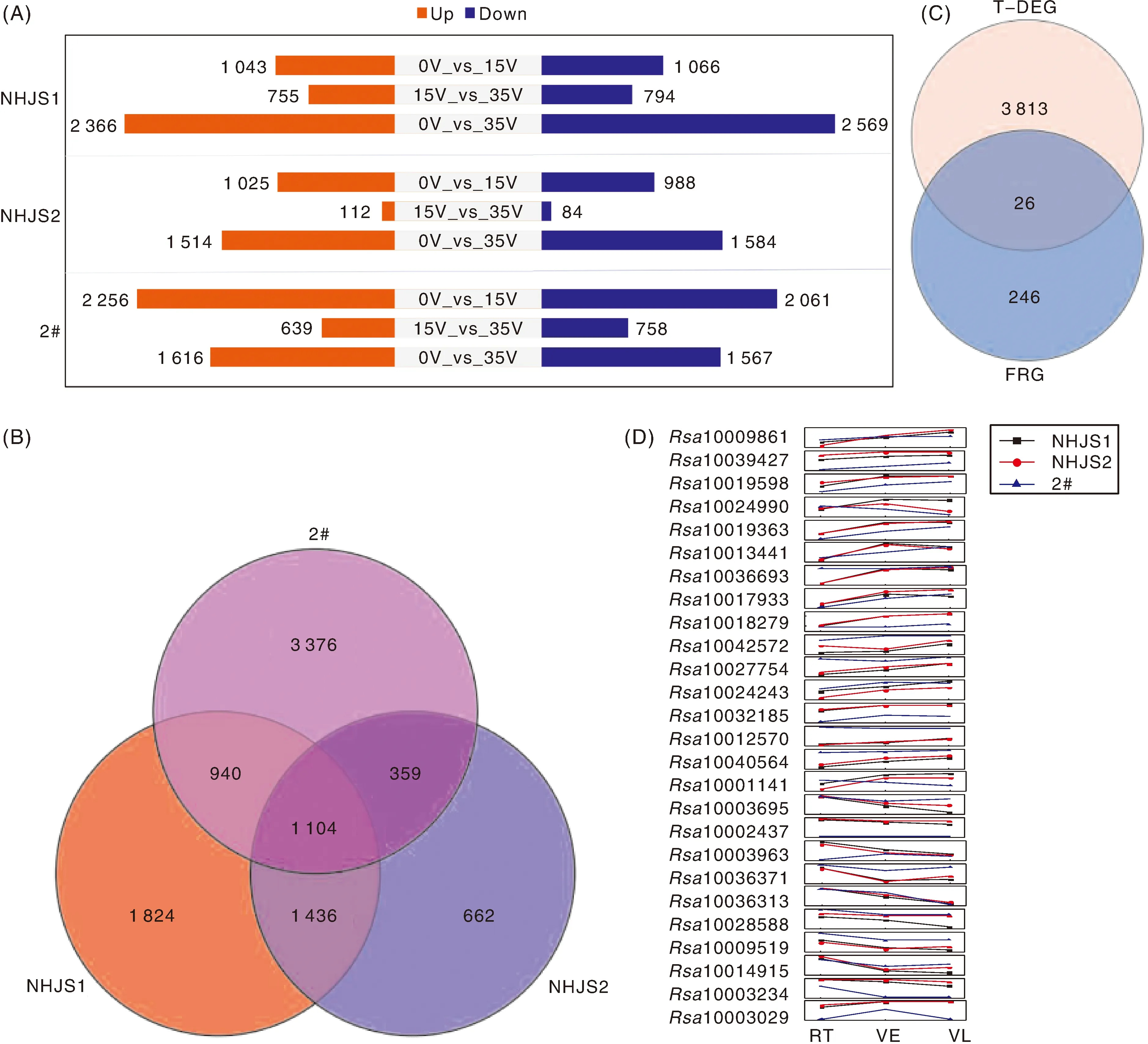
A, 萝卜不同材料、不同春化时间转录组差异表达基因(DEG)分析。B,不同材料差异表达基因韦恩图分析。C,VRG,春化反应相关基因;FRG,开花相关基因,T-DEG,不同材料差异表达基因。D,春化相关基因表达趋势;RT,室温春化开始时;VE,春化处理早期;VL,春化处理后期。
2.5 META分析
对萝卜不同材料、不同春化时间转录组数据进行META分析(图5-A),共获得7 136个DEG;其中,抽薹开花相关基因51个(图5-B)。结合比较转录组学分析数据,共获得春化关键基因25个(图5-B),表明这些基因为萝卜春化响应关键基因。
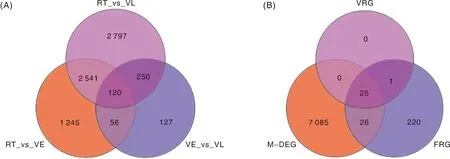
A,META分析维恩图;RT,室温春化开始时;VE,春化处理早期;VL,春化处理后期。B,春化关键基因韦恩图;FRG,开花相关基因;VRG,转录组学分析获得的春化响应相关基因;M-DEG,META分析获得的差异表达基因。
2.6 功能富集分析
对上述获得的25个春化响应关键基因进行GO功能富集分析(图6-)。结果显示,绝大部分基因富集在分生组织从营养生长向生殖生长过渡相关的途径(GO:0010228)、生物过程调控途径(GO:0050789)、光周期途径(GO:0009648)、赤霉素合成(GO:0009685)与信号转导途径(GO:0010476)。只有Rsa10024990(FLC1)、Rsa10036313(FLC2)两个基因富集在春化响应途径(GO:0010219)(图8-A)。对25个春化响应关键基因进行KEGG功能富集分析,结果(图6-B、C)显示,绝大部分基因富集在与外界环境(温度、光照等)适应相关的昼夜节律途径(ko04712)和二萜类化合物生物合成途径(ko00904)。以上结果表明(表2),这些关键基因参与多种途径应答春化反应。
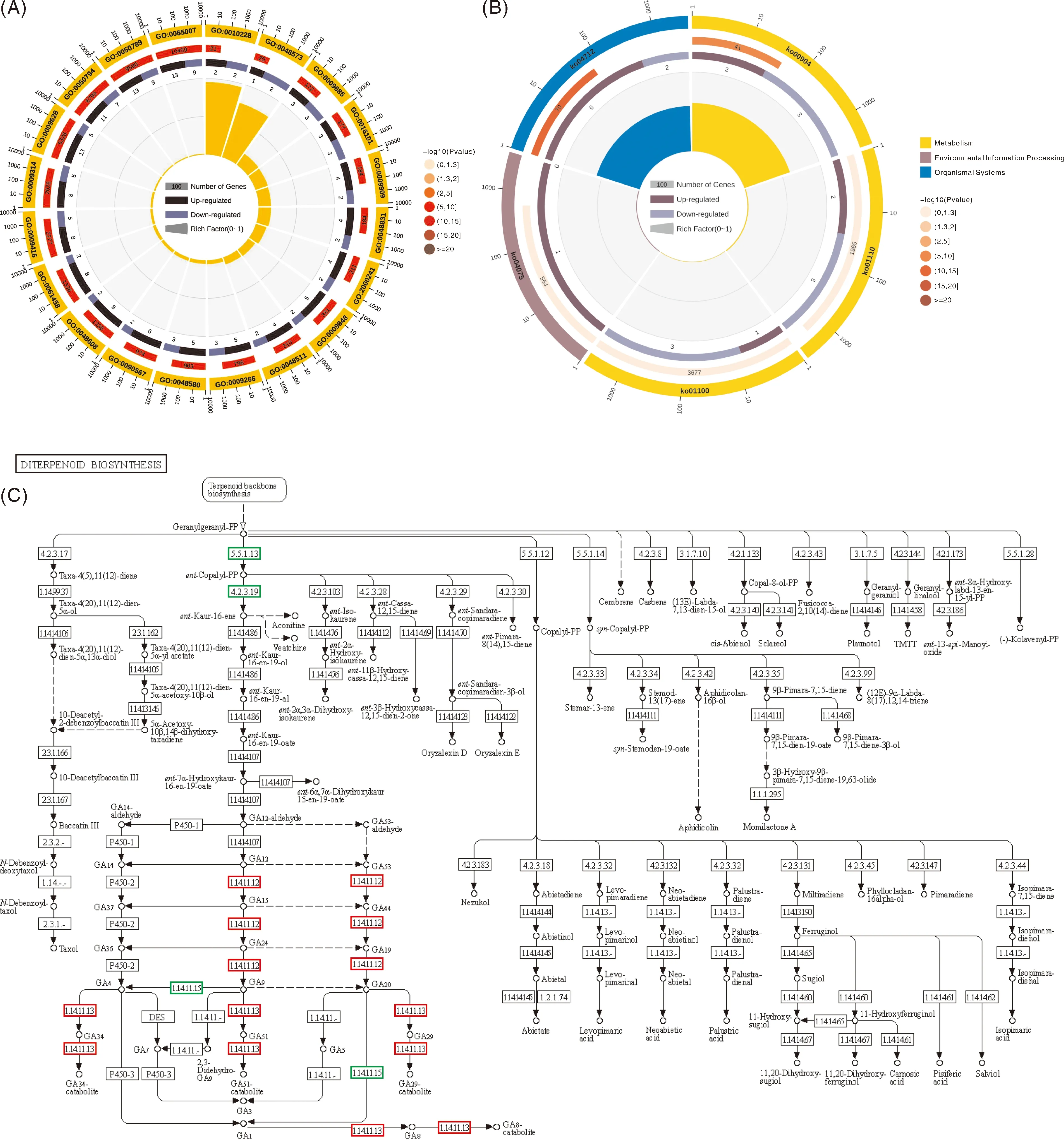
A,GO富集分析;B,KEGG富集分析;C,赤霉素生物合成通路。A和B中,第一圈表示富集到的GO条目和KO号,第二圈表示富集到该通路的背景基因,第三圈表示富集到该通路上下调基因数目,第四圈表示富集因子。
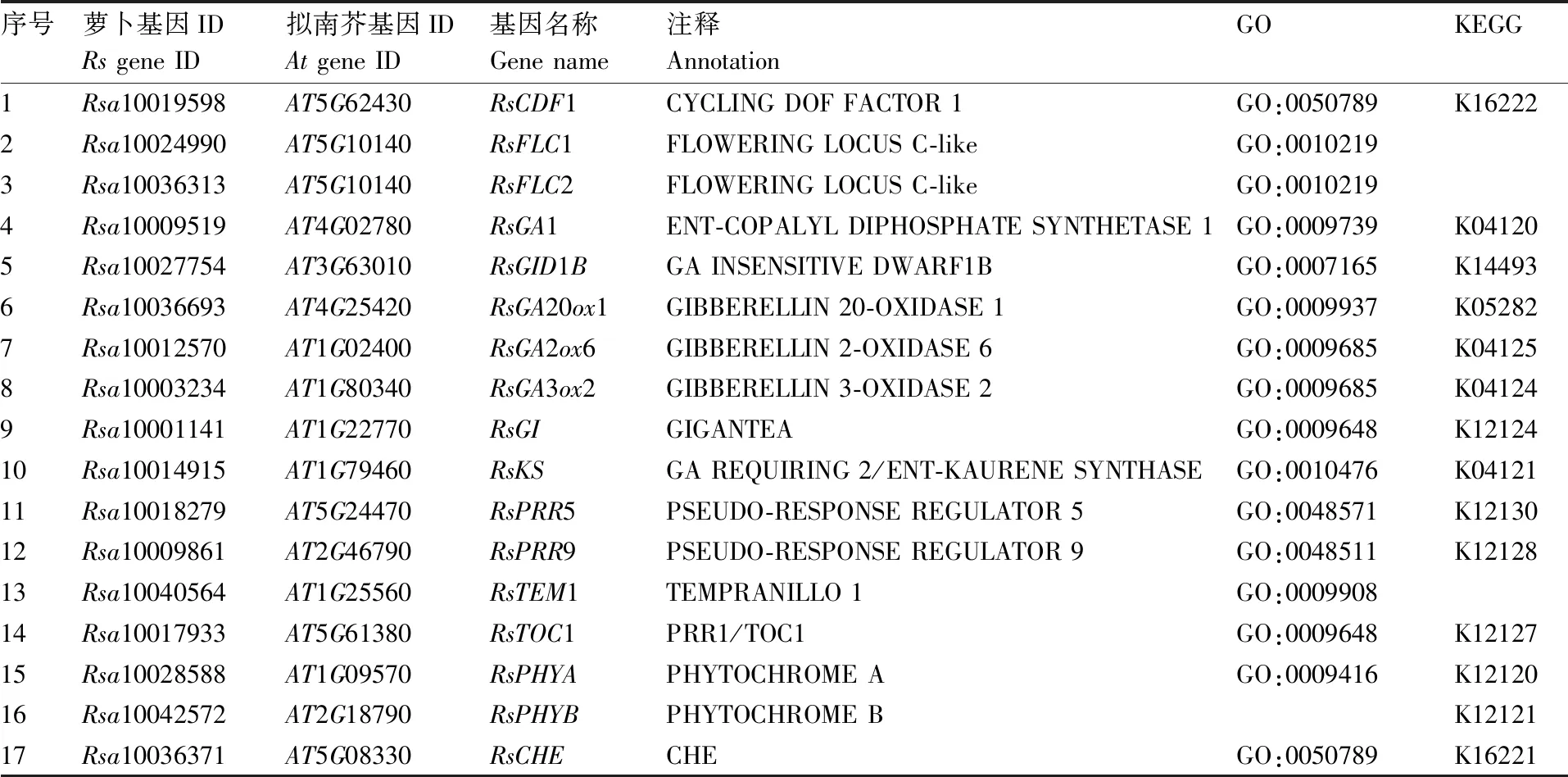
表2 光周期、春化、赤霉素生物合成及信号转导途径上的春化响应关键基因
2.7 PPI网络分析
为了分析上述春化响应关键基因之间的联系,利用STRING数据库构建了PPI网络(图7-A)。结果显示,FLC、TOC1、PHYB、AGL20与其他基因之间的连接度最高,是网络中最重要的节点基因;并且与春化、光周期、赤霉素代谢和信号转导、生物过程调控、萜类化合物代谢等途径相关的蛋白高度聚集(图7-B、图7-C),进一步表明这些基因是萝卜应答春化反应关键基因。
2.8 实时荧光定量PCR验证(qRT-PCR)
对富集在光周期、春化、赤霉素生物合成及信号转导途径上的春化响应关键基因(表2)进行表达分析。结果(图8)显示,RsGA2ox1、RsPHYB、RsCDF1、RsGA1、RsGI、RsGID1B、RsPRR5、RsPRR9、RsKS、RsTOC1等基因显著上调表达,而RsFLC3、RsGA2ox6等基因显著下调表达。
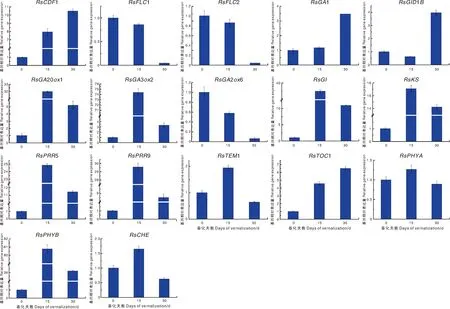
不同小写字母表示差异显著(P<0.05)。
3 讨论
一般而言,十字花科植物抽薹开花属于多基因控制的数量遗传性状,多种调控途径相互交织形成复杂的调控网络[4]。春化途径是十字花科植物抽薹开花诱导的重要途径之一,可加速植物从营养期到生殖期的发育。植物春化作用受多基因调控,可通过调节植物激素合成及信号转导或春化相关途径代谢物水平影响开花时间[20-22]。本研究利用序列同源比对及系统发育分析技术,全基因组鉴定了萝卜272个抽薹开花相关基因(图1)。利用萝卜组织转录组数据分析抽薹开花相关基因的表达模式,发现UBC2(Rsa10007621、Rsa10015570)、SLY1(Rsa10021738)等少数基因在萝卜多个组织中高表达(图2)。据报道,玉米UBC2基因参与低氮胁迫[23],表明这些基因在萝卜抽薹开花等多个生长发育过程中具有重要的作用。
利用比较转录组学与META分析技术,共鉴定出25个萝卜开花相关DEG(图5-B),推测这些基因可能作为响应春化的关键因子,参与调控萝卜抽薹开花过程。对其表达趋势分析(图4-D),发现多数开花相关基因随着春化时间延长,其表达水平逐渐升高;该结果与Liu等[12]的结果一致。对这些春化响应关键基因进行GO与KEGG富集分析(图6),发现大部分基因富集在分生组织从营养生长向生殖生长过渡途径(GO:0010228)、光周期途径(GO:0009648)和昼夜节律途径(ko04712)以及赤霉素生物合成(GO:0009685)和信号转导途径(GO:0010476)中,其中Rsa10024990(FLC1)、Rsa10036313(FLC2)两个基因富集在春化响应途径,表明这些途径关键基因参与了萝卜春化响应。
据报道,春化途径、光周期/昼夜节律途径、赤霉素生物合成及信号转导途径彼此独立又相互交织,协同作用实现对植物开花的精细调控[24-25]。本研究鉴定的萝卜响应春化反应关键基因富集于上述途径中(图6),彼此之间具有紧密的联系(图7),协同作用共同响应春化,从而调控萝卜抽薹开花(图9)。春化途径关键基因FLC通过抑制开花整合因子FLOWERINGLOCUST(FT)的表达调控开花[26],该基因在萝卜基因组中共有3个拷贝[27];本研究共鉴定到2个拷贝,且经过春化后均下调表达,而FLC3(Rsa10013589)可能不参与春化响应,或其表达量较低未被检测到[12]。VERNALIZATIONINSENSITIVE3(VIN3)基因是FLC的上游调控因子[28],其转录在春化后被CIRCADIANCLOCK-ASSOCIATED1(CCA1)/LATE-ELONGATEDHYPOCOTYL(LHY)激活,抑制FLC的表达,共同调控萝卜花芽分化,促使萝卜由营养生长向生殖生长转变[28-29]。蛋白互作网络分析结果显示(图7-A),TIMINGOFCABEXPRESSION1(TOC1)基因作为网络中的重要节点与VIN3基因可能存在相互作用,共同调控FLC1的表达水平。除FLC外,拟南芥中还有分别依赖AGL24与AGL19的独立春化途径,其中AGL24可正向调控SOC1的表达,AGL18与AGL24基序相似(LXLXL)且相互作用[2],因此AGL18也可能直接调控SOC1(图9)。
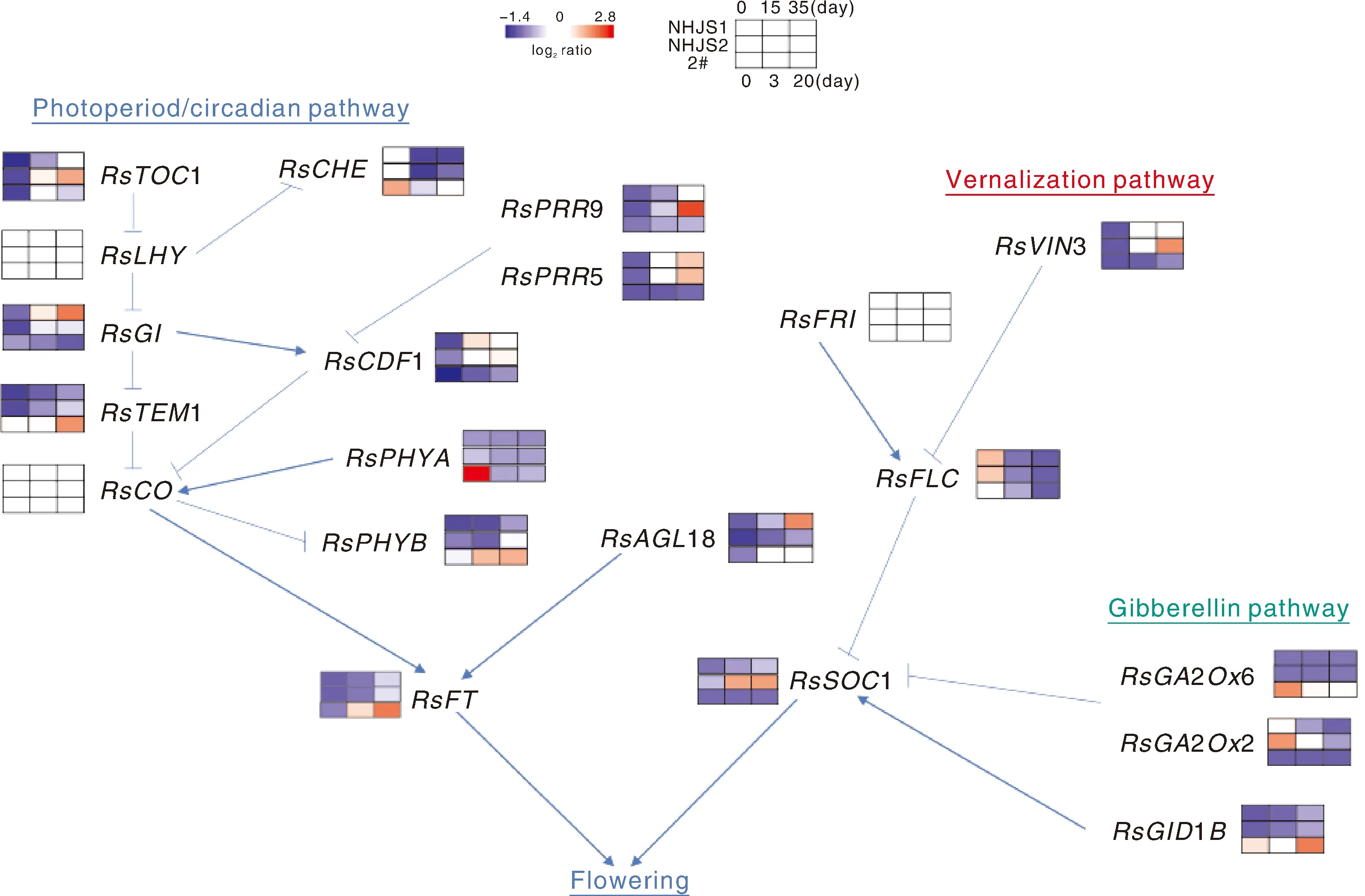
图9 春化响应关键基因调控萝卜抽薹开花
内源激素赤霉素(GAs)在需低温春化植物抽薹开花过程中发挥着重要的调节作用,当春化不足以诱导SOC1激活时,GA在短日照条件下通过激活SOC1而起到关键作用,促进早熟抽薹和开花[30-31]。萝卜幼苗春化过程中喷施GA,发现GA分别通过RsLHY、RsGI和RsTEM1作为激活子和抑制子调控萝卜抽薹开花[11]。本研究中也发现赤霉素合成及信号转导途径相关基因可响应春化反应(表2),RsGA3ox2、RsGA2/KS、RsGID1B基因在春化过程中的表达量均有显著变化(图8)。此外,我们还发现光周期及昼夜节律途径相关基因也参与了春化响应(图9),其表达水平在春化过程中也有显著变化(图8)。转录因子CONSTANS(CO)是光周期及昼夜节律途径的中枢基因,昼夜节律核心组分PSEUDO-RESPONSEREGULATOR(PRR)在特定时间阶段与CO相互作用,通过诱导FT基因的表达来调控抽薹开花[8,32]。GI是CCA1/LHY夜间表达的关键调节因子[33]。除PRP外,核心组分ELF3与COP1相互作用,以降解GI蛋白,进而调节开花时间[13]。光信号途径中光敏色素PHYA、PHYB可通过CO蛋白来调节FT基因的表达[34]。因此,春化、赤霉素及光周期与昼夜节律途径相关基因均参与了春化反应响应过程(图9),共同调控萝卜抽薹开花时间[14,35]。
