气相色谱法测定板栗中亚胺硫磷含量的不确定度评定*
2023-08-21曾永明周静萱黄小芮莫丽严冯沁雄
曾永明,周静萱,黄小芮,莫丽严,冯沁雄,栾 洁
(广西壮族自治区林业科学研究院,广西 南宁 530002)
板栗(学名:Castaneamollissima),别名栗、栗子、风腊,是山毛榉科栗属的植物,有7~9种。目前,我国大部分板栗果园还处于粗放经营阶段,农药的大量施用使环境受到污染。环境中的农药通过食物链传递并富集,进入人体,长期食用农残超标的食品将造成对人体健康的危害。因此,通过板栗中农残污染物的监测,对推动绿色种植板栗,保障板栗质量安全,具有一定作用。
亚胺硫磷(phosemet)纯品为白色无臭晶体,熔点72~72.7 ℃。工业品为白色或浅褐色晶体,熔点59~63 ℃,具有特殊刺激性臭味。20世纪70-80年代迅速发展起来的有机磷类杀虫剂,化学名称为O,O-二甲基-S-(酞酰亚胺基甲基)二硫代磷酸酯,化学式为C11H12NO4PS2,在世界各国广泛使用。在食品安全监测工作中,能够准确的测量农产品中亚胺硫磷含量,对维护食品安全具有重要意义。因此,目前需要依靠第三方检测机构的测量结果的准确性来帮助维护食品安全工作,而测量过程中人为操作因素、环境因素、标准物质和仪器设备等方面都会对结果的不确定度造成影响[1-2],导致农药残留量的测量结果不准确。为了提高测量结果的可靠性,找出影响测量结果的最主要因素,本文参照JJF 1059.1-2012《测量不确定度评定与表示》[3],采用气相色谱法测定板栗中亚胺硫磷的含量,通过评定不确定度的方式对测量过程中可能造成误差的操作均进行测算,确定了影响测量结果的最主要因素以改进农残测量的精准性,对保障板栗质量安全,具有一定作用。
1 材料与方法
1.1 材料与仪器
1)仪器设备:MS 3 basis旋涡混合器(IKA仪器有限公司);离心机TD5A-WS(湘仪离心机仪器有限公司);M32自动高通量平行浓缩仪(北京莱伯泰科仪器股份有限公司);GC-2010Plus气相色谱仪(日本岛津公司),配备火焰光度检测器(FPD),色谱柱:SH-Rtx-1701(30 m×0.25 mm×0.25 μm 毛细色谱柱)。
2)测量仪器:电子天平,最大允许误差为 ±0.5 mg;瓶口分液器,最大允许误差为0.03%;10 mL 移液管,精度 0.02 mL;0.1~1 mL 移液枪,误差范围为±1%;20~200 μL 移液枪,误差范围为±1%;10 mL 容量瓶,精度 0.10 mL;FPD检测器的定量允差1.9%等。
3)标准物质:亚胺硫磷,购于农业农村部环境保护科学监测研究所,质量浓度为 100 μg/mL,不确定度U=±3%(k=2)。
4)化学试剂:乙腈(色谱纯,上海安谱公司);丙酮(色谱纯,上海安谱公司);氯化钠(分析纯,西陇科学股份有限公司);二级水(自制)。
5)耗材:13 mm×0.2 μm 有机滤膜(上海安谱公司)。
6)测定样品:板栗粉,来自国家林业和草原局科技司组织的能力验证机构。
1.2 方法
1)标准工作溶液的配置:从冰箱取出质量浓度为 100 μg/mL 的亚胺硫磷标准溶液,放在室温为 25 ℃ 的实验室回温 4 h 后,用20~200 μL 移液枪移取 100 μL 亚胺硫磷标准溶液于 5 mL 容量瓶中,用丙酮稀释定容至刻度,配制成质量浓度为 2 μg/mL 的工作标准溶液(此工作标准溶液保存在 4 ℃ 冰箱中,有效期一周)。检测时通过稀释在室温为 25 ℃ 的实验室回温 4 h 后工作标准溶液得到0.10、0.15、0.20、0.30、0.40 μg/mL 共5个梯度质量浓度点的标准溶液。采用GC-2010Plus气相色谱仪进行亚胺硫磷含量测定,每一浓度的标准溶液溶液分别进样3次,得到相应的色谱峰面积,用最小二乘法拟合得到标准曲线回归方程。
2)供试品溶液的制备:本次实验的样品为已粉碎的板栗样品,并由国家林草局组织的能力验证机构加入亚胺硫磷农药。
准确称取板栗样品和空白样品各 2 g(精确到 0.01 g)于 50 mL 离心管中,加入 5 mL 蒸馏水涡旋 1 min 复原至板栗鲜样状态,静止 30 min 使板栗充分浸润,然后加入 20 mL 的乙腈和3~5 g 氯化钠,用涡旋混合器进行涡旋 2 min,采用TD5A-WS离心机 4000 r/min 离心 5 min。用 10 mL 移液管吸取 10 mL 上层乙腈溶液到 15 mL 离心管中,调节M32自动高通量平行浓缩仪水浴温度不大于 40 ℃,氮气流量为 40 kPa 吹至近干,加入 1 mL 丙酮,在涡旋混合器涡旋 1 min,过 0.2 μm 有机滤膜,装瓶上机测定。
3)气相色谱条件:毛细管色谱柱:SH-Rtx-1701 (30 m×0.25 mm×0.25 μm);设定升温程序如下:初始温度 200 ℃,以 5 ℃/min 速度升至 220 ℃,不保持,再以 40 ℃/min 升至 280 ℃,保持 6 min;进样体积:1 μL;进样口温度:250 ℃;不分流进样;FPD检测器温度:280 ℃,氢气流量:62.5 mL/min,空气流量:90 mL/min;氮气流量:40 mL/min;柱流量:2 mL/min。
2 结果与分析
2.1 数学模型的建立
分别称取10组试样,进行平行试验,外标法定性和定量,试样中农药残留量计算公式如下:
(1)
式中:w为试样中农药残留量质量分数,mg/kg;ρ为标准溶液中农药的质量浓度,mg/L;A为样品溶液中被测农药的峰面积;As为农药标准溶液中被测农药的峰面积;V1为提取溶剂总体积,mL;V2为吸取出用于检测的提取溶液的体积,mL;V3为样品溶液定容体积,mL;m为试样的质量,g。
2.2 测定不确定度分量来源分析
根据测量过程和公式(1),板栗中亚胺硫磷含量测定不确定度的来源如下:
1)配制标准溶液时引入的不确定度U1,rel,包括标准物质纯度引入的不确定度U1,标准工作溶液稀释过程中移液器引入的不确定度U2,容量瓶容量引入的不确定度U3,定容时人为读数误差引入的不确定度U4,定容时温度变化引入的不确定度U5[4-7];
2)标准曲线引入的不确定度U2,rel[8];
3)称样时电子天平引入的不确定度U3,rel;
4)添加萃取溶剂时瓶口分液器引入的不确定度U4,rel;
5)移取萃取溶液时 10 mL 刻度吸管引入的不确定度U5,rel;
6)样品定容时 1 mL 移液枪引入的不确定度U6,rel;
7)气相色谱仪自动进样引入的不确定度U7,rel;
8)FPD检测器响应值引入的不确定度U8,rel;
9)重复测量的相对不确定度U9,rel(A类)。
试验所用试剂均为色谱纯,因而空白样品测定所致的测定不确定度影响很小,可忽略不计。
2.3 各不确定度的评定
2.3.1 配制标准溶液时引入的不确定度U1,rel
1)标准物质纯度引入的不确定度U1[9-10]

2)标准工作液稀释过程中移液枪引入的不确定度U2

3)标准溶液定容过程中容量瓶容量引入的不确定度U3

4)定容时读数误差引入的相对不确定度U4
定容时人为读数误差引入的不确定度可根据重复读取实验数据进行计算。表1为 10 mL 容量瓶重复6次定容实验结果,根据表1中的数据计算得:
(2)
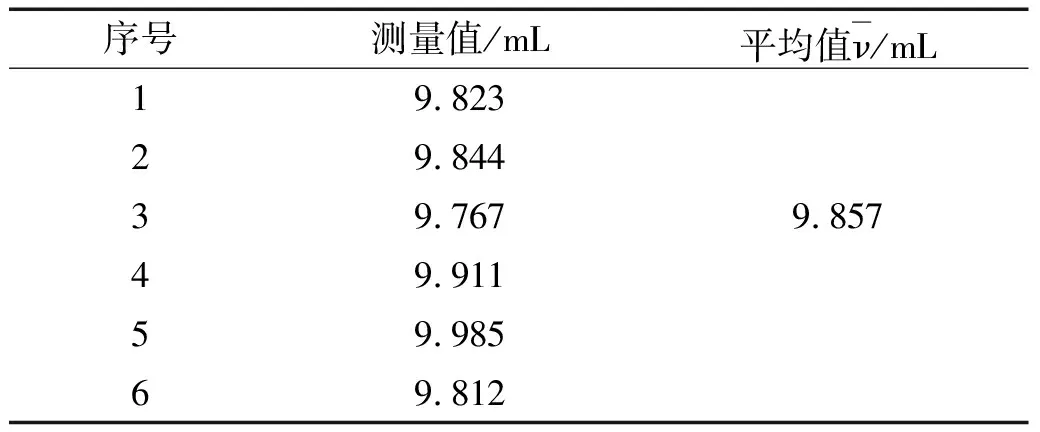
表1 10 mL容量瓶重复定容实验结果
5)定容时温度引起体积变化引入的不确定度U5

拟合以上5项得出配制标准溶液时引入的不确定度为:
=0.0074
2.3.2 标准曲线引入的不确定度U2,rel
本实验经过初筛,确定配置5个梯度质量浓度点的亚胺硫磷标准溶液,其质量浓度分别为0.10、0.15、0.20、0.30、0.40 μg/mL。采用GC-2010Plus气相色谱仪进行亚胺硫磷含量测定,每一浓度的标准溶液分别进样3次,得到相应的色谱峰面积[2](n=15,详见表2)。
用最小二乘法拟合得到线性回归方程为Y=380335.51015x-3192.569488,r2=0.999[10-11]。同时对板栗样品溶液中亚胺硫磷的浓度重复测定3次,由线性回归方程计算得样品溶液的质量浓度分别为0.13、0.14、0.14 mg/kg,平均值为 0.14 mg/kg,则用标准曲线求得样品溶液浓度引入的相对不确定度按式 (3)计算:
(3)
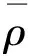
U2,rel=0.024
2.3.3 样品称量时天平引入的相对不确定度U3,rel

2.3.4 添加萃取溶剂时瓶口分液器引入的不确定度U4,rel

2.3.5 移取萃取溶液时 10 mL 刻度吸管引入的不确定度U5,rel
1)移液管体积刻度的不确定度
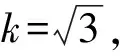
2)液体充满至移液管刻度线的估读误差
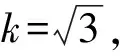
3)温度变化引入体积变化的标准不确定度

合成以上3项得出 10 mL 分刻度吸管不确定度为:
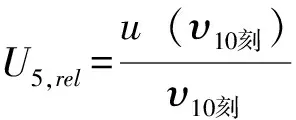
2.3.6 样品定容时 1 mL 移液枪引入的不确定度U6,rel

2.3.7 气相色谱仪自动进样引入的不确定度U8,rel
2.3.8 FPD检测器响应值引入的不确定度U8,rel
气相色谱仪灵敏度较高,故仪器稳定性及测定值分散性是FPD检测器测量不确定度的主要来源。采用标准工作溶液连续测定8次,测得质量浓度数据见表3,以质量浓度值的分散性计算相对不确定度:

表3 标准工作溶液重复测定实验结果
(4)
2.3.9 重复测量的相对不确定度U9,rel(A类)
测量板栗样品中亚胺硫磷质量分数,共进行了10次平行试验,结果见表4。

表4 平行试验结果值
U9=S(c)=0.0067 mg/kg
3 不确定度的合成与扩展
3.1 合成相对标准不确定度
标准不确定度分量来源、量值、贡献率见表5。

表5 标准不确定度分量汇总
利用U1,rel~U10,rel不确定度分量结算结果计算合成相对不确定度[16],得:
本实验测得板栗样品中亚胺硫磷质量分数为 0.14 mg/kg,合成标准不确定度为:
Uc(rel)=Urel×x=0.054×0.14 mg/kg=0.0076 mg/kg
由表5可知,测量板栗中亚胺硫磷质量分数过程中,不确定度的来源影响大小为重复测量>标准工作曲线>标准溶液配置>FPD检测器 >10 mL 分刻度吸管。其中,重复测量、标准工作曲线、标准溶液配置、FPD检测器和 10 mL 分刻度吸管引入的不确定度较大,贡献率达54.70%、27.35%、8.43%、5.24和3.53%。
3.2 扩展不确定度
取95%的置信概率,包含因子k=2,则扩展不确定度U(x)=k×Uc(rel)=0.015 mg/kg,因此,采用气相色谱法测定板栗中亚胺硫磷质量分数,当测量的数据为 0.14 mg/kg 时,测量的结果表示为(0.14±0.015)mg/kg,k=2。
4 结论与讨论
4.1 标准物质的使用
检验用的标准物质或标准溶液的准确性直接影响到定量结果的准确性和可靠性。标准物质的溯源性至关重要,实验应使用有证的标准物质。本试验为农药残留的能力验证活动,对于标准溶液的要求相对来说是比较高的,具体有以下几个方面:一是农残标液应该购买新生产的标液,因为农药具有不稳定性、在光、热影响下容易发生分解及转化;二是农残标液应在符合标液证书的保存条件下进行保存;三是农残的标液不确定度相对来说比较大。因此最好采用液标和固体标准物质的配制溶液进行比较,以确保其可靠性;四是配制农残标准溶液时要注意介质的使用。根据母液与农药的溶解性、样品检验标准方法中的提取液及定容上机的溶剂来进行选择。
4.2 样品的保存和前处理
一是农药残留量本身含量比较低,而且农药具有不稳定的特性,因此实验室在接到样品后应立即进行实验,无法马上进行实验的应将样品处于(0~4)℃冷藏箱中避光保存;二是由于样品是经过冷藏的,在进行实验之前最好将样品放置至室温后再进行称样,否则易吸收空气中的水分造成称量误差;三是样品的前处理要根据检验方法选择合适的有机溶剂,提取方式、时间应按照检验方法的要求严格进行,否则会出现提取不完全的情况;四是由于板栗样品中的成分比较复杂、样品中的色素及脂类成分都可能影响实验结果。所以最好对提取液进行有效的净化处理,而且要进行多次洗脱,使目标组分全部转移到提取溶液中,避免组分的损失。
4.3 仪器设备
一是农残分析对于仪器的要求比较高,实验前应该对仪器的进样针、气路、色谱柱、检测器等进行清洗及净化,使样品分析过程中不受污染。二是分析检测时分析仪器要确保处于稳定状态,参数设置及分析条件优化到最佳状态。实验室应根据所用仪器型号将仪器调整至最佳状态。三是为了避免系统误差,条件允许的情况下,可以用多台仪器进行结果比较,而且要注意进样过程中试剂的挥发对结果造成的影响。
4.4 检验人员
一是检验人员在实验前应熟悉检验方法标准,掌握检测方法基本原理,实验过程要求做到操作规范、熟练严格按检测方法的要求对样品中的目标组分进行检测;二是检验人员应熟知保证结果准确性的验证方法,比如通过进行加标实验,将加标实际结果与理论结果相比较,如果出现回收率过高或过低的情况应及时进行原因分析并纠正;三是检测人员应考虑农残的检测中各种因素的影响,比如样品中的基质效应对农残结果影响是很大的。因此应该通过基质曲线加标的方式将这个影响降低到最小。
因此,用气相色谱法测定板栗中亚胺硫磷农药过程中应选用有证的标准物质,精度较好的量器,规范移液管和容量瓶的操作,确保配置标准工作溶液浓度的准确性;选择拟合线性高的工作曲线进行校准;规范样品的保存和前处理步骤;对分析仪器进行日常维护和按时检定;加强检验人员的检测技术培训,适当增加平行样来降低不确定度,提高检测结果的准确性。
本试验采用气相色谱法测定板栗中亚胺硫磷浓度,测量不确定度主要来源于重复测量、标准工作曲线、标准溶液配置、FPD检测器和 10 mL 分刻度吸管,贡献率分别为54.70%、27.35%、8.43%、5.24和3.53%,其中重复测量引入的不确定对测量结果的影响最大。
