来那度胺联合利妥昔单抗治疗滤泡性淋巴瘤的有效性与安全性的系统评价Meta 分析
2023-08-21吴柚佼毕小慢郑少江
吴柚佼,刘 琳,毕小慢,2,郑少江
(1.海南医学院第一附属医院肿瘤研究所,海南 海口 570102;2.海南医学院生物医学信息与工程学院,海南 海口 571199)
滤泡性淋巴瘤(follicular lymphomas,FL)是最常见的惰性淋巴瘤和第二常见的非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL),其主要特征为弥漫性淋巴结肿大、骨髓受累和脾肿大,具有显著的生物学和临床异质性[1]。FL 进展缓慢、生存期较长,小部分处于疾病初期患者可通过放疗治愈[2]。自抗CD20 单克隆抗体利妥昔单抗(Rituximab)问世以来,复发或难治性FL 患者的生存得到了改善,生存期得以延长至20 年[3,4]。然而,部分患者病情具有复发和转变为侵袭性淋巴瘤的风险,预后较差[5]。越来越多的证据表明,肿瘤微环境(tumor microenvironment,TME)通过促进肿瘤生长和帮助恶性细胞逃逸免疫识别,参与B 细胞恶性肿瘤的疾病进展和耐药性产生。免疫调节药物(如来那度胺)不仅有直接抗肿瘤活性,还靶向TME 的各种细胞区室,包括T 细胞、NK 细胞和基质细胞等[6,7]。它们干扰促肿瘤信号传导,同时激活抗肿瘤免疫反应。来那度胺(Revlimid)作为单药治疗肿瘤已取得良好的临床效果,联合治疗可对FL 产生持久反应。虽然目前大多数患者已采用来那度胺联合利妥昔单抗作为初始治疗手段,但其有效性和安全性有待进一步验证。
探索国内外相关研究及总结相关结论,为循证医学提供有力数据支撑从而指导临床,本研究采用Meta 分析的方法来评价来那度胺联合利妥昔单抗治疗FL 的有效性和安全性。
1 资料与方法
1.1 选择标准
1.1.1 纳入标准 (1)研究类型:国内外发表的关于来那度胺联合利妥昔单抗治疗FL 的随机对照试验(randomized controlled trial,RCT)、非随机对照试验及单臂临床试验研究,语种限定为中、英文,不论是否采取盲法,不论发表状态如何,均纳入试验;(2)研究对象:经过病理学检查明确诊断为FL 的患者,不限制其性别、种族、年龄,不论疾病阶段和先前接受的治疗如何,均纳入试验;(3)干预方法:来那度胺联合利妥昔单抗治疗FL 用于试验组,单药利妥昔单抗治疗FL 用于对照组;(4)结局指标:有效性指标:客观缓解率、完全缓解率;安全性指标:不良反应。
1.1.2 排除标准 (1)重复发表的研究、综述、个案报道及研究组患者人数小于10 例的研究;(2)动物实验、基础研究;(3)研究内容或结局指标与纳入标准不符的文献;(4)研究设计不严谨、治疗措施或干预措施与实验无关的文献;(5)数据存在错误的文献。
1.2 文献检索
检索Web of Science、Embase、PubMed、The Cochrane Library、中国医学生物服务系统、中国知网、维普数据库、万方数据库,ClinicTrails.gov,设置文献发表时间为建库至2022 年6 月23 日。检索词以主题词与自由词相结合。中文检索词包括:“来那度胺”、“利妥昔单抗”、“滤泡性淋巴瘤”等;英文检索词包括:“Revlimid”、“IMiD3 Cpd ”、“CC 5013”、“CC - 5013”、“Revlimid”、“Rituximab”、“CD20 Antibody,Rituximab”、“Rituximab CD20 Antibody”、“Mabthera”、“Lymphoma,Follicular”、“Follicular Lymphomas”等。
1.3 资料提取与方法学质量评价
1.3.1 资料提取 将检索到的相关文献全部导入EndNote 软件,利用软件管理程序对文献进行整合,并且筛选出与本次研究课题有关的文献。两位评价员独立筛选文献检索中所有研究的标题和摘要,并分析是否符合选择标准。当这些信息无法准确判断时,检索并阅读全文来确定是否纳入,或通过讨论达到共识亦或根据第3 位研究人员判断解决分歧。
1.3.2 质量评估 使用Cochrane 偏倚质量风险评估工具对RCT 文献进行质量评估,包括是否符合随机序列分配、是否符合分配方式隐藏、是否对实验人员施盲、是否对研究者施盲、是否结局指标缺失、是否选择报告实验结果以及是否存在其他偏倚7 个方面。对以上统计数据分别做出“高风险偏倚”、“低风险偏倚”和“不确定风险偏倚”3 个不同级别的综合评价。对于非RCT 及单臂试验研究的文献选择MINORS 评估条款进行质量评估,如之前研究方法所示[8]:评价指标共12 项,其中前8 项适用于无对照组研究,每一条分数为0~2 分(计分方法:0 分表示未报道,1 分表示有报道但信息不充分,2 分表示有报道并提供充分的信息),前8 项满分共计16 分;本研究依照MINORS 评价表仅纳入总分≥13 的文献进入Meta 分析。
1.4 统计学处理
采用RevMan5.4 及Stata15 软件对数据进行统计学分析。Q 检验评估研究异质性,当P<0.05 时,我们则认为差异具有统计学意义。当I2≤50%,表明各研究之间同质性较好,选择固定效应模型;反之,如各研究异质性较大,首先应分析异质性产生的原因,根据具体情况做出合理的分析判断。当异质性原因容易得出时,选择随机效应模型分析,并做出描述性解释;当数据异质性大而无法做出合理解释,通过敏感性分析或亚组分析等方式寻找异质性原因。相对风险比(relative risk,RR)及其95%置信区间(confidence interval,CI)用于RCT 中的客观缓解率(objective response rate,ORR)、完全缓解率(complete response rate,CRR)的分析;风险差异(risk difference,RD)及其95% 置信区间用于非RCT 中的客观缓解率、完全缓解率及所有的不良反应的分析。不良反应在试验中被定义为治疗期间发生的任何不良事件。漏斗图用于检查结果是否存在发表偏倚。
2 结果
2.1 文献筛选流程及结果
通过主题词等初步检索,共计检索到413 篇文献。基于筛选标准处理后(图1),最终本研究共纳入8 篇文献[9-16],其中英文文献7 篇[9-15],中文文献1 篇[16]。
2.2 纳入文献的基本特征及偏倚风险评价
纳入的8 项研究,研究资料较齐全。通过总结文献基本特征,发现实验组和对照组患者在年龄、肿瘤分期、疗程及治疗策略等方面均无显著差异。5 篇[9,10,12,14,16]为单臂研究,另外3 篇[11,13,15]为随机对照研究(对照试验的试验组参与单臂试验的统计研究),8 项研究的试验组均采用来那度胺联合利妥昔单,3 项研究的对照组采用利妥昔单抗加或不加安慰剂。对照组采用纳入研究的基本特征详见表1。
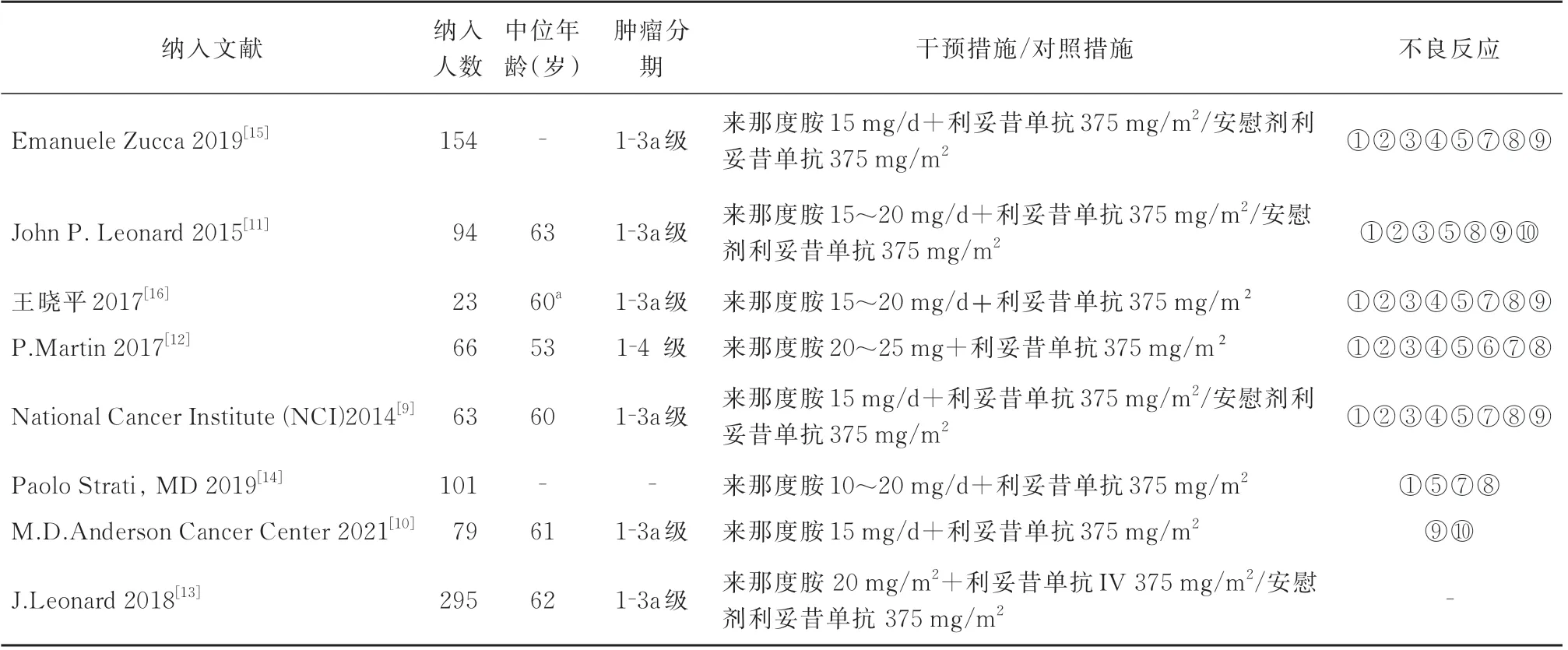
表1 纳入研究一般信息Tab 1 Characteristics of the included studies
根据Cochrane 偏倚质量风险评估工具的条目内容依次对8 篇入组文献进行质量评估(图2)。
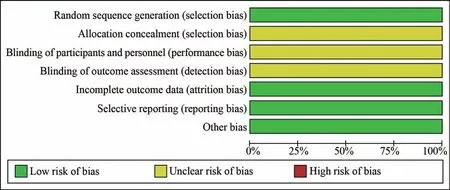
图2 偏倚风险评估总结Fig 2 Summary of risk of bias
2.3 Meta 分析结果
2.3.1 客观缓解率(ORR)
2.3.1.1 按单臂实验方法进行的Meta 分析 满足Meta 分析条件的文献共7 篇[10-16],涉及865 名患者,其中ORR 患者296 例。采用固定效应模型对本次单臂二分类数据进行Meta 分析,I2=0<50%,且Q检验的P=0.76>0.05。分析得出,RD=0.87,95%CI=[0.79,0.96],合并效应量检验Z=20.17,P<0.000 01,具有统计学意义(见图3)。结果显示,来那度胺联合利妥昔单抗治疗FL 的客观缓解效果显著,客观缓解率可达87%。

图3 来那度胺联合利妥昔单抗治疗FL 客观缓解率的meta 分析Fig 3 Meta-analysis on ORR of Revlimid plus Rituximab for the treatment of FL
2.3.1.2 按对照组实验方法进行的Meta 分析 满足分析要求的3 篇[11,13,15]文献中共计543 例患者,其中治疗组270 例,对照组273 例。通过固定效应模型进行分析,发现I2=0<50%;且Q 检验的P值为0.79>0.05,分析得出RR=1.43,95%CI=[1.26,1.61],合并效应量检验Z=5.76,P<0.000 01,具有统计学意义(见图4)。这些结果提示来那度胺联合利妥昔单抗治疗FL 的客观缓解效果显著,优于对照组。

图4 随机对照组下来那度胺联合利妥昔单抗治疗FL 客观缓解率的meta 分析Fig 4 Meta-analysis on ORR of Revlimid plus Rituximab for the treatment of FL in RCT
2.3.2 完全缓解率(CRR)
2.3.2.1 按单臂实验方法进行的Meta 分析 共计7篇[10-16]文献满足分析条件,涉及865 名患者,其中CR患者296 例。采用随机效应模型对本次单臂二分类数据进行meta 分析,I2=81%>50%,异质性较大考虑由纳入较多单臂研究引起。且Q 检验的P<0.000 1,分析得出RD=0.58,95%CI=[0.50,0.67],合并效应量检验Z=13.48,P<0.000 01,结果具有统计学意义(图5)。提示来那度胺联合利妥昔单抗治疗FL 的疾病控制率效果可能较显著,完全缓解率为58%,尚需纳入更多高质量随机实验研究进行汇总探索。

图5 来那度胺联合利妥昔单抗治疗FL 完全缓解率的meta 分析Fig 5 Meta-analysis on CRR of Revlimid plus Rituximab for the treatment of FL
2.3.2.2 按对照组实验方法进行的Meta 分析 符合分析条件的3 篇[11,13,15]文献中包含543 例患者信息,其中治疗组270 例,对照组273 例。采用固定效应模型分析,I2=0<50%,且Q 检验的P=0.79>0.05,分析得出RR=1.67,95%CI=[1.27,2.21],合并效应量检验Z=3.62,P=0.000 3,具有统计学意义(图6)。提示来那度胺联合利妥昔单抗治疗FL的完全缓解效果相比单用利妥昔单抗效果显著,优于对照组。

图6 随机对照组下来那度胺联合利妥昔单抗治疗FL 完全缓解率的meta 分析Fig 6 Meta-analysis on CRR of Revlimid plus Rituximab for the treatment of FL in RCT
2.3.3 主要不良反应 本研究筛选的8 篇[9-16]文献分别从中性粒细胞减少、淋巴细胞减少、血小板减少、贫血、疲劳、腹泻、恶心呕吐、皮疹、感染、血栓等10 个方面报告了主要不良反应,对不同评价标准进行亚组分析,结果见图7。
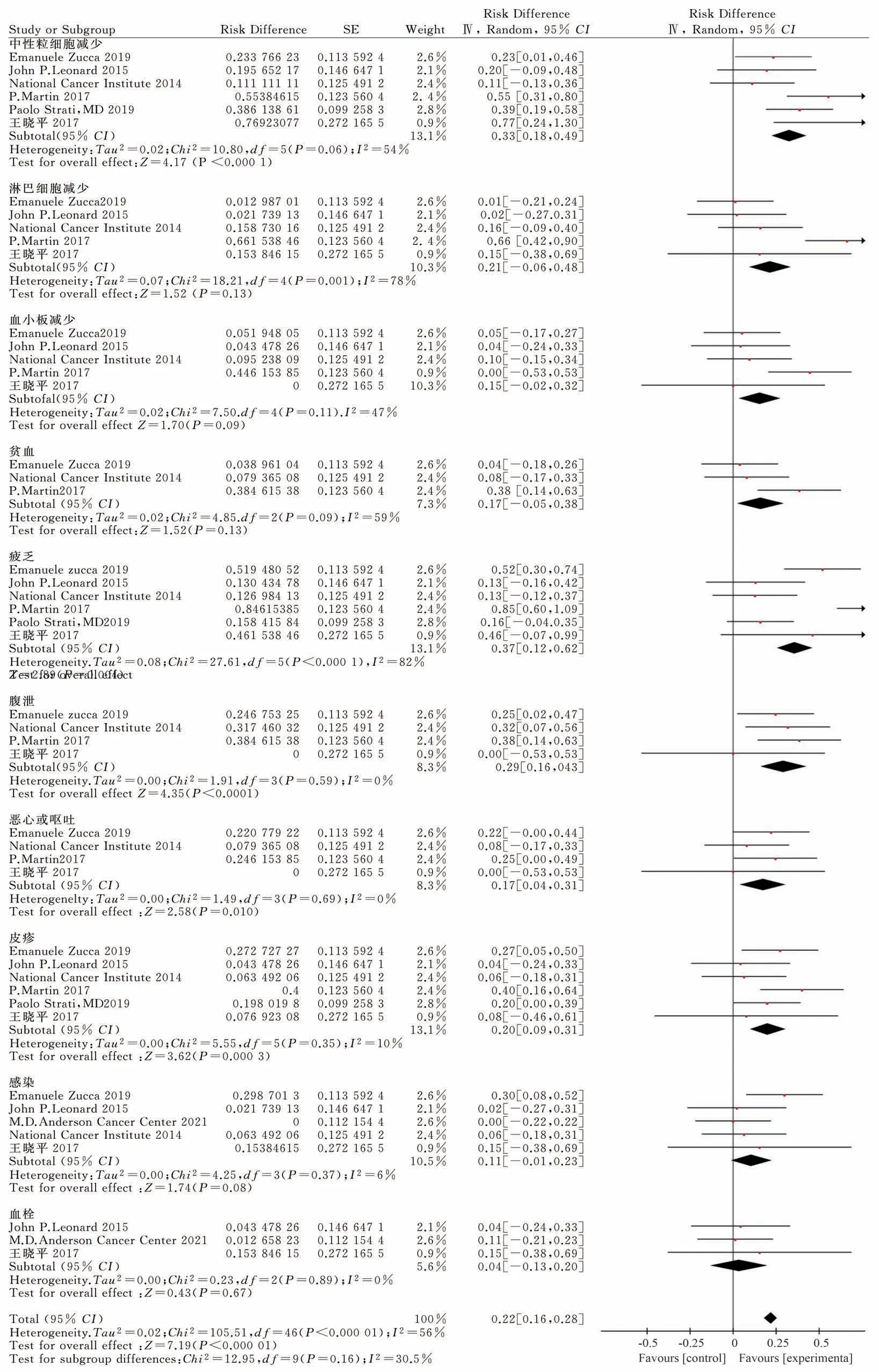
图7 来那度胺联合利妥昔单抗治疗FL 主要不良反应的meta 分析Fig 7 Meta-analysis on adverse events of Revlimid plus rituximab for the treatment of follicular
对报告中性粒细胞减少文献[9,11,12,14,16]中的数据进行统计分析,结果显示,P=0.06<0.1,I2=54%>50%,评价为中度异质性;采用随机效应模型,效应量RD=0.33,95%CI=[0.18,0.49],Q 检验中P<0.000 1,有统计学意义。约33%的病人在接受来那度胺联合利妥昔单抗治疗FL 过程中会出现中性粒细胞减少的不良反应。
对于淋巴细胞减少相关文献[11,12,15,16]中的数据进行统计分析,结果显示,P<0.01,I2=78%>50%,异质性较大;采用随机效应模型,效应量RD=0.21,95%CI=(0.06,0.48),在Q 检验中P=0.13>0.05,差异无统计学意义。
统计分析报告血小板减少相关文献[9,11,12,15,16]中的数据,结果显示,P>0.01,I2=47%<50%,异质性较小;采用固定效应模型,效应量RD=0.15,95%CI=(0.02,0.32),通过Q 检验P=0.09>0.05,无统计学意义。
对报告贫血相关文献[9,12,15]中的数据进行统计分析,结果显示,P<0.01,I2=59%>50%,评价为中度异质性;采用随机效应模型,效应量RD=0.17,95%CI=(0.05,0.38),Q 检验中P=0.13>0.05,无统计学意义。
对于报道疲乏相关文献[9,11,12,15,16]进行数据统计分析,结果表明P<0.000 1,I2=82%>50%,提示异质性较大;故采用随机效应模型,效应量RD=0.37,95%CI=(0.12,0.62),P=0.004<0.05,有统计学意义。约37%的病人在接受来那度胺联合利妥昔单抗治疗FL 过程中会出现疲乏症状。但异质性较大,可能由于文章数量纳入较多单臂研究引起,尚需纳入更多高质量随机实验研究进行汇总探索。
统计分析与腹泻相关文献[9,12,15]中数据,结果显示,P>0.01,I2=0%<50%,异质性小;我们使用固定效应模型,得出效应量RD=0.29,95%CI=(0.16,0.43),P<0.000 1,表明结果具有统计学差异。约29%的病人在接受来那度胺联合利妥昔单抗治疗FL 过程中会出现腹泻事件。
对报告恶心或呕吐文献[9,12,15]中的数据进行统计分析,结果P>0.01,I2=0%<50%,异质性小,采用固定效应模型,效应量RD=0.17,95%CI=(0.04,0.31),P<0.05,有统计学意义。来那度胺联合利妥昔单抗治疗FL 可导致恶心或呕吐的事件概率17%。
对于报道皮疹事件的文献[9,11,12,14-16]进行数据统计分析,结果表明,P=0.35>0.01,I2=10%<50%,说明异质性小;故使用固定效应模型,效应量RD=0.20,95%CI=(0.09,0.31),P<0.05,说明结果具有统计学差异。约有20%的病人在接受来那度胺联合利妥昔单抗治疗FL 中出现皮疹事件。
基于筛选的与感染相关文献[11-13,15,16]数据,通过固定效应模型分析显示,P=0.37>0.01,I2=6%<50%,异质性小,RD=0.11,95%CI=(0.01,0.23),P=0.08>0.05,无统计学意义。
基于筛选的与血栓相关文献[13,15,16]数据,通过固定效应模型分析数据,P=0.89>0.01,I2=0%<50%,异质性小,RD=0.04,95%CI=(0.13,0.20),P=0.67>0.05,无统计学意义。
2.4 偏倚性分析
对客观缓解率(图8A)及完全缓解率(图8B)指标运用Stata14.0 做漏斗图分析,其图形左右对称。我们对上述两图分别进行对称性检验(图8C/D),得到P=0.051>0.05,P=0.946>0.05,该结果表明漏斗图基本对称,提示本次研究的文献不存在明显发表偏倚。
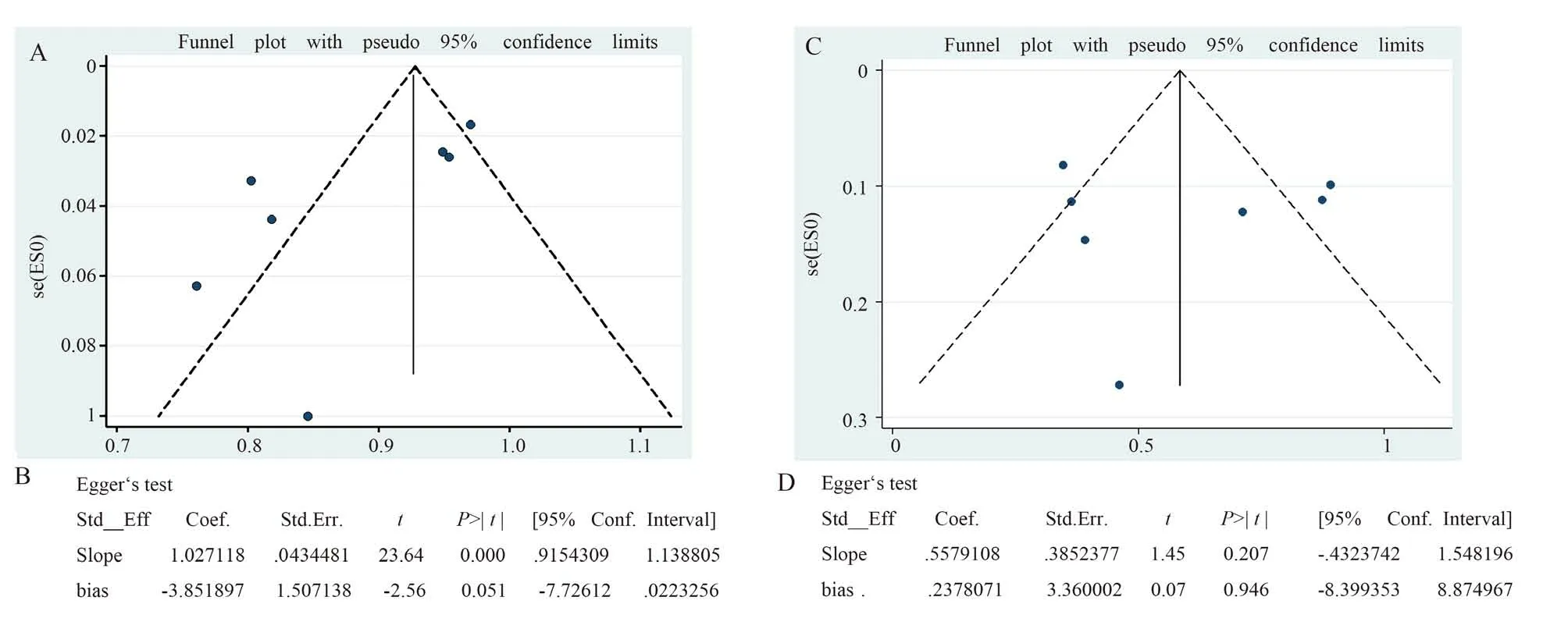
图8 偏倚性分析Fig 8 Bias analysis
3 讨论
来那度胺作为一种靶向免疫调节药物,其与利妥昔单抗联合使用已成为复发性FL 的新治疗选择方案。该联合方案适用于单用利妥昔单抗治疗无效或疗效不佳的患者群体,对于希望避免细胞毒性化疗的患者来说,是一种推荐的选择方案[17]。
在Ⅲ期 AUGMENT 试验中,与安慰剂+利妥昔单抗相比,来那度胺+利妥昔单抗在复发或难治性惰性非霍奇金淋巴瘤患者中显著延长了无进展生存期(PFS;主要终点),PFS 获益在滤泡性淋巴瘤患者表现突出;在复发或难治性惰性非霍奇金淋巴瘤患者(包括利妥昔单抗难治性疾病患者)的Ⅲ期MAGNIFY 试验中来那度胺+利妥昔单抗也显示出明显活性[18,19]。虽然试验中来那度胺+利妥昔单抗组的3 级或4 级中性粒细胞减少比安慰剂+利妥昔单抗组更频繁出现,但可以通过调整剂量可以控制。但是,其治疗效果和安全性仍然缺少高级别临床证据的研究。
基于此,本研究通过纳入8 篇来那度胺联合利妥昔单抗治疗FL 相关的文献进行meta 分析评估其有效性及安全性。结合单臂及对照组实验,与单用利妥昔单抗治疗FL 相比,来那度胺联合利妥昔单抗治疗FL 的客观缓解率和完全缓解率具有大幅提升。在治疗过程中,出现中性粒细胞减少、腹泻、恶心呕吐、皮疹等不良反应风险相对较大,但所占整体比重均处于较低水平,治疗时需要对相关的不良反应做出相应的治疗,且针对上述不良反应,现有的医学水平均能通过药物或其他方式不同程度改善或抑制。此外,由于淋巴细胞减少及疲乏等不良反应指标存在较高异质性,还需要纳入更多对照试验进行进一步探索。
本文旨在论证来那度胺治疗FL 的临床效果。既往文献中不同B 细胞淋巴瘤亚型的患者治疗方案和治疗持续时间存在异质性。本文严格按照纳入标准筛选FL 的临床研究,避免与其他非霍奇金淋巴瘤包括弥漫性大B 细胞淋巴瘤、套细胞淋巴瘤、原发性中枢神经系统淋巴瘤等共同纳入分析后产生较大异质性的风险。另外,本实验涉及到的药物相对一致,能极大地证实和突出显示控制变量后的实际临床疗效。
本研究尚存在一定的局限性:(1)此次纳入的部分文献内容为单臂研究,因此可能导致结果有一定程度的偏差;(2)此次纳入的文献样本量偏少,可能对研究的结果会产生一定的偏倚风险,尚需要大样本、多中心的临床随机对照实验研究纳入;(3)文献研究中的干预措施虽设定为来那度胺联合利妥昔单抗治疗FL,但是由于各研究之间的用药剂量及周期存在差别,可能会对此次的meta 分析结果产生一定影响;(4)尽管在提取数据时较全面收集相关资料,由于不同文献之间的结局指标不同,部分结局指标仍存在无法进行整合分析的问题;(5)本文仅纳入中、英文文献,可能会遗漏其他语言的文献,因此造成纳入文献不全面、纳入人种较局限的问题;(6)少部分纳入文献年限稍久远,但疾病处于不断发展变异的进程,因此对临床的指导意义可能存在一定的局限;(7)纳入文献中不可避免会出现发表偏倚性,这是由于具有统计学意义结果的研究相对容易发表,而那些阴性结果的研究则相反。因此,还需要以更多设计精良的前瞻性大样本、多中心随机对照试验对这项研究的有效性及安全性进行再次meta 分析和评价。
目前来那度胺联合利妥昔单抗或单独使用利妥昔单抗是晚期FL 的标准一线或后续治疗选择方案,其他治疗选择方案(如PI3K 抑制剂、他泽美司他和CAR-T 细胞治疗)也在持续不断发展[2]。研究表明,涉及PI3 激酶和BTK 的增殖信号通路的几种小分子抑制剂具有抗FL 活性[20,21]。另外,EZH2 抑制剂他西美司他在既往二线治疗后被FDA 批准用于FL[22]。最值得一提的是嵌合抗原受体T 细胞(CART)或双特异性抗体构建体对FL 的具有独特的疗效机制[23,24]。鉴于这些多种潜在的非交叉反应机制,设计、优化组合策略有望改善FL 的结局,甚至达到治愈的效果。所以目前仍迫切需要个性化的方法、具有生活质量测量的试验终点、指导可用方案及药物测序的信息[25]。通过新药研发以及FL致病机制的持续发现,将有望改善FL 患者的预后和生存质量。
所有作者声明不存在利益冲突关系。
