珍珠龙胆石斑鱼无水保活过程中肌肉品质变化及近红外光谱模型的构建
2023-08-18何圣琪朱文慧励建荣李学鹏郭晓华
步 营,何圣琪,王 飞,朱文慧,励建荣,李学鹏*,林 洪,郭晓华
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013 2 中国海洋大学食品科学与工程学院 山东青岛 266003 3 山东美佳集团有限公司 山东日照 276800)
珍珠龙胆石斑鱼(Epinephelus lanceolatus♀×Epinephelus fuscoguttatus♂)是近几年通过龙胆石斑鱼和老虎斑杂交产生的石斑鱼新品种,具有生长快速和抵抗力强的杂交优势,是一种极具潜力的商业养殖品种。珍珠龙胆石斑鱼适宜生长于温暖的水域,其必需氨基酸指数高达0.99,为优质蛋白源,脂肪酸中多不饱和脂肪酸的占比较高,肉质鲜美,经济价值高,市场前景好[1-3]。我国的石斑鱼养殖主要集中在东海南部及南海各沿岸,福建、广东及海南的石斑鱼养殖量占我国石斑鱼总量的95%以上[4]。由于分布地区不均匀,因此难以满足市场需求。石斑鱼性格暴躁,背部和腹部有尖刺,运输过程中的振动及拥挤,容易造成应激反应,不利于保活运输[5]。无水保活技术是对水产运输方式的一次巨大革命,是通过预冷或麻醉诱导鱼体休眠,然后在低温、无水及潮湿的环境下长时间保鲜运输,该技术具有投入低、运输效率高、死亡率低、环境污染小等优点,其主要原理是利用麻醉、电击、梯度降温等方式,诱导鱼类缓慢进入半休眠或完全休眠状态[6-8]。人们对水产品的肌肉品质评价中,质地是其主要的评价指标[9]。质构能够反映鱼肉的质地,该指标受到很多条件的影响,例如鱼的品种、生活习性、脂肪含量、蛋白质含量、环境温度及pH 等。王彩霞等[10]研究发现随着保活时间的延长,加州鲈肌肉的硬度、胶黏性、咀嚼性有所下降。肌肉的持水力是指肌肉对水分的保持能力,持水力弱,大量水分流失会导致商品质量损失及小分子物质随水分流失,降低鱼肉品质。而水分显著影响肌肉的色泽及硬度,失水过多会导致肌肉的色泽暗淡无光,同时肌肉的硬度上升。在无水运输后,持水性变化与保活的条件及鱼的品种有关。Refaey 等[11]发现在有水运输24 h 后,肌肉的水、脂肪和能量含量显著降低,肌肉pH 值和剪切力在0 h 时显著降低,24 h 后升高,72 h 后再次降低,168 h 时再次升高。而Wang 等[12]研究发现,运输后中华鲟的持水性在无水保活后无显著变化。Fan 等[13]探究了石斑鱼低温无水保活过程中的能量代谢与氧化应激的规律。本课题组前期研究亦发现,随着无水保活时间的延长,石斑鱼鱼肉中糖原含量逐渐降低。目前,如何快速鉴定石斑鱼的保活时间以及如何通过检测糖原含量鉴定石斑鱼无水保活状态尚未见报道。
近红外光谱(Near infrared spectroscopy,NIRS)技术是一种快速无损检测物质含量和鉴别物质的现代分子光谱分析技术。近红外区域是指波长在780~2 526 nm 范围的电磁波,是人们最早发现的非可见光区域。近红外光谱分析技术是一种间接的定性及定量分析技术,可以通过建立的预测模型在几十秒甚至几秒内测定一个样品的几种甚至几十种物质或浓度数据[14-15]。若能利用近红外光谱技术建立一个快速预测模型来预测石斑鱼中的糖原含量,便能够鉴定石斑鱼无水保活时间和保活状态,加大应用范围。
本文研究石斑鱼无水保活过程中的肌肉品质变化,应用近红外光谱分析技术建立石斑鱼无水保活的定性分析模型及糖原含量分析模型,旨在快速、无损、精确检测鱼体的保活时间及糖原含量。
1 材料与方法
1.1 材料与试剂
珍珠龙胆石斑鱼,购于锦州市林西路水产市场。挑选健康、无疾病,体表完好的石斑鱼作为试验样品,体质量(800±50)g,1 龄,充氧运输至实验室后,将其放入人工海水中(22 ℃),暂养水温为(22±0.5)℃,溶解氧质量浓度为6 mg/L,盐质量分数为(27±2)‰,暂养24 h 以消除应激反应。
葡萄糖和蒽酮,北京索莱宝科技有限公司;氢氧化钾,滨化集团股份有限公司;氯化钾,福晨(天津)化学试剂有限公司。上述试剂均为分析纯级。
1.2 仪器与设备
MS105DU 型分析天平、PE28 型pH 计,梅特勒-托利多仪器(上海)有限公司;UV2550 型紫外-可见分光光度计,日本岛津公司;PEN3 型电子鼻,德国Airsense 公司;PQ001 型低场核磁共振分析仪,上海纽迈电子科技有限公司;TA.XT plus 型质构仪,英国Stable Micro Systems 公司;2600XTR型近红外分析仪,美国Unity 公司;HH-4 型数显恒温水浴锅,常州国华电器有限公司;Biofuge Stratos 型高速冷冻离心机,美国赛默飞公司;BSC-250 生化培养箱,上海博讯实业有限公司。
1.3 试验方法
1.3.1 质构测定 取石斑鱼鱼肉测定TPA,参数:探头类型p/5,测前速度3 mm/s,测试速度0.5 mm/s,测后速度3 mm/s,压缩比例50%,感应力5.0 g,测定时间5 s。选取硬度、弹性、咀嚼、回复性、黏聚性进行质构分析。
1.3.2 pH 测定 称取5 g 石斑鱼肉,绞碎,添加45 mL 蒸馏水,高速均质机均质,室温静置30 min,取上清液,用pH 计测定。
1.3.3 离心损失 取3 g 样品包裹在滤纸中,离心前称重,记为m1。将其转移至50 mL 离心管中,以4 ℃,3 000 r/min 条件下离心10 min,用滤纸吸附鱼肉表面水分,称重,记为m2。计算离心损失。
1.3.4 蒸煮损失 取10 g 解冻后的肉样,记为M3,放入蒸煮袋中封口,置于85 ℃水浴锅中加热25 min,待温度降至室温,用滤纸吸附鱼肉表面水分,称重,记为M4。计算蒸煮损失。
1.3.5 低场核磁分析 低场核磁共振分析条件参考年琳玉[16]的方法并稍作修改。将鱼肉切成2 cm×1 cm×1 cm,置于直径15 mm 的核磁管中。具体测试条件:采用Carr-Purcell-Meiboom-Gill 脉冲序列测定凝胶样品的横向弛豫时间T2。SFI=22 MHz,P90=14 μs,SW=200 kHz,TR=2 000 ms,NS=8,τ=200 μs,Echocnt=4 000。所得CPMG 指数衰减曲线采用仪器自带的软件进行反衍,得到T2图谱。
1.3.6 肌糖原的测定 参考依鸿莉等[17]的方法,糖原采用蒽酮比色法测定。准确称取2.0 g 鱼肉样品,剪碎后加入4 mL 30%KOH 溶液,沸水浴消化20 min,取出后冷却至室温,加入20 mL 无水乙醇,3 000×g 离心15 min,取沉淀后弃上清液,向沉淀中加10 mL 蒸馏水、0.05 mL 饱和KCl 和15 mL无水乙醇,搅拌溶解沉淀物质,3 000×g 离心15 min 后弃上清液,搅拌使沉淀溶解并定容10 mL,静置10 min 后取50 μL 糖原稀释液加入4.5 mL蒸馏水,再取0.5 mL 糖原稀释液加入2 mL 蒽酮显色液,混匀后冷却,在沸水浴中反应10 min,取出,用流水快速冷却,静置10 min,于波长620 nm处测定其吸光度。
1.3.7 近红外光谱采集 将制备好的鱼肉样本均匀置于红外光谱仪的石英比色皿上,确保比色皿表面被鱼肉样品完全覆盖。光谱采集条件为波长680~2 600 nm,扫描次数24 次。分为鲜样、0,3,6,9,12 h 组,每组设置20 个样品,共计120 组样品。每组样品平均采集3 次,取平均值作为原始近红外光谱数据。
1.3.8 SIMCA 模型的建立 将样品按照3∶1 的比例分成校正集和验证集,利用分析建模软件The Unscrambler 10.4 分别在6 个保活时间的鱼肉样品中随机挑选90 个样本作为训练集,对其进行主成分分析(Principal component analysis,PCA),得到聚类分析的模型。剩下的30 个样本作为预测样本,建立SIMCA 模型,用于检验模型的可靠性。
1.3.9 肌糖原定量分析模型的建立 用采集的近红外谱图与紫外-可见分光光度计测定的糖原数据建立偏最小二乘(Partial least squares,PLS)定量分析模型。为消除背景干扰,采用Savitzky-Golay 平滑(SG)、归一化(Normalization)、标准归一化(Standard normal variate,SNV)、多元散射校正(Multiplicative scatter correction,MSC)、基线校正(Baseline correction,BC)、均值中心化(Mean centering)等方式对原始光谱进行预处理。
1.3.10 模型的评价 采用验证集样品对最终模型进行外部验证,用判别率指标评价SIMCA 定性模型。通过校正集相关系数(Correction determination coefficents,Rc2)和校正集均方根差(Root mean squared error of calibration,RMSEC)判断模型的质量,一般Rc2越大,近红外分析结果与化学分析结果越吻合,可信度越高。采用验证集相关系数(Determination coefficient,Rc2)和验证集均方根误差(Root mean squared error of validation,RMSEP)判断模型的精确性,当Rc2越大,RMSEP越小,说明模型的准确度越高,模型的预测能力越好。作为糖原定量分析模型的评判指标。
1.3.11 数据分析 对每个样品做3 次平行试验,使用软件SPSS 19.0 进行正交试验数据分析,结果用“平均值±标准差”表示。用Origin 9.1 作图,The Uscrambler 10.4 进行光谱预处理及模型的构建。
2 结果与分析
2.1 石斑鱼无水保活过程中的质构变化
质构反映鱼肉组织的特性变化,是评判鱼肉品质的重要指标[18],因此测定质构对判断鱼肉品质的好坏及变化很有必要。由表1 可知,与鲜样对比,保活0,3,6,9 h 和12 h 后,鱼肉的硬度、弹性、咀嚼度和黏聚性显著降低(P<0.05),回复性无显著变化。这可能是由于低温条件下鱼体受到一定的胁迫,提高了鱼体的能量代谢,肌肉中的能量物质发生分解,造成成分变化,导致其硬度、弹性、咀嚼度和黏聚性降低[6,19]。

表1 不同保活时间的珍珠龙胆石斑鱼鱼肉质构的变化Table 1 The changes in texture of the fish of pearl gentian grouper with different survival time
2.2 石斑鱼无水保活过程中的pH 变化
新鲜的鱼肉pH 偏弱碱性,pH 值急剧降低会影响鱼肉的新鲜度[20],且pH 变化会引起机体酸碱发生变化,增加肝脏功能的负担,甚至造成损伤[21]。由图1 可以看出,保活12 h 后,pH 值由7.0降至6.7,显著低于鲜样的pH 值(P<0.05)。这可能是因为持续的低温及饥饿刺激鱼体对能量需求增加,糖原和脂肪等储能物质被细胞分解用于供给能量,由于无水环境下只能通过皮肤进行微弱的呼吸,使有氧代谢受到较大程度的抑制,无氧呼吸增加,而通过无氧呼吸产生能量时,不可避免地生产乳酸,从而造成鱼肉的pH 值下降[22-23]。

图1 不同保活时间的珍珠龙胆石斑鱼鱼肉pH 值的变化Fig.1 The changes in pH of pearl gentian grouper with different keep alive time
2.3 石斑鱼无水保活过程中持水力的变化
持水力是指肌肉保持水分的能力,影响肉的嫩度、硬度、营养成分及滋味等,能够快速、准确表明鱼肉品质的变化。持水力的强、弱主要与蛋白质三维网状结构和变性程度相关[24]。通常用离心损失和蒸煮损失表示持水力的大小,由图2a、2b 可知无水保活后,鱼肉的离心损失率与蒸煮损失率均显著升高,这表明其持水力显著下降。可能是因为肌肉pH 下降,导致部分蛋白质分解、变性,大分子的空间网络结构发生变化,减少了水和蛋白质的相互作用,从而降低其水分保持能力[25-26]。

图2 不同保活时间的珍珠龙胆石斑鱼鱼肉持水力的变化Fig.2 The changes in water retention capacity of pearl gentian grouper with different keep alive time
2.4 石斑鱼无水保活过程中水分分布变化
低场核磁共振技术可以测量质子弛豫,在食品加工领域经常被用来检测水的迁移和肌肉结构的变化[27-28],在肉品中水分被分为3 种相态,分别为结合水(T21,0.01~10 ms)、不易流动水(T22,10~100 ms)和自由水(T23>100 ms)。弛豫峰面积变化可以反映不同相态水分的相对含量,其变化情况可以表征各相态水分群的流动迁移情况[23]。由图3及表2 可知,与新鲜石斑鱼相比,经无水保活12 h 后,T22的峰面积减少了2.53%,T23的峰面积增加了111.63%,表明鱼肉中不易流动水含量下降,自由水含量增加,说明保活过程中不易流动水向自由水方向转化,水分的流动性增强。
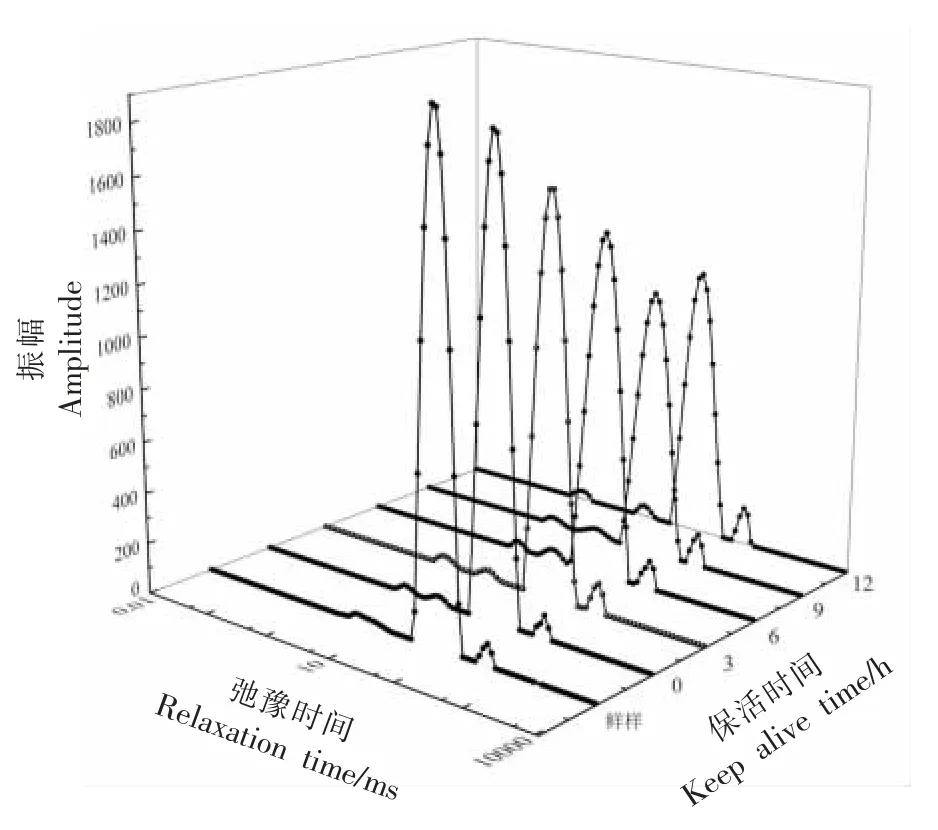
图3 不同保活时间的珍珠龙胆石斑鱼鱼肉水分分布变化Fig.3 Changes of water distribution in pearl gentian grouper with different keep alive time

表2 保活过程中石斑鱼横向弛豫时间T2 峰面积比例的变化Table 2 Changes in the area ratio of T2 peak of lateral relaxation time in grouper during waterless preservation
2.5 不同保活时间的石斑鱼鱼肉的肌糖原含量
糖原是鱼体的主要储备能源,包括肝糖原和肌糖原,在保活运输过程中作为能源物质被消耗。图4 显示不同无水保活时间的肌糖原含量变化,从保活0 h 至12 h,肌糖原含量呈下降趋势。无水保活过程中,由于缺氧,珍珠龙胆石斑鱼肌肉中的糖原由有氧代谢转化为无氧代谢,糖原经无氧酵解产生乳酸,因此导致无水保活过程中肌糖原含量下降。

图4 不同保活时间的石斑鱼的肌糖原含量Fig.4 The content of muscle glycogen in pearl gentian grouper during waterless preservation
2.6 不同保活时间的石斑鱼鱼肉的红外光谱分析
图5 为石斑鱼的近红外原始光谱。不同保活时间的石斑鱼鱼肉样本的近红外光谱谱线相近,形状大致相同,不完全重合,吸光值强度在0.45~3.05 之间,在波长970,1 190,1 440,1 910,2 530 nm 处有强烈的吸收峰。研究表明,近红外光谱不同波段代表的信息不同,波长1 501 nm 为OH 伸缩振动和NH 伸缩振动的一级倍频吸收带,在1 400 nm 处为水的吸收带,1 728 nm 处是脂肪分子中CH 基团伸缩振动一级倍频吸收带[29]。鱼肉中的水分含量大于70%,在1 400 nm 处吸收峰非常明显,在1 934~2 040 nm 范围是N-H 键伸缩振动产生的合频峰,反映鱼肉中与蛋白质或氨基酸相关组分的含量信息,而1 100~1 400 nm 和2 200~2 400 nm 是C-H 键的合频和一级倍频峰,可以指示与碳水化合物及脂肪有关的含量信息[30]。因脂肪、水分含量及碳水化合物含量均与肌肉的品质有关,故这些吸收峰的变化对预测结果的准确性尤其重要。

图5 不同保活时间的珍珠龙胆石斑鱼鱼肉近红外原始光谱图Fig.5 The original near-infrared spectra of pearl gentian grouper with different keep alive time
2.7 SIMCA 定性模型分析
在光谱扫描范围,取90 个石斑鱼鱼肉样本的近红外光谱,对这些光谱数据组成的矩阵进行主成分分解,以其前2 个得分向量作图,结果见图6。X 轴为样本的第1 主成分PC1,Y 轴表示样本第2 主成分PC2,图中不同形状和颜色的图标分别代表不同保活时间的鱼肉,PCA 定性描述了不同保活时间的石斑鱼鱼肉间的特征差异。可以看出鲜样,0,3,12 h 几个组的样品有较好的聚类效果,而6 h 和9 h 的鱼肉光谱虽有一定的重叠性,但重叠不明显。这可能是由于在石斑鱼保活6 h前,生存环境发生变化,为适应环境,鱼体消耗大量糖原为机体供能,导致前期糖原含量下降明显,6 h 到9 h 时,鱼体中糖原消耗速率较低,而保活时间12 h 后,糖原含量处于一个较低的水平。反映在主成分图上则表现为6 h 和9 h 的糖原含量差异较小,导致区分度有所下降,且鲜样,0,3 h 与12 h 相聚较远,能够被较好地区分识别。
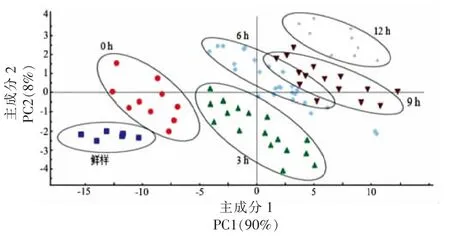
图6 不同保活时间的珍珠龙胆石斑鱼鱼肉的主成分分析Fig.6 Principal component analysis of pearl gentian grouper with different keep alive time
表3 为SIMCA 对不同保活时间石斑鱼鱼肉的判别率。鲜样,0,3 h 下判别率均达到100%,而保活6 h 和9 h 的判别率为80%。SIMCA 可区分不同保活时间的30 个石斑鱼样品,出现2 个错判现象,正确判别率93.3%,说明近红外谱具有区分不同保活时间的鱼肉的能力。

表3 珍珠龙胆石斑鱼鱼肉保活时间的SIMCA 判别的有效性(n=5)Table 3 Validity of SIMCA discrimination of pearl gentian grouper(n=5)
2.8 肌糖原定量模型分析
为了得到准确可靠的分析结果,对光谱数据进行预处理是十分必要的。为校正光谱数据,建立更简单、更稳健的回归模型,常采用Savitzky-Golay 平滑(SG)、归一化(Normalization)、多元散射校正(Multiplicative scatter correction,MSC)、基线校正(Baseline correction,BC)、均值中心化(Mean centering)等预处理方法对原始光谱图进行处理[31-32]。数学预处理可以减少干扰,改善待分析化合物的化学信号[33]。图7 为不同预处理的红外谱图,可以看出MSC、Mean Centering 和SNV 在简化谱的复杂性和增加模型预测方面效果很好。表4 为以不同预处理方式对原始光谱进行预处理后,构建PLS 糖原定量模型所得评价结果。经Mean centering 预处理的模型的RMSEP 值最小(0.24),Rp2值最大(0.89),说明该模型的准确度最高,模型的预测能力最好。图8 为石斑鱼近红外光谱经Mean Centering 处理后,肌糖原的真实值和预测值的相关关系图。相关性方程y=0.9522x+0.0523,相关系数R2为0.9408,表明其具有较好的预测能力和定标关系。

图7 不同预处理的红外光谱图Fig.7 Near infrared spectra with different pretreatments
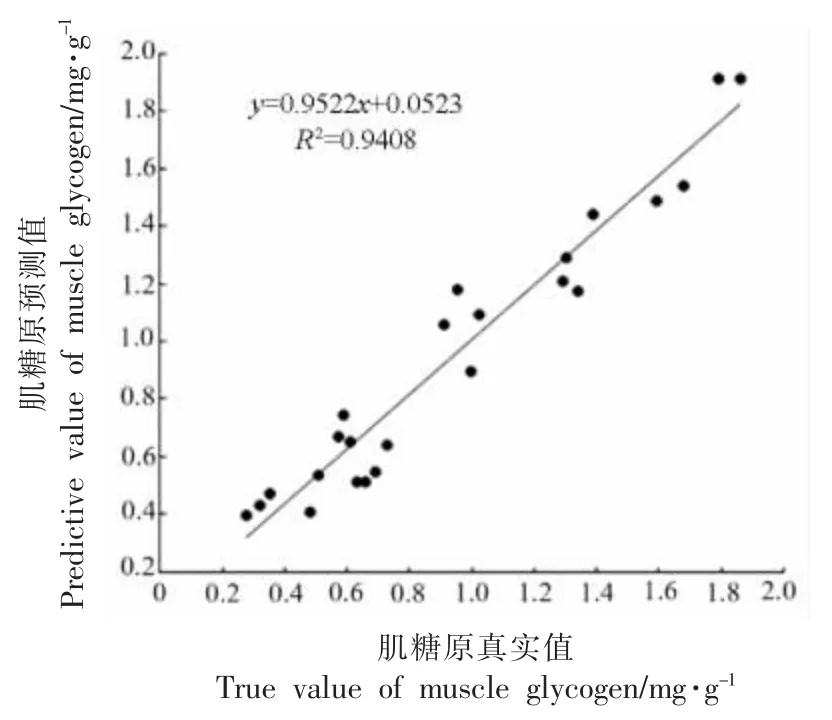
图8 珍珠龙胆石斑鱼糖原含量真实值与预测值关系图Fig.8 The relationship between the true value and the predicted value of glycogen content in pearl gentian grouper

表4 不同光谱预处理方法建立的珍珠龙胆石斑鱼糖原PLS 分析结果Table 4 PLS analysis results of pearl gentian grouper glycogen established by different spectral pretreatment methods
2.9 肌糖原定量模型的外部验证
利用验证集中的样品光谱代入建立的模型中,得到一系列预测值。将预测值和实测值进行比较,计算预测值与实际值的相对偏差,结果见表5。鱼肉肌糖原模型测定值和真实值比较接近,预测值与实际值的相对偏差(Relative deviation,RD)在0.01~0.15 之间,这表明所构建的模型具有较好的预测能力,能较为准确地预测糖原含量,可用于保活后石斑鱼鱼肉样品糖原含量的快速检测。

表5 珍珠龙胆石斑鱼肌糖原含量模型外部验证结果Table 5 External verification results of pearl gentian grouper glycogen content model
3 结论
对不同保活时间的石斑鱼鱼肉肌肉品质的变化情况进行分析,随着保活时间的延长,石斑鱼鱼肉的硬度和黏聚性显著降低,pH 有所下降,离心损失率和蒸煮损失率有不同程度的增大。这表明在无水后,鱼肉的品质受到一定影响。低场核磁共振结果显示鱼肉中不易流动水含量下降,自由水含量增加,说明保活过程中不易流动水向自由水方向转化,水分的流动性增强。
通过近红外检测技术结合化学计量学方法对不同保活时间的鱼肉的红外光谱进行分析,PCA和SIMCA 结合能够实现对不同保活时间鱼肉的判别分析,正确判别率达93.3%。通过Mean centering 预处理后建立的PLS 模型能够用于保活后鱼肉肌糖原的快速检测。
