磷酸盐与生物素最适浓度配比对谷氨酸发酵影响的研究
2023-08-17王锐麒王硕徐庆阳
王锐麒 王硕 徐庆阳
摘要:在L-谷氨酸發酵中,磷酸盐和生物素的添加量直接影响着谷氨酸棒状杆菌的菌体生长和菌体转型,生物素和磷酸盐的含量过多或过少都会直接影响L-谷氨酸的产量,为缓解这一问题,提出了调配磷酸盐与生物素的最适浓度配比(PVH)的策略控制发酵。为了确定发酵过程中生物素和磷酸盐的准确含量,利用单因素实验对磷酸盐与生物素的浓度配比进行调整,以找出最有利于菌体快速生长和细胞迅速转型的实验组。该实验设计生物素浓度梯度为4,10,14 μg/L,磷酸盐浓度梯度为3,5 g/L,通过实验发现,当磷酸盐与生物素浓度配比为5∶14时,菌体量大,细胞转型快,产酸多,糖酸转化率高,在此条件下,最大OD600 nm达到82,较其他组分别提高了24%、47%、50%、65%,最终的菌体量为74,较其他组分别提高了29.7%、48.6%、54%、72%,L-谷氨酸的产量为86 g/L,相较于其他组分别提高了30%、45.3%、54.6%、80%。同时,在最适PVH条件下常规发酵L-谷氨酸的实验中可以看出,其整体发酵水平高于其他非最适PVH组,该常规发酵实验中,L-谷氨酸产量高达178 g/L,转化率达到77%,对于谷氨酸发酵具有借鉴意义。
关键词:L-谷氨酸;生物素;磷酸盐;糖酸转化率;磷酸盐与生物素浓度配比;常规发酵
中图分类号:TS201.24 文献标志码:A 文章编号:1000-9973(2023)08-0039-06
Study on the Effect of Optimum Concentration Ratio of Phosphate to Biotin on Glutamic Acid Fermentation
WANG Rui-qi1, WANG Shuo1, XU Qing-yang1,2,3*
(1.College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China;
2.Tianjin Engineering Laboratory of Efficient and Green Amino Acid Manufacturing,
Tianjin 300457, China; 3.National and Local United Engineering Laboratory of
Metabolic Control Fermentation Technology, Tianjin 300457, China)
Abstract: In the fermentation of L-glutamic acid, the addition amount of phosphate and biotin directly affects the bacterium growth and transformation of Corynebacterium glutamicum. Too much or too little biotin and phosphate will directly affect the yield of L-glutamic acid. In order to alleviate this problem, the optimal concentration ratio of phosphate to biotin (PVH) strategy is put forward to control the fermentation. In order to determine the accurate content of biotin and phosphate in the fermentation process, the concentration ratio of phosphate to biotin is adjusted by single factor experiment, so as to find out the experimental group which is most beneficial to the rapid growth of bacteria and the rapid transformation of cells. In this experiment, the concentration gradient of biotin is 4, 10, 14 μg/L, and the concentration gradient of phosphate is 3, 5 g/L. Through the experiment, it is found that when the concentration ratio of phosphate to biotin is 5∶14, the bacterial volume is large, cell transformation is fast, acid production is high, and sugar-acid conversion rate is high. Under such conditions, the maximum OD600 nm reaches 82, which is 24%, 47%, 50%, 65% higher than that of the other groups respectively. The final bacterial volume is 74, which is 29.7%, 48.6%, 54%, 72% higher than that of the other groups respectively. The L-glutamate yield is 86 g/L, which is 30%, 45.3%, 54.6%, 80% higher than that of the other groups respectively. At the same time, in the experiment of conventional fermentation of L-glutamic acid under optimal PVH conditions, it can be seen that the overall fermentation level is higher than that of other non-optimal PVH groups. In this conventional fermentation experiment, the yield of L-glutamic acid is as high as 178 g/L and the conversion rate is as high as 77%, which has reference significance for glutamic acid fermentation.
Key words: L-glutamic acid; biotin; phosphate; sugar-acid conversion rate; phosphate to biotin concentration ratio; conventional fermentation
收稿日期:2023-02-27
基金项目:内蒙古自治区科技计划项目(2021GG0299);呼伦贝尔市“科技兴市”重点专项(2021hzzx07)
作者简介:王锐麒(1998-),男,硕士研究生,研究方向:代谢工程与发酵过程控制。
通信作者:徐庆阳(1980-),男,研究员,博士生导师,博士,研究方向:代谢工程与发酵过程控制。
L-谷氨酸在动物大脑及谷类蛋白质中含量丰富,对生物体的代谢进程有着非常重大的影响[1]。这使得L-谷氨酸普遍运用于食品、医药等各大行业,其为全球范围内规模最庞大的氨基酸产品,使得其有非常光明的发展潜力[2-3]。但是,我国的发酵水平相较于国外,发酵产酸率较低,糖酸转化率在60%左右,其主要是因为我国谷氨酸发酵行业中,不同批次玉米浆和糖蜜所提供的生物素含量不一,从而造成发酵过程中生物素含量難以控制,同时发酵过程中磷酸盐含量影响菌体量的大小,只要发酵过程中生物素和磷酸盐浓度搭配不一,就会导致菌体活力不足,产酸能力弱,因此,找出最适磷酸盐与生物素浓度配比成为提高谷氨酸产量的关键因素[4-5]。
我国谷氨酸生产规模虽然占比大,生产技术比较先进,但还存在一些问题:国内现有谷氨酸的生产菌株主要为温度敏感型突变株。温度敏感型突变株发酵培养基中玉米浆用量高,造成发酵过程中容易起泡,在发酵中后期容易染菌,提取过程中谷氨酸发酵液浓缩比低,产物收率低,初次结晶产品颜色深,含杂质高;且种子培养周期长,工序多,造成染菌风险大。因此,本文选用生物素亚适量型[6]发酵谷氨酸工艺,该工艺玉米浆用量低,周期短,不容易出现染菌,产酸方面较稳定,有着较优秀的提取收率,产品品质好。
生物素可充当羧化、脱羧等多个场景的辅助因子,参与到机体代谢进程中[7],磷酸盐是极为关键的缓冲剂,对能量的储存与传递等有着重大的影响[8]。据朱蕾蕾等研究发现,在发酵过程中,生物素和磷酸盐浓度过低或过高都会影响菌体生长和产酸量,当生物素过多时,不利于脂肪酸合成,进而影响磷脂和细胞膜的合成[9],谷氨酸的产量降低;当磷酸盐浓度过低时,菌体生长缓慢,耗糖慢,产酸低。
针对上述问题,此次研究中采用GDK-9为供试菌,通过单因素实验,控制生物素和磷酸盐的添加量,找到最适PVH(磷酸盐与生物素的浓度配比),在最佳PVH的条件下,研究该最适PVH对常规谷氨酸发酵的影响。
1 材料与方法
1.1 菌种
L-谷氨酸生产菌:生物素亚适量型菌株黄色短杆菌GDK-9,本校相关科室负责存储。
1.2 培养基
1.2.1 种子培养基
葡萄糖30 g/L;VH 3 μg/L;VB1 0.2 mg/L;FeSO4·5H2O 10 mg/L;(NH4)2SO4 1 g/L;MnSO4·H2O 10 mg/L;MgSO4·7H2O 1 g/L;K2HPO4·3H2O 3 g/L;精氨酸 0.3 g/L;赖氨酸0.3 g/L;苏氨酸0.3 g/L;丙氨酸0.3 g/L;蛋氨酸0.3 g/L;苯丙氨酸0.3 g/L;氯化胆碱0.2 g/L;卡那霉素10 mg/L。
1.2.2 发酵培养基
葡萄糖40 g/L;(NH4)2SO4 6 g/L;VB1、VB2、VB3、VB5、VB12分别为2 mg/L;FeSO4·5H2O 10 mg/L;MnSO4·H2O 15 mg/L;MgSO4·7H2O 1.5 g/L;K2HPO4·3H2O(2.4,4.4 g/L)做梯度;生物素(1,7,11 μg/L)做梯度;氨基酸包 20 g/L;氯化胆碱 0.4 g/L;甜菜碱 0.2 g/L;卡那霉素 10 mg/L。
1.3 主要仪器
LDZH-100KBS全自动高压蒸汽灭菌器 天津博鑫生物科技有限公司;Biotech-5JG 5 L自动控制发酵罐 上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪 济南延和生物科技有限公司;UV1800紫外可见分光光度计 上海菁华科技仪器有限公司。
1.4 培养方法
1.4.1 菌种活化
从-80 ℃冰箱中取出保菌管,于超净台上,用接种环在火焰附近,从保菌管中取3环于一代试管斜面上,在32 ℃培养箱中持续培养12 h。
1.4.2 一级种子培养
待菌种活化后,于超净台上运用接种环,在试管斜面上取2~3环菌种,将其接入至3个1 L圆底烧瓶中,于220 r/min、34 ℃的摇床中培养10~12 h。
1.4.3 二级种子培养
将培育完成的种子放到火焰旁边,经过5 L罐的进样口倾倒至罐内,后续将pH控制在7.0左右,实际温度参数控制在34 ℃,溶氧数据保持在50%~60%。
1.4.4 发酵培养
当OD600 nm提升至大约20的情况下,依据20%的接种量接入至发酵培养基的5 L发酵罐中。同时加入100 mL底糖,流加氨水,使pH维持在7.0~7.4弱碱环境下,依靠调整转速与通风,从而让初期阶段的罐压为0.08 MPa,溶氧数据大约为50%~60%,通风速率为4~6 L/min,初始发酵温度为34 ℃,发酵周期约为32 h。
1.5 实验方法
1.5.1 磷酸盐与生物素混合添加控制实验
设计5组添加策略:
A组采取的具体设计方案:在培养基内部增加实际剂量为3 g/L的磷酸二氢钾,4 μg/L的生物素;
B组采取的具体设计方案:在培养基内部增加实际剂量为3 g/L的磷酸二氢钾,10 μg/L的生物素;
C组采取的具体设计方案:在培养基內部增加实际剂量为3 g/L的磷酸二氢钾,14 μg/L的生物素;
D组采取的具体设计方案:在培养基内部增加实际剂量为5 g/L的磷酸二氢钾,10 μg/L的生物素;
E组采取的具体设计方案:在培养基内部增加实际剂量为5 g/L的磷酸二氢钾,14 μg/L的生物素。
1.5.2 常规谷氨酸发酵中验证最适磷酸盐与生物素浓度配比实验
根据1.5.1各实验组中的数据,用常规发酵原材料玉米浆代替生物素,验证最适添加组能否使菌体量最大、细胞转型快、糖酸转化率高。
1.6 发酵检测方法
1.6.1 发酵过程中pH测定
以罐内pH电极进行测试,样液运用精密pH试纸进行精准测试。
1.6.2 发酵过程中残糖测定
发酵起始每2 h取样测试,将样品倒入1.5 mL EP管中,采用TG16-W离心机持续处理2 min,取对应的上清液,对此进行稀释百倍的处理,后续运用SBA-40E生物传感分析仪测试具体的残糖参数。
1.6.3 发酵过程中菌体量测定
菌体量测定可用吸光度OD600 nm表示,每2 h取样,根据发酵周期稀释相应倍数,采用UV1800紫外可见分光光度计测定OD600 nm。菌体量=OD600 nm×稀释倍数。
1.6.4 发酵过程中谷氨酸测定
发酵起始,每2 h取样,用离心机离心2 min,取上清液,稀释100,200,300等相应倍数,再用SBA-40E生物传感分析仪测定谷氨酸产量。
2 结果与讨论
2.1 不同磷酸盐与生物素浓度配比对发酵过程的影响分析
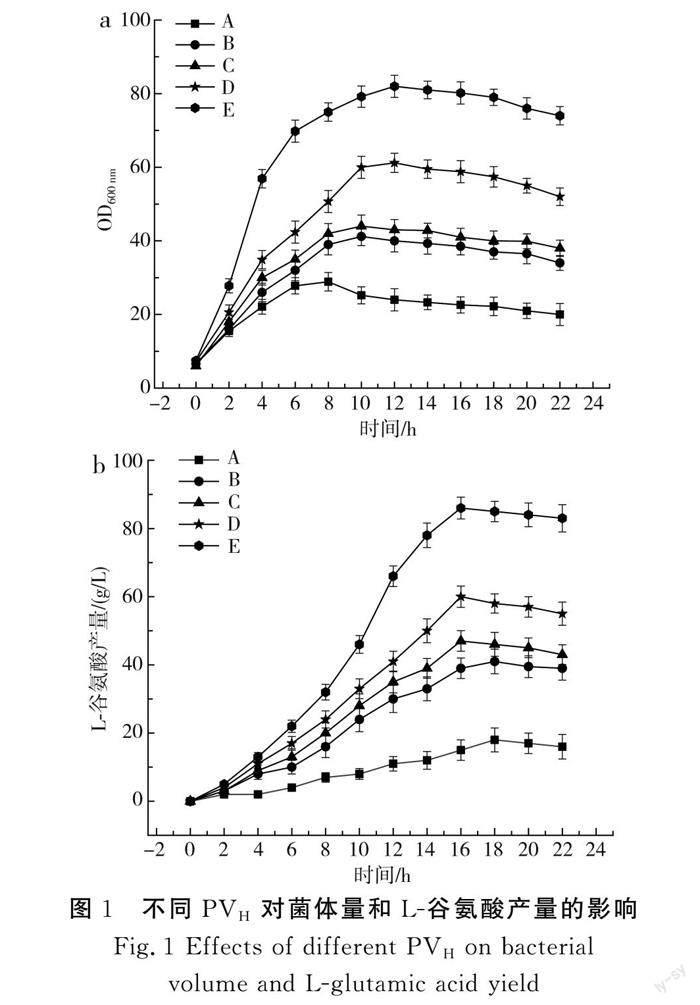
在5 L发酵罐中进行不同磷酸盐与生物素浓度配比的分批发酵,在发酵过程中每2 h测定菌体量(OD600 nm)、L-谷氨酸的产量和最终的糖酸转化率,并绘制发酵过程的菌体量曲线、产酸曲线和转化率图表,按照不同浓度配比设计出单因素实验组,磷酸盐与生物素浓度配比分别为A(3∶4)、B(3∶10)、C(3∶14)、D(5∶10)、E(5∶14),从而确定最佳混合配比,通过测定发酵过程中L-谷氨酸产量、菌体量以及糖酸转化率,明确不同配比对菌体生长与产酸的影响,结果见图1。
由图1中a可知,菌体量在整个发酵过程中首先处于急剧增加趋势,随后进入平稳期,最后走向衰退期[10],不同实验组的菌体量在4 h内均呈现不同幅度的上升,其中E组菌体量上升幅度最快,最高组菌体量OD600 nm为82,随着生物素和磷酸盐浓度的调整,A、B、C、D组最高菌体量OD600 nm分别为25.2,41.2,43,61.2;较E组分别降低了69.2%、49.7%、47.5%、25.3%。E组终菌体量为74,较A、B、C、D组分别提高了72.9%、54%、48.6%、29.7%。由图1中b可知,发酵0~4 h的时间段,发酵液中有L-谷氨酸产出且不同实验组呈现不同速度的增长幅度,由此说明此时间段菌体开始转型,4 h后谷氨酸开始大量积累,到22 h时产酸均达到最大,E组最高产酸量达到86 g/L。A、B、C、D组L-谷氨酸产量分别为18,41,47,60 g/L,较E组分别降低了79%、52.3%、45.3%、30%。结合图1中a和b可知,菌体量与L-谷氨酸产量呈正相关,菌体量越大,L-谷氨酸产量越大。由图1中a可知,A组磷酸盐浓度为3 g/L,生物素浓度为4 μg/L,此时磷酸盐浓度过低,导致谷氨酸棒状杆菌生长受到抑制,菌体量增长缓慢[11];生物素浓度过低,不利于脂肪酸合成,进而影响磷脂合成,导致细胞转型慢[12],造成L-谷氨酸产量相对于其他组低。在相同磷酸盐浓度的条件下,A、B、C组整体菌体量增幅明显低于高磷酸盐组,且最大菌体量也低于高磷酸盐组,由此说明磷酸盐浓度过低,菌体生长受到抑制[13]。同组内,由于生物素浓度依次提高,菌体量增幅C组>B组>A组,相邻两组最大菌体量下降幅度依次为3.5和16,由此说明,磷酸盐与生物素的浓度配比影响着菌体量的生长。另外,由图1中a可知,A、B、C组整个发酵过程延滞期明显长于D、E组,A组延滞期最长,最大菌体量最低。由图1中b可知,0~4 h内,各组均有产酸,且每组增幅差距不是特别大,这是因为发酵起始时,磷酸盐和生物素浓度对发酵产酸的影响不明显,4 h后,细胞开始大量转型,D、E组最高产酸量分别为60,86 g/L,产酸水平高于A、B、C组,由于磷盐浓度较高于其他组,细胞呼吸和胞内ATP水平得以控制,糖代谢水平高,所以整体产酸水平高[14]。同磷酸盐浓度水平的各组中,生物素浓度提高,产酸量也随之提高。A、B、C组最高产酸量分别为18,41,47 g/L,相邻两组产酸量升高幅度依次为23和5。这是因为生物素浓度的高低决定细胞转型的水平。细胞转型快,转型数量多,对应的产酸量高。当生物素浓度过量时,几乎没有产酸型细胞,细胞形态和种子较接近,几乎未分泌谷氨酸,有着仅长菌、耗糖、不产酸的现象[15]。综合结果来看,在发酵时应当选择E组磷酸盐/生物素的最适浓度配比。
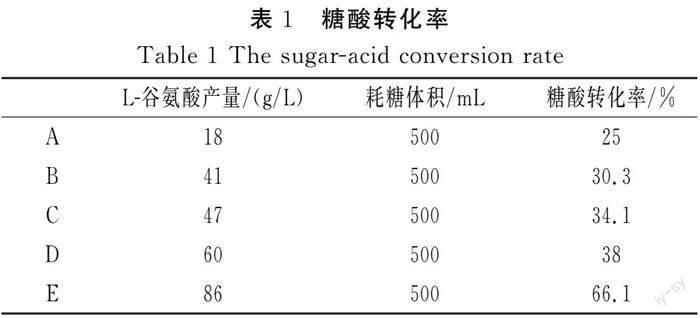
由表1可知,在低磷酸盐浓度组中,C组谷氨酸产量最大,加入相同体积80%葡萄糖溶液后,发现A组转化率最低,由于该组生物素含量低,细胞转型慢,转型细胞数量少,产酸率低,当磷酸盐不足时,发酵后期发酵液中磷酸盐几乎耗尽,发酵相对无力,菌体早衰,因此糖酸转化率低,仅为25%。而高磷酸盐组中,E组生物素和磷酸盐足够使菌体快速转型,菌体量大量上升,因此耗糖大,转化率高,约为66.1%。高磷酸盐、高生物素组糖酸转化率明显大于低磷酸盐、低生物素组,且转化率接近正常水平[16];因此,E组相较于其他组,磷酸盐与生物素的比值最适宜。
通过上述结果分析,可以看出生物素与磷酸盐的浓度对L-谷氨酸发酵产酸具有十分重要的影响:菌体生长需要磷酸盐,在整个谷氨酸发酵过程中,磷源的量与菌体形变及生长速度有很大的关系。作为EMP途径的关键元素,磷和ATP的产生有密切联系[17-18];细胞中ATP的周转以及能量水平会极大影响EMP途径的葡萄糖耗费。因此,在培养基中必须添加一定量的磷酸盐才能保证菌体的正常生长。磷酸盐在5 g/L时菌体长得最快,菌体量相对于3 g/L的磷酸盐长得多。生物素是控制L-谷氨酸积累的重要因素。生物素是催化乙酰CoA羧化酶的重要辅酶[19],进而加入到脂肪酸的合成进程中,因此干涉磷脂的合成、细胞膜的正式诞生,为诞生有益于谷氨酸排放的细胞膜[20],期望磷脂合成不足,所以要求合理管控生物素亚适量的状态,改组实验中生物素最适浓度为14 μg/L左右。
2.2 最适生物素与磷酸盐的比值对常规发酵的影响
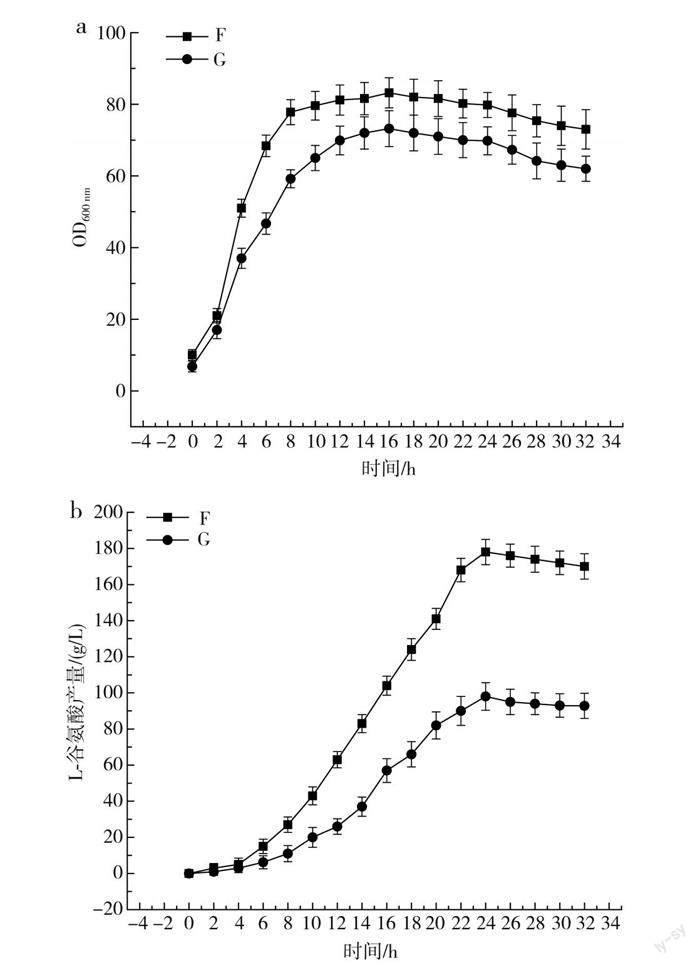
通过上述实验的探究分析可得出,当磷酸盐与生物素浓度配比在5∶14的条件下,发酵过程中菌体量、L-谷氨酸产量、糖酸转化率均比其他组高。但相较于传统发酵培养基,实验组发酵培养基成分简单,取消了传统有机氮源豆饼水解液和玉米浆等工业原料,而这些工业原料在发酵过程中除了提供生物素和氮源外,还有很多供菌体生长的营养物质,因此,导致实验组即使是在最适PVH条件下,由于整体培养基营养不够,菌体量不能进一步生长,进而导致L-谷氨酸的产量不够高,达不到正常水平。所以,常规发酵实验中,发酵培养基中添加豆饼水解液和同一批次且生物素含量确定的玉米浆等有机原料,以提高菌体量,增大产酸量,结果见图2。
图2中F组和G组磷酸盐与生物素浓度配比分别为5∶14、3∶14,由图2中a可知,在相同生物素的条件下,随着磷酸盐浓度的增加,菌体量F组>G组,由图2中c可知,菌体量生长速度在4 h时出现最大值,表明在同生物素、不同磷酸盐的条件下,高磷酸盐的菌体量长得更快,衰退时间更晚,在F组中,其最大菌体量为86,终菌体量为73,G组最大菌体量为73.2,终菌体量为62,相较于G组,F组菌体量提高了14.8%,终菌体量提高了15%,终菌体量升高幅度为11,最大菌体量升高幅度为12.8,两组曲线趋势大致相同,起始都以较高的生长速率生长,4 h达到最高比生长速率,菌体量达到峰值,伴随着实际发酵时间的不断增长,比生长速率有一定程度的降低,数值接近0,此时,菌体增幅不大,开始积累L-谷氨酸,18 h以后,該数据是负值的情况下,意味着该阶段的菌体量有所降低,F组比G组比生长速率数值绝对值小,因此菌体量比G组下降缓慢,所以可以分析出高磷酸盐、高生物素菌体量更大,生长速率更快。
由图2中b可知,F组和G组的曲线趋势大致一致,2 h细胞转型,4 h后开始大量产酸,F组最高产量为178 g/L,G组最高产量为98 g/L,相较于G组,F组L-谷氨酸产量提高了44.9%,升高幅度为80;F组L-谷氨酸终产量为170 g/L,G组L-谷氨酸终产量为92.8 g/L,相较于G组,F组L-谷氨酸终产量提高了45.4%,升高幅度为77.2。由图2中d可知,单位时间内,谷氨酸产量越大,合成速率越高,F组的L-谷氨酸合成速率比G组整体要高,说明F组在发酵过程中更早进入产酸期,更早转型,0~16 h合成速率快,因为发酵前期生物素和磷酸盐比例合适,加上培养基成分丰富,营养高,菌体量迅速升高,细胞快速度过长菌型,进而更早进入产酸期,代谢方向会有所转变,依靠管控脂肪酸生物合成,进一步调整细胞的渗透性,导致大量谷氨酸排入发酵液中,高磷酸盐、高生物素菌体量迅速提升的同时,糖耗加快,进而提高了糖酸转化率。
由表2可知,F组的糖酸转化率为77%,远大于G组,当生物素亚适量的情况下,使得菌体量进入到最优状况,菌体转型快,有着优秀的产酸表现,最终的糖酸转化率表现较乐观,菌体生物素与磷酸盐不匹配时,菌体生长缓慢,竞争生物素能力不足,进而使得菌体无法转型或者转型慢,从而影响菌体产酸和糖酸转化率。
3 结论
本研究在对磷酸盐和生物素浓度配比进行调配时发现,当磷酸盐浓度为3 g/L时,菌体量整体较低,最大菌体量较高磷酸盐组降低了约47%;当生物素浓度为10 μg/L及以下时,细胞转型慢,L-谷氨酸产量低,其最大产量较高,生物素浓度组降低了约31.6%;当磷酸盐浓度为5 g/L、生物素浓度为14 μg/L时,对于菌体生长及生产性能的提高最大。在此条件下,最大OD600 nm达到了86,较对照组提高了14.8%,最终的菌体量为73,较对照组提高了15%,升高幅度为11,最终的L-谷氨酸产量为178 g/L,提高了44.9%,糖酸转化率由40%提高至77%,因此,该磷酸盐与生物素最适浓度配比在传统谷氨酸发酵工业中,对提升菌体活力等有巨大价值,对于高效产酸等也有一定的参考价值。
参考文献:
[1]刘景阳,余子辰,徐庆阳.NH4+双阶段发酵控制谷氨酸工艺研究[J].中国调味品,2022,47(9):7-14.
[2]汤超.酿酒酵母高产谷氨酸补料发酵研究[D].武汉:湖北工业大学,2019.
[3]KHAN N S, MISHRA I M, SINGH R P, et al. Modeling the growth of Corynebacterium glutamicum under product inhibition in L-glutamic acid fermentation[J].Biochemical Engineering Journal,2005,25(2):173-178.
[4]臧传刚,梁恒宇,王宏龄,等.不同磷酸氢二钠浓度对谷氨酸发酵的影响[J].食品研究与开发,2015,36(14):125-130.
[5]刘树涛,王文风.生物素与谷氨酸发酵[J].发酵科技通讯,2010,39(2):36-39.
[6]申宏伟.生物素超亚适量谷氨酸发酵高产酸菌种选育及工艺优化[D].周口:河南莲花味精股份有限公司,2012.
[7]黄瑶,廖兰,廖春燕,等.不同来源生物素对谷氨酸短杆菌的影响[J].广西工学院学报(自然科学版),2010,21(3):80-83.
[8]CHEN X C, SONG H, FANG T, et al.Enhanced cyclic adenosine monophosphate production by Arthrobacter A302 through rational redistribution of metabolic flux[J].Bioresource Technology,2009,101(9):3159-3163.
[9]BECKER J, WITTMANN C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J].Current Opinion in Biotechnology,2012,23(5):718-726.
[10]张文惠,安小平,范航,等.一株粪肠球菌噬菌体的分离及其生物学特性研究[J].生物技术通讯,2013,24(4):484-487.
[11]田孝俊,张路军,任伟,等.三种磷酸盐在谷氨酸发酵中的应用分析[J].发酵科技通讯,2005(1):15-16.
[12]高君,赵二红,张国庆,等.谷氨酸多级混合转型发酵技术研究与应用:中国,LH20070203[P].2009-07-07.
[13]LAMPILA L E.Applications and functions of food-grade phosphates[J].Annals of the New York Academy of Sciences,2013,1301(1):37-44.
[14]劉翠翠.谷氨酸棒杆菌合成微生物油脂的代谢途径平衡[D].上海:华东理工大学,2020.
[15]杨阳,张苗苗,高越,等.谷氨酸棒状杆菌高效发酵谷氨酸的关键分子机理研究进展[J].食品工业科技,2019,40(5):311-315,321.
[16]WEN J B, XIAO Y Q, LIU T, et al. Rich biotin content in lignocellulose biomass plays the key role in determining cellulosic glutamic acid accumulation by Corynebacterium glutamicum[J].Biotechnology for Biofuels,2018,11(1):132.
[17]ALEKSEENKO V, ALEKSEENKO A.The abundances of chemical elements in urban soils[J]. Journal of Geochemical Exploration,2014,147:245-249.
[18]STEPHEN R C, ELENA M B.Reconsideration of the planetary boundary for phosphorus[J].Environmental Research Letters,2011,6(1):14009.
[19]杨帆.不同外源添加条件下白灵菇细胞质中乙酰辅酶A的合成途经和功能研究[D].沈阳:沈阳农业大学,2020.
[20]WENDISCH V F, SPIES M, REINSCHEID D J, et al. Regulation of acetate metabolism in Corynebacterium glutamicum: transcriptional control of the isocitrate lyase and malate synthase genes[J].Archives of Microbiology,1997,168(4):262-269.
