响应面法优化泡盛曲霉产抗肿瘤活性物质发酵工艺
2023-08-17许丽,刘欣
许 丽,刘 欣
(江苏省肿瘤医院 江苏省肿瘤防治研究所 南京医科大学附属肿瘤医院,江苏 南京 210009)
喜树(CamptothecaacuminateDecne.)是我国特有的药用植物,系珙桐科(Nyssaceae)喜树属(CamptothecaDecne.)植物[1]。自1966年Wall等从喜树茎中分离提取出具有抗肿瘤活性的喜树碱(camptothecin,CPT)[2]以来,至今已从喜树中分离得到喜树碱类物质27种左右,其中喜树碱和10-羟基喜树碱(10-hydroxyamptothecin,HCPT)的抗肿瘤活性较强,尤其是HCPT[2-3]。研究[4]表明,喜树碱是迄今发现的唯一抑制拓扑异构酶Ⅰ(topoisomerase Ⅰ,Topo Ⅰ)的天然植物活性成分,阻碍染色体复制进而造成细胞凋亡。喜树碱是一种广谱抗癌药物,广泛用于卵巢癌、宫颈癌、结肠癌、慢性粒细胞性白血病等的治疗,被称为“第三大植物抗癌药”[5]。目前,喜树碱、HCPT及其衍生物的合成方法主要包括化学合成[6]、组织培养[7]、分离提取[8]等。
为了保护药用植物,避免过度开采,从药用植物中分离筛选能合成与药用植物相同或相似次级代谢产物的内生菌逐渐成为研究热点[9-11]。陈毅坚等[12]从红豆杉枝条中分离出52株内生真菌,发现其中19株可发酵产紫杉醇;张玲琪等[13]从药用植物长春花中分离筛选出1株尖孢镰刀菌,发现该菌在适宜条件下可发酵产抗肿瘤活性物质长春新碱;李俊峰等[14]在铁皮石斛植株体内分离筛选出内生菌TG2,发现其次级代谢产物具有明显抗肿瘤作用,且抗肿瘤活性与次级代谢产物的量成正比;作者所在研究团队从喜树中分离筛选出1株HCPT高产内生真菌——泡盛曲霉CS24(AspergillusawamoriCS24),HCPT产量可达到94.6 mg·L-1。为进一步提高泡盛曲霉CS24发酵产HCPT的能力,作者在此对发酵培养基及发酵工艺进行优化,以期为规模化发酵生产抗肿瘤活性物质提供帮助。
1 实验
1.1 材料、试剂与仪器
泡盛曲霉CS24,从喜树(CamptothecaacuminateDecne.)果实中分离筛选,具有较强的发酵产HCPT能力及体外抗肿瘤活性,经形态学观察、显微镜检及ITS测序分析,鉴定其为泡盛曲霉(Aspergillusawamori),保存于江苏省肿瘤防治研究所;人胃癌细胞BGC-823,上海联迈生物工程有限公司;酵母浸膏、琼脂、蔗糖、可溶性淀粉、麦芽浸膏、胰蛋白胨,山东浩中化工科技有限公司;马铃薯,市售。
10-羟基喜树碱(HCPT)标准品,上海一基生物试剂有限公司;甲醇、乙腈,色谱纯,西亚化学科技(山东)有限公司;CCK-8试剂盒,上海炎熙生物科技有限公司;CaCl2、K2HPO4、NaCl、KH2PO4、KNO3、Na2HPO4、MgSO4·7H2O、葡萄糖,分析纯,无锡亚泰联合化工有限公司。
11-LC-20AT型高效液相色谱仪,日本岛津公司;HZ-124/85S型电子分析天平,广州璟骐仪器有限公司;UV-1600型紫外可见分光光度计,山东安耐自动化仪表有限公司;TGL27A型高速冷冻离心机,上海五相仪器仪表有限公司;XFH-30CA型高压蒸汽灭菌锅,绍兴景迈仪器设备有限公司;BBS-SDC型超净工作台,济南欧莱博科学仪器有限公司;HS系列-250(F)型恒温恒湿培养箱,青岛聚创环保集团有限公司;JSZZ10L型发酵罐,江苏中正生物工程设备有限公司。
1.2 培养基
PDA培养基:马铃薯200.0 g·L-1(去皮,切成1 cm3小块),葡萄糖20.0 g·L-1,琼脂 17.0 g·L-1,双蒸水1 000 mL,pH值自然,121 ℃灭菌20 min。
PDB培养基:马铃薯200.0 g·L-1(去皮,切成1 cm3小块),葡萄糖20.0 g·L-1,双蒸水1 000 mL,pH值自然,121 ℃灭菌20 min。
1.3 泡盛曲霉CS24发酵产HCPT的工艺条件优化
选择PDB培养基,以泡盛曲霉CS24为发酵菌种,在初始pH值为5.0、发酵温度为29 ℃、搅拌转速为380 r·min-1、通风量为0.6 vvm、发酵时间为6 d的条件下发酵培养。
以HCPT产量为考核指标,通过单因素实验分别考察初始pH值、发酵温度、搅拌转速、通风量、氮源、碳源、无机盐离子等对泡盛曲霉CS24发酵产HCPT的影响,每组实验做3个平行;在单因素实验的基础上,以HCPT产量为响应值,选取初始pH值、发酵温度、搅拌转速、通风量、花生饼粉含量、玉米浆干粉含量、蔗糖含量、糊精含量、麦芽糖含量、Mg2+含量等10个因素进行Plackett-Burman实验[15-17]、最陡爬坡实验[18]、Box-Behnken响应面实验,对泡盛曲霉CS24发酵产HCPT的工艺条件进行优化。
1.4 菌体生物量和HCPT产量的测定
泡盛曲霉CS24菌体生物量的测定:取泡盛曲霉CS24发酵液10 mL,于4 ℃、5 000 r·min-1离心15 min,弃上清液,得到泡盛曲霉CS24菌体,用电子分析天平称重,即为菌体生物量。
泡盛曲霉CS24发酵液中HCPT产量的测定:采用高效液相色谱法测定[19]。
1.5 数据处理
使用OriginPro 8.0软件对实验数据进行分析处理[20],使用Design-Expert Ⅴ13.0.5.0软件进行响应面实验设计和分析[21-24]。
2 结果与讨论
2.1 单因素实验结果
2.1.1 初始pH值对泡盛曲霉CS24发酵产HCPT的影响
其它条件保持不变,调节初始pH值发酵6 d,测定菌体生物量和HCPT产量,结果如图1所示。
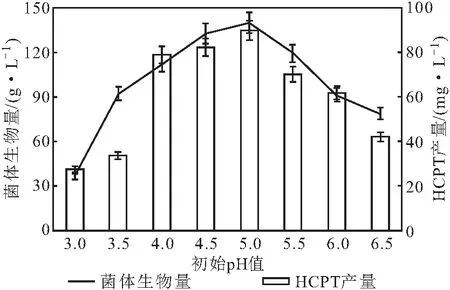
图1 初始pH值对泡盛曲霉CS24发酵产HCPT的影响Fig.1 Effect of initial pH value on production of HCPT by Aspergillus awamori CS24
由图1可知,随着初始pH值的增大,泡盛曲霉CS24菌体生物量和HCPT产量均先升高后降低;在初始pH值为5.0时,菌体生物量和HCPT产量均达到最高,分别为139.9 g·L-1和89.9 mg·L-1。因此,初始pH值选择5.0。
2.1.2 发酵温度对泡盛曲霉CS24发酵产HCPT的影响
将处于对数生长期成熟的泡盛曲霉CS24接种于发酵罐中,其它条件保持不变,调节发酵温度发酵6 d,测定菌体生物量和HCPT产量,结果如图2所示。
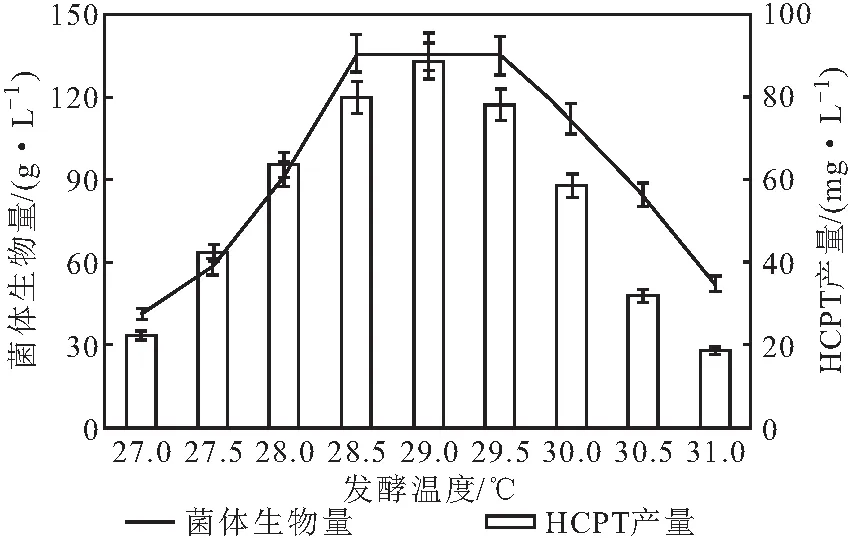
图2 发酵温度对泡盛曲霉CS24发酵产HCPT的影响Fig.2 Effect of fermentation temperature on production of HCPT by Aspergillus awamori CS24
由图2可知,随着发酵温度的升高,泡盛曲霉CS24菌体生物量和HCPT产量均先升高后降低;在发酵温度为28.5~29.5 ℃时,菌体生物量达到最高,为136.2 g·L-1;在发酵温度为29.0 ℃时,HCPT产量达到最高,为89.7 mg·L-1。因此,发酵温度选择29.0 ℃。
2.1.3 搅拌转速对泡盛曲霉CS24发酵产HCPT的影响
发酵过程开动搅拌有利于物质的传递以及增加溶氧。将处于对数生长期成熟的泡盛曲霉CS24接种于发酵罐中,其它条件保持不变,调节搅拌转速发酵6 d,测定菌体生物量和HCPT产量,结果如图3所示。

图3 搅拌转速对泡盛曲霉CS24发酵产HCPT的影响Fig.3 Effect of stirring speed on production of HCPT by Aspergillus awamori CS24
由图3可知,随着搅拌转速的加快,泡盛曲霉CS24菌体生物量和HCPT产量均缓慢升高而后迅速降低;在搅拌转速为380 r·min-1时,菌体生物量和HCPT产量均达到最高,分别为141.4 g·L-1和94.7 mg·L-1。这可能是因为,搅拌转速过快形成的较大剪切力损伤了泡盛曲霉CS24的菌丝,抑制了菌体生长和产物合成。因此,搅拌转速选择380 r·min-1。
2.1.4 通风量对泡盛曲霉CS24发酵产HCPT的影响
发酵过程中向发酵罐中通入无菌空气,主要是为发酵菌种提供氧气,氧气含量是发酵过程中重要的限制因素;泡盛曲霉CS24是好氧菌,发酵过程需要一定量的氧气。将处于对数生长期成熟的泡盛曲霉CS24接种于发酵罐中,其它条件保持不变,调节通风量发酵6 d,测定菌体生物量和HCPT产量,结果如图4所示。

图4 通风量对泡盛曲霉CS24发酵产HCPT的影响Fig.4 Effect of ventilation rate on production of HCPT by Aspergillus awamori CS24
由图4可知,随着通风量的增加,泡盛曲霉CS24菌体生物量和HCPT产量均先升高后降低;在通风量为0.6 vvm时,菌体生物量和HCPT产量均达到最高,
分别为146.8 g·L-1和92.6 mg·L-1。因此,通风量选择0.6 vvm。
2.1.5 氮源对泡盛曲霉CS24发酵产HCPT的影响
分别以黄豆饼粉、花生饼粉、棉籽饼粉、玉米浆干粉、酵母浸粉、酪蛋白、尿素、硫酸铵和硝酸钾作为培养基氮源,含量为10 g·L-1,发酵6 d,测定菌体生物量和HCPT产量,结果如图5所示。

图5 氮源对泡盛曲霉CS24发酵产HCPT的影响Fig.5 Effect of nitrogen source on production of HCPT byAspergillus awamori CS24
由图5可知,氮源对泡盛曲霉CS24菌体生物量和HCPT产量影响显著。以花生饼粉、玉米浆干粉、酪蛋白作为氮源时,菌体生物量和HCPT产量均较高,分别为117.6 g·L-1、137.8 g·L-1、123.6 g·L-1和73.8 mg·L-1、79.4 mg·L-1、69.8 mg·L-1;以玉米浆干粉作为氮源时,菌体生物量和HCPT产量均达到最高。综合考虑原材料成本,选择花生饼粉和玉米浆干粉作为培养基氮源。
2.1.6 碳源对泡盛曲霉CS24发酵产HCPT的影响
分别以可溶性淀粉、玉米粉、燕麦粉、糊精、麦芽糖、蔗糖、乳糖、葡萄糖和山梨醇作为培养基碳源,含量为30 g·L-1,发酵6 d,测定菌体生物量和HCPT产量,结果如图6所示。

图6 碳源对泡盛曲霉CS24发酵产HCPT的影响Fig.6 Effect of carbon source on production of HCPT by Aspergillus awamori CS24
由图6可知,碳源对泡盛曲霉CS24菌体生物量和HCPT产量影响较大。以麦芽糖、蔗糖、葡萄糖作为碳源时,菌体生物量较高,分别为134.6 g·L-1、143.7 g·L-1、139.7 g·L-1;以糊精、麦芽糖、蔗糖作为碳源时,HCPT产量较高,分别为83.6 mg·L-1、88.9 mg·L-1、94.3 mg·L-1;以蔗糖作为碳源时,菌体生物量和HCPT产量均达到最高。综合考虑原材料成本,选择蔗糖、糊精和麦芽糖作为培养基碳源。
2.1.7 无机盐离子对泡盛曲霉CS24发酵产HCPT的影响
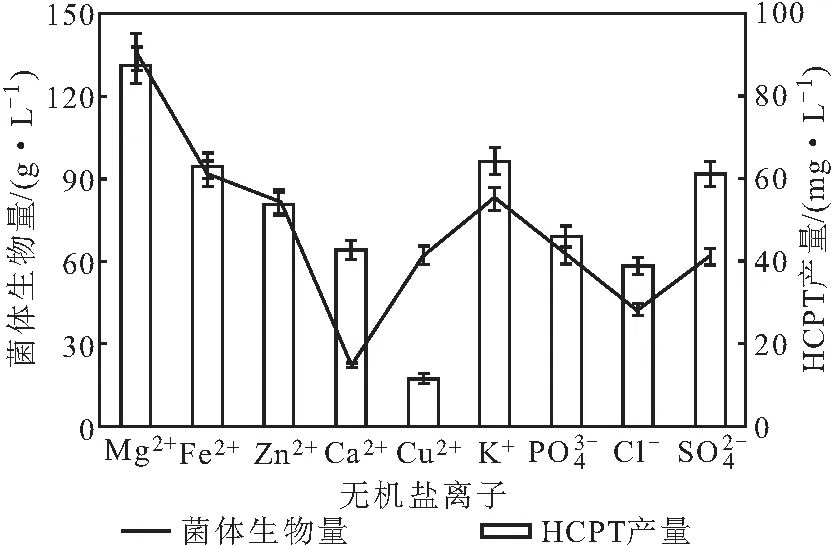
图7 无机盐离子对泡盛曲霉CS24发酵产HCPT的影响Fig.7 Effect of inorganic salt ion on production of HCPT by Aspergillus awamori CS24
由图7可知,无机盐离子对泡盛曲霉CS24菌体生物量和HCPT产量影响显著。Ca2+严重抑制了泡盛曲霉CS24的生长繁殖,菌体生物量仅22.6 g·L-1;Cu2+严重抑制了HCPT的合成,HCPT产量仅12.4 mg·L-1;Mg2+对泡盛曲霉CS24的生长繁殖和HCPT合成均具有明显的促进作用,菌体生物量和HCPT产量分别达到了136.6 g·L-1和87.9 mg·L-1。因此,选择在培养基中添加Mg2+进行后续实验。
2.2 Plackett-Burman实验结果
Plackett-Burman实验的因素与水平见表1,设计与结果见表2,方差分析见表3。
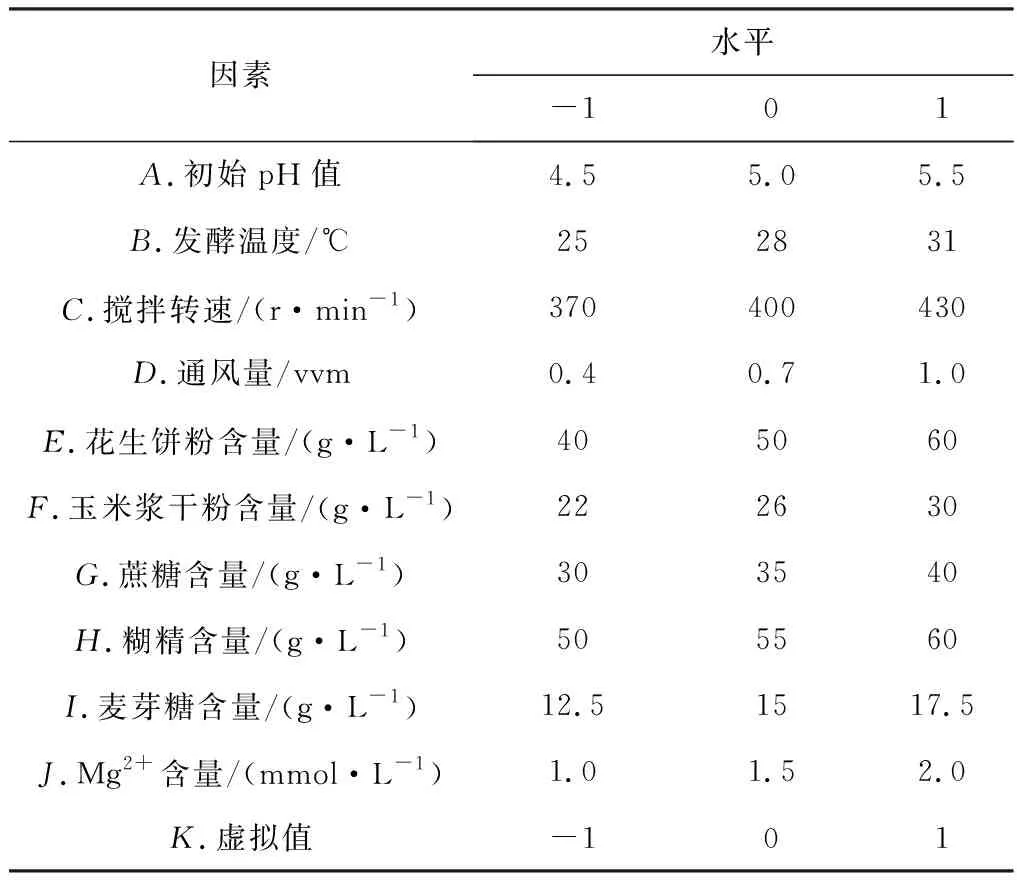
表1 Plackett-Burman实验的因素与水平

表2 Plackett-Burman实验设计与结果
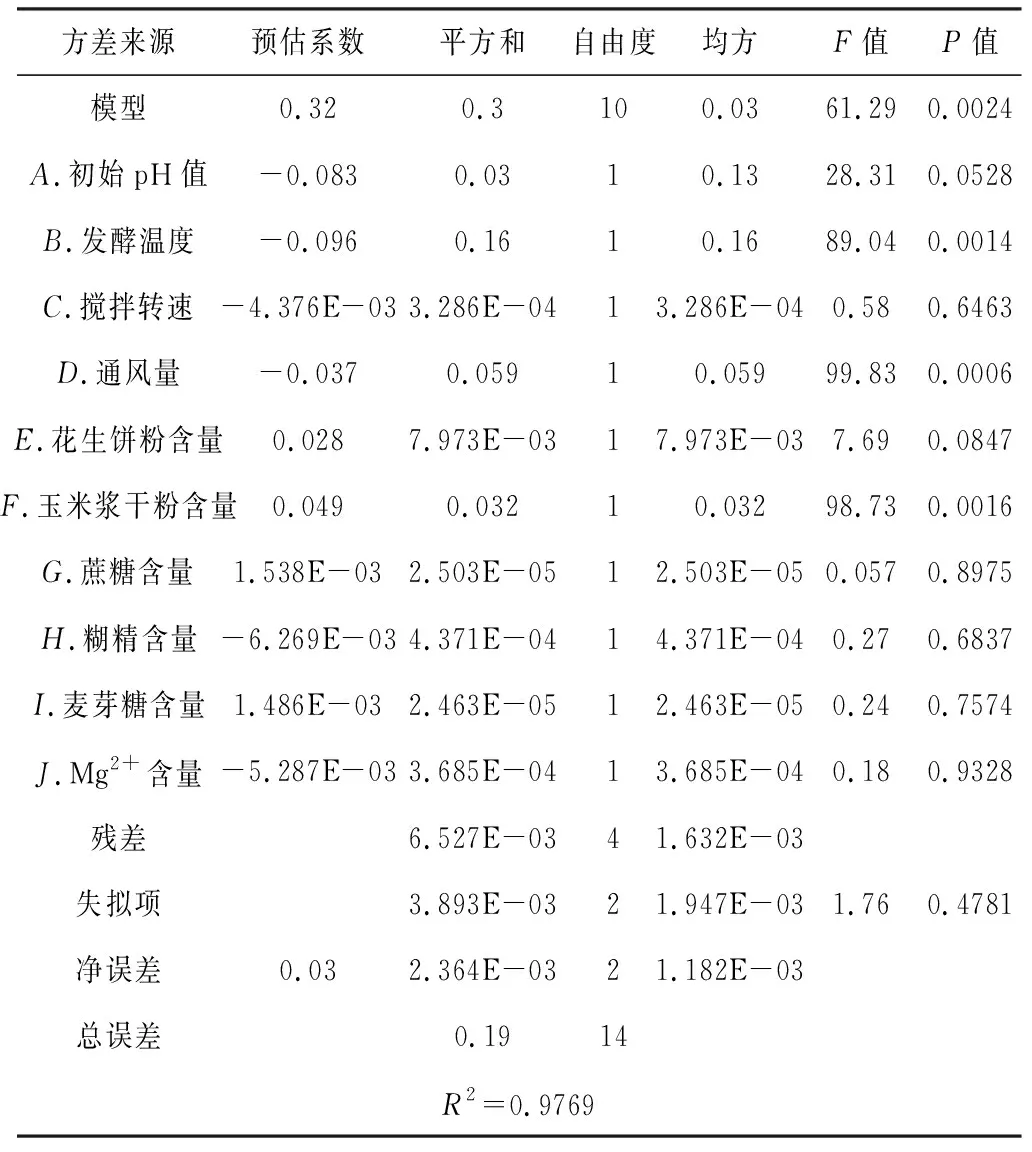
表3 Plackett-Burman实验的方差分析
由表3可知,模型的P值为0.002 4(<0.01),而失拟项的P值为0.478 1(>0.05),说明设计的模型具有统计学意义。从方差来源的各个因素来看,发酵温度、通风量、玉米浆干粉含量等3个因素对HCPT产量影响极显著(P<0.01);初始pH值、搅拌转速、花生饼粉含量、蔗糖含量、糊精含量、麦芽糖含量、Mg2+含量等7个因素对HCPT产量影响不显著(P>0.05)。同时根据各因素的预估系数可以看出,发酵温度和通风量对HCPT产量的影响表现出负效应,而玉米浆干粉含量表现出正效应。
2.3 最陡爬坡实验结果
在Plackett-Burman实验的基础上,筛选出3个显著影响泡盛曲霉CS24发酵产HCPT的因素:发酵温度、通风量、玉米浆干粉含量,根据实际情况设计每个因素的步长和爬坡方向,进行最陡爬坡实验以确定中心组合设计的水平中心。最陡爬坡实验设计与结果见表4。

表4 最陡爬坡实验设计与结果
由表4可知,第2组实验的HCPT产量最高,达到94.6 mg·L-1。所以,以第2组实验的条件(发酵温度29 ℃、通风量0.6 vvm、玉米浆干粉含量12 g·L-1)作为中心组合设计的水平中心。
2.4 响应面实验结果
2.4.1 Box-Behnken实验
综合Plackett-Burman实验及最陡爬坡实验结果,以发酵温度29 ℃、通风量0.6 vvm、玉米浆干粉含量12 g·L-1为中心点,以HCPT产量为响应值,进行Box-Behnken实验,实验设计与结果见表5,方差分析见表6。

表5 Box-Behnken实验设计与结果

表6 Box-Behnken实验的方差分析
对表5数据进行拟合,得到回归模型:Y=21.27000-0.79842A+1.67342B+1.83245C-1.53984AB+1.45783AC-0.75467BC-8.97654A2-5.78345B2-2.49887C2。

2.4.2 响应面分析
泡盛曲霉CS24发酵产HCPT过程中各因素交互作用对HCPT产量影响的响应面图及等高线图如图8所示。

图8 各因素交互作用对HCPT产量影响的响应面图及等高线图Fig.8 Response surface plots and contour plots for effects of interaction between various factors on HCPT yield
由图8a可知,当发酵温度一定时,HCPT产量随着通风量的增加呈现出先升高后降低的趋势;同时,当通风量一定时,HCPT产量随着发酵温度的升高也呈现出先升高后降低的趋势;二者的等高线呈明显的椭圆形,表明发酵温度与通风量的交互作用对HCPT产量影响极显著。由图8b可知,发酵温度与玉米浆干粉含量的曲面都有一定的弧度,并且发酵温度的曲面弧度大于玉米浆干粉含量的,表明发酵温度对HCPT产量的影响大于玉米浆干粉含量;二者的等高线呈明显的椭圆形,但不如发酵温度与通风量的交互作用,表明发酵温度与玉米浆干粉含量的交互作用对HCPT产量影响不显著。由图8c可知,通风量与玉米浆干粉含量的交互作用对HCPT产量影响的响应面图及等高线图与图8b相似,表明通风量与玉米浆干粉含量的交互作用对HCPT产量影响不显著。综上,各因素对HCPT产量的影响大小顺序为:发酵温度>通风量>玉米浆干粉含量,与Box-Behnken实验的方差分析结果一致。
运用软件Design-Expert V 13.0.5.0对回归方程求解,得到泡盛曲霉CS24发酵产HCPT的最优工艺条件为:发酵温度29 ℃、通风量0.6 vvm、搅拌转速380 r·min-1、初始pH值5.0、玉米浆干粉含量13 g·L-1、花生饼粉含量25 g·L-1、蔗糖含量10 g·L-1、糊精含量30 g·L-1、麦芽糖含量15 g·L-1、Mg2+含量0.5 mmol·L-1。
2.5 验证实验
对回归方程预测的最优发酵工艺条件进行3次平行验证实验, HCPT产量平均值为171.6 mg·L-1(SD=0.0024),比优化前(94.6 mg·L-1)提高了44.9%,比现有文献[25]报道的HCPT产量高出238.6%,与预测值吻合度较高,表明构建的模型可靠,可用于预测泡盛曲霉CS24发酵产HCPT的实际生产。
3 结论
利用泡盛曲霉CS24发酵产HCPT。通过单因素实验和Plackett-Burman实验,筛选出发酵温度、通风量和玉米浆干粉含量等3个影响发酵的显著因素;然后通过最陡爬坡实验确定中心组合设计的水平中心;最后通过Box-Behnken实验、响应面分析获得最优培养基为:玉米浆干粉13 g·L-1、花生饼粉25 g·L-1、蔗糖10 g·L-1、糊精30 g·L-1、麦芽糖15 g·L-1、Mg2+0.5 mmol·L-1;最优发酵工艺为:发酵温度29 ℃、通风量0.6 vvm、搅拌转速380 r·min-1、初始pH值5.0。在此条件下,HCPT产量达到了171.6 mg·L-1,比优化前(94.6 mg·L-1)提高了44.9%。该研究为工业化发酵生产HCPT奠定了理论和实践基础。
