全癌标志物:助力实现消灭宫颈癌战略目标
2023-08-17王玫瑰
王玫瑰
2018年5月,世界卫生组织(WHO)宣布实施全球消除宫颈癌行动,2020年11月17日发布实施“加速消除宫颈癌全球战略”,宣告全球194个国家将在2030年实现“90-70-90”目标,即90%的女孩15岁以前完成人乳头瘤病毒(HPV)疫苗接种、70%的35~45岁女性接受高质量宫颈癌筛查、90%的确诊宫颈病变女性得到治疗。中国政府积极响应,2023年1月20日,国家卫生健康委等十部门联合印发《加速消除宫颈癌行动计划(2023—2030年)》,通过接种HPV疫苗、筛查、治疗等三级预防措施有效防控并最终实现消除宫颈癌,而超早期诊断宫颈癌是实现这些目标的重要一环。
提早干预HPV感染有望阻断宫颈癌的发生
研究者根据HPV的致癌性将其分为高危型和低危型。高危型HPV16/18/31/33/35/39/45/51/52/56/58/59被国际癌症研究机构(IARC)列为1类致癌物[1]。高危型HPV的持续感染可导致子宫颈、肛门、生殖器等部位癌变和癌前病变,低危型 HPV可致生殖器疣和其他良性病变。
HPV感染具有高度的嗜上皮特点,只选择性感染皮肤、黏膜上皮细胞,但90%以上的HPV感染可在2年内被宿主免疫机制清除,只在部分病例中HPV感染持续存在并与宿主细胞DNA整合,导致宿主细胞癌变,HPV基因组感染宿主后的生物学行为表现各异,在临床干预手段下的结局仍不尽相同。HPV的一过性感染,组织学上可表现为子宫颈低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL),即轻度子宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)(CIN1),如果持续感染,则进展为高级别鳞状上皮内病变 (high-grade squamous intraepithelial lesion, HSIL),即部分中度CIN(CIN2)和重度CIN(CIN3)。CIN1有很高的自然消退率,60%以上的 CIN1会自然好转,只有约 1%的CIN1最终可进展为宫颈癌,约18%的CIN2会进展为宫颈癌,仅进行局部活检未行下一步治疗的CIN3人群在30年内发展为宫颈癌的比例为31%[2]。
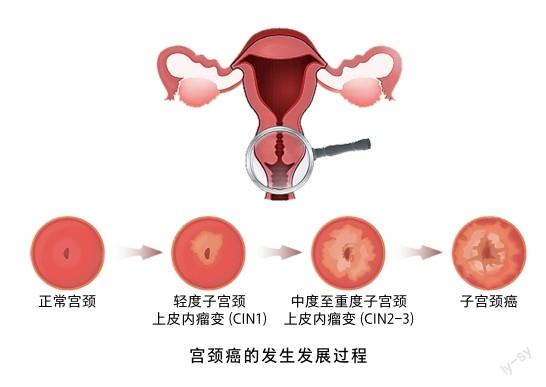
从HPV感染发展到宫颈癌的时间各有不同,通常HPV持续感染经过10~20年的自然演化发展为癌,其间经历了许多遗传学和表观遗传学的变化。表观遗传调控分子基础有两个方面,即针对DNA 本身的修饰和对组蛋白的修饰。表观遗传修饰影响细胞生长、分化、凋亡、转化以及肿瘤发展相关基因的转录。从表观遗传学的角度研究宫颈癌的发病进程,有望找到宫颈癌病程进展相关的标志物,为阻断宫颈癌的发生提供可行的解决方案。
表观遗传学变化贯穿宫颈癌发病全过程
表观遗传学在胚胎发育、癌症生物学和免疫系统反应等多种生物过程中发挥重要作用。目前研究最成熟的表观遗传学变化是DNA甲基化。DNA甲基化是一种发生在胞嘧啶环上的共价化学修饰,是在第5号碳位上增加一个甲基基团(-CH3)。长期以来,DNA甲基化的异常被认为与癌症有关。恶性肿瘤中呈现出整体的低甲基化和局部的高甲基化现象,其发生的机制仍有待阐明。在癌症的DNA甲基化研究中,最早的观察是关于低甲基化的[3],后来发现区域性高甲基化是沉默肿瘤抑制基因的表达手段[4]。
HPV促宫颈癌的发生通常分为三个阶段:启动阶段、促进阶段和进展阶段。在启动阶段,HPV病毒感染通过破损的皮肤黏膜表层进入宿主基底细胞,开始是以环状DNA 方式自我复制,随着病情进展,有些HPV基因整合到宿主细胞DNA中,致宿主细胞异常分化终致癌变,诱发DNA损伤,经受过病毒打击的基底细胞出现低甲基化和全基因组不稳定性的現象,不仅会导致大量的同源重组和非同源重组,以及基因的扩增、缺失、倒置、异位等大片段的DNA结构变化,也会导致许多基因表达状态的长期改变,这种现象早于肿瘤的发生。宫颈细胞由整体高甲基化转变为整体低甲基化、局部高甲基化现象,细胞恢复了自身的部分全能性来适应由于病毒带来的局部环境的改变,产生早期区域性效应,但此时诱发的DNA甲基化变异多数是不稳定的、局部的、不完全性甲基化,对于CIN1、CIN2人群,年轻的有较高的逆转率,且经宫颈锥切等治疗后大多数女性可终生不再得宫颈癌及高级别病变,但随着HPV的持续性感染,以及伴随着年龄增大等因素,局部性的改变将扩展到敏感基因的全部。从收集的宫颈癌样本中研究发现,HPV和患者中DNA甲基化均发生了改变,宫颈癌的许多表观遗传改变不仅在癌组织周边的非癌组织中存在,在CIN中也存在,且这些变化随着CIN程度的增加呈增高趋势。在促进阶段,基底细胞是在区域性效应基础上累及更多遗传和表观遗传改变的组织干细胞,这些细胞首先发生癌变重编程,成为恶性转化细胞,然后发生一系列的适应性改变,最终固化为可在细胞分裂过程中稳定传递的表观遗传改变,已经发生表观改变的细胞获得生长优势,促进肿瘤发展。一旦细胞已经癌变,疾病进入进展阶段,从宫颈癌早期发展到晚期仅需要6个月至1年时间。
全癌标志物将宫颈癌诊断提前到“未癌”阶段
2021年,全癌标志物研究联盟发表了第二个全癌标志物PCDHGB7[5]。此前,基于拥有自主知识产权的全基因组DNA甲基化检测技术——导航定位测序(guide positioning sequencing, GPS),已在2019年发表了第一个全癌标志物HIST1H4F[6]。全癌标志物PCDHGB7的发现将宫颈癌筛查提前到“未癌”阶段。研究团队将PCDHGB7用于宫颈癌早期检测,收集了包括病理诊断阴性(非癌)、两种癌前病变(低级别瘤变和高级别瘤变)及宫颈癌的样本,发现PCDHGB7在高级别瘤变阶段就已经显著高甲基化,提示全癌标志物可以实现宫颈癌的超早期诊断。
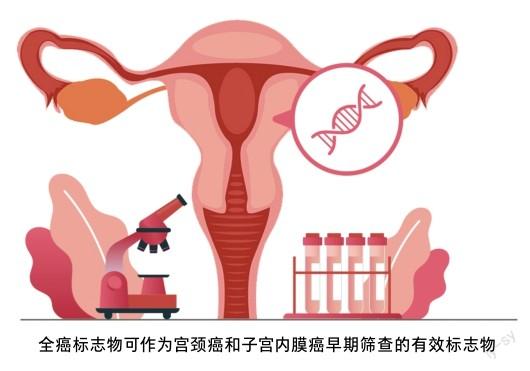
由于全癌標志物是一类存在于全部癌症中的特征性甲基化标志物,研究人员又在子宫内膜癌的临床研究中验证PCDHGB7的检测效能,并对比子宫内膜刷和宫颈刷2种不同取样方式的检测效能,发现使用宫颈刷进行全癌标志物PCDHGB7检测能较好地筛查诊断子宫内膜癌[7]。进一步研究发现,通过采集临床样本——宫颈脱落细胞,就可以实现宫颈腺癌、宫颈癌、子宫内膜癌3种女性生殖道肿瘤的早期有效筛查,也进一步验证了全癌标志物在肿瘤检测中的优势。
研究团队已经在宫颈癌和子宫内膜癌筛查诊断领域积累了超过5万例的真实世界的全癌标志物临床数据验证。为了探索适合不同经济发展水平地区的宫颈癌筛查策略,研究团队分别在上海、山东菏泽、宁夏开展了三个大型宫颈癌筛查队列。
研究团队在上海四家临床中心入组了超过近2万例样本,发现全癌标志物比现有技术具有突出的优势。研究发现上海地区的宫颈癌和子宫内膜癌的流行病学特征与欧美等发达国家相似,呈现子宫内膜癌发病率高于宫颈癌的特点。
研究团队在菏泽以公益项目的形式开展为期3年的宫颈癌、子宫内膜癌筛查,计划完成万例样本检测,这是对全癌标志物临床应用的一次大样本考验。在已完成的6465例宫颈癌全癌标志物甲基化检测中,发现甲基化检测阳性者216例,在经历漫长而艰难的动员后完成随访53例,其中确诊8例宫颈癌、28例宫颈高级别癌前病变,这次大考的结果更坚定了研究团队将全癌标志物推广应用的决心。

宁夏地区宫颈癌筛查形势相对严峻,当地妇女结婚偏早、筛查意识不强、依从率低,研究团队与宁夏回族自治区人民医院通过科技部东西部合作项目,在宁夏海原县及盐池县进行宫颈癌早筛的民生项目,通过持续3年的DNA甲基化筛查,检测总量超过1万例样本,以期达到降低当地宫颈癌发病率的目标。在已经完成全癌标志物甲基化检测强阳性的64例筛查女性中,完成随访的11例患者中已经有10例经阴道镜病理确诊为宫颈高级别病变(癌前病变)或宫颈癌,全癌标志物在这一过程中有效提高了当地医院的诊疗水平并精准发现漏诊患者。
全癌标志物在妇科肿瘤应用场景的扩展
宫颈癌前病变的分流和进展预测 宫颈癌前病变的临床诊疗存在过度诊疗和漏诊并存的现象,原因是缺乏有效的分流和监测手段。宫颈癌前病变的自然转归有消退、持续和进展三个方向,组织病理学诊断为低级别病变者原则上无需治疗,进行临床观察,而临床诊断为高级别病变的则为临床治疗对象,通常采取宫颈锥切等手术治疗,但由于宫颈锥切存在宫颈黏连狭窄的风险,且有证据表明宫颈锥切会增加女性早产的风险,而宫颈癌前病变常发生于25~35岁育龄妇女中,势必给宫颈癌前病变的治疗决策选择带来更多顾虑和考量,精细化、精确化的CIN管理势在必行。由于阴道镜检查对医生临床经验依赖性强,在医疗资源欠发达地区存在一定的漏诊和误诊概率。对宫颈癌筛查异常者,尽管阴道镜下活检病理为低级别病变者,仍有10%最终诊断为高级别病变的可能,因此全癌标志物未来可用于宫颈上皮内病变转归的探索,作为一种去经验化的手段协助临床医生做出更好的诊断,给患者提供更精准的治疗建议。

妊娠期宫颈病变监测 妊娠期宫颈病变是宫颈癌临床筛查诊断的难点,妊娠期宫颈管搔刮术属于禁忌症,且妊娠期宫颈由于孕期女性激素的影响,宫颈转化区外移,宫颈细胞水肿及增生,发生细胞学检查异常的风险高,且妊娠期HPV清除效率下降,使得传统筛查手段在孕期假阳性增高,造成不必要的阴道镜转诊和反复行宫颈刮片,而且妊娠期无论是宫颈活检还是锥切都存在较多的顾虑,相比HPV的高假阳性和细胞学在妊娠期的尴尬处境,全癌标志物是相对更适合作为此场景宫颈病变的监测手段,无创、精准,但需要更多前瞻性临床数据来支撑此设想。
辅助宫颈锥切后持续HPV感染决策制定 宫颈锥切后HPV呈持续性感染的患者是否需二次锥切或者行全子宫颈切除在临床诊疗中尚存在争议,检测方法的局限让CIN宫颈锥切术后随访和治疗陷入了低危人群分流不足和高危人群诊断困难的两难境地,因此就这类患者进行风险评估和分层管理显得尤为重要。因此,从局部残留阳性和锥切术后HPV阳性的妇女中有效识别出未来可发生进展的患者是减少过度诊疗、保存生育能力的关键,而全癌标志物可为宫颈锥切后治疗决策制定提供客观有效的技术支撑。
全癌标志物,幸好有你
宫颈腺癌因为发病于宫颈管,在HPV和TCT筛查中最易漏诊,占漏诊病例的70%~80%。我们团队就遇到过一个真实案例,2021年8月,在菏泽宫颈癌、子宫内膜癌筛查中,有一名在当地医疗卫生系统工作的女性张某的全癌标志物检查结果引起了研究团队的注意,这名女性健康意识较强,国家两癌筛查活动每次都认真参加且已经接种过HPV疫苗,本次HPV筛查和细胞学结果均为阴性,但是全癌标志物甲基化检测结果提示阳性,高度怀疑子宫或宫颈存在癌变,于是张某在当地医院行阴道镜检查并复核4点病理为黏膜慢性炎+低级别病变。但研究团队出于对技术的信心,遂建议张某前往济南某三甲医院就诊,经过1个月的奔波,该三甲医院给予的诊断结果依旧为炎症,随后研究团队邀请张某来上海复查,但两次阴性结果让张某不再相信我们的建议,且开始不再接来自我们团队的沟通电话。然而到了11月份,张某开始出现阴道不规则出血,结合8月份的全癌标志物甲基化检测结果,她惴惴不安地又去了当地妇科医院,这次妇科医院的B超提示宫颈区存在实性占位,她赶紧主动联系了我们团队,团队技术人员迅速又安排再次进行全癌标志物甲基化检测,结果呈强阳性,提示张某极有可能存在恶性肿瘤且已经进展。事不宜迟,我们团队迅速联系了上海知名三甲医院妇科专家,最终张某的病理提示“显著浸润性腺癌”,手术后病理结果诊断为“子宫下段高级别内膜样癌”。目前患者手术后已经完成了放化疗,我们团队承诺对该患者终生进行全癌标志物的追踪随访。
结 语
全癌标志物在宫颈癌临床诊疗中可用于宫颈癌筛查、HPV阳性分流、宫颈癌治疗效果评估、宫颈癌前病变风险分层和进展预测、妊娠期宫颈病变监测等,通过多维度、多场景应用,不断丰富临床数据,助力《加速消除宫颈癌行动计划(2023—2030年)》的实现,并最终制订一套可执行的消除宫颈癌中国行动方案。
[1]Bouvard V, Baan R, Straif K, et al. Biological agents. Lyon: IARCA, 2012.
[2]McCredie M R E, Sharples K J, Paul C, et al. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol, 2008, 9: 425-434.
[3]Feinberg A P, Vogelstein B. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature, 1983, 301: 89-92.
[4]de Bustros A, Nelkin B D, Silverman A, et al. The short arm of chromosome 11 is a “hot spot” for hypermethylation in human neoplasia. Proc Natl Acad Sci U S A, 1988, 85(15): 5693-5697.
[5]Dong S H, Lu Q, Xu P, et al. Hypermethylated PCDHGB7 as a universal cancer only marker and its application in early cervical cancer screening. Clin Transl Med, 2021, 11: e457.
[6]Dong S H, Li W, Wang L, et al. Histone-related genes are hypermethylated in lung cancer and hypermethylated HIST1H4F could serve as a pan-cancer biomarker. Cancer Res, 2019, 79: 6101-6112.
[7]Yuan J J, Mao Z R, Lu Q, et al. Hypermethylated PCDHGB7 as a biomarker for early detection of endometrial cancer in endometrial brush samples and cervical scrapings. Front Mol Biosci, 2021, 8: 774215.
[8]Kocken M, Helmerhorst T J M, Berkhof J,et al. Risk of recurrent high-grade cervical intraepithelial neoplasia after successful treatment: a long-term multi-cohort study. Lancet Oncol, 2011, 12: 441-450.
關键词:宫颈癌 子宫内膜癌 全癌标志物 PCDHGB7 ■
