普通拟杆菌调控高血压小鼠小肠上皮细胞腺苷合成的机制探究
2023-08-15王一梁张安坤何冬旭
王一梁,张安坤,何冬旭
(江南大学 食品学院,江苏 无锡,214122)
高血压影响机体器官功能,是心血管疾病的主要可改变因素。据调查数据显示,我国普通人群中高血压患病率高,且患病率随年龄增长而稳步上升[1]。高血压发病诱因的多样性决定了高血压病理生理机制的复杂性。因此,深入辨析心血管健康维护和心血管疾病危险因素、揭示相关通路与机制对开发新型降压药物及心血管疾病的预防和干预有重要意义。基于对高血压机制及治疗的研究基础,科学家们提出了将肾交感神经去神经支配术作为耐受性高血压的一种新型治疗方法[2]或将质膜钙ATPases作为治疗原发性高血压的潜在靶标[3]。不过,由于近年来肠道微生物群与疾病相关性和因果关系研究的兴起[4],已有研究发现肠道内生菌群结构及其代谢物功能对于维持人体生态平衡、调节心血管健康尤为重要[5]。它们可以通过影响营养物质消化吸收、宿主微生物组和肠道细胞相关基因通路及各类第一信使代谢等方式,直接或间接地调控血管细胞及心血管系统稳态[6]。
有趣的是,长期的高盐饮食习惯,不仅直接与肠道代谢、内环境息息相关,也是我国民众日常生活中最多见的高血压引发因素之一[7],因此,从高盐饮食引发的高血压入手,研究肠道内生菌影响心血管健康的机制,具有充分的科学合理性及可行性。在人类众多肠道内生菌种属中,拟杆菌属(Bacteroides)是健康人群中最丰富的优势菌属。拟杆菌属中的普通拟杆菌(Bacteroidesvulgatus)对维持宿主肠道生态系统健康有重要作用,它可以减少血管斑块,促进血管健康[8]。肠道上皮屏障的生态失调可引起全身炎症并破坏肠道机械传导[6]。益生菌定殖在肠道后与肠道细胞相互影响,维护肠上皮屏障稳态,调节小肠上皮细胞代谢物分泌并入血,进而调控宿主健康[9-10],这提示我们B.vulgatus也可能促进小肠上皮细胞表达分泌某些物质而进入血液循环。由于这些代谢物在血液中是直接与血管腔接触[11],即可直接影响血管功能,从而构成肠道内生菌影响心血管健康的机制。
因此,本研究从实验室已经稳定造模的高盐饮食诱导的小鼠高血压模型入手[12],探讨了小鼠肠道中B.vulgatus的稳态与高血压进程的关联及机制,发现了B.vulgatus菌群定殖缓解了小鼠高血压进程[13],增加了血浆中抗高血压物质——腺苷[14]的含量。为探索腺苷的来源,我们继而解析了B.vulgatus定殖后,该内生菌与小肠上皮细胞的互作表达谱,以期探索B.vulgatus调控小肠上皮细胞腺苷合成的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
8周龄C57BL/6J雄性小鼠,无特定病原体(specific pathogen free,SPF)级,上海斯莱克实验动物有限责任公司。动物实验的开展遵守实验动物操作指南,实验方案经江南大学实验动物伦理委员会审核批准,审批编号为JN.No20220615c0201230 [290]。
1.1.2 实验菌株
普通拟杆菌(Bacillusvulgatus),由本课题组从小鼠粪便中获得,30%甘油重悬保存于-80 ℃冷库中。
1.1.3 主要试剂
高盐小鼠饲料(质量分数为8% NaCl),南京特洛菲饲料科技有限公司;脑心浸出液肉汤(brain heart infusion,BHI)培养基,青岛海博生物技术有限公司;胶原酶XI(C7657),美国Sigma公司;表皮生长因子、纤维细胞生长因子,PeproTech公司;DMEM-F12培养基,美国Gibco公司;重组Anti-CD39抗体,Abcam公司;D-PBS,碧云天公司。
1.1.4 仪器设备
BP-2010A智能无创血压剂,北京软隆生物技术有限公司;Sorvall WX 100+离心机、Forma Steri-Cycle i250细胞培养箱,美国Thermo Scientific公司;CM1950全自动冷冻切片机,德国Leica公司;LSM880倒置激光共聚焦显微镜,德国Zeiss公司;Mini-PROTEANTetra垂直电泳仪、GellDoc Go全自动凝胶成像仪,美国Bio-Rad公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;BSC-1004IIA2生物安全柜,苏州安泰空气技术有限公司。
1.2 菌株活化和发酵液、灌胃菌悬液制备
挑取适量菌液,在BHI琼脂平板上划线活化2次(37 ℃厌氧培养20 h)。挑取单菌落接种于含有1 g/L半胱氨酸盐酸盐、2 mg/L维生素K1、10 mg/L血晶质的BHI液体培养基中,置于37 ℃的厌氧工作站进行发酵培养。取对数生长后期的发酵液,离心(4 ℃,8 000 r/min,10 min)收集菌泥,生理盐水(质量分数为0.9% NaCl,下同)重悬得到灌胃菌液(109CFU/mL);收集上清液过0.22 μm滤膜得到发酵液。
将C57BL/6J小鼠随机分为安慰剂对照组(A组,n=8)和B.vulgatus灌胃组(B组,n=8)。A组给予生理盐水安慰剂灌胃(0.9% NaCl,200 μL/只);B灌胃组给予菌液灌胃(109CFU/mL,200 μL/只), 以1 mL无菌注射器打入小鼠食道内。2组灌胃期间均使用高盐饲料饲养,灌胃时间持续4周。
1.3 小鼠血压检测
在无人、温暖的环境中对小鼠血压进行测量,避免环境问题引起小鼠血压波动。测量前连接好传感器,设定温度为39 ℃,感应灵敏度为3,选择中号鼠袋和鼠网,将小鼠固定稳妥并将加压感应器置于鼠尾根处开始测量,记录数据以得知灌胃进程中的血压变化情况。
1.4 HPLC靶向检测小鼠血浆腺苷
取小鼠全血装入含有肝素钠的抗凝管,上下颠倒5次,离心(4 ℃,3 000 r/min,10 min),上清液即为血浆。将上清液移至普通离心管中,-80 ℃超低温保存。取小鼠血浆与甲醇按1∶3的体积比混合沉淀蛋白质后,离心(4 ℃,14 000 r/min,10 min),收集上清液。取上清液于真空浓缩仪中蒸发干燥2 h,以等量20%的甲醇水溶液复溶后离心(4 ℃,14 000 r/min,5 min)。取上清液于0.22 μm滤膜过滤,滤液待测。
采用HPLC进行血浆腺苷检测,HypersilTMODS C18反相色谱柱(125 mm×4.6 mm,5 μm)梯度洗脱。流动相A:0.1%甲酸水溶液(pH 9.0);流动相B:V(甲酸)∶V(水)∶V(甲醇)=0.1∶9.9∶90(pH 9.0)。梯度洗脱程序设置如下:0~5 min:100%(A)0%(B);5~10 min:75%(A)25%(B);10~15 min:50%(A)50%(B);15~20 min:25%(A)75%(B);20~25 min:0%(A)100%(B);25~30 min保持5 min。流速1.0 mL/min。对色谱峰积分,根据标准曲线计算小鼠血浆腺苷含量变化情况。
1.5 小肠上皮细胞培养方法建立
小鼠CO2安乐死,取小肠,去掉周围脂肪组织,放入含有细胞清洗液的小皿中。吸取细胞清洗液冲洗小肠内容物,随后移到新的细胞清洗液的小皿中,用剪刀纵切肠道,冲洗小肠内壁至内容物被完全洗净。将小肠剪碎至约2 mm2,转移至含细胞清洗液的离心管中,清洗,静置,弃上清液,重复多遍至上清液澄清。转移组织至含有消化液的10 mL离心管中,37 ℃振荡消化5 min,静置,弃上清液,重复3次。在剩余组织中加入消化液,37 ℃振荡消化10 min,静置,转移上清至新的10 mL离心管,室温270×g离心5 min,弃上清液,用完全培养基重悬,重复4次。收集细胞,70 μm滤膜过滤除菌3次后270×g室温离心5 min,弃上清液,用完全培养基重悬种于六孔板中,随后置于细胞培养箱中培养,48 h后换液。
1.6 小肠上皮细胞转录组测序
分离B.vulgatus处理前后的小肠上皮细胞进行细胞转录组表达谱测序(美吉生物公司)。基于Illumina NovaSeqTM6000测序平台,对所有mRNA进行测序,采用Illumina TruSeqTMRNA sample prep Kit方法进行基因文库构建。使用统计学方法,比较2个条件或多个条件下的基因表达差异,从中找出与条件相关的特异性基因,然后进一步分析这些特异性基因的生物学意义。
1.7 免疫蛋白印迹法(Western Blot)验证小肠上皮细胞腺苷合成关键基因表达
1.7.1 细胞蛋白的提取
待六孔板内的细胞密度达到90%进行细胞蛋白的提取。吸弃细胞培养基,D-PBS冲洗3次。配制细胞蛋白裂解液(RIPA∶PMSF=100∶1),每孔加入100 μL裂解液,移液枪轻轻吹打收集细胞,将收集到的细胞与裂解液转移至1.5 mL离心管中,4 ℃层析柜旋转裂解30 min。裂解完毕后,离心(4 ℃,12 000×g,15 min),上清液即为提取到的细胞蛋白,蛋白存于-80 ℃冰箱以备后续实验。
1.7.2 组织蛋白的提取
取实验小鼠小肠组织,研磨成组织匀浆,加入适量蛋白裂解液(每50~100 mg组织约加入1 mL裂解液),将组织匀浆与裂解液一同转入10 mL离心管中,4 ℃层析柜旋转裂解30 min,离心(4 ℃,12 000×g,15 min),上清液即为提取到的组织蛋白,蛋白存于-80 ℃冰箱以备后续实验。
1.7.3 Western Blot实验
配制10%分离胶加入制胶板内,异丙醇封胶,待分离胶凝固后弃去异丙醇。配制5%浓缩胶加入制胶板内,放入梳子,待胶凝固后进行后续操作。蛋白样品中加入适量1×loading buffer,金属浴(98 ℃,10 min)。在电泳槽内外加入1×Running,拔出梳子,加入蛋白样品。上层浓缩胶:恒压70 V,30 min;下层分离胶:恒压120 V,60 min。将5.5 cm×8.5 cm的聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜在甲醇溶液中浸泡2 min后取出。将转膜液转移至铝制饭盒中,将海绵、滤纸、PVDF膜依次浸泡其中。切除浓缩胶以及多余部分,组装好转印夹板。转膜条件为恒流330 mA,80 min,全程水浴。转膜结束后,将PVDF膜取出,置于5%牛血清白蛋白(bovine serum albumin,BSA)封闭液中,水平摇床室温封闭2 h。根据蛋白marker位置判断并剪出所需条带(CD39约75 kDa),将条带置于一抗溶液中4 ℃孵育过夜。吸弃一抗,三乙醇胺缓冲盐水溶液+吐温-20(Tris buffered saline+Tween-20,TBST)清洗3次。TBST 溶液配制相应二抗,室温孵育2 h,孵育结束后,TBST清洗3次。配制ECL显色液(A液与B液按1∶1比例避光配制),使用全自动凝胶成像系统进行显影,以GAPDH为内参,使用Image J软件对其灰度值进行定量分析。
1.8 小肠上皮细胞鉴定和CD39蛋白表达免疫荧光分析
1.8.1 组织冷冻切片
小鼠CO2安乐死,取3 cm小肠浸泡于4%多聚甲醛(paraformadehyole,PFA)中固定24 h。待组织沉入管底后取出,立刻浸泡于20%蔗糖溶液中,24 h后转移至30 %蔗糖溶液中进行梯度脱水,24 h后将组织从30%蔗糖溶液中取出,浸泡于OCT胶中24 h。用锡纸做好包埋槽,加入一半OCT胶并置于-80 ℃冰箱凝固,待包埋槽内OCT胶完全凝固,立刻将组织展平包埋其中,并用OCT胶覆盖,放入-80 ℃冰箱凝固。随后,使用全自动冰冻切片机,修平组织横切面并切片。切片完成后置于60 ℃烘箱中烘片1 h,取出切片进行后续实验。
1.8.2 组织免疫荧光
取小肠切片,PBS清洗3次,洗净OCT胶,用组化笔圈出小肠组织,在圈内加入0.1% Triton X-100,室温通透10 min,随后加入5% BSA封闭液,室温封闭30 min。加入一抗置于湿盒中4 ℃孵育过夜,实验所用一抗CD39配制比例为1∶200。吸弃一抗,PBS清洗3次,加入荧光二抗,室温避光孵育2 h,实验所用二抗AF-568配置比例为1∶200。二抗孵育结束后,4′,6-二脒基-2苯基吲哚(4,6-Diamidino-2-phenylindole dihydrochloride,DAPI)室温避光染色10 min,吸弃DAPI,PBS清洗多次。使用中性树脂封片,盖上盖玻片,保证组织上没有气泡,避光保存,于倒置激光共聚焦显微镜下进行拍摄。
1.8.3 细胞鉴定和免疫荧光
将细胞爬片置于24孔板中,明胶包被过夜,细胞种在24孔板中培养至稳定,待细胞贴壁生长到约80%密度后,去除培养基,PBS清洗,加入4% PFA溶液室温固定30 min。吸去PFA,PBS清洗多次,加入0.1% Triton X-100和5% BSA混合液,室温通透封闭1 h。加入一抗4 ℃孵育过夜,实验所用Anti-E-Cadherin和CD39配制比例分别为1∶250和1∶100。弃去一抗,PBS清洗多次,加入二抗,室温避光孵育2 h,实验所用二抗AF-488稀释比例为1∶200。弃去二抗,PBS清洗多次,加入DAPI,室温避光孵育10 min,DAPI稀释比例为1∶1 000。弃去DAPI,PBS清洗多次,将细胞爬片置于共聚焦小皿中,于倒置激光共聚焦下拍摄。
1.9 数据统计与分析方法
数值表示为平均值±标准差,采用Prism 8进行统计分析和图形绘制。显著性标准设为P<0.05;其中*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 B.vulgatus缓解小鼠高血压进程
实验组以B.vulgatus对小鼠灌胃28 d,菌液浓度为109CFU/mL,生理盐水重悬,灌胃剂量为200 μL/只;对照组以生理盐水为安慰剂对小鼠灌胃28 d。灌胃组和对照组同时饲喂高盐饲料。在此期间,我们对小鼠血压以智能无创血压仪进行监测。由图1可知,在灌胃第14天,高盐饮食对照组小鼠出现了血压升高,但是接受了B.vulgatus灌胃的小鼠,血压呈现出降低趋势,第21天与对照组呈现出显著统计学差异。因此,结果提示B.vulgatus可以缓解小鼠高血压进程。
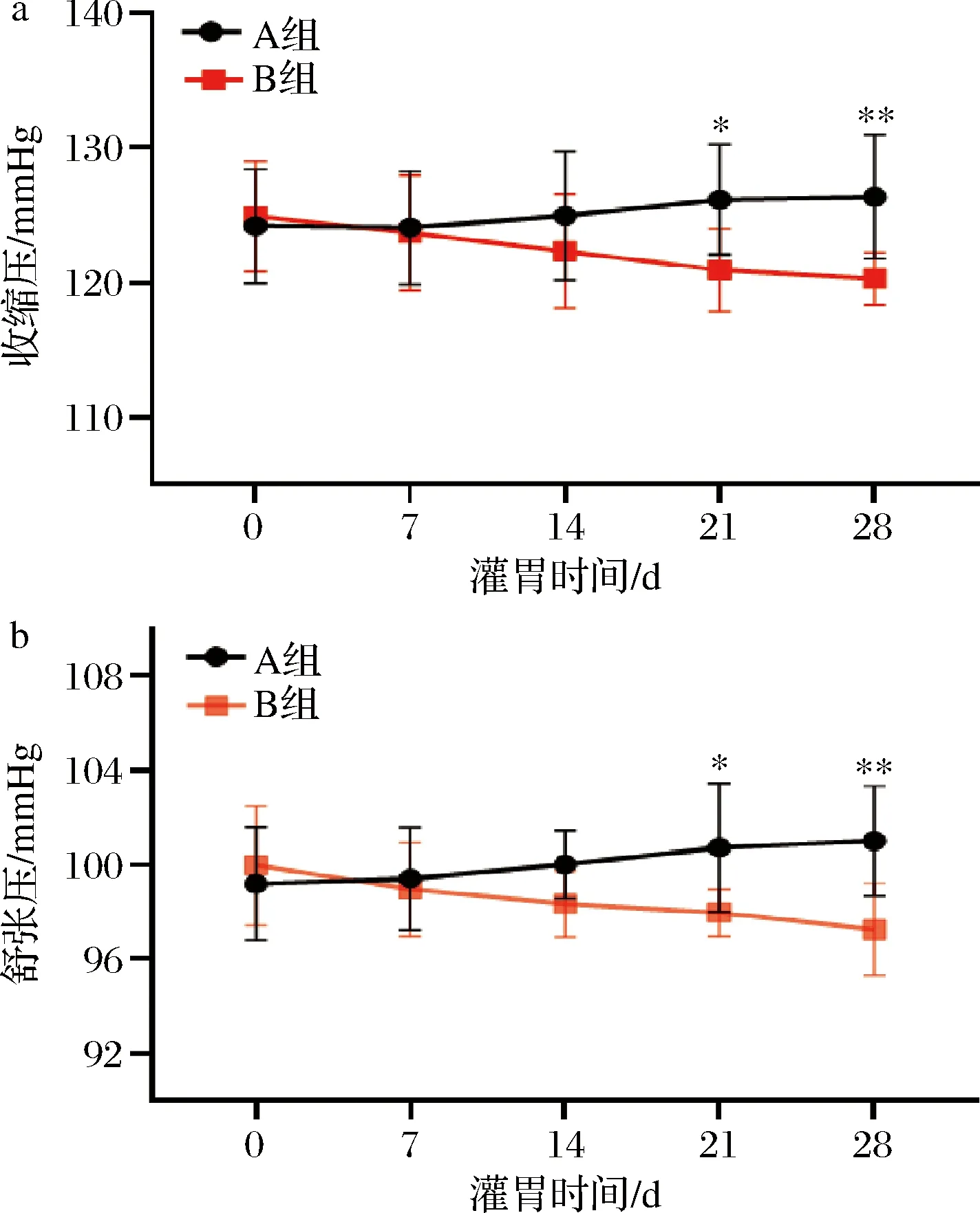
a-收缩压变化图(0~28 d);b-舒张压变化图(0~28 d)
2.2 B.vulgatus增加小鼠血浆腺苷含量
前期研究中,对B.vulgatus定殖前后的高血压小鼠进行了血浆代谢谱学分析,发现腺苷为B.vulgatus定殖前后的显著差异代谢物。然而,该部分研究并没有对代谢谱学、包括腺苷含量的结果进行验证,也没有对腺苷产生机制进行探讨。由此出发,利用HPLC法,验证了如上腺苷含量的变化,结果如图2所示,由于血浆中含有多种核苷酸、嘌呤类物质,所以我们通过标准品比对,确定了腺苷的出峰位置。可以看到,在小鼠灌胃B.vulgatus后,小鼠血浆中的腺苷含量显著升高。为了探究血浆中腺苷变化的来源,利用HPLC法检测了普通拟杆菌发酵上清液中的腺苷含量,结果发现,灌胃后腺苷含量的增高不是由普通拟杆菌分泌引起的。
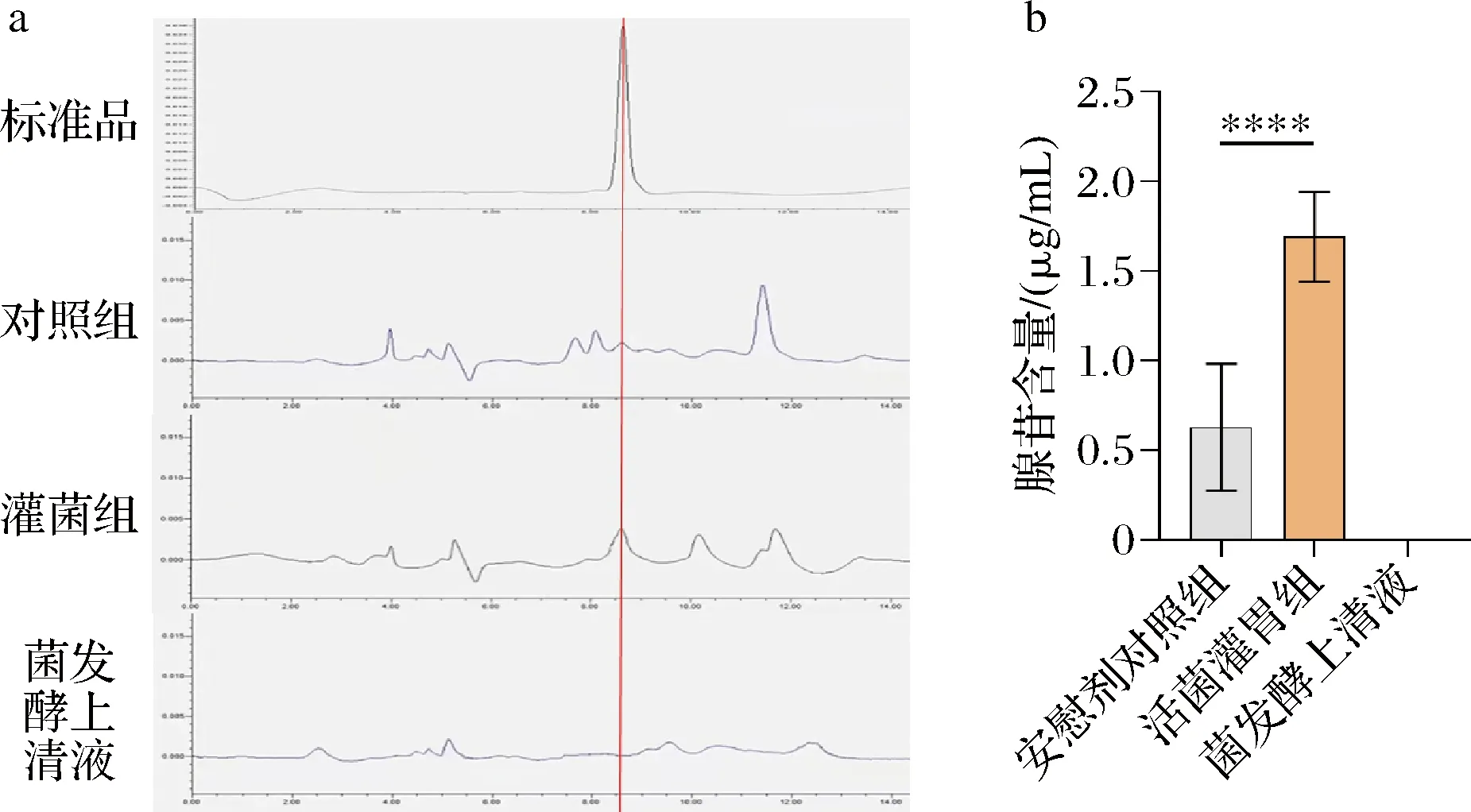
a-HPLC峰面积图;b-小鼠血浆腺苷含量
2.3 小肠上皮细胞表达谱测序
小肠上皮细胞为机体腺苷产生的主要场所之一[15]。因此,我们推断血浆中增加的腺苷有一部分可能来源于B.vulgatus与肠道细胞互作产生,并经肠道微血管入血循环[9-10]。为了深入解析小肠上皮细胞在与B.vulgatus互作的过程中,涉及哪些与腺苷合成和核苷酸代谢相关的通路,将B.vulgatus培养前后的小肠上皮细胞的mRNA进行了测序(P为对照组、K为B.vulgatus灌胃组,各n=3)。6个样品的转录组分析共获得40.44 Gb的Clean Data,各样品Clean Data均达到 5.99 Gb以上,Q30碱基百分比在94.12%以上(图3-a~图3-c)。随后,分别将各样品的Clean Reads与小鼠参考基因组(Mus_musculus;GRCm39)进行序列比对,比对率为97.13%~97.74%,共检测到26 066个表达基因,其中已知基因25 494个,新基因572个;表达转录本共86 087个,其中已知转录本75 333个,新转录本10 754个。
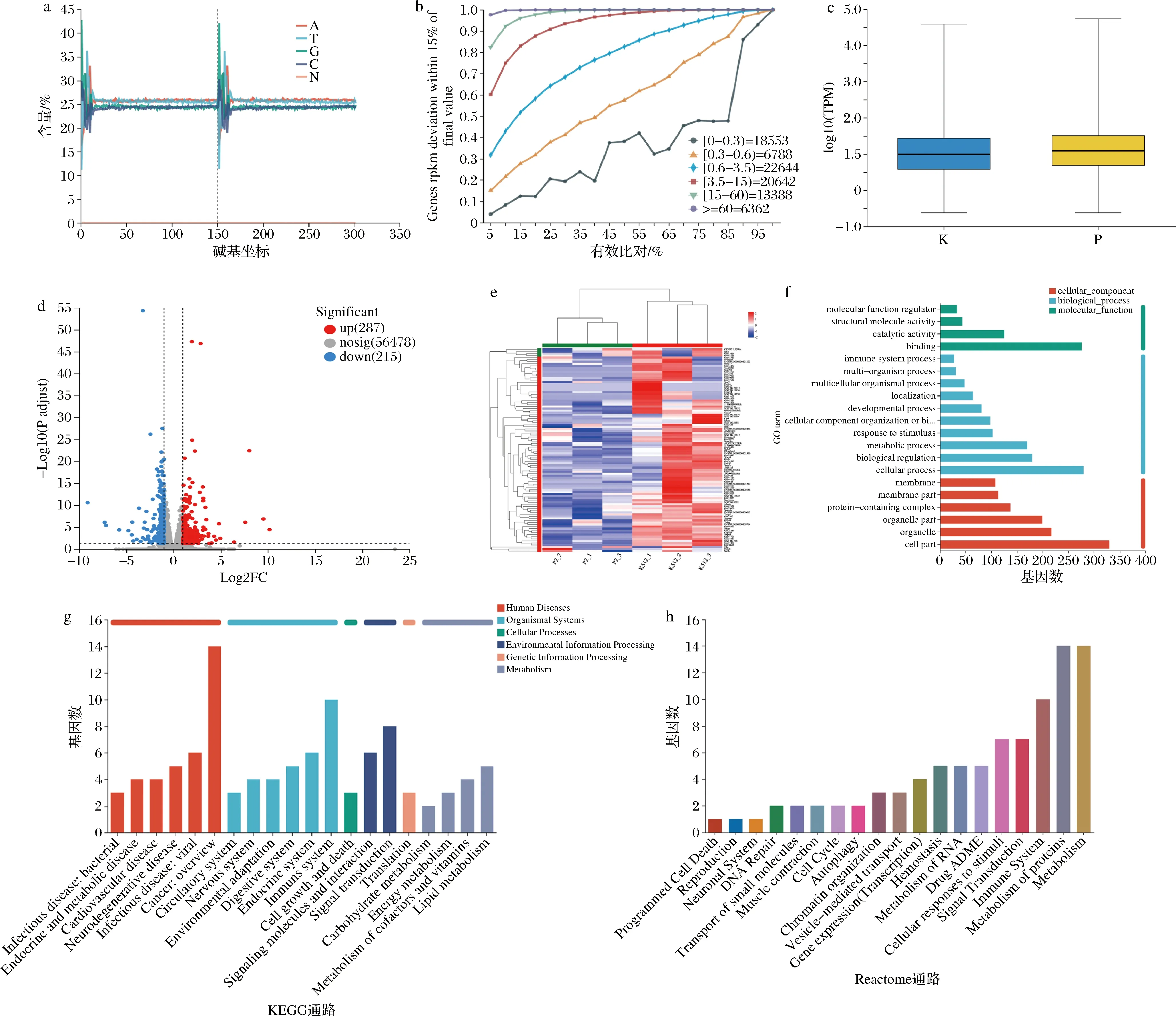
a-碱基含量分布;b-测序饱和度曲线;c-差异基因表达量分布分析;d-差异基因表达量火山图分析;e-差异基因表达聚类热图分析;f-差异基因GO注释分析;g-差异基因KEGG注释分析;h-差异基因Reactome注释分析
随后,将B.vulgatus灌胃鼠及对照鼠小肠上皮细胞的表达谱数据进行比对,利用DESeq2软件进行组间差异基因分析,获得两组间发生差异表达的基因(|log2Fold Change|>=1;P<0.05),共发现287个显著上调基因,215个显著下调基因(图3-d),差异基因热图如图3-e所示。
对这些基因进行GO分析。在生物过程方面,差异基因在细胞代谢、生物合成、分子应答(biological regulation,metabolic process,response to stimulus,cellular component organization or biogenesis)等方面显著富集。在细胞成分方面,差异基因在细胞表面和细胞器中等部位(organelle, membrane)显著富集。在分子功能方面,差异基因显著富集于细胞结合和催化等过程(catalytic activity,binding)。更详细的GO富集分析结果如图3-f所示。同时,对差异基因进行了KEGG通路分析(图3-g),发现在KEGG代谢过程中,脂肪代谢(fat metabolism)、能量代谢(energy metabolism)、辅酶(coenzyme metabolism)及维生素代谢(vitamin metabolism)等过程都显著富集。与之对应的,在Reactome通路分析中,细胞内对蛋白质(protein)、核苷酸(ribotide)等物质的代谢通路发生了显著改变(图3-h)。总之,通过对上述差异基因功能富集结果提示,B.vulgatus灌胃后,小鼠小肠上皮细胞的代谢相关通路的改变为重要切入点。
2.4 小肠上皮细胞腺苷合成关键基因表达验证
由于本研究主要关注腺苷的合成过程,对上述差异基因富集的核苷酸代谢、能量代谢通路中涉及的差异表达基因进行了分析。有趣的是,我们发现细胞腺苷合成中几个关键基因,包括Adcy9,Prps1l3,Adarb2,Entpd1表达都发生了上调。其中,与腺苷合成直接相关的Adcy9(腺苷酸环化酶9,adenylyl cyclase 9)能够促进细胞产生cAMP,cAMP调节Entpd1产物CD39生成,继而促进腺苷合成[16]。为了验证该通路,我们通过Western Blot和免疫荧光实验分别从细胞层面(图4-a~图4-c)和组织层面(图4-d~图4-g)对通路中的最后一步——CD39的表达进行了验证,结果发现B.vulgatus灌胃鼠的CD39表达显著增加,提示小肠上皮细胞的腺苷合成被激活。
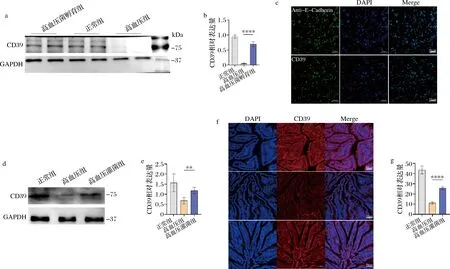
a-Western Blot验证CD39在正常、高血压、高血压灌菌小鼠小肠上皮细胞中表达量的变化;b-正常、高血压、高血压灌菌小鼠小肠上皮细胞CD39平均灰度统计图;c-小肠上皮细胞CD39的免疫荧光表达;d- Western Blot验证CD39在正常、高血压、高血压灌菌小鼠小肠组织中表达量的变化;e-正常、高血压、高血压灌菌小鼠小肠组织CD39平均灰度统计图;f-正常、高血压、高血压灌菌小鼠小肠组织CD39免疫荧光表达;g-正常、高血压、高血压灌菌小鼠小肠组织CD39的平均荧光强度统计图
2.5 小肠上皮细胞腺苷合成与血浆腺苷含量相关性分析
基于HPLC检测血浆腺苷含量及Western Blot验证CD39表达量实验的结果,我们对小鼠血浆腺苷含量与小肠上皮细胞CD39表达量做了皮尔逊相关性分析,血浆腺苷含量与小肠上皮细胞CD39表达量呈显著正相关(P<0.01)(图5)。
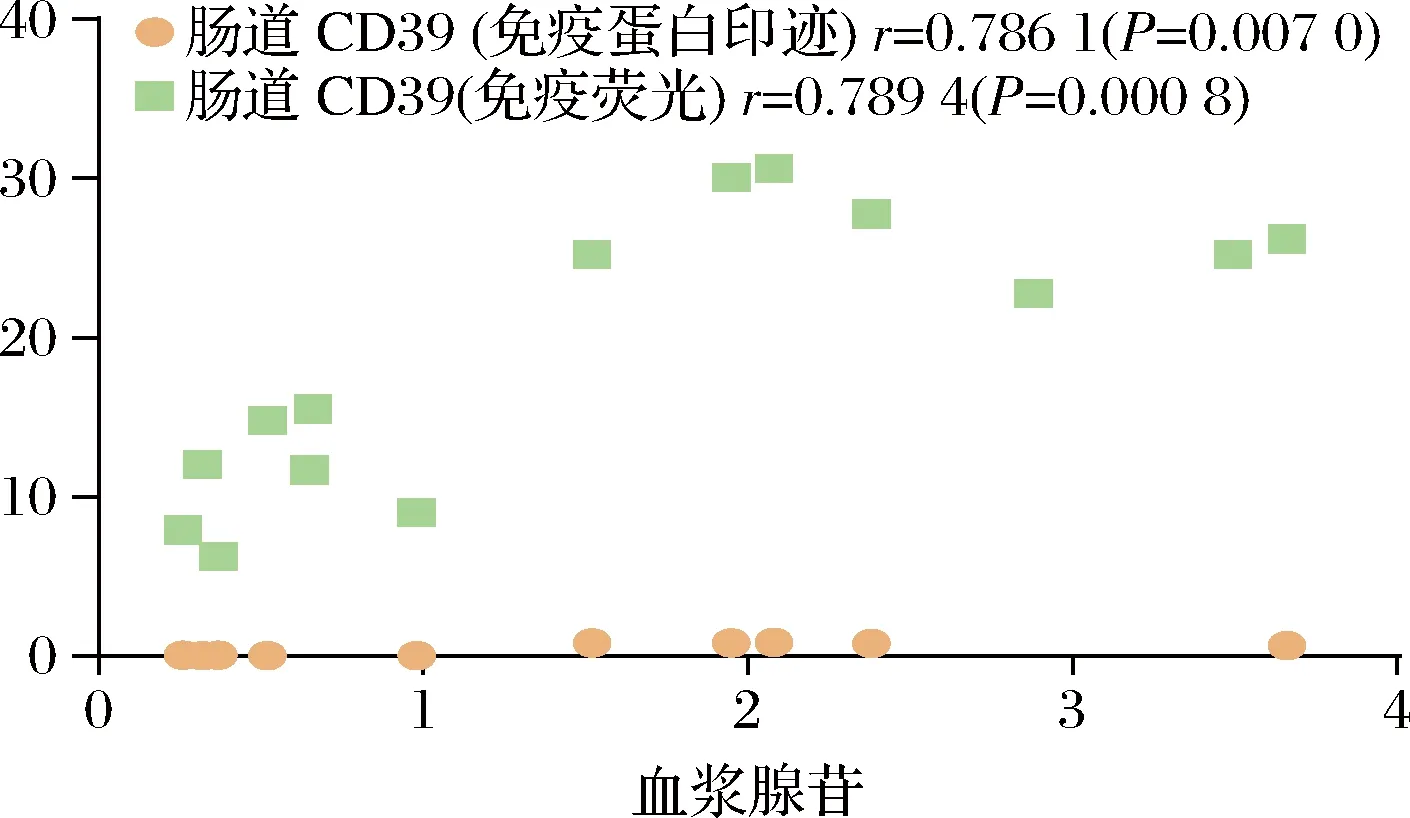
图5 小肠上皮细胞腺苷合成与血浆腺苷含量相关性分析
3 结论与讨论
在过去的十年里,出现了大量证据支持肠道内生菌群在调节血压方面的作用。拟杆菌属作为健康肠道中的优势菌属,对它的研究较为广泛。YOSHIDA等[8]在报道中称,B.vulgatus及其衍生的代谢物可以调控肠道脂多糖产生而维护血管稳态。不过,上述研究中普通拟杆菌与血压的明确关联和作用机制都没有完全阐明。本研究构建了高盐饮食诱导的高血压小鼠模型,发现了B.vulgatus可以调节小鼠高血压进程,证实了该过程伴随着血浆中腺苷含量的增加和小肠上皮细胞腺苷合成通路的激活,且二者存在显著的相关性(图6)。
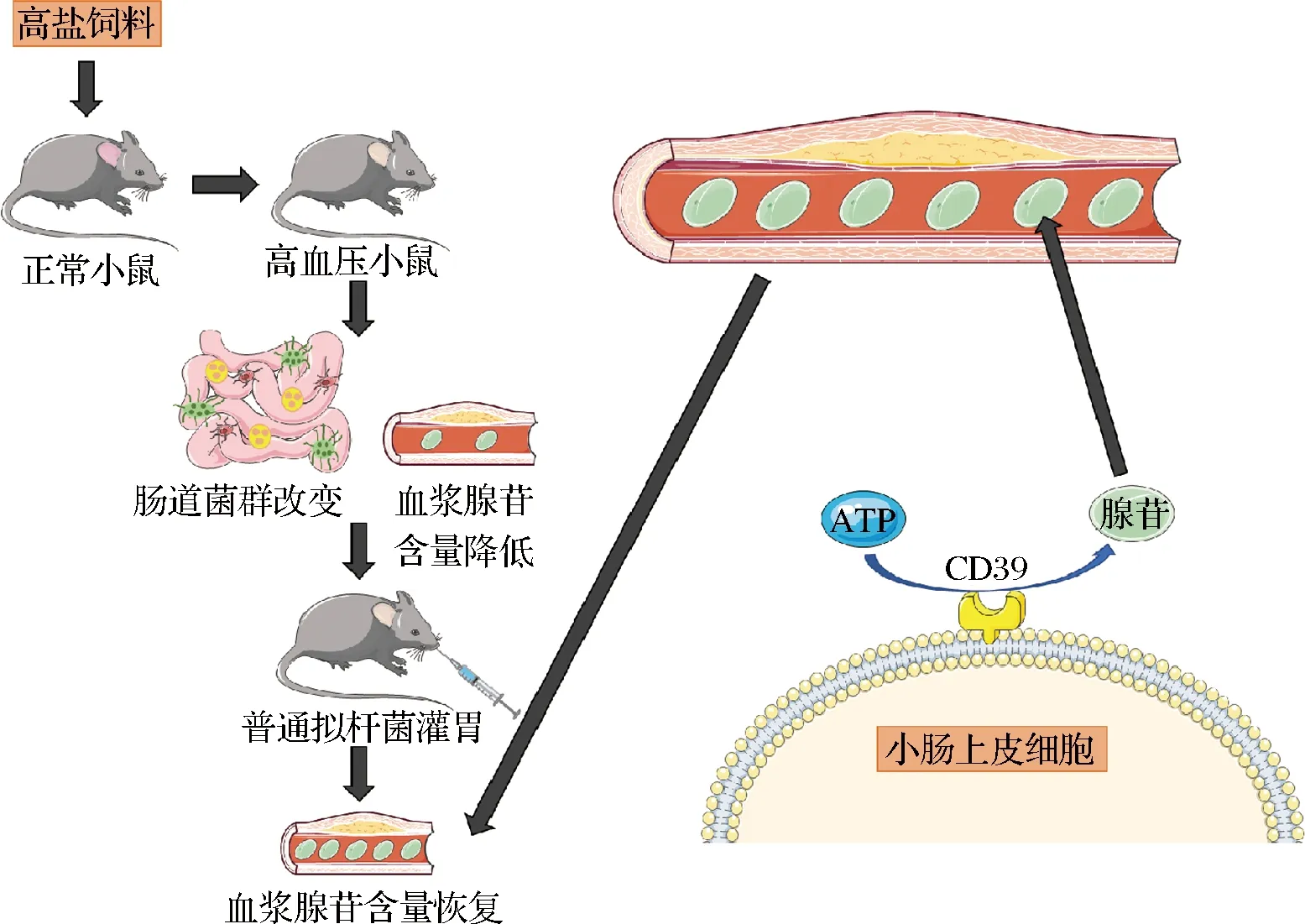
图6 B.vulgatus调控高血压小鼠小肠上皮细胞腺苷合成的机制
由于我们发现了B.vulgatus定殖可升高血浆腺苷的含量,且小肠为腺苷的主要合成场所之一,因此推断血浆中增加的腺苷有一部分可能来源于B.vulgatus与肠道细胞互作,产生的腺苷随后经肠道微血管入血循环。目前,已有研究证实腺苷合成及作用的通路较为复杂。在细胞中,腺苷可以通过ATP和AMP的去磷酸化、甲硫氨酸循环、肾上腺素刺激等通路合成[17];腺苷随后与A1R、A2AR、A2BR和 A3R 4种腺苷受体结合[18],调节炎症反应、血管生成等多种重要的细胞生理病理功能[14],其参与的通路也可以引起机体血管舒张从而缓解高血压[19]。然而,尚不明晰B.vulgatus是通过怎样的通路促进小肠上皮细胞产生腺苷的。因此,为深入解析小肠上皮细胞在与B.vulgatus互作的过程中,涉及哪些腺苷合成相关、核苷酸代谢相关的通路,将B.vulgatus培养前后的小肠上皮细胞的mRNA进行了测序,以便从中筛选到本系统中参与腺苷合成的关键通路,并进行后续验证。以此,我们发现B.vulgatus显著改变了小肠上皮细胞表达谱,影响其代谢过程,其中就包括了小肠上皮细胞上与腺苷合成相关的关键酶CD39[20]。这里需要指出的是,因为本研究关注的是腺苷合成通路,所以在诸多显著变化的代谢通路中我们着重对腺苷生成相关通路进行了解析及验证。但是,在数据分析的过程中我们还发现了诸如蛋白质、核苷酸、能量物质等代谢过程也发生了显著改变,值得在未来研究中继续深入探索。
需要指出的是,本研究在转录组学的实验设计时,采取了高血压小鼠小肠上皮细胞合并培养基孵育与高血压小鼠小肠上皮细胞合并菌液孵育的组间比较方案,筛选出了一些在2组小肠上皮细胞中差异表达的基因,没有设置正常小鼠小肠上皮细胞对照。但后期实验验证候选蛋白质时均设置了正常小鼠小肠上皮细胞对照数据,确保了数据的准确性和合理性。
总之,本研究揭示了B.vulgatus促进小肠上皮细胞合成腺苷的通路,阐述了B.vulgatus缓解高血压的机制。基于小肠上皮细胞为机体腺苷产生的主要场所之一,此处生成的腺苷很有可能经肠道微血管入血循环。因此,在未来的工作中将继续探索腺苷合成后是如何进入血液循环从而发挥作用的,对于阐明普通拟杆菌调节血管稳态的完整机制,具有重要意义。
