酿酒酵母固态发酵的精准调控技术研究
2023-08-15白钰琨廖博曦孙昭高翔陈建新
白钰琨,廖博曦,孙昭,高翔,陈建新*
1(江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122)2(无锡市玉祁酒业有限公司,江苏 无锡,214184)
中国白酒是我国一种传统的乙醇发酵饮料,其发酵方式主要为固态发酵[1]和液态发酵[2]。我国优质的白酒则主要通过固态发酵生产,生产工序主要包含原料选择、酒曲制备、酒醅堆积、入池发酵、酒糟蒸馏、储存产香、勾兑调味及品质控制等[1]。相对于液态发酵来说,固态发酵具有适宜微生物的生长环境;生产能耗低;产生的风味成分更加多样,白酒品质更加出色[3]等优点。但是,由于白酒固态发酵模式的开放性,发酵过程难以实现精准控制。
近些年来,国内外学者对于白酒酒醅发酵过程中微生物群落结构[4-5]及风味物质[6]的研究获得突破性进展。酿酒酵母(Saccharomycescerevisiae)[7-9]作为白酒酿造中的重要真菌微生物,不仅可以产生大量乙醇,还可以将原料中的氨基酸等物质转换成风味成分,对白酒的产量和风味具有重要的影响[10-11]。目前学者们对于酿酒酵母发酵代谢的研究多集中在液态发酵方面,例如,刘朋肖等[12]对酿酒酵母Y3401液态有氧条件进行优化,优化后乙醇产量提高1.24倍,并代谢产生了对白酒品质有重要贡献的风味物质;任文斌[13]通过超声波辅助酿酒酵母液态发酵,将乙醇的产量提高了30.79%;孙美玲等[14]采用固定化及游离酿酒酵母对猕猴桃全汁进行发酵,果酒口味更加纯正柔和,具有更好的抗氧化能力。
本文以白酒发酵过程中具有重要作用的酿酒酵母作为研究中心,试图通过精准控制白酒生产过程中可调控的操作因素进行酿酒酵母单菌固态发酵,研究酿酒酵母在不同发酵条件下的生长及代谢特性。
1 材料与方法
1.1 材料
1.1.1 原料
粉碎高粱、稻壳,取自无锡市玉祁酒业有限公司,取回后真空密封,放在4 ℃冷库保存。
1.1.2 试剂
NaCl、NaOH、HCl、乳酸、乙酸、乙酸钠、酒石酸钾钠、CuSO4·5H2O、酚酞、乙醇、次甲基蓝、亚铁氰化钾等试剂(分析纯),国药集团化学试剂有限公司;白酒36组分混标、2.0%乙酸正丁酯溶液(内标),兰州东立龙信息技术有限公司;葡糖淀粉酶,夏盛实业集团;酵母浸出粉胨葡萄糖琼脂培养基初始接菌量由7.085 lg CFU/g提高到8.401 lg CFU/g酒醅时,乙醇最终产量提高了13.92%,海博生物技术有限公司。
1.1.3 仪器与设备
SPX-250B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;SORVALL-ST-16R型超高速冷冻离心机,赛默飞世尔科技有限公司;KQ5200E型超声波清洗器,昆山市超声仪器有限公司;GC-2010 Plus型气相色谱仪,日本SHIMADZU公司;CT90A型高压灭菌锅,上海伯能仪器有限公司;SW-CJ-2FD型超净工作台,苏州净化气团安泰公司;-70 ℃超低温冰箱,日本Sanyo公司。
1.1.4 菌种
酿酒酵母(Saccharomycescerevisiae),安琪酵母股份有限公司。
1.2 实验方法
1.2.1 发酵酒醅的实验室模拟制备[15]
1.2.1.1 润粮及蒸粮
取粉碎的高粱600.0 g,加420.0 mL(原料的70%)的70 ℃的蒸馏水,混匀,保鲜膜密封后润粮1 h 40 min,然后加60.0 g稻壳,混匀,继续润粮20 min,然后蒸粮40 min。
1.2.1.2 菌液、酶液及酸液配制
取适当干酿酒酵母,加50.0 mL的2.0%的无菌糖水进行溶解,然后放在37 ℃培养箱下温育40 min;取适当的原酶溶液(酶活力为2.6×105U/mL)用10%的pH=4.6醋酸-醋酸钠溶液稀释至100.0 mL;取适当的乳酸溶液用无菌水稀释至50.0 mL。
1.2.1.3 发酵酒醅的制备
取蒸完的粮1.0 kg,混匀后摊粮,冷却到适当温度,添加50.0 mL的菌液、50.0 mL的酸液、100.0 mL的酶液,充分混匀。
1.2.1.4 装罐发酵及留样
将混合后的发酵酒醅装在200 mL的灭菌组培瓶中,每瓶装140.0 g,放在培养箱内进行发酵培养。定时进行发酵酒醅的取样,混匀后放置在-70 ℃冰箱进行保存。
1.2.2 快速判断酒醅发酵结束依据
酿酒酵母在厌氧代谢发酵过程中主要产生乙醇及CO2[16],而CO2通过组培瓶的透气盖排除,乙醇等物质被截留下来。因此,通过测定酒醅样品的减重变化可以快速判断乙醇发酵是否结束,按照每瓶组培瓶装140.0 g酒醅来说,当每24 h的酒醅减重位于0.1~0.2 g,乙醇发酵则基本已经结束。
1.2.3 酒醅理化指标的测定[17-18]
包含菌落数、还原糖、淀粉、酸度、水分的测定。
1.2.4 乙醇含量测定
运用精确度为0.2的酒精计进行测定,取40.0 g发酵酒醅,加100 mL的蒸馏水,混匀,蒸馏冷凝,并定容到75.0 mL,通过酒精计测定乙醇含量,并测定酒样的温度,换算为20 ℃时10 g酒醅中乙醇的质量(g/10 g)。
1.2.5 有机代谢物质的测定[19]
1.2.5.1 标准品测定
购自兰州东立龙信息技术有限公司的白酒36组分混标,测定物质包含乙醛、甲醇、异丙醇、异丁醛、正丙醇、乙酸乙酯、双乙酰、仲丁醇、异丁醇、乙缩醛、正丁醇、异丁酸乙酯、乙酸、异戊醇、丁酸乙酯、乙酸正丁酯(内标)、异戊酸乙酯、丙酸、乳酸乙酯、戊酸乙酯、1,2-丙二醇、异丁酸、正己醇、糠醛、丁酸、异戊酸、己酸乙酯、戊酸、丁酸异戊酯、2-乙基丁酸、庚酸乙酯、3-甲硫基丙醇、己酸、庚酸、β-苯乙醇、己酸异戊酯。
1.2.5.2 酒醅预处理
取10.0 g酒醅,加35 mL的80%乙醇及70 μL内标乙酸正丁酯溶液,混匀后,超声波处理30 min,4 ℃下10 000 r/min离心8 min。用0.22 μm有机滤膜过滤上清液到棕色气相瓶,放在4 ℃冰箱保存。
1.2.5.3 气相色谱分析条件
LZP-930色谱柱(30 m×0.32 mm;1 μm);进样口温度220 ℃,FID检测器温度230 ℃;升温程序为:50 ℃保持6 min,再以5 ℃/min的速度升温至200 ℃,保持10 min;进样量为0.3 μL,分流比为10,载气为高纯氮气,尾吹流量30 mL/min,氢气流量40 mL/min,空气流量400 mL/min。
1.2.5.4 物质的相对定量
本次定量采用内标定量法,按公式(1)、公式(2)计算:
(1)
(2)
式中:Ki,测定物质的相关常数系数;An,混标中内标的峰面积;Ai,混标中测定物质的峰面积;Ci,混标中测定物质的已知质量浓度,mg/L;Cn,混标中内标的已知质量浓度,mg/L;C′i,酒醅中待测物质相对含量,μg/g;C′n,内标的质量浓度,mg/L;A′i,样品中待测样品的峰面积;A′n,样品中内标的峰面积;3.507,1 g酒醅中萃取的样品体积,mL/g。
1.3 统计分析
实验数据均重复测定3次,结果用平均值±标准差表示。利用Excel 2016和Origin 2018进行图表的绘制;利用Design Expert 13进行响应面实验数据的处理及分析。
2 结果与分析
2.1 不同初始加酶量对酿酒酵母固态发酵代谢的影响
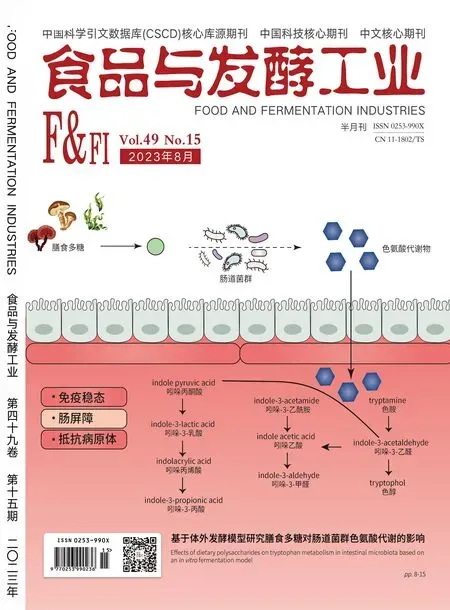
本发酵条件处于30 ℃下恒温发酵。如图1所示,当初始葡萄糖淀粉酶添加量为13.43~67.17 U/g时,酿酒酵母单菌固体发酵的最终乙醇产量基本保持一致,乙醇质量浓度均达到0.976 g/10 g左右;但是,加酶量的不同会影响乙醇的产生速率,这是因为加酶量通过影响酒醅中的还原糖含量(图1-c)影响酵母的生长及代谢,从而影响到乙醇的产生速率。
a-乙醇(20 ℃)含量变化;b-酿酒酵母数量变化;c-还原糖含量变化;d-淀粉含量变化;e-酸度含量变化;f-含水率变化
从图1-b可得出,在长期低糖状态下,酿酒酵母并未急速凋亡。这是因为在低糖状态下,酿酒酵母细胞经历剧烈的生理和代谢变化,能在几分钟内重建恒定的较低能量生产水平,一是通过降低呼吸作用,二是大量自噬(一种释放氨基酸的过程)和通过β氧化的脂质降解来适应低糖环境[20]。
2.2 不同发酵温度对酿酒酵母固态发酵代谢的影响
本发酵条件的初始加酶量为47.02 U/g,初始接菌量为7.792 lg CFU/g。如图2所示,乙醇的最终产量随温度的升高呈现出先上升后下降的变化趋势。最适发酵温度区间为24~27 ℃,乙醇达到最大产量1.065~1.117 g/10 g;从乙醇的产生速率可以看出,温度越高,乙醇的产生速率越快,发酵周期越短。这是因为温度高时抑制了酿酒酵母的生长,降低了对乙醇的耐受能力,但却促进了酿酒酵母代谢速率。

a-乙醇(20 ℃)含量变化;b-酿酒酵母数量变化;c-还原糖含量变化; d-淀粉含量变化
由图2-c可知,不论发酵温度的高低,酒醅中还原糖含量的变化都呈现出一个先下降后上升的变化趋势,这是由于发酵前期酿酒酵母代谢产生大量乙醇,此时还原糖的消耗速率大于其产生速率,而发酵后期,酿酒酵母代谢受到乙醇的抑制,能耗降低,还原糖含量逐渐增加。
2.3 不同初始接菌量对酿酒酵母固态发酵代谢的影响
本发酵条件为30 ℃下恒温发酵,初始加酶量为70.53 U/g。由图3-a可知,发酵酒醅的最佳初始接菌量为8.401 lg CFU/g,当低于此接菌量时,酒醅中乙醇的最终产量随接菌量增加而提高;当高于此接菌量时,酒醅中乙醇的最终产量达到最高且保持稳定。初始接菌量由7.085 lg CFU/g提高到8.401 lg CFU/g酒醅时,乙醇最终产量提高了13.92%。

a-乙醇(20 ℃)含量变化;b-酿酒酵母数量变化;c-还原糖含量变化; d-淀粉含量变化
另外,由图3-b可知,当初始接菌浓度较低时,酿酒酵母经生长繁殖均达到基本相同的稳定期菌体浓度;当初始接菌浓度高于稳定期的菌体浓度时,菌体不会立即大量死亡,而是能维持较长时间,这可能是因为酒醅前期乙醇浓度并不会导致菌体死亡,但随着酒醅中乙醇浓度的逐渐提高,菌体逐渐死亡。
2.4 不同初始酸度对酿酒酵母固态发酵代谢的影响
本发酵条件为30 ℃下恒温发酵,初始接菌量为7.791 lg CFU/g,初始加酶量为47.02 U/g,选用乳酸溶液调节酒醅酸度。首先,由图4-a可知,当酒醅的初始酸度低于0.75 mmol/10 g时,酒醅的乙醇产生速率及最终产酒量均达到最大,此浓度的酸度基本不会抑制酿酒酵母的生长及代谢;当酒醅的初始酸度高于0.75 mmol/10 g时,酒醅的乙醇产生速率及最终的产酒量都随酸度的增加而降低。酸度由0.20 mmol/10 g提高到1.95 mmol/10 g酒醅时,乙醇最终产量降低了16.53%。其次,由图4-b可知,发酵过程中,高酸度酒醅中菌体整体数量都要低于低酸度酒醅,这可能是酸度的提高不仅对酿酒酵母的生长存在抑制作用,还降低了酿酒酵母对乙醇的耐受性。最后,由图4-c可知,发酵阶段主要是通过葡糖淀粉酶来水解淀粉产生还原糖,而酸度低的酒醅不仅产酒速率高,还原糖含量也高,这可能是加入的酸抑制了葡糖淀粉酶的活性,从而降低了糖化速率,这和润粮前加入酸溶液能够促进淀粉糊化[21]正好相反。

a-乙醇(20 ℃)含量变化;b-酿酒酵母数量变化;c-还原糖含量变化;d-酸度含量变化
2.5 多因素综合对酿酒酵母固态发酵产乙醇的响应面法分析[22]
2.5.1 响应面实验设计及结果
由2.1的实验结果可以看出,初始加酶量的改变对酒醅乙醇的最终产量基本没有影响。因此,通过响应面实验探究温度、酸度、接菌量对酿酒酵母单菌固态发酵代谢乙醇的多因素综合影响,结果如表1所示。

表1 响应面实验设计及结果
2.5.2 模型的建立及分析
利用Design expert 13软件进行数据的处理及分析,得到关于乙醇产量的二次回归模型编码方程为:
Y=0.152 230×A-0.186 115×B+0.292 135×C-0.001 074×AB+0.003 936×AC-0.052 105×BC-0.002 965×A2+0.019 752×B2-0.046 193×C2-0.415 475
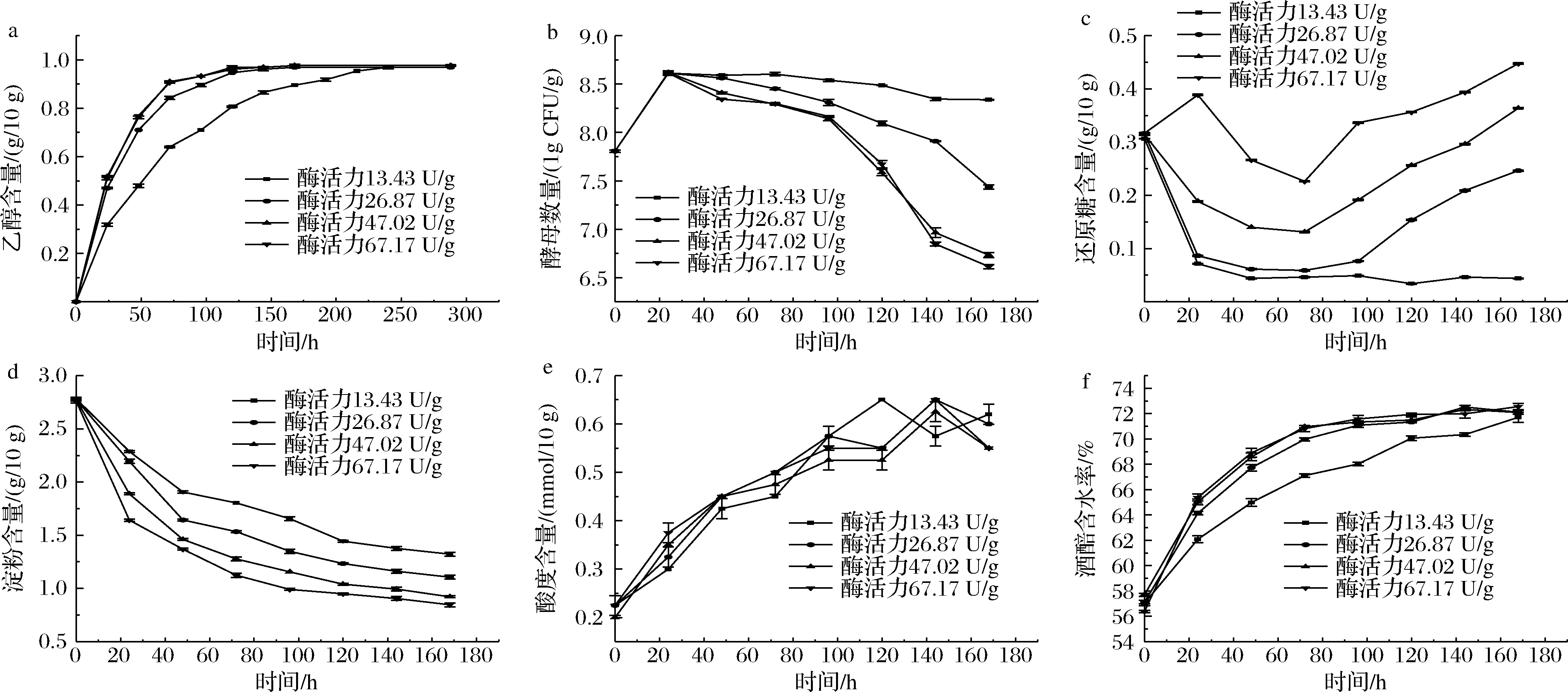
通过模型方差分析表2可以看出,模型极显著(P<0.000 1),其中A及A2对乙醇的产量影响较大,达到极显著(P<0.000 1);C达到了显著(P<0.05);但是B并不显著,这可能是因为随温度及酸度(图5)的提高,酿酒酵母的发酵环境发生改变,影响了酿酒酵母的生长及代谢,降低了接菌量这一因素对乙醇产率的影响作用。另外通过表3可以看出,模型的R2为0.948 7,校正系数R2为0.915 6,预测系数R2为0.887 0,其中校正系数和预测系数较为接近,说明此模型拟合度较好,可以用来分析酿酒酵母单菌固态发酵产乙醇的条件。

表2 模型方差分析
a-温度与酸度对乙醇产量交互影响的三维响应曲面图;b-温度与接菌量对乙醇产量交互影响的三维响应曲面图;c-酸度与接菌量对乙醇产量交互影响的三维响应曲面图

表3 模型R2综合分析
2.5.3 发酵条件的响应面分析
首先,由图5-a可知,随发酵温度的逐渐提高,乙醇产量先增大后减少,在温度位于25.1 ℃时达到最大值,随酸度的增大,乙醇产量逐渐降低;其次,由图5-b可知,随接菌量的提高,乙醇产量和接菌量呈现正相关性,并且温度越低时,接菌量对乙醇产量的影响效果更明显;最后,由图5-c可知,随酸度和接菌量的提高,乙醇产量变化不明显,这是因为酸度和接菌量对乙醇产量的影响存在部分抵消导致的。
2.6 最佳发酵条件下酒醅发酵跟踪分析
根据上述发酵条件的响应面分析可知,最适乙醇产量发酵条件为温度25.1 ℃,接菌量8.323 lg CFU/g,酸度为0.20 mmol/10 g。考虑到实际发酵工艺的易操作性,将优化参数更改为发酵温度25 ℃,接菌量8.300 lg CFU/g,酸度为0.15 mmol/10 g。在此条件下进行跟踪发酵实验,所得最终产酒量为1.198 g/10 g。此条件下利用乙醇产量的二次回归模型编码方程计算得出的产酒率为1.123 g/10 g,实际值与预测值的误差在6.26%,与预测值相差较小,可见该模型较好的预测了实际发酵结果。最适发酵条件下酒醅的相关理化指标及菌体量变化如图6所示。
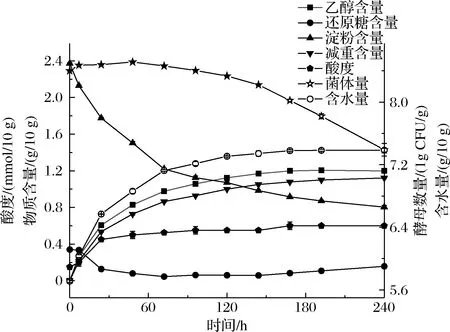
图6 最适发酵条件下酒醅中菌体数及其理化指标变化
2.7 最佳发酵条件下酒醅的风味成分分析
采用气相色谱内标定量法对最佳发酵条件下酒醅的风味成分进行跟踪测定,结果如表4所示。与白酒的36组分相比,酿酒酵母单菌固态发酵共检测出13种风味成分,醇类主要以异丁醇、异戊醇、β-苯乙醇为主,酸类主要以乙酸和丁酸为主,并且还检测出微量的酯类物质,如乙酸乙酯、异戊酸乙酯、丁酸乙酯及己酸异戊酯。其中醇类主要为杂醇油,有研究表明,饮料酒中的杂醇油总量75%来自合成代谢途径,25%来自氨基酸分解代谢途径[23]。但是,由于白酒固态发酵原料含有丰富的氨基酸,酿酒酵母细胞不需要合成氨基酸,同时氨基酸的存在对合成代谢途径具有反馈抑制作用,因此,酿酒酵母主要通过氨基酸分解代谢途径来合成杂醇油[24],异丁醇、异戊醇及β-苯乙醇分别由缬氨酸、亮氨酸及苯丙氨酸分解代谢而产生。糠醛主要产生于发酵的前中期,此物质主要通过(1)糖类和含氮化合物的美拉德反应为主要途径;(2)戊糖的直接裂解为次要途径;(3)戊聚糖间的间接转化(贡献最小),这3条途径进行合成[25]。而酿酒酵母不能直接代谢产生糠醛,而是先通过代谢产生糠醛的前体物质,然后再经美拉德反应而形成。酯类的合成则主要由相应的酸及醇在酯化酶的作用下经酯化作用而产生。关于丁酸的形成机理尚不清楚,还有待进一步研究。

表4 酿酒酵母单菌固态发酵过程中产生的风味成分及其定量 单位:μg/g
3 结论
本文前期通过精准调控探究了单因素变量加酶量、温度、接菌量、酸度对酿酒酵母单菌固态发酵的影响,结果表明,初始加酶量在一定范围内对乙醇产量没有影响;乙醇产量随发酵温度的升高呈现出先上升后下降的趋势,最适发酵区间为24~27 ℃;接菌量与乙醇产量呈现正相关性;酸度则与乙醇产量呈现负相关性。并设置多因素响应面分析,得出最适乙醇产量发酵条件为:发酵温度25 ℃,接菌量8.300 lg CFU/g,酸度0.15 mmol/10 g。对最适发酵条件下的酒醅进行风味成分的跟踪测定,结果表明,酿酒酵母单菌固态代谢过程中主要产生异丁醇、乙酸、异戊醇、糠醛、丁酸、β-苯乙醇等风味物质,并产生少量的酯类物质。
白酒发酵的优劣除了考虑乙醇含量外,还需考虑风味成分组成,这和其他菌株的协同发酵密切相关,为了充分了解白酒固态发酵的机理,对于白酒发酵中其他重要微生物,例如乳酸菌、芽孢杆菌、产酯酵母等的作用及功能,将进行进一步研究。以期后续通过人为调节发酵酒醅的菌株比例来控制风味成分的产生,以此来提高白酒发酵的产量及质量。