苏北沿海保护地耐盐碱辣椒品系(种)对炭疽病的果期抗性评价
2023-08-14张丽娜梅燚王薇薇吴永成陈长军刘哲沈峰冯汝超祖艳侠郑佳秋
张丽娜 梅燚 王薇薇 吴永成 陈长军 刘哲 沈峰 冯汝超 祖艳侠 郑佳秋

摘要:辣椒炭疽病是辣椒生产的主要病害之一,是一种由复合真菌类群引起的真菌性病害,多危害果实,严重降低辣椒品质和市场价值,抗性品种培育是重要的育种目标。通过对盐城、连云港、南通地区辣椒种植区进行炭疽病病原菌分离、纯化,分析其形态特征,同时通过基因序列分析确定当地炭疽病优势致病菌,以高致病力炭疽病优势致病菌尖孢炭疽菌(Colletotrichum acutatum)C18为接种菌,采用菌碟接种法对128份沿海地区耐盐碱辣椒材料进行抗炭疽病筛选。结果表明,沿海地区辣椒炭疽病的优势致病菌为尖孢炭疽菌;羊角椒资源中,有7份高抗辣椒资源,有21份抗病资源,23份耐病资源,以汉丰一号作为对照,炭疽病抗性显著优于汉丰一号的羊角椒资源有23份,其中包括沿海地区农业科学研究所最新登记的盐椒4号品种;牛角椒资源中,有7份耐病资源。沿海地区炭疽病原菌多样性调研和高抗炭疽病辣椒材料的筛选发掘为沿海地区辣椒抗病育种和抗性基因发掘提供了坚实的材料基础。
关键词:辣椒;炭疽病;致病菌;抗性鉴定
中图分类号:S436.418.1+1 文献标志码:A
文章编号:1002-1302(2023)13-0121-06
辣椒(Capsicum annum L.)是我国产值最大的蔬菜之一,且我国辣椒种植面积及产量均呈逐年增长的趋势,是全球产量最多的地区。据联合国粮食与农业组织(FAO)统计,2021年我国辣椒种植面积约82.7万hm2,产量达2 013万t(https://www.fao.org/faostat/)。辣椒也是江苏沿海地区主栽蔬菜作物,由于沿海地区土壤含盐量高,辣椒风味独特[1],深受消费者青睞。但由于沿海地区辣椒的连年种植,辣椒生产过程中病害问题愈发严重,尤其是辣椒炭疽病发病率持续增长,一般年份辣椒平均果实发病率为10%~15%,最严重时甚至达到50%以上[2],已经严重威胁到辣椒的种植和产业发展。
目前,辣椒炭疽病的防治手段主要包括农业防治、化学防治和生物防治。但农业防治效果有限,化学防治带来的抗药性、农药残留、环境污染和健康问题日益严重,而生物防治手段尚不成熟,防治效果不稳定,难以广泛应用于生产实践,因此推广和使用抗病品种是辣椒生产上防治炭疽病最经济有效的方法。优质抗炭疽病品种是发掘抗性基因的材料基础,由于沿海地区辣椒品种的选育一直集中在耐盐碱特性的筛选,免疫和高抗炭疽病辣椒资源匮乏,使得沿海地区辣椒炭疽病抗病育种一直未取得有效突破,迫切需要在沿海地区耐盐碱种质资源的基础上筛选炭疽病高抗种质资源。
辣椒炭疽病主要侵染辣椒叶片和果实[3]。叶片病斑初为褪绿水渍状斑点,逐渐变为褐色,病斑近圆形而中间为淡灰色。果实上发病,先产生水浸状黄褐色斑,扩大后呈圆形或不规则形斑、稍凹陷,具稍隆起的同心环状斑,斑上生黑色或红色小点,潮湿时溢出淡红色黏质物(病菌的分生孢子盘和分生孢子),干燥时病斑常干缩似羊皮纸,易破裂[2]。不同地区辣椒炭疽病病菌种类不同,同一地区不同辣椒品种辣椒炭疽病菌也不同[4-6],已报道的辣椒炭疽病的病原菌主要为胶孢炭疽菌(Colletotrichum gloeosporoides)、黑色炭疽菌(C. nigrum)、黑点炭疽菌(C. capsici)、尖孢炭疽菌(C. acutatum),但沿海地区辣椒炭疽病的优势致病菌尚不明确。确定沿海地区辣椒炭疽优势病原菌,对制定辣椒炭疽病的防治方案及选育抗病品种具有重要的意义。
针对上述问题,本研究自江苏盐城、连云港、南通地区采集了辣椒炭疽病病样,分离鉴定沿海地区辣椒炭疽病的优势致病菌小种,并在沿海地区耐盐碱种质资源的基础上筛选出能够高抗炭疽病当地优势致病小种的种质资源。研究结果旨在为沿海地区优质辣椒炭疽病抗病品种的培育建立优质的抗病种质资源库,对满足生产需求、提高辣椒产能具有重要意义。
1 材料与方法
1.1 试验材料
供试标准菌株C18为南京农业大学杀菌剂生物学实验室陈长军教授提供的尖孢炭疽病菌(C. acutatum)高致病力菌株,该菌株分离自江苏盐城。尖孢炭疽菌株转接到马铃薯葡萄糖琼脂培养基(PDA)平板上,在26 ℃恒温培养箱中黑暗培养5 d后备用。
本研究以江苏沿海地区农业科学研究所多年选育的辣椒品系为试材,穴盘育苗,塑料大棚栽培,采收成熟期无病、整齐的青果接种,重复3次,每个重复16果,每果根据果实大小接种1~3处。
1.2 试验方法
1.2.1 辣椒炭疽病菌菌株分离
辣椒病样2021年采集自江苏盐城、连云港和南通。病样采回后从病健交界处切取小块组织,经75%乙醇浸泡3 s后,用灭菌水冲洗,晾干,置于含有硫酸链霉素的PDA平板上培养5 d,取菌落边缘的小块菌碟转接到新的PDA平板上,培养5 d后,保存,备用。
1.2.2 病原菌的形态学鉴定
病原菌在26 ℃下于PDA平板培养5 d,菌落边缘取5 mm大小菌饼至新PDA平板,26 ℃培养7 d后,观察菌落形态生长变化。光学显微镜下观察炭疽病菌的分生孢子大小、形态等显微特征。
1.2.3 病原菌的分子鉴定
采用真菌DNA快速提取试剂盒(广州索莱宝生物科技有限公司)提取菌株DNA,0.8%琼脂凝胶电泳检测提取产物,-20 ℃保存备用。采用ITS1/ITS4通用引物对ITS序列进行PCR扩增,选取阳性克隆送至南京金斯瑞生物科技有限公司测序。将测序所得序列在GenBank数据库里进行序列比对,在MEGA 11软件中采用Clustal W方法进行序列比对,进而采用最大简约法(maximum parsimony,简称MP)构建系统发育树,分析亲缘关系。
1.2.4 病原菌的致病力测定
病原菌致病力测定采用针刺法接种辣椒[7]。选取分离到的16株尖孢炭疽病菌和C18菌株到PDA平板,5 d后从菌落外周处取直径5 mm菌碟。用灭菌的1 mm注射器针头在汉丰一号辣椒表面人为制造深约为1 mm的伤口,将制备好的菌碟随机接种在辣椒伤口表面,以无菌琼脂块接种作为对照,每个处理6次重复,每个重复5个果实。接种好的辣椒放置于26 ℃培养箱保湿培养5 d后记录病斑直径。
1.2.5 炭疽病抗性鉴定
辣椒果期抗病性鉴定采用针刺法[7-8],略有改进。将活化的尖孢炭疽菌株转接到PDA平板上,5 d后从菌落外周1/3处制备菌碟。试验于2021年进行,辣椒材料种植于江苏沿海地区农业科学研究所新洋试验基地,采集转色期果实,75%乙醇表面消毒并晾干后,用直径1 mm的注射器针头刺穿果实表皮,制造深约1 mm的伤口,将制备好的菌碟随机接种在辣椒伤口表面,每种品系(种)辣椒设置3~6次重复,每个重复5个果实。接种好的辣椒放置于26 ℃培养箱保湿培养5 d后检查结果。
成熟果病级调查分级标准:0 级,无病斑;1级,病斑直径≤0.5 cm;2级,病斑直径>0.5~1.0 cm;3级,病斑直径>1.0~2.0 cm,病斑上无霉或有少量霉层;4级,病斑直径>2.0~3.0 cm,病斑上霉层较多;5级,病斑直径>3.0 cm,病斑上有大量霉层。
病害严重度=∑(发病植株数×病级数)/(总植株数×最高病级数)×100%;
品系群体抗病性划分标准:高抗(HR),病害严重度0~20.0;抗病(R),病害严重度20.1~40.0;耐病(T),病害严重度40.1~50.0;感病(S),病害严重度>50.0。
1.3 数据处理
试验数据以“平均值±标准差”表示,在Excel中进行基本处理后,使用SPSS进行差异显著性分析,使用LSD Test(α=0.05)。
2 结果与分析
2.1 病原菌的菌落特征和形态
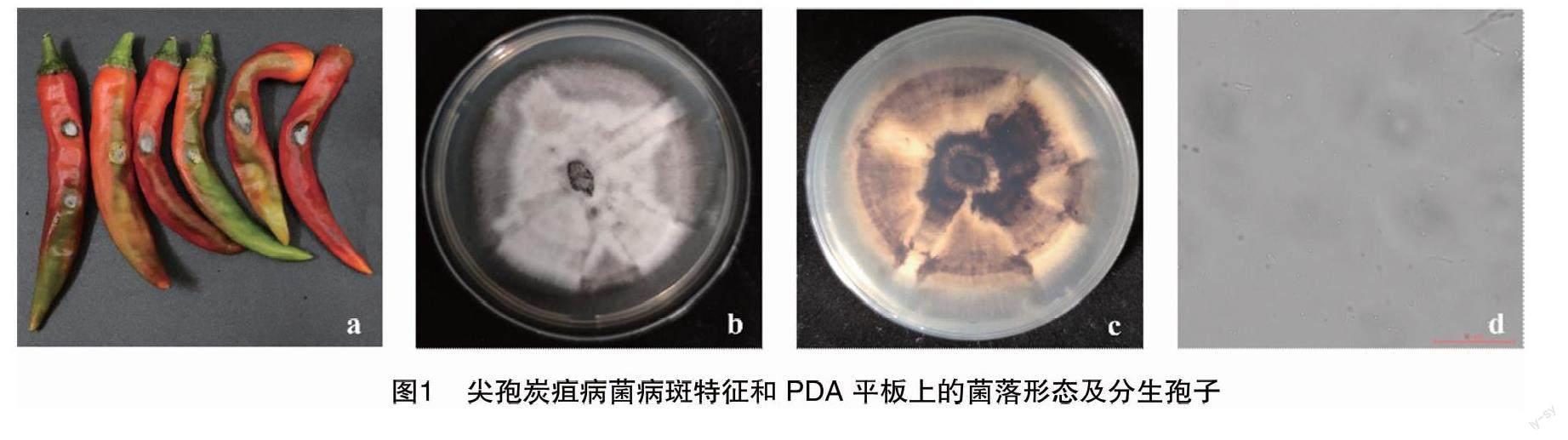
试验共分离18个菌株。经ITS鉴定,其中16株为尖孢炭疽病菌(C. acutatum),1株为链格孢属(Alternaria spp.)菌株,1株为镰刀菌属(Fusarium spp.)菌株。因此,沿海地区炭疽病主要致病菌为尖孢炭疽病菌。尖孢炭疽菌引起的辣椒炭疽病果上病斑褐色,水渍状,呈椭圆形;菌落初期呈灰白色,绒毛状,后期呈灰色,轮纹状(图1)。
2.2 病原菌的分子鉴定
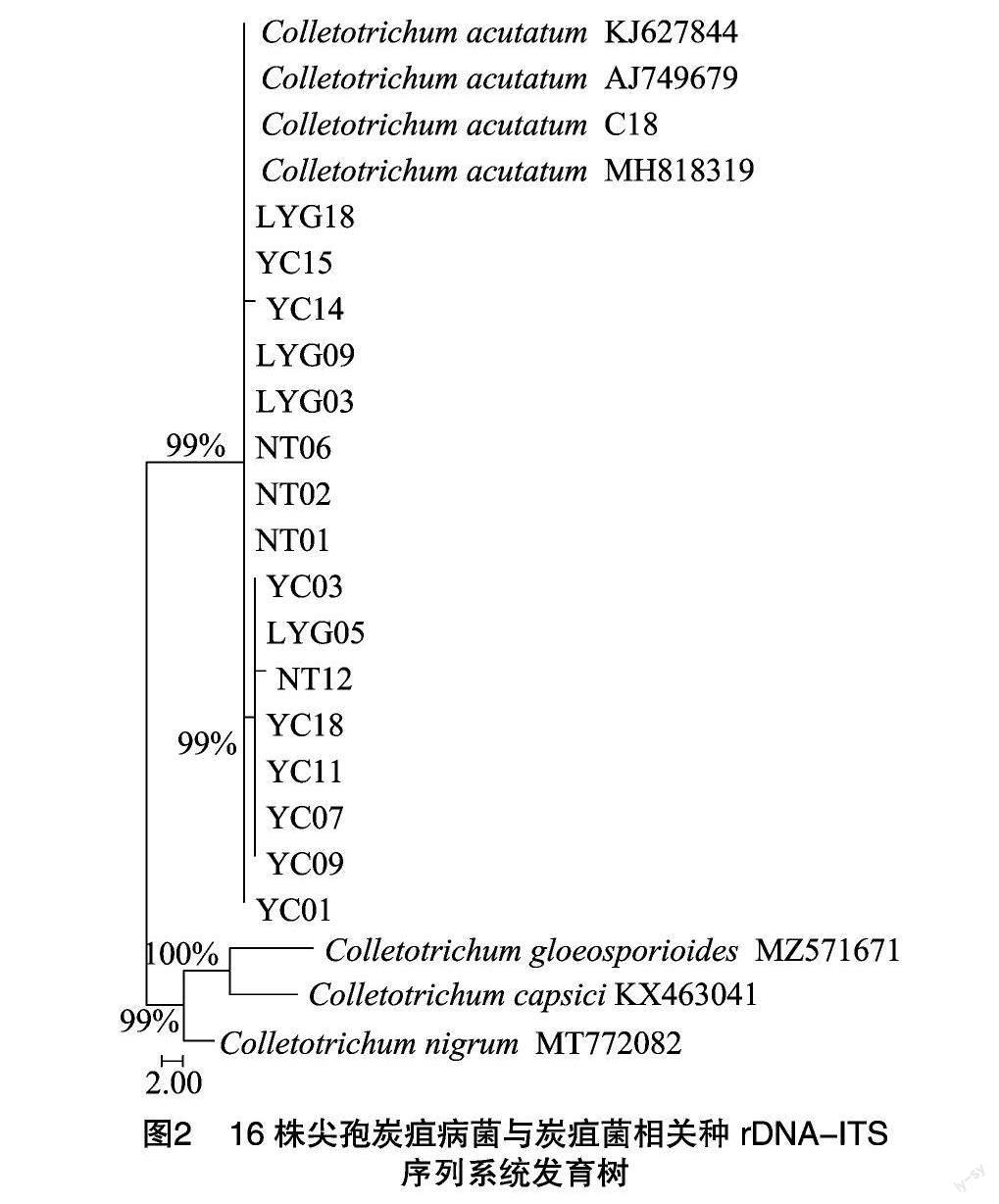
将分离得到的16株尖孢炭疽菌的rDNA-ITS序列与炭疽菌属所得序列进行序列比对和尖孢炭疽菌3株代表菌株及C18、胶孢炭疽菌、黑色炭疽菌、黑点炭疽菌进行系统发育分析,发现16株尖孢炭疽病菌与尖孢炭疽菌KJ627844、AJ749679、MH818319、C18聚在同一分支,亲缘关系置信度99%,胶孢炭疽菌、黑色炭疽菌、黑点炭疽菌聚在另一分支(图2)。
2.3 病原菌致病力测试
将尖孢炭疽菌标准菌株C18和16株分离到的尖孢炭疽菌接种到汉丰一号辣椒上,根据汉丰一号的病斑大小确定分离得到的几株病原菌的致病力。结果表明(表1),标准菌株C18致病力和YC14、NT01、NT02、LYG03致病力相差不大,病斑直径约为10 mm;YC11致病力最强,病斑直径为14.05 mm;LYG18致病力最弱,病斑直径为2.55 mm。
2.4 沿海地区耐盐辣椒品系对炭疽病抗性鉴定
利用尖孢炭疽病原菌标准菌株C18对110份羊角椒资源和18份牛角椒资源进行炭疽抗性筛选(图3)。结果表明,羊角椒资源(表2)中,有12份资源辣椒平均病斑直径<5 mm,有23份资源平均病斑直径满足5 mm≤R<10 mm,剩余75份资源平均病斑直径≥10 mm;牛角椒资源(表3)中,6份平均病斑直径满足5 mm≤R<10 mm的资源,其他12份资源平均病斑直径≥10 mm。根据品系抗病性划分,羊角椒资源中,高抗辣椒资源有YHS1715、YHS0519、YHS1512、YHS0498、YHS1198、YHS2131、YHS1037共7份,抗病资源有YHS0247、YHS1933、YHS1c10、YHS5471、YHS1372、YHS0972、YHS2551、YHS3852、YHS9823、YHS6621、YHS5523、鹽椒4号、YHS4131、YHS5522、YHS85a1、YHS5520、YHS3861、YHS5614、YHS3121、YHS5243、YHS3833共21份,23份耐病资源,59份感病资源;牛角椒资源中,7份耐病资源,11份感病资源。目前,羊角椒是沿海地区广泛种植的辣椒,其中汉丰一号是沿海地区种植规模最大,经济效益最高的羊角椒品种,以汉丰一号作为对照,炭疽病抗性显著优于汉丰一号的有23份羊角椒资源,其中包括了沿海地区农业科学研究所最新登记的盐椒4号品种,是目前最优的值得推广的抗炭疽病辣椒品种。
3 讨论与结论
国内抗炭疽病辣椒品种十分稀缺,种质资源较少。张世才等对74份美国、西班牙等的辣椒种质资源进行尖孢炭疽菌的抗性鉴定,共筛选到2份高抗材料和2份抗病材料,抗病资源的仅占5.4%[9]。马蓉群等以青岛当地主要致病菌红色炭疽菌对收集的73份辣椒资源进行炭疽病抗性鉴定,筛选到7份抗病材料,未筛选到免疫和高抗材料,抗病材料占比9.6%[10]。吕玲玲等对全国不同地区采集到的62份辣椒材料进行炭疽病抗性鉴别,共筛选到2份免疫资源,3份高抗资源,5份抗病资源,抗病性材料占比16.1%[11]。种质资源是育种工作的基石,而筛选抗病材料是抗病性育种的关键,所以对耐炭疽病辣椒资源的筛选与鉴定,对辣椒抗病性选育有重要意义。对于辣椒耐炭疽病材料的室内鉴定,国内多采取苗期喷雾接种的方式,在实际生产中,由于辣椒炭疽病菌主要在结果期侵染果实,因此,以接种离体果实的方法来评价辣椒对炭疽病抗性于辣椒育种而言更为准确[12]。同时,辣椒炭疽是一种复合侵染的真菌性病害,不同地区优势致病菌存在差异,致病性也各不相同[3],这也为炭疽病抗病材料的筛选带来巨大的挑战。
目前,辣椒炭疽病抗病性的鉴定主要依赖接种后观察发病,外观表现是受基因控制的,所以通过分子辅助筛选材料是否具备抗病基因是最可靠、最直接的鉴定材料抗病性的方法[13-14]。根据正向遗传学研究思路,抗性基因的筛选,首先要基于抗原材料,构建分离群体,结合抗性表型和分子标记分离情况,找到与炭疽病抗性紧密连锁的基因,为辣椒抗炭疽病育种提供依据[15-17]。
本研究對沿海地区辣椒炭疽病果实进行了病原菌分离纯化和鉴定,共分离得到16株尖孢炭疽病菌,1株链格孢属和1株镰刀菌属病原真菌,因此,沿海地区辣椒炭疽病的优势致病菌为尖孢炭疽病菌。为筛选适应沿海地区的抗炭疽病辣椒种质资源,本研究对128份耐盐辣椒种质资源进行尖孢炭疽菌抗性筛选,共筛选出7份高抗资源,21份抗病资源,为后期辣椒抗炭疽病品种的研发及抗性基因的遗传和定位研究提供了材料基础。本次鉴定仅用沿海地区主要致病菌尖孢炭疽病菌进行接种,但炭疽病的田间发病还存在其他致病菌,此次筛选到的抗病材料仍需进行进一步的鉴定和筛选,抗病资源的抗病机制及抗病遗传规律尚不清楚,是下一步的研究重点。
参考文献:
[1]张海英,吉雪花,李慧姬,等. 色素辣椒果实品质对盐、碱胁迫的差异响应[J]. 石河子大学学报(自然科学版),2021,39(2):198-203.
[2]郑 洁,周成丽,赵东风,等. 辣椒炭疽病的发病症状与防治方法[J]. 上海蔬菜,2021(3):39-40.
[3]贺字典,薛制国,薛 雨,等. 辣椒炭疽病菌种类及主栽品种抗病性鉴定[J]. 河北科技师范学院学报,2020,34(2):5-9,18.
[4]王 妮,尹显慧,彭丽娟,等. 辣椒炭疽病病原鉴定及其杀菌剂毒力测定[J]. 植物保护,2019,45(4):216-223.
[5]刘方玲. 四川辣椒炭疽病的病原学研究[D]. 雅安:四川农业大学,2015:1-52.
[6]欧阳超,刘思珍,满益龙,等. 辣椒炭疽病菌效应因子NIS1-PCR-RFLP标记系统的建立[J]. 南方农业学报,2021,52(9):2473-2481.
[7]毛爱军,胡 洽,耿三省. 辣椒炭疽病抗病性鉴定技术及利用[J]. 华北农学报,2004,19(2):87-91.
[8]沈会芳,杨祁云,谢祥恩,等. 辣椒尖孢炭疽菌生物学特性研究[J]. 广东农业科学,2021,48(5):110-117.
[9]张世才,李怡斐,王春萍,等. 辣椒种质尖孢炭疽菌抗性鉴定与评价[J]. 园艺学报,2022,49(4):885-892.
[10]马荣群,黄 粤,宋正旭,等. 辣椒炭疽病抗性资源筛选[J]. 北方园艺,2008(9):186-187.
[11]吕玲玲,李 威,谷 会,等. 辣椒资源对炭疽病的抗性比较研究[J]. 种子,2014,33(2):60-62.
[12]林 清,吕中华,黄任中,等. 辣椒炭疽病抗性鉴定方法研究[J]. 西南农业学报,2006,19(6):1071-1073.
[13]Lee J,Hong J H,Do J W,et al. Identification of QTLs for resistance to anthracnose to two Colletotrichum species in pepper[J]. Journal of Crop Science & Biotechnology,2010,13(4):227-333.
[14]deAlmeidaCLP,dosSantosB C,Sudré C P,et al. Genotype-
Ideotype distance index and multivariate analysis to select sources of anthracnose resistance in Capsicum spp.[J]. European Journal of Plant Pathology,2020,156(1):223-236.
[15]Sun C Y,Mao S L,Zhang Z H,et al. Resistances to anthracnose (Colletotrichum acutatum) of Capsicum mature green and ripe fruit are controlled by a major dominant cluster of QTLs on chromosome P5[J]. Scientia Horticulturae,2015,181:81-88.
[16]Kethom W,Mongkolporn O. New QTLs for anthracnose resistance identified in Capsicum baccatum ‘PBC80-derived recombinant inbred lines[J]. Euphytica,2021,217(6):128.
[17]Guo G J,Wang S B,Liu J B,et al. Rapid identification of QTLs underlying resistance to Cucumber mosaic virus in pepper (Capsicum frutescens)[J]. Theoretical and Applied Genetics,2017,130(1):41-52.
