黄鳝HSP70理化性质和分子结构的生物信息学分析
2023-08-14杨文林魏红波杨代勤
杨文林 魏红波 杨代勤

摘要:为了研究黄鳝(Monopterus albus)热休克蛋白70(Heat Shock Protein 70,简称HSP70)的结构和功能,试验采用生物信息学方法对黄鳝HSP70的基本理化性质、亲/疏水性、信号肽、磷酸化位点、糖基化、无序化特征、二级结构、三级结构、相互作用蛋白网络及进化树进行了研究。结果表明,黄鳝HSP70由441个氨基酸组成,相对分子质量为48146.31,等电点为5.98,整体呈碱性,是较稳定的亲水性蛋白质,有信号肽,但不存在跨膜结构,属于分泌型蛋白质。黄鳝HSP70存在35个潜在磷酸化位点,其中包括19个Ser、14个Thr和2个Tyr磷酸化位点,有5个典型的N糖基化位点。二级结构以α-螺旋(39.68%)、延伸链(20.41%)、β-折叠(6.58%)和无规则卷曲(33.33%)为主要结构。热休克蛋白70(HSP70)作为分子伴侣,在蛋白质折叠和运输、细胞周期调控、细胞凋亡和精子发生等方面发挥着重要作用。研究表明,黄鳝HSP70在抵抗外界应激源、环境应激保护等方面起着重要作用。
关键词:黄鳝(Monopterus albus);热休克蛋白70(HSP70);理化性质;分子结构;生物信息学分析
中图分类号:S963.7文献标志码:A
热休克蛋白(Heat Shock Proteins,HSPs)是一个保守的细胞蛋白家族,存在于从细菌到哺乳动物[1]的所有生物体中。热休克蛋白在正常条件下和应激条件下都起着重要的生物学作用[2]。在正常情况下,热休克蛋白作为分子伴侣,参与蛋白质折叠和运输、细胞周期调控、细胞凋亡和精子发生[3]。当生物体受到应激源时,如存在温度、溶解氧水平和渗透压的变化,以及重金属和微生物感染时,热休克蛋白的表达显著增加,使其能够抵抗这些应激源,并维持稳态[4]。
根据其分子量,HSPs可分为HSP110(HSPH)、HSP90(HSPC)、HSP70(HSPA)、HSP60(HSPD)和小HSPs(HSPB)。在热休克蛋白中,热休克蛋白70(HSP70)家族是最保守的家族之一[5]。HSP70家族包含两个不同的基因,一个是诱导型HSP70,另一个是构成型HSC70(热休克同源基因70)[6]。如在人、羊、鼠、鱼、虾、水稻和小麦等物种中均有广泛研究。研究證明HSP70会在人类肿瘤细胞中广泛表达,并且涉及肿瘤细胞的增殖、入侵、转移和凋亡[7]。在山羊中,急性热应激能增加山羊血清TNF-α、IL-1β等促炎细胞因子含量,可能与HSP70家族基因介导了热应激导致山羊炎症反应的免疫调控过程有关[8]。在鱼类中,发现热应激使HSP70在鱼类体内的合成速度显著增加,以提高鱼类的抗应激能力,同时也会使caspase-3基因被激活,诱导细胞发生凋亡[9]。在小麦中,HSP70可以显著提升小麦在胁迫后的抗氧化酶活性,从而参与小麦对胁迫的应答过程[10]。在水稻中,HSP70在水稻应对稻瘟病菌胁迫中具有重要作用[11]。据报道,HSP70可激活先天免疫,并在应激诱导损伤[12]中对应激的适当反应和生存中发挥关键作用。HSP70家族的成员还参与了胚胎和性腺的发育、精子的发生,以及对环境应激的保护。
目前,HSP70在人、羊、鼠、鱼、虾、水稻和小麦等常见动植物方面均有研究,但在黄鳝中的研究较少。该研究利用生物信息学方法对黄鳝HSP70的基本理化性质、亲/疏水性、信号肽、磷酸化位点、糖基化、无序化特征、二级结构、三级结构和进化树等进行预测和分析,为后续的黄鳝HSP70研究提供一定的参考。
1 材料与方法
1.1 材料
黄鳝HSP70基因(XM_020600302.1)及氨基酸序列(XP_020455958.1)在美国国家生物信息中心NCBI(https://www.ncbi.nlm.nih.gov/)数据库中查询得到。
1.2 方法
利用表1中的在线软件工具对黄鳝HSP70的基本理化性质、亲/疏水性、信号肽、磷酸化位点、糖基化、无序化特征、二级结构、三级结构和进化树进行预测分析。
2 结果与分析
2.1 HSP70基本理化性质分析
使用ProtPARam在线软件[13]对黄鳝HSP70进行基本理化性质分析,得出该段氨基酸序列总共编码441个氨基酸,相对分子质量为48146.31,由2162个碳(C)原子、3469个氢(H)原子、589个氮(N)原子、638个氧(O)原子、7个硫(S)原子组成,推测其分子式为C2162H3469N589O638S7,其等电点PI=5.98,不稳定系数为39.60,亲水性平均值为-0.001,消光系数为18910M-1cm-1,因此推测该蛋白为碱性、较稳定的亲水性蛋白质。20种氨基酸含量由高到低排序依次是亮氨酸Leu(11.3%)、缬氨酸Val(9.3%)、甘氨酸Gly(8.4%)、丙氨酸Ala(7.7%)、谷氨酸Glu(7.3%)、异亮氨酸Ile(6.3%)、丝氨酸Ser(6.1%)、精氨酸Arg(5.4%)、脯氨酸Pro(5.4%)、苏氨酸Thr(5.4%)、谷氨酰胺Gln(4.8%)、苯丙氨酸Phe(4.5%)、天冬酰胺Asn(4.3%)、赖氨酸Lys(4.3%)、天冬氨酸Asp(3.6%)、络氨酸Tyr(2.0%)、组氨酸His(1.8%)、甲硫氨酸Met(1.4%)、半胱氨酸Cys(0.2%)、色氨酸Trp(0.2%)。
氨基酸是构成蛋白质的基本单位,是研究蛋白质的结构、生理功能和作用机制的基础。蛋白质的酸碱性作为蛋白质的重要理化性质之一,其酸碱性是由蛋白质侧链上酸性氨基酸和碱性氨基酸上带有的可解离的基团所决定的,这些可解离基团可以决定蛋白质的酸碱性,因此蛋白质的酸碱性取决于该蛋白中酸性氨基酸与碱性氨基酸的数量之比[14]。蛋白质的等电点主要是由可电离氨基酸的pKR值决定的,而且也受其氨基酸组成及分子量分布的影响[15]。
影响蛋白质稳定性的原因有很多,如脱酰胺反应会导致其亲水性发生改变,蛋白质氧化作用会导致蛋白质失活或聚集等,蛋白质的稳定性可以通过蛋白质的不稳定系数来进行预测,若蛋白质的不稳定系数大于40,则该蛋白质为不稳定性蛋白质,若蛋白质的不稳定系数小于40,则该蛋白质为稳定性蛋白质[16]。蛋白质的消光系数指的是蛋白质对某段波长光的吸收能力,且与该蛋白质中半胱氨酸的数量有较大关系[17],在HSP70中只存在一个半胱氨酸,蛋白质中没有二硫键,所以HSP70的消光系数仅为18910M-1cm-1。
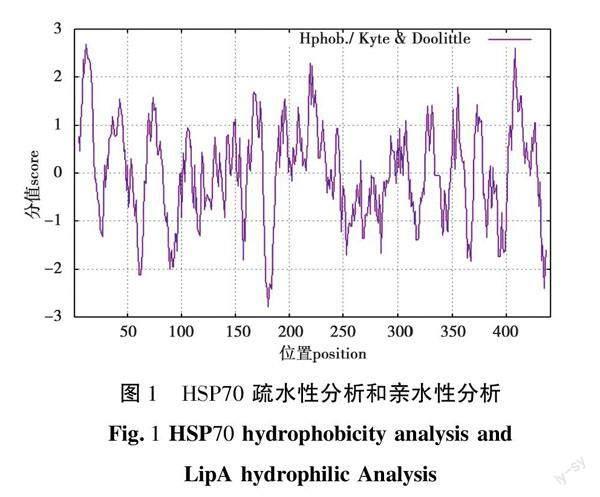
2.2 HSP70亲/疏水性分析
利用在线软件ProtScale[18]对黄鳝HSP70亲/疏水性进行预测分析,结果如图1所示。根据K-D标度定义疏水性氨基酸较高打分值>0表示疏水性,<0表示亲水性得出,黄鳝HSP70有22个区域具有疏水性,最强疏水区在Gly9~Leu16区间,疏水区最强位点为第12位的异亮氨酸,分值为2.689;HSP70有15个区域具有亲水性,最强亲水区在Asp178~Asn183亲水区最强位点为180位的精氨酸,分值为-2.778。
氨基酸的亲/疏水性的分布对蛋白质的结构和功能具有重要的作用。亲水性氨基酸和疏水性氨基酸能预测蛋白质跨膜的位置,疏水氨基酸的疏水基團可以构成疏水的二级结构便于蛋白质的跨膜形成更高级结构,是维持蛋白质三维结构的稳定性以及驱动蛋白质折叠的最主要的动力,疏水性氨基酸也常作为水溶性蛋白质的内部支撑结构[19]。
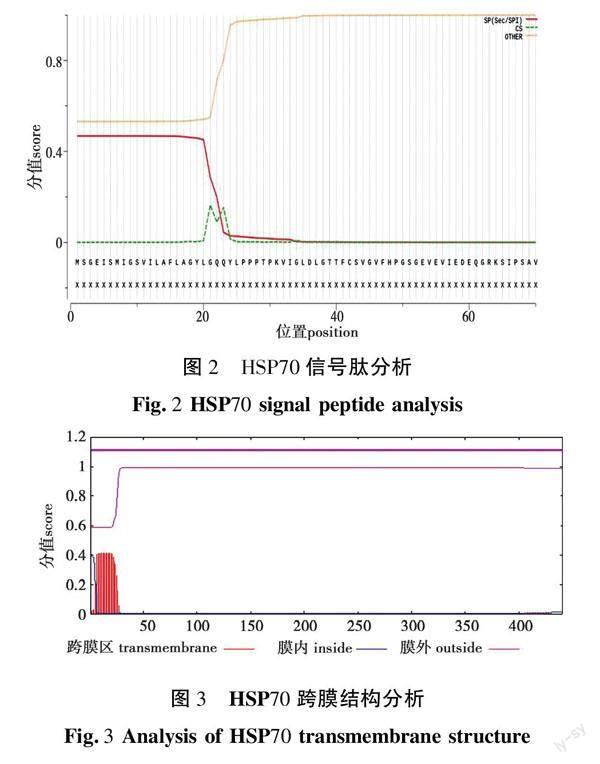
2.3 HSP70信号肽、跨膜结构分析
利用在线程序SignalP5.0对HSP70进行信号肽预测分析,结果如图2所示。黄鳝HSP70信号肽分析发现在20~24位氨基酸之间存在裂解位点,存在信号肽,故推测该蛋白为分泌型蛋白质,结合其亲/疏水性分析发现20~25位氨基酸为疏水性氨基酸,表明HSP70前段信号肽的疏水性较强。信号肽处于蛋白质N端,是引导新合成的蛋白质向分泌通路转移的短肽链,对蛋白质的引导和定位起着重要的作用,是分泌型蛋白质发挥生物学功能不可或缺的一部分。
利用在线程序TMHMM2.0对HSP70进行跨膜结构预测分析,结果如图3所示。黄鳝HSP70跨膜结构分析发现HSP70不存在跨膜结构,所以推测HSP70在细胞外或细胞膜表面发挥其生物学功能,不通过跨膜发挥生物学作用。跨膜结构作为蛋白质跨越细胞膜的通道,对蛋白质发挥其功能和蛋白质的定位具有重要作用。
2.4 HSP70的磷酸化位点
通过在线程序NetPhos3.1对HSP70进行预测分析,结果如图4所示。通过对黄鳝HSP70的磷酸化位点分析表明,HSP70有35个潜在磷酸化位点,其中包括19个Ser、14个Thr和2个Tyr磷酸化位点。结果分析表明,HSP70存在多个磷酸化位点,这些位点可能是调控HSP70活性的靶位点。
蛋白质的磷酸化指的是通过蛋白激酶催化,把磷酸基团转移到底物蛋白质氨基酸残基上的过程,蛋白质的磷酸化主要集中在肽链中的丝氨酸、苏氨酸和络氨酸等残基上,当磷酸化作用后,使蛋白质带有了电荷,从而使蛋白质的结构发生改变,进一步引起蛋白质活性的变化,蛋白质的磷酸化是调节和控制蛋白质活力和功能的重要机制[20]。
2.5 HSP70的糖基化分析
通过在线程序NetNGlyc对HSP70的糖基化位点进行预测分析,结果如图5所示。结果分析表明,黄鳝HSP70有5个典型的N糖基化位点,分别位于126、136、183、297、397位,此范围内有多个糖基化修饰位点,预测该区段内的氨基酸对HSP70发挥其生物学功能具有重要的意义。
糖基化的主要作用是在蛋白质成熟过程中折叠成正确的构想和增加蛋白质的稳定性是由糖基转移酶催化的单糖与蛋白质上的某些残基形成共价连接,是蛋白质的一种重要的翻译后修饰,在蛋白质的机构和功能中发挥极其重要的作用[21]。
2.6 二级结构预测及三级结构同源建模
通过在线程序SOPMA对黄鳝HSP70的二级结构进行预测分析,结果如图6所示。预测结果表明,HSP70含有α-螺旋、延伸链、β-折叠和无规则卷曲四种结构,其中α-螺旋和无规则卷曲占比较大,分别为39.68%、33.33%,延伸链和β-折叠占比分别为20.41%、6.58%。
通过在线程序SWISS﹣MODEL对HSP70的三级结构进行预测分析,得到HSP70的三级结构图(图7),目标蛋白与模板蛋白结构相似性的TM值为0.74±0.05,GMQE为0.69。黄鳝HSP70以α-螺旋、延伸链、β-折叠和无规则卷曲为主要结构,图中蓝色表示α-螺旋、黄色表示无规则卷曲、红色表示延伸链、绿色表示β-折叠。三级结构图中以α-螺旋和无规则卷曲为主,与二级结构预测结果一致。
蛋白质的空间结构通常包括蛋白质一级、二级和三级结构。蛋白质的一级结构决定了二级结构和三级结构的构象,是蛋白质发挥生物活性的基础;二级结构进一步盘绕、折叠成三级结构,而蛋白质的二级结构作为蛋白质分子的早期折叠阶段,是蛋白质三维结构的基础;蛋白质的三级结构和四级结构确定了蛋白质的三维结构,并进一步影响蛋白质的功能特性[22]。蛋白质生物功能的行使与其空间结构密切相关,其功能调控也主要依赖于蛋白质构象和相互作用的动态调节[23]。
2.7 进化树分析
在NCBI搜索到HSP70在人、黄牛、家鼠、野猪、鸡、中华鳖和大黄鱼中的同源序列,在利用Clustal Omega软件进行同源序列比对后,利用MEGA-X软件构建进化树,结果如图8所示,HSP70基因的进化树分为两大支,黄鳝一支,其他七个物种一支,黄鳝与其他几个物种的亲缘关系都比较远,而人与黄牛较近,其次是家鼠,再者是野猪;鸡与中华鳖之间较近,其次是大黄鱼。
3 讨论
该研究在生物信息学的基础上通过各种生物信息分析软件对黄鳝HSP70的基本理化性质、亲/疏水性、信号肽和跨膜结构、磷酸化位点、糖基化、二级结构和三级结构进行分析和预测。分析结果表明,在黄鳝HSP70中亮氨酸Leu、缬氨酸Val等的含量最高,半胱氨酸Cys和色氨酸Trp的含量最低,在蛋白质的一级结构中,亮氨酸等水溶性氨基酸常作为水溶性蛋白质的内部支撑结构,而半胱氨酸所形成的二硫键对于蛋白质结构的稳定性具有重要作用,可推测黄鳝HSP70稳定性较低,与理化性质分析结果一致。蛋白质的酸碱性是由蛋白质侧链上酸性氨基酸和碱性氨基酸上带有的可解离的基团所决定的,这些可解离基团可以决定蛋白质的酸碱性,因此蛋白质的酸碱性取决于该蛋白中酸性氨基酸与碱性氨基酸的数量之比,在黄鳝HSP70中碱性氨基酸的数量远多于酸性氨基酸的数量,可推测黄鳝HSP70为碱性蛋白质,与理化性质分析结果一致。蛋白质的消光系数与蛋白质中半胱氨酸的数量有较大关系,在黄鳝HSP70中半胱氨酸仅占该精氨酸总数的0.2%,所以黄鳝HSP70的消光系数较低,与理化性质分析结果一致。
黄鳝HSP70亲/疏水性分析发现,20~25位氨基酸为疏水性氨基酸,表明HSP70前段信号肽的疏水性较强。分析表明黄鳝HSP70不存在跨膜区,所以推测HSP70在细胞外或细胞膜表面发挥其生物学功能,不通过跨膜发挥生物学作用[19]。
蛋白質的磷酸化是生物体内重要的共价修饰方式之一,与信号转导、基因表达以及细胞生长发育等众多生物体机制调控起着重要作用,在磷酸化反应中,蛋白质的酯化作用会导致其构型和生物活性发生改变[20]。对黄鳝HSP70磷酸化位点预测分析发现存在多个磷酸化位点,这些位点可能是调控黄鳝HSP70生物活性的靶位点。
蛋白质的糖基化和磷酸化都是蛋白质翻译后修饰的组成部分,在细胞免疫、信号传导、蛋白翻译调控、蛋白降解等诸多生物过程中也起着重要作用[24]。根据黄鳝HSP70的糖基化位点分析发现,糖基化位点分布在126~397位,可知发挥功能的结构域可能在126~397位,其他的碱基可能主要起修饰蛋白质的作用。
黄鳝HSP70的二级结构和三级结构分析发现,黄鳝HSP70以α-螺旋、延伸链、β-折叠和无规则卷曲为主要结构。黄鳝HSP70的二级结构和三级结构及其生物功能与其他生物HSP70相似。
在不同种属的HSP70中,黄鳝HSP70与其他几个物种亲缘关系较远,但除黄鳝HSP70外其余几个物种HSP70关系较近,其序列也高度相似,属于保守性蛋白质。结构决定功能,故而可以推测除黄鳝外的几个物种HSP70所行使的生物功能类似。
4 结论
该研究利用生物信息学分析的方法分析黄鳝HSP70的基本理化性质和分子结构,结果得出黄鳝HSP70由441个氨基酸组成,相对分子质量为48146.31,等电点为5.98,整体呈碱性、较稳定的亲水性蛋白质,有信号肽,但不存在跨膜结构,属于分泌型蛋白质。存在多个磷酸化和糖基化位点,二级结构和三级结构以α-螺旋、延伸链、β-折叠和无规则卷曲为主要结构。该研究将为进一步研究黄鳝HSP70的结构和功能提供参考。
参考文献:
[1]Tong Liu,Luqing Pan,Yuefeng Cai,et al.Molecular cloning and sequence analysis of heat shock proteins 70 (hsp70) and 90 (hsp90) and their expression analysis when exposed to benzo(a)pyrene in the clam ruditapes philippinarum[J].Gene,2015,555(2):108-118.
[2]Weijie Mu,Haishen Wen,Jifang Li,et al.Cloning and expression analysis of a hsp70 gene from korean rockfish (sebastes schlegeli )[J].Fish and Shellfish Immunology,2013,35(4):1111-1121.
[3]Di-An Fang,Qun Wang,Lin He,et al.Corrigendum to “characterization of heat shock protein 70 in the red claw crayfish (cherax quadricarinatus): evidence for its role in regulating spermatogenesis” [gene 492 (2012) 138-147][J].Gene,2012,503(1):177-177.
[4]Anon.Gram-negative bacteria-vibrionaceae; new vibrionaceae findings from ningbo university described [molecular cloning and expression analysis of five heat shock protein 70 (hsp70) family members in lateolabrax maculatus with vibrio harveyi infection][J].Ecology Environment & Conservation,2017:3292.
[5]JIN Shihuai,DENG Zhaochao,XU Shengyong,et al.Genome-wide identification and low-salinity stress analysis of the hsp70 gene family in swimming crab (portunus trituberculatus).[J].Int J Biol Macromol,2022,208:126-135.
[6]LI Jiuxuan,ZHANG Haibin,ZHANG Xiuyue,et al.Molecular cloning and expression of two heat-shock protein genes (hsc70/hsp70) from prenant's schizothoracin (schizothorax prenanti).[J].Fish Physiol Biochem,2015,41(2):573-85.
[7]樊欣,彭仁.热休克蛋白70:生物学功能与作用机制研究进展[J].生命科学,2019,31(03):270-278.
[8]彭孝坤,赵天,黄晓瑜,等.急性热应激对山羊血液生化指标及血淋巴细胞热休克蛋白70家族基因表达的影响[J].畜牧兽医学报,2019,50(06):1219-1229.
[9]张华琨,王冠,王秀利.热应激对鱼类hsp70基因和caspase-3基因影响的研究进展[J].河北渔业,2022(02):28-32.
[10]王艳朋.小麦B-box和Hsp70基因家族的全基因组分析[D].哈尔滨:哈尔滨师范大学,2021.
[11]刘秋林.稻瘟病菌胁迫下水稻热激蛋白质与异三聚体G蛋白质的作用机理研究[D].福州:福建农林大学,2015.
[12]Jianhua Ming,Jun Xie,Pao Xu,et al.Molecular cloning and expression of two hsp70 genes in the wuchang bream ( megalobrama amblycephala yih)[J].Fish and Shellfish Immunology,2009,28(3):407-418.
[13]WILKINS MR,GASTEIGER E,BAIROCH A,et al.Protein identification and analysis tools in the expasy server.[J].Methods Mol Biol,1999,112:531-52.
[14]吴斌. 固定化细胞酶性质及蛋白质分子可及性研究[D].武汉:武汉大学,2003.
[15]吴松锋. 蛋白质组表达谱基本生物信息学研究及全蛋白质组等电点分布研究[D].北京:中国人民解放军军事医学科学院,2005.
[16]GAMAGE D G,GUNARATNE A,PERIYANNAN G R,et al.Applicability of instability index for in vitro protein stability prediction.[J].Protein Pept Lett,2019,26(5):339-347.
[17]PACE CN,VAJDOS F,FEE L,et al.How to measure and predict the molar absorption coefficient of a protein.[J].Protein Sci,1995,4(11):2411-23.
[18][18]KYTE J,DOOLITTLE R F.A simple method for displaying the hydropathic character of a protein[J].J Mol Biol,1982,157(1):105-132.
[19]呂文涛,杨华,杨彩梅,等.不同物种ANGPTL4基因及其蛋白理化性质和分子结构的生物信息学分析[J].中国畜牧杂志,2022,58(02):127-136.DOI:10.19556/j.0258-7033.20210409-04.
[20]梁前进,王鹏程,白燕荣.蛋白质磷酸化修饰研究进展[J].科技导报,2012,30(31):73-79.
[21][21]YIN Xiaobo,KONISHI takayuki,HORIKAWA Kazuo,et al.Structure and function of potential glycosylation sites of dynactin-associated protein dynap.[J].Mol Biotechnol,2022(prepublish):1-10.
[22]丁静,钱俊青.蛋白质二级与三级结构的表征方法[J].浙江化工,2020,51(11):49-54.
[23]周烨,刘哲益,王方军.结构蛋白质组学研究进展[J].色谱,2019,37(08):788-797.
[24]李军,杜鑫,Hosseini MoghaddamSH,等.蛋白质糖基化修饰研究进展[J].科技通报,2009,25(06):773-778+783.
Bioinformatics analysis of physical and chemical properties and molecular structure of Monopterus albus HSP70
YANG Wenlin1,WEI Hongbo1,YANG Daiqin1,2
(1.College of Animal Sciences,Yangtze University, Jingzhou 434025, Hubei China; 2. Hubei Province Monopterus albus Technology Research Center, Jingzhou 434025, Hubei China)
Abstract:In order to study the structure and function of Monopterus albus Heat Shock Protein 70(HSP70), bioinformatics methods were used to study the basic physical and chemical properties, hydrophilicity/hydrophobicity, signal peptides, phosphorylation sites, glycosylation, disorder characteristics, secondary structure, tertiary structure, interaction protein network and evolutionary tree of Monopterus albus Hsp70. The results showed that Monopterus albus HSP70 was composed of 441 amino acids, with a relative molecular weight of 48146.31 and an isoelectric point of 5.98. It was an alkaline, relatively stable hydrophilic protein with signal peptides, but no transmembrane structure, belonging to a secretory protein. There are 35 potential phosphorylation sites in Monopterus albus HSP70, including 19 ser, 14 thr and 2 Tyr phosphorylation sites, and 5 typical N-glycosylation sites. Secondary structure with α- Spiral(39.68%), extended chain(20.41%) β- Folding(6.58%) and irregular curling (33.33%) are the main structures. As a molecular chaperone, Heat Shock Protein 70(HSP70) plays an important role in protein folding and transport, cell cycle regulation, apoptosis and spermatogenesis. These results indicate that eel HSP70 plays an important role in resisting external stressors and protecting environmental stress.
Keywords:Monopterus albus; HSP70; physical and chemical properties; molecular structure; bioinformatics analysis
基金項目:财政部和农业农村部国家现代农业产业技术体系资助项目(CARS-46)。
作者简介:杨文林(1998- ),男,硕士研究生。研究方向:特色淡水鱼类增养殖。E-mail:2587022061@qq.com。
通信作者:杨代勤(1966- ),男,教授。研究方向:特色淡水鱼类增养殖学。E-mail:yangdaiq@163.com。
