白术多糖硫酸酯制备工艺优化及抗乳腺增生作用
2023-08-13厉昌旭张意可戚泽筠汤威威刘嘉悦邵梦婷王艳艳
厉昌旭,李 烁,张意可,戚泽筠,汤威威,高 琪,刘嘉悦,邵梦婷,王艳艳,赵 宏
(佳木斯大学药学院,黑龙江佳木斯 154007)
白术(Atractylodes macrocephalaKoidz)为多年生菊科草本植物,是我国传统的中草药,其味苦、甘,性温,归脾、胃经,具有健脾益气、燥湿利水等功效,且白术属药食同源性药材,早在2002 年便被国家卫健委纳入可用于保健食品的中药材,其在食品和医药领域有着广泛作用,古人常以白术为原料熬汤,用以驱除体寒,现代主要用于补脾胃,疏肝气[1-3]。研究发现白术中含有挥发油、多糖以及氨基酸等多种化学成分,其中,多糖是其主要活性成分之一,具有抗氧化、抗衰老、促进胃肠黏膜损伤修复、保护肝脏等作用[3]。目前,白术多糖(AMP)在分离、纯化、药品及保健产品等方面拥有广泛的研究报道,但对其进行结构修饰及修饰后活性研究等方面却鲜有报道[4]。
中药多糖是药用植物中的主要活性成分之一,是生物体中继蛋白质、核酸之后的新一类信息分子[5]。现有研究表明,多糖的活性与其结构密切相关,因此,对多糖进行适当修饰可改变其分子结构和理化性质,从而可以提高或改变其原本的生物活性。目前,中药多糖的各种修饰方法中,硫酸酯化、磷酸化和羧甲基化是最常见的方法[6-8]。其中硫酸酯化会取代中药多糖中的羟基,使得C-6 位的单糖残基更为活跃,相比于其他两种修饰方法,硫酸酯化多糖的生物活性,如抗氧化、抗病毒等有明显提高[9]。硫酸酯化常用的方法为浓硫酸法、三氧化硫-吡啶法、氯磺酸-吡啶法,其中浓硫酸法具有试剂方便易得、制备流程简单易行、易分离、毒性低等优点[10]。
研究证实,乳腺属湿寒性器官,而现代人吃的食物又普遍性凉,进而导致乳腺功能的失衡,引发乳腺增生,故在乳腺增生的日常保健中要避免摄入高脂性凉的食物,可适量服用一些养血、益气、散瘀、温热类的营养保健品或食物,还应保持心情舒畅,营造良好的内外环境。而白术是可缓解人体湿寒性的食品原料,更有“白术茶”“参苓白术颗粒”等可散寒除痹,补脾益气的保健佳品,故以白术为原材料用于乳腺增生的食疗保健产品必将会有广阔的市场[11]。故本文基于对天然活性成分衍生增效这一理念,结合多糖羟基是其重要修饰基团的理论基础,结合前期研究基础,以增强白术多糖治疗乳腺增生为目的,得到白术多糖硫酸酯制备工艺,所得参数稳健可靠,重现性高,方便易得,所制备硫酸酯化白术多糖在改善MGH 大鼠病理及生理等方面有显著提升,不仅为其它植物多糖的衍生物制备工艺研究提供了理论参考,为天然产物增效研究提供科学思路,同时也为白术在药食两用方面的开发提供基础。
1 材料与方法
1.1 材料与仪器
SD 大鼠(SPF 级) 50 只,雌性(200~220 g),长春亿斯实验动物技术有限责任公司,(许可证号:SCXK(吉)-2020-0002)。饲养于佳木斯大学SPF 级实验动物中心,动物使用许可证号:SYXK(黑)2021-018,饲养环境的温度为(22±2)℃,湿度为60%±5%。所有实验程序均经佳木斯大学实验动物中心伦理委员会审核通过(伦理批号:JMSU-242);白术 哈尔滨普方药业饮片有限公司,产地:浙江,批号:201001,经佳木斯大学药学院张宇教授鉴 定为菊科植物白术(Atractylodes macrocephalaKoidz.)的干燥根茎;二苯代苦味酰肼 天津市恒兴化学试剂制造有限公司;苯甲酸雌二醇、黄体酮注射液上海全宇生物科技动物药业有限公司;枸橼酸他莫昔芬片 扬子江药业集团;所有分离用有机溶剂 均为国产分析纯。
F-101S 型恒温磁力搅拌器 郑州长城科工贸有限公司;FDU-1200 型冷冻干燥机 日本东京理化株式会社;FTIR-8400S 型红外光谱仪 日本Shimadzu公司;Agilent-1260 高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 白术多糖(AMP)的制备 白术粉碎、干燥后,采用70%乙醇回流脱脂,阴干。取白术干燥粉末500 g,加入9 L 蒸馏水,90 ℃回流提取3 次,每次3 h,过滤,合并滤液,减压浓缩,离心,取上清液加入无水乙醇至上层溶液乙醇浓度为80%,4 ℃静置48 h,4000 r/min,离心10 min,收集沉淀,复溶浓缩,冷冻干燥后得白术总多糖,经Sevag 法除蛋白,透析,冷冻干燥,得AMP。
1.2.2 硫酸酯化白术多糖(SAMP)的制备 将2.5 mL正丁醇按照一定物料体积比与浓硫酸混合后加入至干燥三颈瓶中,随后加入125 mg 的(NH4)2SO4充分搅拌,再将0.2 g AMP 缓缓加入,在一定温度下,搅拌反应一定时间。反应结束后采用2.5 mol/mL 的NaOH 调节反应液pH 至中性(pH7.0~8.0)。透析48 h,加入无水乙醇至上清液浓度为80%,4 ℃静置48 h,4000 r/min 离心15 min 收集沉淀,复溶浓缩,冷冻干燥得到SAMP。每组实验重复3 次,计算SAMP 硫酸基取代度[12]。
1.2.3 硫酸基取代度的测定 采用氯化钡-明胶浊度法,绘制硫酸基取代度(degree of substitution,DS)标准曲线[13-14]。称取SAMP 10 mg 于10 mL 水解管中,加入1 mol/L 盐酸溶液定容,振荡溶解,100 ℃水解4 h,冷却至室温。吸取糖水解液0.2 mL,加1 mol/L盐酸补至2 mL,依次加入3.8 mL 3%三氯乙酸、1 mL氯化钡-明胶溶液(氯化钡1%,明胶0.5%),室温静置15 min 后,于360 nm 下测定反应吸光度值。按上述方法得硫酸基标准曲线回归方程为y=0.06825x+0.03319,R2=0.99509,硫酸基含量在0.2~2.0 mg 范围内线性关系良好。
DS 参照以下公式(1)、(2)计算:
式中:S 为待测样品硫酸基的含量,%;WS为糖解液吸光度对应下的硫酸基质量,mg;W 为所取多糖的质量,mg;DS 为待测样品硫酸基取代度。
1.2.4 单因素实验
1.2.4.1 反应试剂比对SAMP 取代度的影响 称取0.5 g 白术多糖分别加入反应试剂比为1:1、2:1、3:1、4:1 的浓硫酸和正丁醇溶液中,0 ℃下,反应时20 min,按1.2.2 项下方法进行操作,考察反应试剂比对SAMP 取代度的影响[15]。
1.2.4.2 反应时间对SAMP 取代度的影响 称取0.5 g 白术多糖加入反应试剂体积比为2:1 的浓硫酸和正丁醇溶液中,0 ℃下分别反应10、20、30、40 min,按1.2.2 项下方法进行操作,考察反应时间对SAMP 取代度的影响。
1.2.4.3 反应温度对SAMP 取代度的影响 称取0.5 g 白术多糖加入反应试剂比为2:1 的浓硫酸和正丁醇溶液中,分别在-10、0、10、20 ℃下反应20 min,按1.2.2 项下方法进行操作,考察反应温度对SAMP取代度的影响。
1.2.5 响应面试验 根据单因素实验结果选取因素水平,以SAMP 取代度为响应值建立三因素三水平的Box-Behnken 实验。结果如表1 所示。

表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiment
1.2.6 AMP 及SAMP 的基本组成分析
1.2.6.1 苯酚-浓硫酸法测定糖含量 参考肖恩来等[16]的方法,以0.1 mg/mL 葡萄糖溶液为标准品,绘制标准曲线。配制0.1 mg/mL 的AMP 与SAMP 样品溶液,按文献方法处理。
1.2.6.2 考马斯亮蓝法测定蛋白质含量 参考李哲明等[17]的方法,以0.1 mg/mL 牛血清白蛋白溶液为标准品,绘制标准曲线。配制1 mg/mL 的AMP 与SAMP 样品溶液,按文献方法处理。
1.2.6.3 硫酸-咔唑法测定糖醛酸含量 参考刘良伟等[18]的方法,以1 mg/mL 葡萄糖醛酸溶液为标准品,绘制标准曲线。配制1 mg/mL 的AMP 与SAMP样品溶液,按文献方法处理。
1.2.7 傅里叶红外光谱测定 参考蒋茂婷等[19]的方法,取AMP 与SAMP 样品,使用红外光谱仪,在500~4000 cm-1波数范围内扫描,确定AMP 硫酸酯的合成情况。
1.2.8 AMP 及SAMP 的分子量测定1.2.8.1 色谱条件 仪器:Agilent 1260 高效液相色谱仪;检测器:UM4800 蒸发光检测器;色谱柱:Ultrahydrogel TM linear(7.8 mm×300 mm)色谱柱;柱温:50 ℃;检测器温度:50 ℃;流动相:超纯水;流速:0.5 mL/min;进样量15 μL。
1.2.8.2 右旋糖酐标准曲线的测定 参考何坤明[20]的方法,分别称取不同分子量标准品右旋糖酐(3000、12000、25000、50000、80000、150000、270000 Da),进HPLC 分析;以保留时间(min)为x 轴,标准品相对分子质量对数(lgMW)为y 轴,绘制标准曲线;AMP 与SAMP 分析条件同上,根据保留时间计算相应样品分子量。
1.2.9 抗氧化活性测定 根据梁中焕等[21]的方法进行DPPH、ABTS+、OH 自由基测定,以L(+)-抗坏血酸(VC)溶液作为阳性对照,按照公式(3)、(4)、(5)分别计算其自由基清除能力。
式中:A0表示空白对照组吸光度值;A1表示乙醇代替DPPH 溶液吸光度值;A2表示样品组吸光度值。
式中:A0表示空白对照组吸光度度值;A1表示蒸馏水代替ABTS 工作液吸光度值;A1表示样品吸光度度值。
式中:A0表示空白对照组的吸光度值;A1表示加入样品及H2O2的吸光度值;A2表示以蒸馏水代替H2O2的吸光度值。
1.2.10 AMP 与SAMP 抗乳腺增生作用
1.2.10.1 动物分组、造模及给药 雌性SD 大鼠40 只,适应性喂养7 d,随机分为空白组(Con)、模型组(Mod)、阳性药物组(Pos)、AMP 组、SAMP 组,每组8 只。参照黄越等[22]的造模方法,除Con 外,其余各组大鼠肌注苯甲酸雌二醇0.5 mg/(kg·d),连续25 d,继而注射黄体酮5 mg/(kg·d),连续5 d,大鼠毛色微黄,乳头红肿,体重增长迅速表示造模成功。
他莫昔芬给药量换算:按照说明书上70 kg 成人每日最大用药量换算大鼠的给药剂量为4 mg/(kg·d);AMP 及SAMP 给药剂量换算:根据《中国药典》(2022 版)中记载70 kg 成人每日摄取白术最大用药量为12 g,换算大鼠的生药剂量为白术生药量1.575 g/kg;根据白术生药剂量换算多糖给药剂量,AMP 组(278 mg/(kg·d)),SAMP 组(278 mg/(kg·d))。于造模结束后,第31 d 起,于每日下午Con 组、Mod 组大鼠给予生理盐水,Pos 组给予他莫昔芬混悬液,AMP、SAMP 组给予相应多糖,连续30 d。
1.2.10.2 指标检测 每7 d 对大鼠体重进行测量,末次给药24 h 后,腹腔注射10%水合氯醛麻醉动物,用游标卡尺测量第二对乳头直径,剖取第2 对乳腺组织,用PBS 洗涤并固定在4%多聚甲醛溶液中。将固定的组织包埋在石蜡块中,将每个样品切成4 μm 厚的切片并用苏木精伊红(H&E)染色进行组织学检查。
1.3 数据处理
所有数据使用GraphPad 8.0 软件进行统计学分析,组间比较均采用单因素方差分析(One Way ANOVA),数据以均数±标准差(MEAN±SD)表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 反应试剂比对SAMP 取代度的影响 由图1可知,SAMP硫酸基取代度随浓硫酸含量增加而上升,并且在浓硫酸与正丁醇体积比为2:1 时,取代度达到最大为0.64。但当浓硫酸含量继续增大后,产物的取代度反而降低,这可能因为浓硫酸过量后,酸性增强,极易引起SAMP 的碳化,造成取代度的下降。故选择反应试剂比2:1(v/v)为响应面设计的中心值。
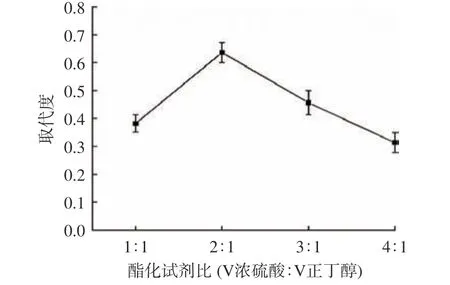
图1 反应试剂比对SAMP 取代度的影响Fig.1 Effect of reagent proportion on the degree of substitution of SAMP
2.1.2 反应时间对SAMP 取代度的影响 由图2 可知,随反应时间增加,SAMP 硫酸基取代度呈上升趋势,20 min 时,取代度达到最大为0.54。当反应超20 min,取代度逐渐下降。这可能由于反应时间的延长有利于多糖与酯化试剂的充分吸附和反应,当反应时间持续延长时,反应趋于平衡,继续反应致使多糖发生降解,极易在醇沉、透析时造成损耗,导致SAMP 取代度降低。故选择反应时间20 min 为响应面设计的中心值。
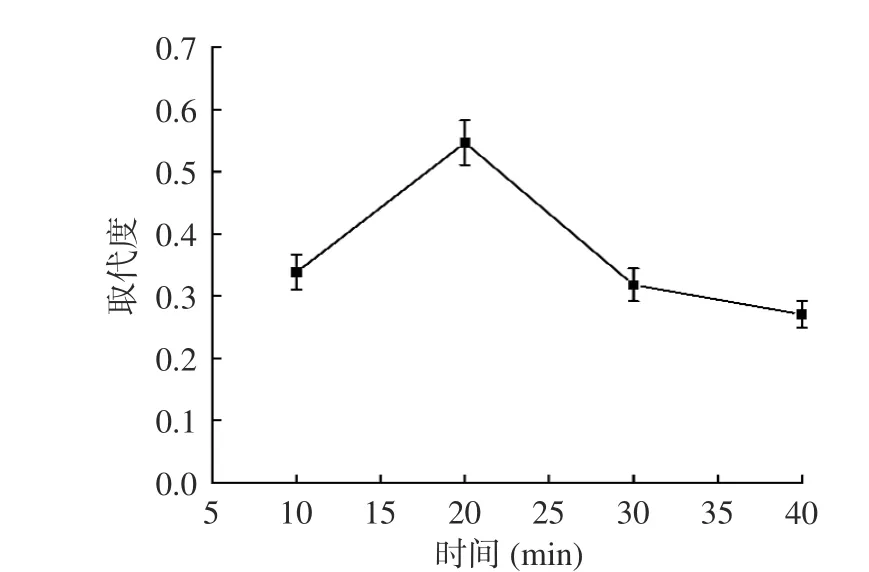
图2 反应时间对SAMP 取代度的影响Fig.2 Effect of reaction time on the degree of substitution of SAMP
2.1.3 反应温度对SAMP 取代度的影响 由图3 可知,随反应温度上升,SAMP 硫酸基取代度呈先上升后下降的趋势,0 ℃时取代度最高为0.51,随温度继续上升,取代度反而下降,其原因可能为多糖的硫酸酯化反应为可逆性放热过程,过高的反应温度阻碍化学平衡向产物生成的方向发展,从而造成SAMP 取代度的下降。故选择反应温度0 ℃为响应面设计的中心值。
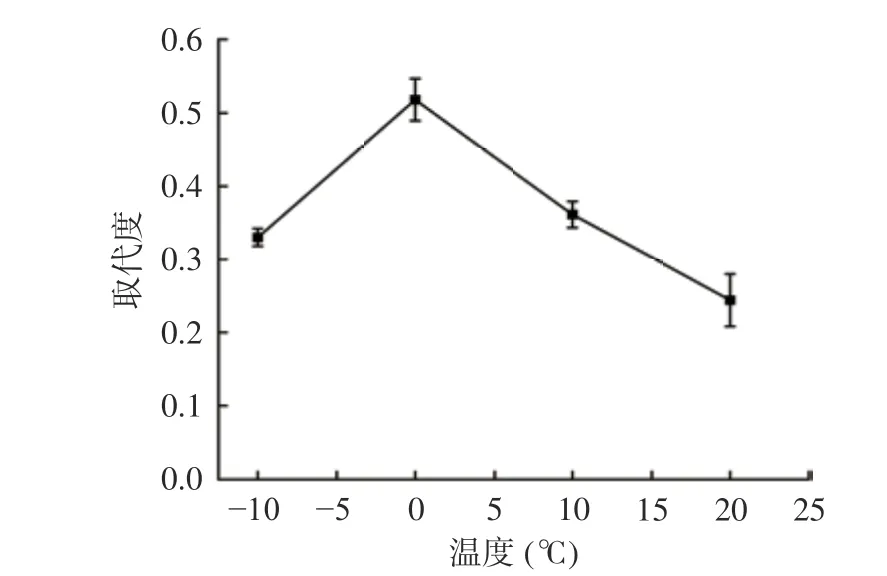
图3 反应温度对SAMP 取代度的影响Fig.3 Effect of reaction temperature on the degree of substitution of SAMP
2.2 响应面优化试验结果
Box-Behnken 设计实验结果见表2。利用Design-Expert 12 对优化实验结果进行二次多元回归拟合,得回归方程:

表2 Box-Behnken 试验设计与结果Table 2 Box-Behnken experiment design and the results
由回归模型进行方差分析,结果见表3 所示。由表3 可知在实验设计范围内,该拟合模型的P<0.01 为极显著,失拟项P>0.05,说明该模型具有统计学显著性,模型决定系数R2=0.9884,表明试验响应值与预测值的相关度高。数据中没有异常点,拟合程度良好,可用此模型对白术多糖硫酸酯制备工艺进行预测和分析。模型一次项A 和B 对响应值综合评分影响达到显著(P<0.05),交互项AB 对响应值影响显著(P<0.05),AC、BC 无显著影响(P>0.05),二次项A2、B2、C2对响应值综合评分影响均达到极显著水平(P<0.01);根据回归模型作出相应的响应面及等高线,结果见图4。分析反应试剂比、反应时间、反应温度三个因素交互作用对响应值的影响,曲面越陡则表明该因素对响应值的影响越大,等高线图为椭圆形表示两因素交互影响显著,圆形反之。其中,反应试剂比对响应值影响较强,曲面较陡,等高线呈椭圆;反应时间与反应温度对响应值影响较弱,曲面较缓,曲面图为圆形。综上,3 个因素对响应值的影响大小依次为:反应试剂比>反应时间>反应温度。
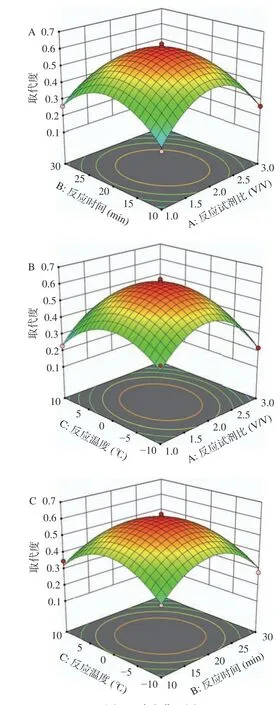
图4 响应曲面图Fig.4 Response surface plots
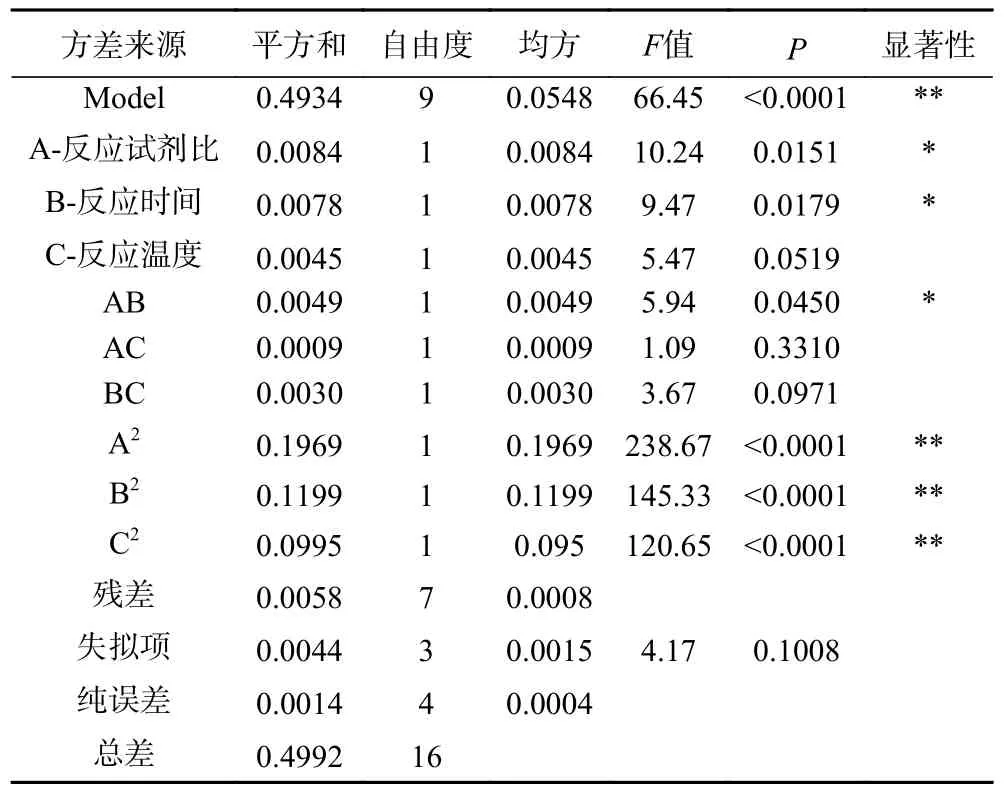
表3 回归方程的方差分析Table 3 Analysis of variance (ANOVA) of regression equations
2.3 验证试验结果
结合实际实验条件需要,确定最佳硫酸酯化工艺优化为:反应试剂比2:1(V:V),反应温度-4 ℃,反应时间21 min,并进行三次平行实验验证所得优化工艺。三次平行实验得平均取代度为0.59±0.00391,误差较小,实际测量值与预测值基本一致,表明该模型预测有效、准确度高。
2.4 AMP 及SAMP 基本组成分析
2.4.1 糖含量测定结果 葡萄糖标准曲线回归方程:y=7.25653x+0.11191,R2=0.9996,在0.02~0.10 mg/mL范围内线性良好,经计算AMP 糖含量为64.23%,SAMP 糖含量为54.75%。
2.4.2 蛋白质含量测定结果 牛血清白蛋白标准曲线回归方程:y=7.31466x+0.08008,R2=0.9977,在0.02~0.10 mg/mL 范围内线性良好,经计算AMP 蛋白含量为3.38%,SAMP 蛋白含量为2.98%。
2.4.3 糖醛酸含量测定结果 得葡萄糖醛酸标准曲线回归方程:y=1.45271x-0.00891,R2=0.9926,在0.02~0.10 mg/mL 范围内线性良好,经计算AMP 糖醛酸含量为5.36%,SAMP 糖醛酸含量为3.17%。
2.5 AMP 及SAMP 的红外光谱分析结果
AMP 在3353 cm-1附近处有O-H 伸缩振动吸收峰,2925 cm-1附近处有C-H 伸缩振动吸收峰,1641 cm-1附近有C=O 非对称收缩振动峰,说明AMP 具有多糖特征吸收峰[23];1432 cm-1附近处为糖分子C-H 键变角振动峰,1029 cm-1附近为吡喃糖环(C-O-H)伸缩振动吸收峰,933 cm-1附近为C-OC 不对称伸缩振动峰[24]。SAMP 不仅在3403、2942、1617 cm-1具有多糖特征吸收峰,且在833 cm-1处出现C-O-S 特征吸收峰,在1226 cm-1处出现S=O 特征吸收峰,证明硫酸根基团已经成功连接到AMP 的糖残基上,白术多糖硫酸酯制备成功[25]。结果如图5所示。
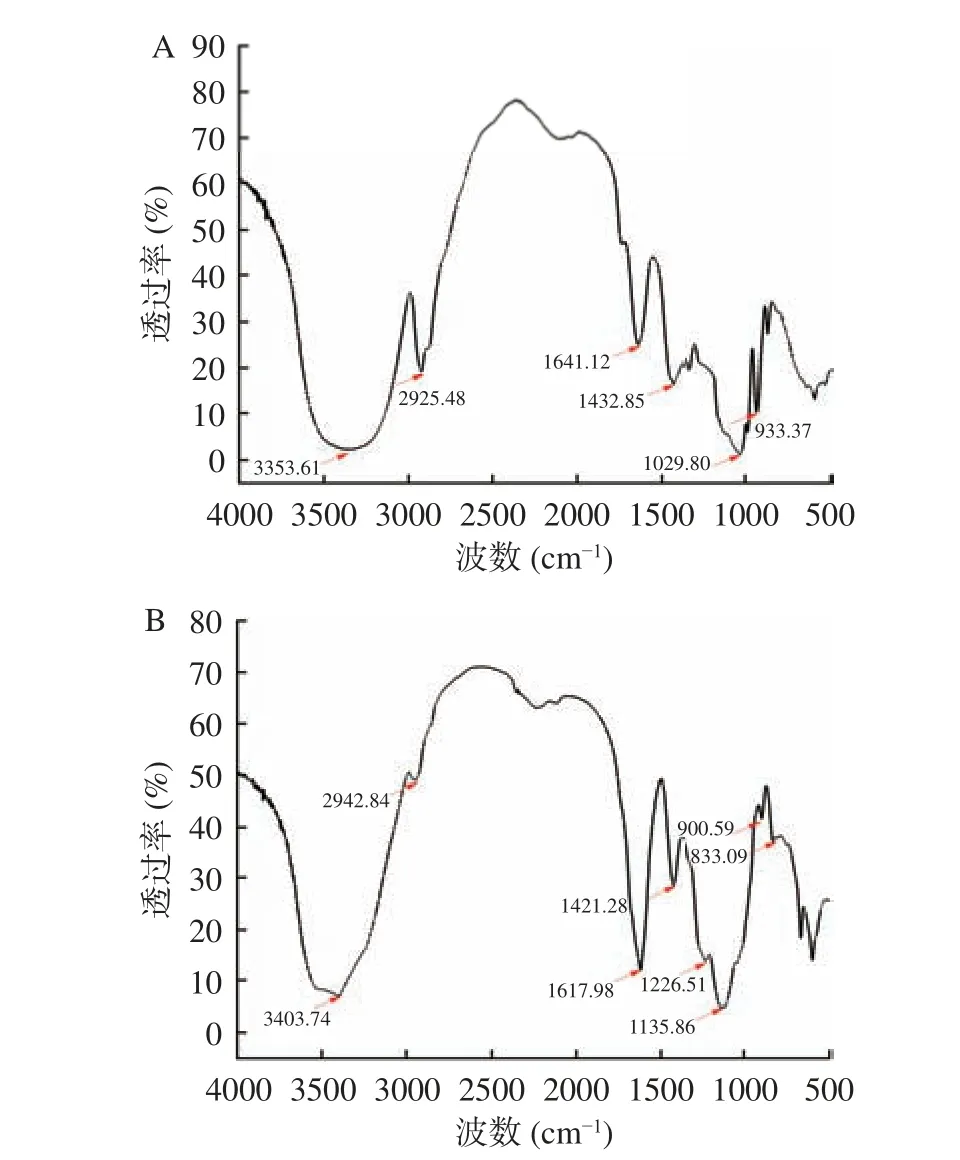
图5 AMP 和SAMP 红外光谱图Fig.5 IR spectrum of AMP and SAMP
2.6 AMP 及SAMP 分子量测定结果
由图6 可知,右旋糖酐标准品线性回归方程:y=-0.51368x+12.73243,R2=0.99174,分子量在3000~2700000 Da 范围内线性关系良好。由此得AMP 与SAMP 分子量分别为2719、33524 Da。与AMP 比较,SAMP 分子量明显增加,说明AMP 糖链上的羟基被硫酸基取代,证实硫酸酯化成功[26]。
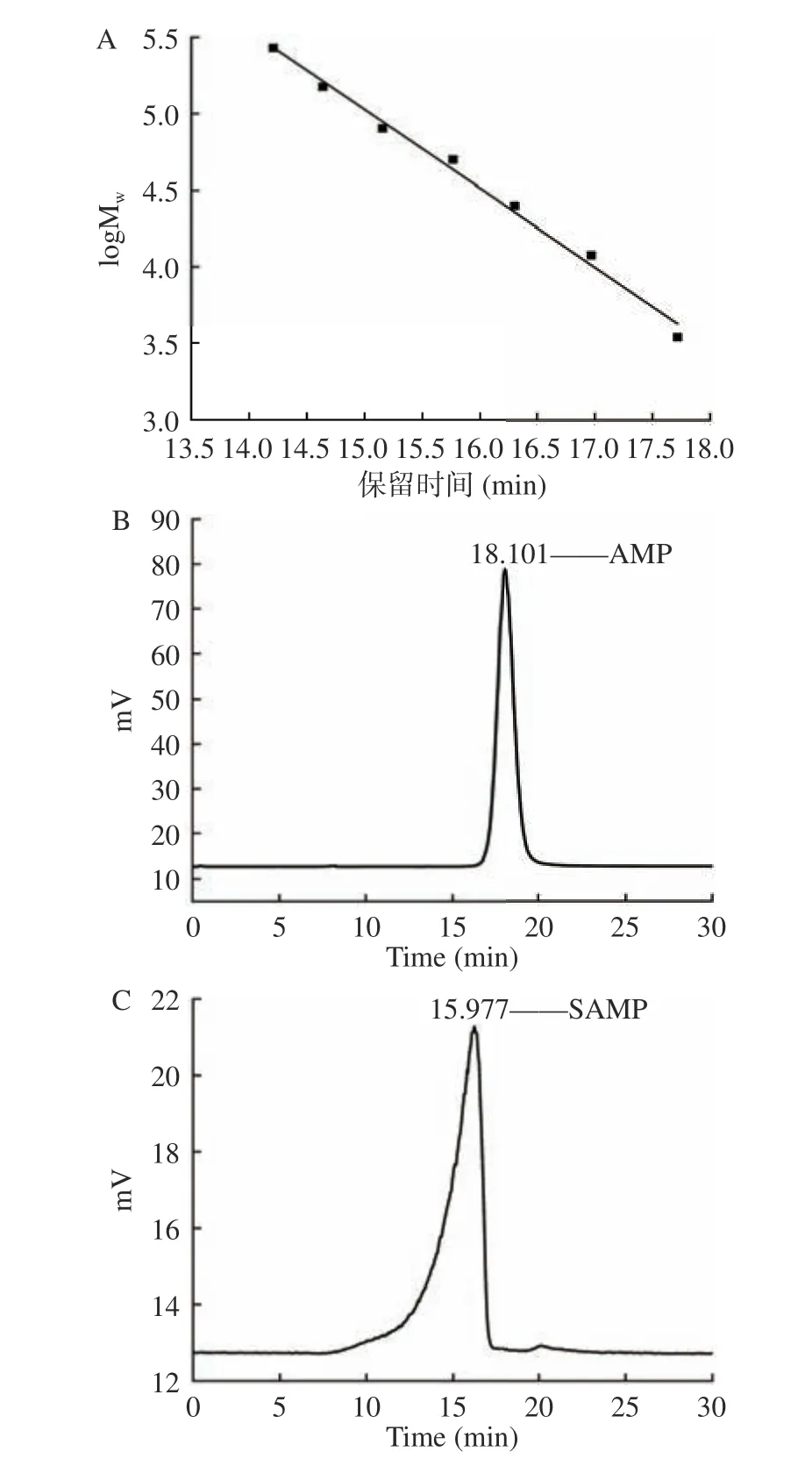
图6 AMP 和SAMP 分子量测定结果Fig.6 Molecular weight determination results of AMP and SAMP
2.7 AMP 及SAMP 抗氧化活性测定结果
由图7 可知,AMP 与SAMP 对DPPH、ABTS+和OH 自由基均具有较好的清除作用,与浓度呈正相关,且SAMP 的清除能力均优于AMP。当溶液质量浓度达到0.5 mg/mL 时,SAMP 对自由基的清除能力最大,对DPPH、ABTS+、OH 自由基清除率分别为54.91%、38.21%、42.23%;AMP 对DPPH、ABTS+和OH 自由基清除率分别为41.88%、34.64%、36.90%;研究表明,经硫酸酯化修饰的多糖,其自由基清除能力高于未修饰多糖,与本文研究结果一致[27-29]。由此可以推断出硫酸基对自由基的清除起到重要作用,其机理可能是经硫酸酯化修饰后,多糖分子中部分-OH被-OSO3H 取代,从而使自由基清除能力增强[30]。
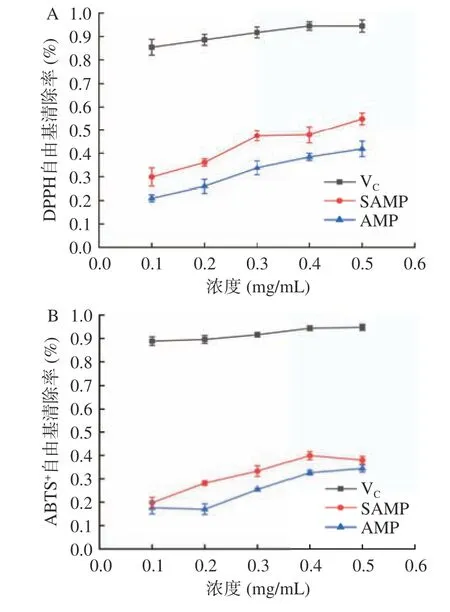
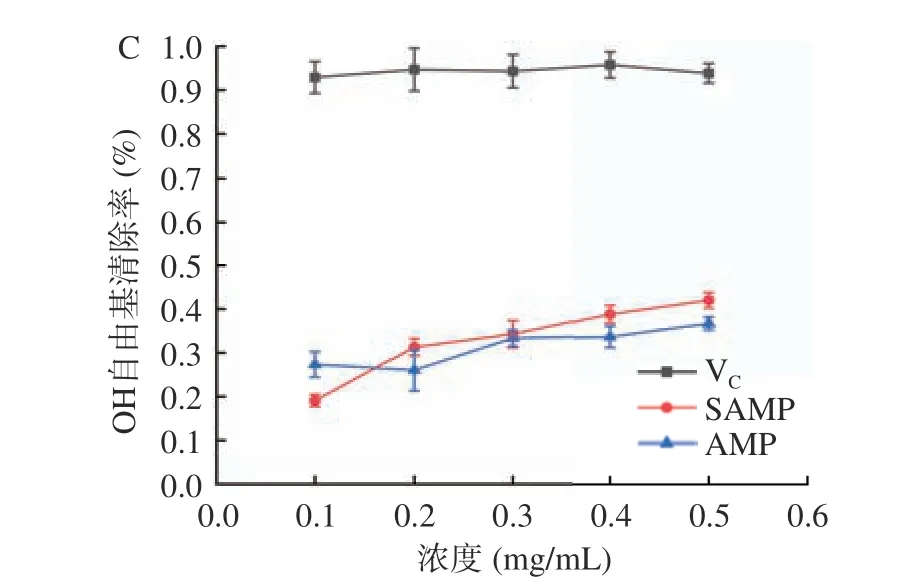
图7 AMP 和SAMP 对DPPH、ABTS+和OH 自由基清除率Fig.7 Scavenging activity of AMP and SAMP on DPPH,ABTS+, and hydroxyl free radical rate rate
2.8 乳头直径及体重测定结果
根据Liu 等[31]的造模结果,造模后大鼠体重增长迅速,乳头红肿且高挺,证明造模成功。如图8A所示,与Con 组比较,Mod 组大鼠乳头直径极显著增大(P<0.01);与Mod 组比较,AMP 组大鼠乳头直径显著减小(P<0.05),SAMP 组大鼠乳头直径极显著减小(P<0.01)。如图8B 所示,Con 组体重始终平稳增长并逐渐趋于稳定,其余各组在造模时体重增长迅速,给药干预后体重逐渐恢复正常,Mod 组与治疗组大鼠体重有极显著性差异(P<0.01),Pos 组接近正常大鼠体重,AMP 与SAMP 组的大鼠体重有所改善。这可能是因为造模后大鼠体内雌激素水平升高,导致大鼠代谢紊乱,而多糖给药后能通过调理大鼠体内雌激素水平,改善大鼠代谢水平,使大鼠体重恢复正常。
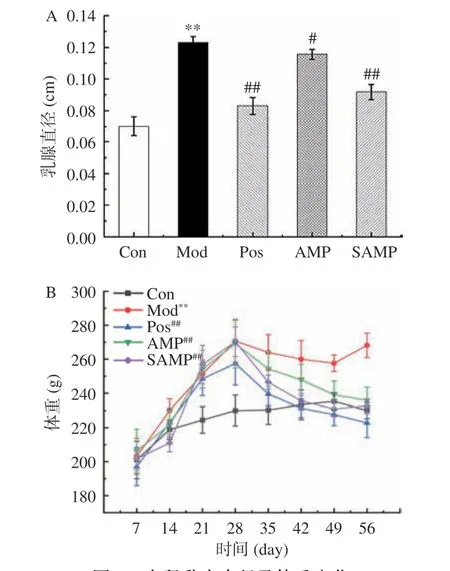
图8 大鼠乳房直径及体重变化Fig.8 Changes of mammary breast diameter and body weight in rats
2.9 乳腺组织病理学结果
Con 组大鼠乳腺组织细胞形状规则,乳腺小叶腺泡数少,导管细长,无增生性病变和分泌物。Mod 组导管增生扩张明显,小叶内腺泡密集,大小不等,形状不规则,内含分泌物;与Mod 组比较,Pos 组小叶内腺泡形状规则,导管为细长状,无分泌物;AMP 组大鼠小叶内腺泡数量减少,腔内少量分泌物,导管扩张程度减轻;SAMP 组小叶内腺泡排列较规则,腔内分泌物不可见,导管扩张程度明显减轻。说明白术多糖可降低大鼠乳腺增生程度,且其硫酸酯化后作用更为明显。结果如图9 所示。
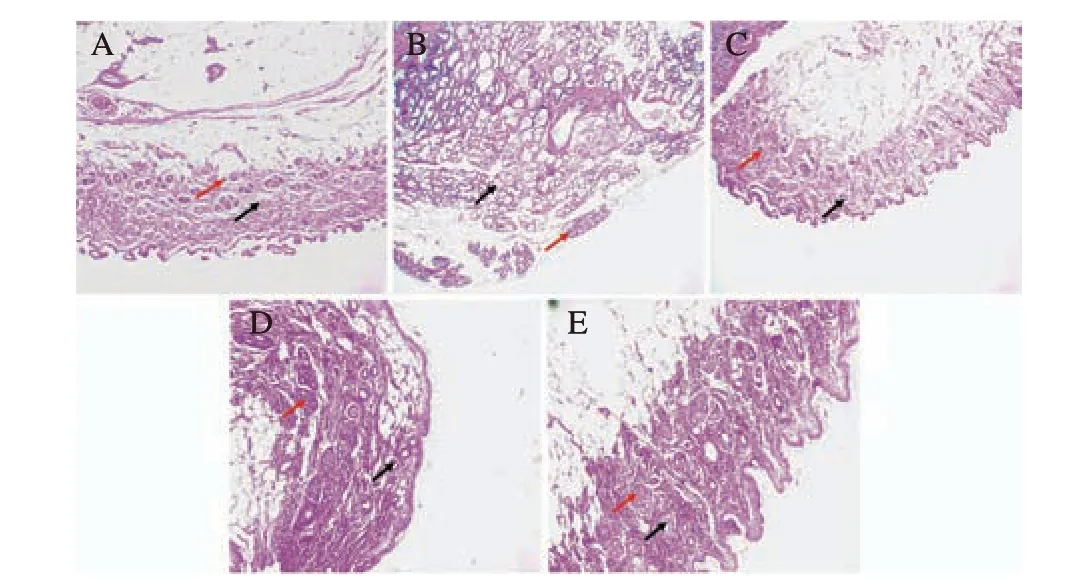
图9 大鼠乳腺组织病理切片图(HE,×100)Fig.9 Histopathological section of rat mammary gland(HE,×100)
3 讨论与结论
据报道,天然多糖的活性与其结构密切相关,通过结构修饰将部分基团进行替换可有效改善其生物活性,如硫酸酯化,是利用硫酸根基团取代多糖侧链上的羟基,进而改变多糖的分子量、电荷或链构象等,使其抗氧化、抗炎等活性得到明显提高[32]。本文采用浓硫酸法对AMP 进行硫酸酯化修饰,但其取代度往往因反应试剂比例、反应时间、温度等因素的不同而有较大差异,进而影响其生物活性,因此可通过响应面法优化白术多糖硫酸酯制备工艺。相较于传统的正交设计,响应面法得到的回归方程精度更高,并可评价各因素的交互作用。实验结果表明,白术多糖硫酸酯最佳制备工艺条件准确度好、精密度高、与实际值贴合。
在正常状态下,人体内自由基的产生及清除处于动态平衡状态,一旦这种平衡被打破,疾病就会被诱发或加重。据相关报道,在乳腺组织中雌激素含量的增加伴随着脂质过氧化的发生,其产物MDA 大量生成,自由基产生和清除之间的平衡被打破,并由于MDA 具有细胞毒性,可引起乳腺细胞的损伤,导致乳腺间质水肿反复发作,并形成不同程度的导管上皮和纤维结缔组织增生,引发囊肿,最终发展为乳腺增生[33]。本实验结果显示,AMP 与SAMP 对DPPH、ABTS+、OH 自由基均具有良好的清除能力,且可减小MGH 大鼠乳头直径、减少腺泡数量、减轻导管的异常扩张、平稳大鼠体重。表明AMP 及SAMP 均具有良好的抗氧化作用与治疗MGH 作用,且AMP经硫酸酯化修饰后活性显著增强。
综上所述,本实验通过响应面优化法获得白术多糖硫酸酯的最佳制备工艺,初步评价白术多糖硫酸酯的体外抗氧化与抗MGH 两个方面的生物活性,为进一步阐明天然产物衍生化的构效关系奠定基础,为探讨白术多糖及其衍生物治疗MGH 的作用机制提供前期数据,对临床中药治疗MGH 具有参考价值。但本实验仍需对白术多糖与白术多糖硫酸酯的构效关系作进一步阐明以及两者通过抗氧化途径治疗MGH 的具体作用机制进行深入研究。
