长茎葡萄蕨藻中β-1,3-木聚糖的提取工艺优化及单糖组成分析
2023-08-13晋文慧矫浩田谢全灵张怡评赵元晖
刘 倩,晋文慧 ,矫浩田,谢全灵,张怡评,洪 专,赵元晖
(1.自然资源部第三海洋研究所,海洋生物资源开发利用工程技术创新中心,福建厦门 361005;2.中国海洋大学三亚海洋研究院,海南三亚 572024;3.厦门海洋职业技术学院,福建厦门 361000)
自然界植物藻类中半纤维素是第二大丰富的多聚糖,仅次于纤维素,含量约占20%~30%,其主要成分是木聚糖[1-2]。木聚糖可分为β-1,4-木聚糖和β-1,3-木聚糖[3]。β-1,4-木聚糖主要发现在陆生植物细胞壁的半纤维素中,而β-1,3-木聚糖主要存在于海藻的细胞壁多糖中[4-5]。一些红藻和绿藻细胞壁中完全不含纤维素,取而代之的是β-1,3-木聚糖[6-8]。功能性海藻如红藻和绿藻的细胞壁含有较多的β-1,3-木聚糖[9-10],如红藻中的紫菜属(porphyra)[11]、红皮藻属红皮藻属(Rhodymenia)[12],绿藻中的石莼属(Ulva)[13]、蕨藻属(Caulerpa)[14]、松藻属(Codium)[15]。其中有两种蕨藻较为常见,一种是目前已经人工养殖的可食用长茎葡萄蕨藻(Caulerpa lentillifera)[16],另一种是高度入侵物种杉叶蕨藻(Caulerpa taxifolia)[17-18]。长茎葡萄蕨藻又名海葡萄,含有多糖、粗纤维、多种氨基酸与维生素,呈味氨基酸含量较高[19],总脂肪含量较低,不含胆固醇,还富多种微量元素,与其他海藻相比,是潜在的高营养价值保健食品[20-22]。多糖作为长茎葡萄蕨藻主要的活性成分,近十年来成为学者们首要研究的重点[23],目前一些报道揭示了β-1,3-木聚糖具有抗氧化、抗炎、抗病毒和抗癌等活性[24]。
海藻多糖的提取方法主要有醇提法[25-26]、热水提取法[27]、微波辅助提取法[28-29]、超声波辅助提取法[30-31]等,β-1,3-木聚糖在长茎葡萄蕨藻中的提取得率明显高于其他藻类[32],又因其营养价值较高,被广泛应用于药品、食品与保健品中,故多糖的成分组成分析对其应用有重要意义,因此对其单糖组分进行研究分析可对后续β-1,3-木聚糖的应用提供参考。单糖组成分析的方法有很多,多数分析方法需要先对多糖进行降解,本研究采用碱提法来提取β-1,3-木聚糖并采用特异性酶解法对其进行鉴定,β-1,3-木聚糖酶Xyl3088 从太平洋火色杆菌Flammeovirga pacifica菌株WPAGA1 的编码基因中翻译而来,它是降解β-1,3-木聚糖以得到短链β-1,3-低聚木糖和木糖的水解酶,可确定其单糖组成成分[33]。本研究通过对常见经济藻类进行筛选,并利用单因素实验和正交试验优选β-1,3-木聚糖的最佳提取工艺,以期为β-1,3-木聚糖功效物质的制备及后续应用奠定基础。
1 材料与方法
1.1 材料与仪器
长茎葡萄蕨藻 杭州牧海食品经营有限公司;紫菜(Porphyra)、南极冰笋(Durvillaea antarctica)、红皮藻(Palmaria palmata)、海带(Laminaria japonica)、石蒓(Ulva lactuca)、浒苔(Enteromorpha proliferaMuller J. Agardh)、羊栖菜(Sargassum fusiforme) 自然资源部第三海洋研究所藻类保藏库;极品肉汤、氨苄青霉素钠、甘油、异丙基硫代-β-D-半乳糖苷(IPTG) 北京索莱宝科技有限公司;蛋白胨、酵母粉 OXIOD 公司;琼脂粉 广东环凯微生物科技公司;SDS-PAGE 凝胶试剂盒 上海碧云天生物技术有限公司;4×Laemmli Sample Buffer、10×Tris-Glycine-SDS 电泳缓冲液 BIO-RAD 公司;Fast Blue蛋白快速染色液 Biosharp 公司;磷酸缓冲液 西陇科学股份有限公司;三氟乙酸 上海阿拉丁生化科技股份有限公司;硫酸、盐酸、氢氧化钠、乙酸、氯化钠、无水乙醇、高氯酸钠、Tris 分析纯,国药集团化学试剂有限公司;β-1,4-D-(+)-木糖 标准品,上海源叶生物科技有限公司;所有菌株和质粒均由自然资源部第三海洋研究所构建保存;菌株:宿主菌为大肠杆菌Escherichia coliBL21(DE3) 生工生物工程(上海)股份有限公司提供;质粒:pET-22b(+) 氨苄抗性,由苏州金唯智生物科技有限公司提供。
DFT-200A 200g 手提式高速粉碎机 温岭市林大机械有限公司;RXH-8 热风循环烘箱 南京銮豪机械设备有限公司;FNLY-2 冷冻干燥机 上海翡诺医药设备有限公司;DF-101S 集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;ZD-9950转移摇床 其林贝尔公司;JY92-IIN 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ZQTY-90S 振荡培养箱 上海知楚仪器有限公司;SW-CJ-1FD 洁净工作台 苏净基团苏州安泰空气技术有限公司;Ni NTA Beads 6FF 重力柱 常州天地人和生物科技有限公司;GIS-2008 成像系统 上海天能科技有限公司;DB-I 不锈钢电热板 上海梅香仪器有限公司。
1.2 实验方法
1.2.1 木糖标准曲线的制备
1.2.1.1 苯酚-硫酸法测多糖含量标准曲线 分别吸取0、0.1、0.2、0.3、0.4、0.6、0.8 和1.0 mL 现配的0.1 mg·mL-1的D-木糖溶液,每一管用去离子水补加至1 mL,在冰浴条件下加入0.5 mL 5%的苯酚溶液,混匀后缓慢加入3 mL 浓硫酸,待其处于不放热状态时,冷却后于490 nm 处测吸光度[33]。以吸光度Y 为纵坐标,D-木糖浓度X(mg·mL-1)为横坐标,绘制木糖标准曲线。线性方程为y=2.3806x-0.0145,R2=0.9993。
1.2.1.2 DNS 法测还原糖含量标准曲线 分别吸取0、0.04、0.08、0.12、0.16、0.2、0.24、0.28、0.32 和0.4 mL 现配的1 mg·mL-1的D-木糖溶液,每一管用去离子水补加至为1 mL,再加入0.4 mL DNS 试剂,沸水浴5 min,冷却后加入2.6 mL 蒸馏水,于540 nm处测吸光度[34]。以吸光度Y 为纵坐标,D-木糖浓度X(mg·mL-1)为横坐标,绘制木糖标准曲线。线性方程为y=1.1484x-0.0051,R2=0.9992。
1.2.2 不同海藻中粗木聚糖的提取 由于β-1,3-木聚糖没有商业销售,参考Iriki 等[11]的方法通过以下步骤获得纯度较高的粗木聚糖。
如图1 所示,将长茎葡萄蕨藻、海带、紫菜、红皮藻、石蒓、南极冰笋、浒苔和羊栖菜分别进行清洗干净,于60 ℃烘箱内烘干后用研磨机碾成粉末,待用。

图1 提取工艺流程图Fig.1 Extraction process flow chart
分别称取20 g 长茎葡萄蕨藻、红皮藻、石蒓、浒苔、南极冰笋、羊栖菜粉末,依次加入1000 mL 0.3 mol·L-1的NaOH 溶液,加热煮沸30 min,待其冷却至室温,6 ℃条件下离心(10000 r·min-1)20 min,弃上清液,并用去离子水洗涤沉淀两遍;将沉淀转入1000 mL 0.25 mol·L-1硫酸溶液中重复上一步操作;向沉淀中加入1600 mL 2% NaClO4溶液,于25 ℃下搅拌脱色2 h 除去杂质,再用去离子水洗涤离心沉淀3 次;向脱色后的沉淀中加入800 mL 2.5 mol·L-1NaOH 溶液,冰浴搅拌1.5 h 后于6 ℃离心(10000 r·min-1)20 min,弃沉淀,收集上清;在烧杯中加入4 倍体积无水乙醇,再沿壁缓缓倒入上清,静置冷藏库4 ℃过夜;取醇沉后得到的沉淀,6 ℃离心(10000 r·min-1)20 min 收集沉淀,于1200 mL 的5.7 mol·L-1无水乙酸溶液中和洗涤,再用去离子水洗涤离心三遍去除残留乙酸;将上述沉淀即粗木聚糖转移至冻干机真空干燥,取出并碾成粉末,待用。
1.2.3 长茎葡萄蕨藻粗木聚糖提取单因素条件优化
1.2.3.1 NaOH 浓度对粗木聚糖得率的影响 步骤同1.2.2 除去酸碱杂质后,料液比1:40 g·mL-1,选取1.0、2.0、2.5、3.0 和4.0 mol·L-1不同浓度NaOH 作为提取剂,在冰浴条件下提取1.5 h,再经NaClO4脱色,醇沉后冻干,计算粗木聚糖得率。
1.2.3.2 提取时间对粗木聚糖得率的影响 步骤同1.2.2 除去酸碱杂质后,料液比1:40 g·mL-1,以浓度为2.5 mol·L-1NaOH 水溶液为提取剂,在冰浴条件下分别提取1、1.5、2、3 和5 h,再经NaClO4脱色,醇沉后冻干,计算粗木聚糖得率。
1.2.3.3 料液比对粗木聚糖产量的影响 步骤同1.2.2 除去酸碱杂质后,以浓度为2.5 mol·L-1NaOH水溶液为提取剂,选取1:20、1:40、1:60、1:80、1:100 和1:120 g·mL-1不同料液比条件,在冰浴条件下提取1.5 h,再经NaClO4脱色,醇沉后冻干,计算粗木聚糖得率。
1.2.4 正交试验 根据单因素实验的结果,选择合适的NaOH 浓度(A)、提取时间(B)和料液比(C)为参考因素,以粗木聚糖得率为指标,选择单因素试验影响较大的碱量、提取时间和料液比3 个因素,进行三因素三水平正交试验,确定粗木聚糖提取工艺条件的最优组合。
1.2.5 特异性β-1,3-木聚糖酶(Xyl3088)制备与纯化由苏州金唯智公司合成并验证了Xyl3088 的基因序列,构建了pET-His-Xyl3088-SpyTag 表达载体,并将上述质粒成功地导入宿主菌E.coliBL21(DE3)中进行表达[33]。于200 mL LB 培养基内依次加入0.2 mL 0.1 g·mL-1氨苄青霉素钠溶液和250 μL 甘油菌,于摇床37 ℃,200 r·min-1培养12 h 活化;在400 mL TB 培养基内依次加入0.2 mL 0.1 g·mL-1氨苄青霉素钠溶和2 mL 活化后的菌液,于摇床37 ℃,200 r·min-1培养3~4 h,待菌体处于对数生长期时,加入1 mL 0.1 mol·L-1IPTG 溶液,于摇床20 ℃,180 r·min-1培养24 h 进行诱导表达;将诱导表达后的菌液于4 ℃,10000 r·min-1条件下离心20 min 后弃掉上清,将菌体细胞与PBS 缓冲液(pH=7.0)混合(1:20,v/v),重复上述离心操作;菌体细胞于冰浴条件下进行细胞破碎,超声功率300 W(50%),超声开时间2 s,超声关时间4 s,工作时间20 min;细胞经超声破碎后于4 ℃,11000 r·min-1条件下离心20 min,上清液经0.45 μm 的滤膜过滤后即为酶液粗提物。经镍柱进行分离纯化,使用浓度从低到高的咪唑缓冲液洗脱目标蛋白以确定最佳的咪唑洗脱浓度,联合SDS-PAGE 分析镍柱吸附目的蛋白质的情况,最后收集各流出液通过SDS-PAGE 电泳鉴定目的蛋白。
1.2.6 粗木聚糖单糖组成成分的鉴定
1.2.6.1 不同海藻粗木聚糖的制备、酶解及酶解前后还原糖含量测定 分别将长茎葡萄蕨藻、红皮藻、石蒓、浒苔、羊栖菜、南极冰笋、海带和紫菜在提取时间3 h、NaOH 浓度2.5 mol·L-1、料液比1:100 g·mL-1的条件下制得粗木聚糖,精密称取0.1 g 溶于Tris-HCl 溶液(pH=7.0)配制成1%粗木聚糖溶液。取400 μL 的1%的粗木聚糖溶液于离心管中,加入50 μL Xyl3088(酶活为49 U/mg),37 ℃的水浴锅中反应24 h,再于100 ℃煮沸5 min 使酶灭活,离心收集上清即为1%β-1,3-木寡糖溶液,为酶解实验组。将Xyl3088 替换为去离子水,重复上述操作,为空白对照组。通过DNS 法测定了空白对照组与酶解实验组的还原糖含量,在540 nm 处测定吸光度,并根据标准曲线计算还原糖含量。
1.2.6.2 长茎葡萄蕨藻粗木聚糖的酶解产物的薄层鉴别 称取粗木聚糖1.0 g,加入20 mL 浓度为1 mol·L-1的三氟乙酸,利用三氟乙酸的强酸性,对β-1,3-木聚糖充分水解,在70 ℃孵育2 h 和12 h 后分别取少量木寡糖溶液离心,上清液用1 mol·L-1的NaOH 进行中和至pH=7.0,便可作为薄层层析色谱标准品使用[35]。将上述溶液分别在薄层板上点样展开,由于极性的不同,各成分随着展开剂不断上升,当距离硅胶顶端5 cm 处,取出,均匀喷洒显色剂,放置250 ℃电炉加热10 min 显色拍照。
展开剂:正丁醇:冰醋酸:去离子水=10:5:3。
显色剂:2.0 g 二苯胺、2 mL 苯胺、10 mL 磷酸、100 mL 丙酮配制而成。
1.3 数据处理
每组数据重复进行3 次,结果以平均值±标准偏差来表示。实验数据整理采用Excel 2019;数据统计分析采用SPSS 24.0 软件,并进行显著性分析;绘图采用Origin Pro 2021 软件。
2 结果与分析
2.1 海藻中粗木聚糖提取结果对比
通过碱提法对长茎葡萄蕨藻、紫菜、南极冰笋、红皮藻、海带、石蒓、浒苔和羊栖菜进行初步筛选,计算粗木聚糖得率(见图2),长茎葡萄蕨藻粗木聚糖得率最高,可达到13.67%±0.25%,其他几种藻类的得率较低,均在5%以下。研究表明,董喆[36]采用水提醇沉法,以超纯水为溶剂,在提取时间3 h,提取温度80 ℃,料液比为1:30 g·mL-1的条件下对长茎葡萄蕨藻多糖进行提取,最终得率约为5.04%。与水提醇沉法和超声波辅助法的结果[36-37]相比,碱提法的粗木聚糖得率最高,且长茎葡萄蕨藻的粗木聚糖得率远高于其它经济藻类,故选取长茎葡萄蕨藻作为对象,进行下一步研究。
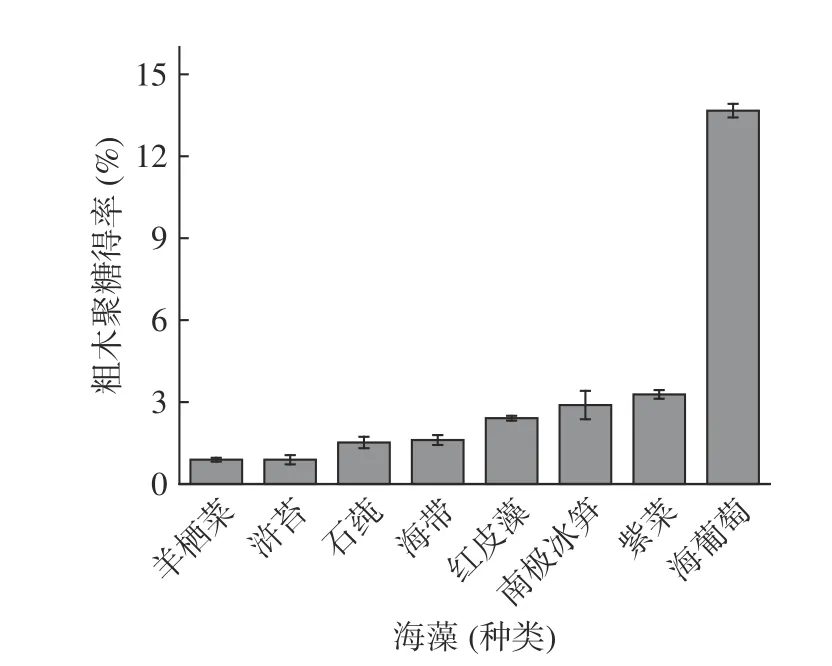
图2 不同海藻中粗木聚糖得率Fig.2 Yield of crude xylan in different algae
2.2 单因素实验结果
2.2.1 NaOH 浓度对粗木聚糖得率的影响 在料液比1:40 g·mL-1,提取时间为1.5 h 的条件下,以粗木聚糖得率为考察指标,考察NaOH 浓度对粗木聚糖产量的影响。由于木聚糖难溶于水,易溶于碱溶液,所以碱液浓度是提取的重要参数。木聚糖作为细胞壁中的一类结构性多糖,它与纤维素、木质素、蛋白质和多糖等形成较为复杂的共价键,有非常复杂的物理交缠关系,在水提法和稀碱条件下,提取困难[38]。由图3 可知,当NaOH 浓度为1 mol·L-1时,粗木聚糖得率较低,仅为3.6%±0.1%,表明较低NaOH 浓度的处理作用较弱,不能完全透过长茎葡萄蕨藻细胞壁,从而导致提取率低,只能溶解出与木质素、纤维素等其他木聚糖成分结合程度较低的部分,而不足以完全破坏长茎葡萄蕨藻的结构,以溶解出较多的木聚糖[39]。当NaOH 浓度到2.5 mol·L-1时,得率趋于平缓,达到21.4%±0.2%;随着NaOH 溶液浓度增加,NaOH 溶液浓度为4 mol·L-1时,可能导致糖的降解,故引起木聚糖得率略有降低至20.0%±0.2%。因此,在兼顾得率和经济性的同时,选择浓度为2.5 mol·L-1NaOH 溶液作为最佳提取液条件。
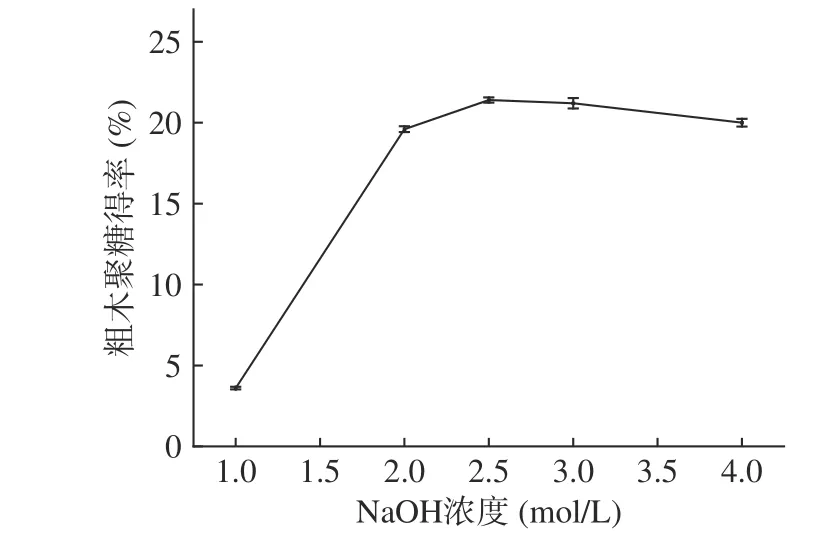
图3 NaOH 浓度对长茎葡萄蕨藻粗木聚糖得率的影响Fig.3 Effect of NaOH concentration on yield of crude xylan from Caulerpa lentillifera
2.2.2 提取时间对粗木聚糖得率的影响 在料液比1:40 g·mL-1,以浓度为2.5 mol·L-1NaOH 水溶液为提取剂的条件下,以粗木聚糖得率为考察指标,考察不同提取时间对粗木聚糖产量的影响。由图4 可知,当提取时间从1 h 增大到3 h 时,粗木聚糖得率随着水解时间的增大而逐渐升高,由18.6%±0.1%提高至24.1%±0.2%,结果表明适当延长水解时间有助于提高粗木聚糖的得率。在提取时间较短的情况下,提取液和多糖的接触不完全,混合不彻底,长茎葡萄蕨藻组织原料的多糖组分随着时间增加逐渐降低,多糖物质的浓度梯度继续降低,不断溶解并扩散到提取液中使得溶剂中多糖含量逐渐增加[40]。当提取时间为大于3 h 时,粗木聚糖得率增加变得缓慢,趋于稳定。由增加提取时间带来的收益并不显著,过度增加提取时间并没有太大的意义,出于节约时间及能源的考虑,选择提取时间为3 h 最佳预处理条件。
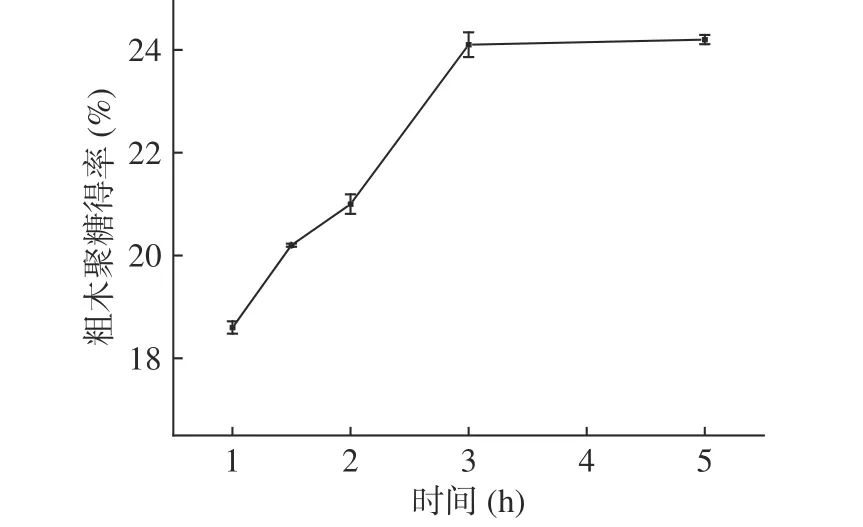
图4 提取时间对长茎葡萄蕨藻粗木聚糖得率的影响Fig.4 Effect of extraction time on yield of crude xylan from Caulerpa lentillifera
2.2.3 料液比对粗木聚糖得率的影响 以浓度为2.5 mol·L-1NaOH 水溶液为提取剂,提取时间为1.5 h条件下,以粗木聚糖得率为考察指标,考察不同料液比对粗木聚糖得率的影响。由图5 可知,当料液比为1:20 g·mL-1时,粗木聚糖得率较低,仅为8.2%±0.1%,可能是由于样品浓度过高,溶剂的量较少,物质的溶解扩散缓慢,不利于细胞壁中木聚糖的溶解溶出,从而得率较低。随着料液比的降低,提取物和提取剂的接触面积也在不断增大,传递速率也随之增高,粗木聚糖得率也随之迅速升高,可达21.1%±0.3%。当料液比小于1:100 g·mL-1时,粗木聚糖得率有所减少,降至19.7±0.4%,这是因为在提取物有限的表面积的基础上,溶剂量增大导致多糖浓度降低,有利于多糖的传质。当溶剂量大于一定程度后,在制备及收集过程中,原料的损耗也随之增加,后续浓缩过程耗能和时间会随之增加[27]。于是随着料液比的减少,长茎葡萄蕨藻粗木聚糖得率会出现小幅降低的趋势。因此,选择料液比1:100 g·mL-1为最佳预处理条件。
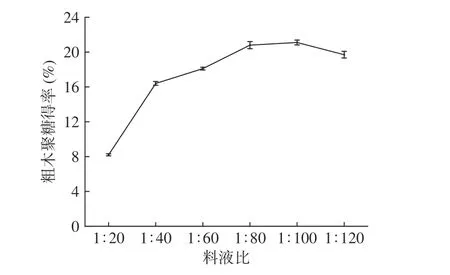
图5 料液比对长茎葡萄蕨藻粗木聚糖得率的影响Fig.5 Effect of feed-liquid ratio on yield of crude xylan from Caulerpa lentillifera
2.3 正交试验结果
2.3.1 正交试验设计结果及验证 在单因素实验基础上,选择NaOH 浓度(A)、提取时间(B)和料液比(C)三个因素,进行三因素三水平正交试验。各因素水平见表1,提取粗木聚糖的正交试验结果见表2。
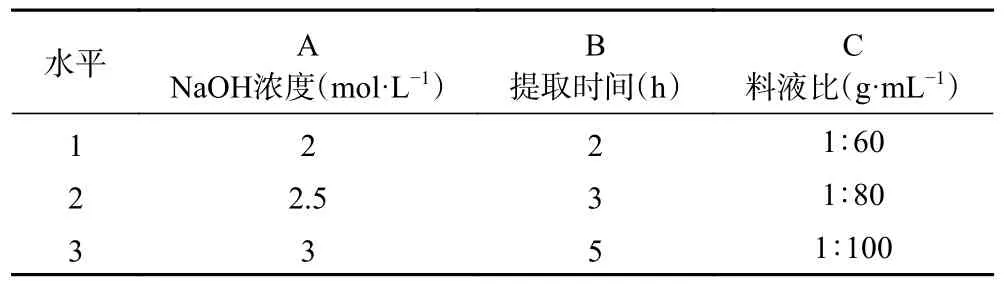
表1 长茎葡萄蕨藻粗多糖提取正交试验Table 1 Orthogonal experiment of crude xylan extraction from Caulerpa lentillifera
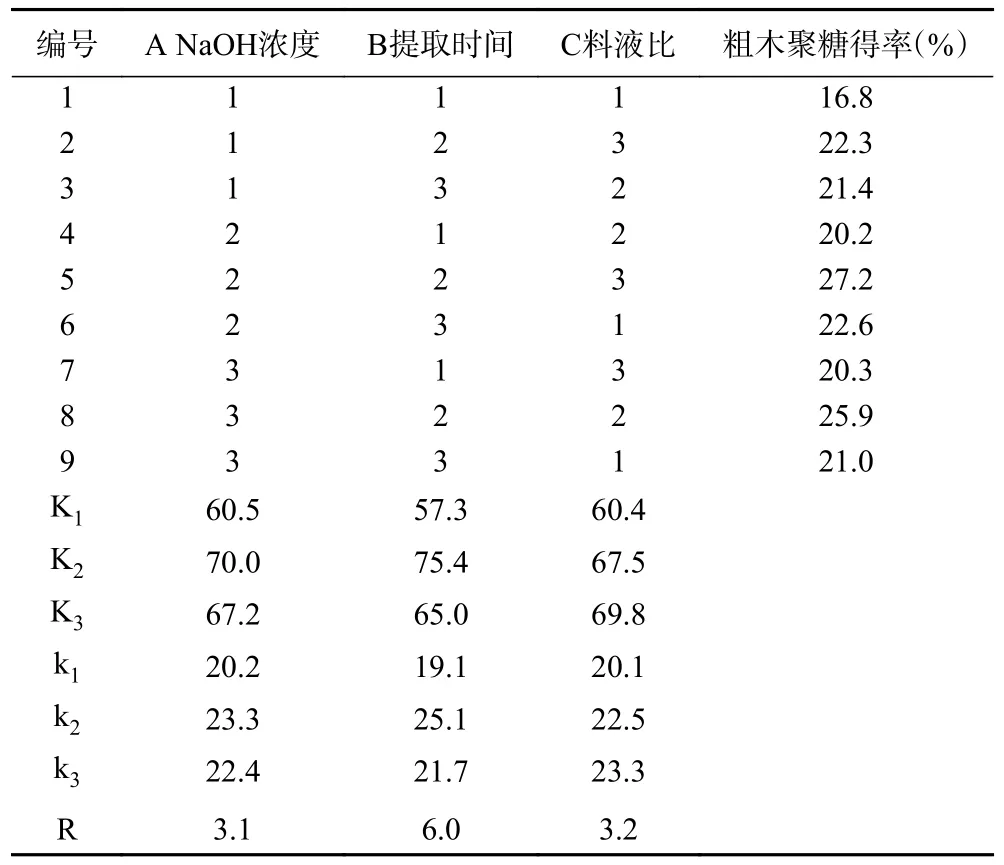
表2 长茎葡萄蕨藻粗木聚糖提取正交试验结果Table 2 Results of the orthogonal test for crude xylan extraction from Caulerpa lentillifera
由表2 可知,试验号5 号的粗木聚糖得率最高,为27.2%。不同提取条件对长茎葡萄蕨藻粗木聚糖的影响程度不同,R 值越大,表明该因素对粗木聚糖得率的影响越大[41],因此影响提取因素顺序为提取时间(B)>料液比(C)>NaOH 浓度(A),即提取时间对粗木聚糖得率影响最大,其次是料液比和NaOH浓度。通过比较K 值可知,3 个因素的最佳水平为A2B2C3,即提取时间3 h、NaOH 浓度2.5 mol·L-1、料液比1:100 g·mL-1。
2.3.2 方差分析及验证最优工艺试验 正交试验方差分析结果见表3,由表可知,三个因素对长茎葡萄蕨藻粗木聚糖得率的影响顺序为提取时间(B)>料液比(C)>NaOH 浓度(A),与极差分析结果一致。由P值可知,三个因素中提取时间对粗木聚糖得率有显著影响。为进一步验证最优工艺可靠性,在最佳提取条件下,重复三次,测得长茎葡萄蕨藻粗木聚糖得率为28.1%±0.6%,高于正交试验结果,表明该条件稳定可行。
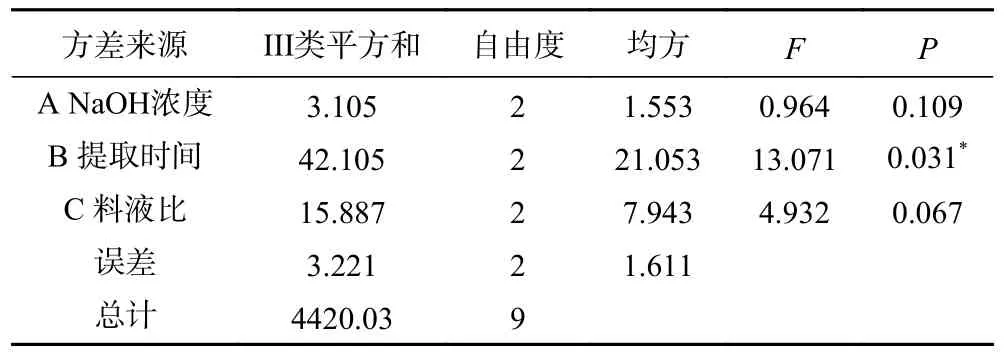
表3 长茎葡萄蕨藻粗木聚糖得率回归模型方差分析Table 3 Regression model ANOVA for crude xylan yield of Caulerpa lentillifera
2.4 β-1,3-木聚糖酶的表达与鉴定结果
SDS-PAGE 分析如图6 所示,在第1 泳道可看见在分子量40~55 kDa 中间有明显的条带,分子量与由ProtParam(http://web.expasy.org/protparam/)计算出的相应理论值48.2 kDa 相吻合,说明含有重组蛋白Xyl3088[33],用Image J 软件进行灰度分析得到目标蛋白的纯度,结果表明纯度可达90%以上,说明已经成功地将Xyl3088 的基因在大肠杆菌中表达,可用于后续木聚糖的酶解。
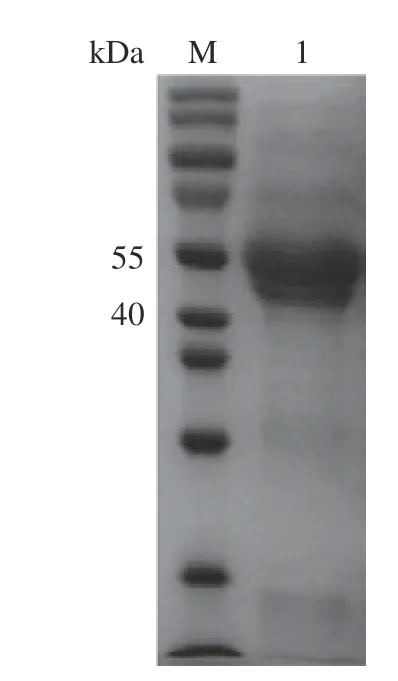
图6 Xyl3088 镍柱纯化后电泳图Fig.6 SDS-PAGE of Xyl3088
2.5 不同海藻中β-1,3-木聚糖的鉴定结果
到目前为止,根据碳水化合物活性酶(CAZy)数据库可知,所有发现的β-1,3-木聚糖酶都属于糖苷水解酶(GH)家族26。特异性水解酶β-1,3-木聚糖酶(Xyl3088)可以酶解β-1,3-木聚糖中的β-1,3-木糖基,以得到短链β-1,3-木寡糖,产物主要以β-1,3-木二糖和β-1,3-木三糖为主[8]。由图7 说明,长茎葡萄蕨藻中粗木聚糖溶液酶解后产生大量还原糖,说明该粗木聚糖为β-1,3-木聚糖,且其酶解产物中还原糖含量为12.23%±0.41%,而海带、紫菜、南极冰笋、红皮藻、羊栖菜、浒苔和石莼等酶解结果表明,其β-1,3-木聚糖含量相对较低,并没有明显的显色反应,说明这几种经济藻类中并不含β-1,3-木聚糖或含量很低。
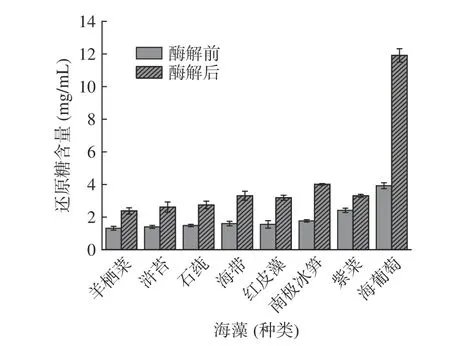
图7 不同海藻粗木聚糖酶解前后还原糖含量Fig.7 Content of reducing sugars before and after enzymatic hydrolysis of crude xylan from different algae
2.6 长茎葡萄蕨藻粗木聚糖单糖组成成分的鉴定
β-1,3-木聚糖酶(EC 3.2.1.32)能特异性水解β-1,3-木聚糖中1,3-糖苷键,产物为具还原性的β-1,3-D-木糖,三氟乙酸同样可以通过其强酸性将β-1,3-木聚糖断裂成不同程度的寡糖或单糖成分,但β-1,3-木聚糖酶为特异性裂解酶可以更准确识别酶切位点,以获得所需的目的产物,从而特异性地鉴定粗木聚糖单糖组成成分。利用自制的Xyl3088 酶解粗木聚糖得到寡糖溶液,对其进行薄层层析分析(见图8)以确定酶解产物。因市面无β-1,3-木聚糖和β-1,3-木寡糖标准品[42],故利用三氟乙酸的强酸性,对β-1,3-木聚糖充分水解,将1 mol·L-1的TFA 于70 ℃下降解β-1,3-木聚糖,在2 h 和12 h 分别取少量寡糖溶液离心,上清液用1 mol·L-1的NaOH 进行中和后进行薄层层析。在水解2 h 时,β-1,3-木聚糖并未完全降解,所得产物与Xyl3088 的酶解产物类型一致;在水解12 h 时,β-1,3-木聚糖几乎完全被酸解,得到单一组分,推测与β-1,4-D-木糖标准品同属于单糖成分[42]。Xyl3088 显示出一定的酶解活性,产生一系列包括木糖、木二糖、木三糖和木四糖在内的β-1,3-木寡糖,水解产物主要为二糖,初步证明从长茎葡萄蕨藻中提取的粗木聚糖为β-1,3-木聚糖。本研究仅采用薄层色谱法对β-1,3-木聚糖的单糖组成进行了定性分析,而未进行定量分析,后续可通过进一步的检测分析确定单糖组分及酶解产物种各寡糖含量。
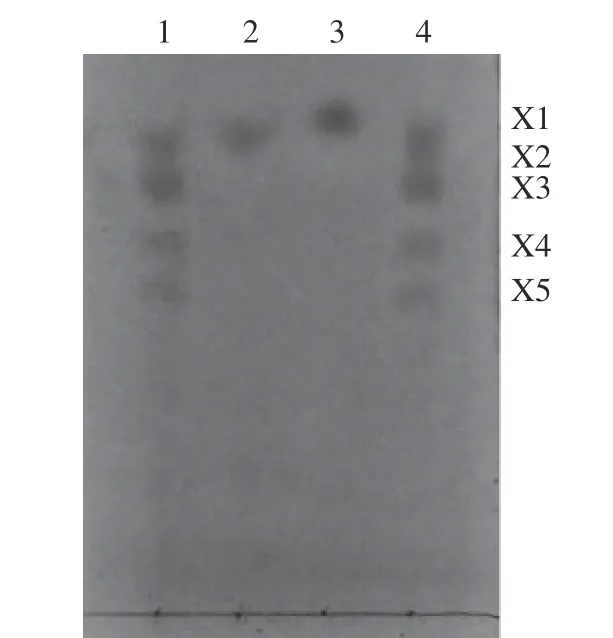
图8 水解木聚糖产物的薄层色谱图Fig.8 TLC of hydrolysis products of xylan
3 结论
本研究通过对常见经济藻类进行筛选,发现长茎葡萄蕨藻中β-1,3-木聚糖含量远远高于其他经济藻类,故确定了将长茎葡萄蕨藻作为提取β-1,3-木聚糖主要原料。采用碱提方法,在提取时间3 h、NaOH浓度为2.5 mol·L-1、料液比1:100 g·mL-1的条件下,粗木聚糖的得率可达28.1%±0.6%,优于其他传统提取方法。同时,经β-1,3-木聚糖酶特异性酶Xyl3088酶解,结合薄层色谱鉴定酶解产物,表明该碱溶性粗多糖为β-1,3-木聚糖。综上所述,本研究优化了β-1,3-木聚糖的提取工艺并明确了β-1,3-木聚糖的单糖组成,为进一步开展β-1,3-木聚糖的纯化、结构解析与寡糖功能研究奠定了基础,对β-1,3-木聚糖的深入研究具有指导意义。
