云南木姜子醇提物抑菌活性及其稳定性研究
2023-08-13薛桥丽胡永金魏美娟陈中爱
陈 聪,薛桥丽 ,胡永金,魏美娟,陈中爱
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.云南农业大学学报编辑部,云南昆明 650201)
随着人口的急速扩增,保证大批量食品供给中的食品安全成为了现代社会的主要挑战之一[1]。食源性致病菌污染是影响食品安全和引发公共卫生事件的潜在威胁因素[2]。其中金黄色葡萄球菌(Staphylococcus aureus)为典型革兰氏阳性菌,是引起食品污染和食物中毒的重要和常见细菌之一[3],其引发的食源性疾病成为食品行业的主要挑战。S.aureus引发的疾病常发于春夏季,会引发伤口化脓,严重的会引起肺炎、心包炎等炎症等[4]。大肠杆菌(Escherichia coli)是典型的革兰氏阴性菌,在自然环境中广泛存在,传播途径较广[5]。常通过污染肉、奶、蔬菜等食品导致人体感染[6],会引起呕吐、轻度发烧、肠道感染、腹泻等[7]。因此,控制金黄色葡萄球菌、大肠杆菌在食品中的污染具有重要意义。
研究表明,革兰氏阳性菌和革兰氏阴性菌能被植物提取物有效抑制,植物提取物拥有与抗生素相似的抑菌作用机制[8-9]。目前国内外对植物提取物的研究非常活跃,筛选对食品腐败菌和致病菌具有抑菌效果的植物提取物,并对其活性成分提取、分离鉴定,抑菌机理探索以及应用研究逐渐成为生鲜农产品防腐保鲜领域的研究热点。
木姜子(Litsea pungensHemsl.)为樟科,樟属落叶小乔木,别名山姜子、木香子、木樟子、山苍子以及山胡椒等[10]。中医药上又名毕澄茄[11],是我国珍贵芳香油料植物[12],大多分布在华南和西南北纬18°~34°之间的安徽、浙江、福建、云南、四川和西藏等省,其中云南种类最多(37 种),主要产高山木姜子、近轮叶木姜子、毛叶木姜子等[13-14],其果实不仅可以入药[15],还可以用作烹饪调味品,对胃寒呕吐、风湿骨痛等疾病有较好的治疗效果[16],果实中还含有大量精油,主要成分是柠檬醛,占60%~80%,具有新鲜柠檬果香[17]。该属植物含有丰富的化学成分,主要有生物碱类、黄酮类、甾体、木脂素、内酯、挥发油等[18-19]。现阶段大量研究对象为木姜子精油(Litsea cubebaessential oil,LCEO),且证明其具有抑菌效果、抗氧化性和对生物的趋避性等天然特性[20],LCEO 被证明可以破坏细菌细胞结构的完整性和细胞膜通透性,从而导致细胞内有机物的渗漏[21]。对大肠杆菌、沙门氏菌、金黄色葡萄球菌、黄曲霉素等具有明显的抑制作用[22-23]。在食品保鲜领域具有潜在应用价值[20],在食品工业领域可作为食品防腐剂[15]。但是目前仅仅研究了95%乙醇木姜子提取物对燕麦镰刀菌(Fusarium avenaceum)、烟草赤星病菌(Alternaria alternata)、石榴枯萎病菌(Ceratocystis fimberiata)三种植物病原菌均有抑制效果[24],对抑制食源性致病菌没有相关研究。
因此,本研究以云南木姜子为原材料,通过不同浓度乙醇提取制备EELC,并对EELC 对S.aureus、E.coli抑菌活性及其稳定性进行研究,为其开发成高效、无毒、稳定的天然防腐、保鲜剂提供依据。
1 材料与方法
1.1 材料与仪器
云南木姜子 2021 年8 月采自云南省临沧市;大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus) 云南省高校食品微生物资源与利用重点实验室;氢氧化钠、盐酸、乙醇、吐温80、2,3,5-三苯基氯化四氮唑(TTC) 分析纯,北京索莱宝科技有限公司;LB 肉汤培养基、LB 琼脂培养基 广东环凯生物科技有限公司。
GZX-GH01-3-BS 电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;RE-5205 旋转蒸发仪 上海亚荣生化仪器厂;MS3 涡旋震荡仪 德国ika 公司;DC-3010 恒温水浴锅 宁波新芝生物科技有限公司;ST3100 pH 计 奥豪斯国际贸易(上海)有限公司;Spectra Max iD5 光栅型多功能酶标仪 赛默飞世尔有限公司;UV-6100 紫外-可见分光光度计 上海美谱达仪器有限公司;SW-CJ-1F 超净工作台 苏净集团苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 EELC 的制备 根据文献[24-25]方法并加以分析改进,云南木姜子鲜果室温自然晾干10 d,再转于电热恒温鼓风干燥箱内烘干、粉碎过40 目筛密闭保存备用。准确称取10 g 云南木姜子粉末按1:10料液比分别加入纯水、55%乙醇、75%乙醇、95%乙醇以及无水乙醇30 ℃浸泡2 h,合并2 次过滤的滤液,将滤液用旋转蒸发仪45 ℃浓缩至提取溶剂挥发完全即得提取物,置于-20 ℃冰箱中密闭冷冻备用。用无菌水按试管二倍稀释法稀释成浓度为20 mg/mL 的EELC 稀释液备用,EELC 得率按下式计算。
1.2.2 培养基的制备 LB 肉汤培养基:2.1 g LB 肉汤粉加入至100 mL 蒸馏水中溶解混匀;LB 琼脂培养基:3.6 g LB 琼脂粉加入至100 mL 蒸馏水中溶解混匀;121 ℃高压蒸汽灭菌20 min。
1.2.3 菌株的活化 将金黄色葡萄球菌、大肠杆菌接种到装有5 mLLB 肉汤培养基的试管中,37±1 ℃培养12~18 h。用接种环挑取菌悬液以划线法接种到LB 琼脂固体平板上,37±1 ℃恒温培养箱中培养18~24 h,然后从平板中挑取单菌落接种在LB 琼脂培养基试管斜面内,37±1 ℃恒温培养箱中培养18~24 h,后将试管斜面贮存于4 ℃冰箱内作为保存菌备用,保存期不超过一个月,每月传代一次,传代次数不超过10 代[26]。
1.2.4 菌悬液的制备 用接种环取保存菌,以划线法接种到LB 固体平板上,37±1 ℃恒温培养箱内培养24 h,LB 固体平板在4 ℃条件下保存,1 周内使用。用接种环挑取LB 固体平板上单菌落接种在100 mL LB 肉汤培养基内,37±1 ℃培养12~18 h。采用麦氏比浊法,使用LB 肉汤培养基调整菌液浓度至1×108~5×108CFU/mL,并以此作为后续试验菌悬液,菌悬液在4 ℃条件下保存,4 h 内使用[26]。
1.3 不同乙醇浓度EELC 对S.aureus、E.coil 抑菌活性分析
1.3.1 抑菌活性测定 采用KB 纸片法[26]测定不同乙醇浓度EELC 对S.aureus、E.coil的抑菌活性。取1.2 中的菌悬液用冷却至55 ℃左右的LB 琼脂培养基按1:10(菌悬液25 mL:LB 琼脂培养基225 mL)的比例稀释,充分混匀后取20~30 mL 于无菌平板中,轻轻摇动平板使菌液均匀铺平,待其凝固后制成检测平板备用。将浸泡浓度为20 mg/mL EELC 稀释液的6 mm 饱和滤纸片晾干,然后贴在检测平板表面,一个平板贴3 个滤纸片,倒置于37±1 ℃恒温培养箱内,利用游标卡尺十字交叉法测量抑菌圈大小,以无菌水作对照。
1.3.2 最小抑菌浓度(MIC)的测定 利用2,3,5-氯化三苯基四氮唑(TTC)法[27]测定EELC 对S.aureus、E.coil的MIC。将100 μL 浓度为108CFU/ mL 的菌液加入96 孔板中,再加入100 μL 不同浓度的EELC,使醇提物的最终浓度分别达到10、5、2.5、1.25、0.6、0.3、0.15、0.07、0.04、0.02、0.01 mg/mL,以不加样的菌悬液作为对照,不加样以及不加菌悬液的液体培养基为未处理组,培养箱中培养24 h 后加入20 μL 0.2% TTC 溶液,避光培养4 h 后,观察颜色确定MIC,每个处理均设置3 次重复。
1.4 EELC 稳定性分析
1.4.1 EELC 抑菌稳定性的测定 采用1.5×106CFU/mLE.coil、S.aureus为指示菌、终浓度为2MIC EELC溶液进行实验。其中未处理组为未经处理的EELC与菌悬液等体积混合;对照组为不加EELC 的菌悬液。设置3 次平行实验,采用96 孔板法检测不同条件对EELC 抑菌活性的影响[28-29]。
1.4.2 温度对EELC 抑菌活性的影响 将筛选出抑菌活性最佳EELC 分别在20、40、60、80、100 ℃的水浴中处理30 min,以不加样组作为对照,以S.aureus、E.coil为指示菌,每组试验设3 个重复,采用96 孔板法分别检测不同温度对EELC 抑菌活性的影响[28-29]。
1.4.3 热处理时间对EELC 抑菌活性的影响 将筛选出抑菌活性最佳EELC 以及在最佳温度分别水浴处理1、2、3、4、5 h。以不加样组作为对照,以S.aureus、E.coil为指示菌,每组试验设3 个重复,采用96 孔板法分别检测不同热处理时间对EELC 抑菌活性的影响[28-29]。
1.4.4 pH 对EELC 抑菌活性的影响 分别用1 mol/L的盐酸和1 mol/L 氢氧化钠溶液将筛选出抑菌活性最佳EELC 的pH 调为4.0、6.0、8.0、10.0,以不加样组作为对照,以S.aureus、E.coil为指示菌,每组试验设3 个重复,采用96 孔法分别检测pH 对EELC 抑菌活性的影响[28-29]。
1.4.5 紫外线照射对EELC 抑菌活性的影响 将筛选出抑菌活性最佳EELC 敞开放置在30 W 紫外灯光下,分别照射10、20、30、40、50、60 min,以不加样组作为对照,以S.aureus、E.coil为指示菌,每组试验3 个重复,采用96 孔法分别检测紫外线对EELC抑菌活性的影响[28-29]。
1.5 数据处理
所有试验均重复3 次,采用Excel 进行数据统计;使用SPSS 19.0 的单因素方差分析中的邓肯氏多重比较进行显著性差异分析,以P<0.05 为差异显著;P<0.01,表明具有极显著性差异;用Origin 9.0 软件绘图。
2 结果与分析
2.1 不同浓度乙醇EELC 得率的测定
为选择一种较好的提取溶剂,本研究分别用纯水、55%、75%、95%和无水乙醇对云南木姜子进行提取来做抑菌效果的实验。从图1 可以看出,使用纯水、55%乙醇、75%乙醇、95%乙醇和无水乙醇作为云南木姜子的提取溶剂,它们的提取效率并不相同。95%乙醇的得率最高,为44.28%,而纯水的得率最低,只有7.25%。一般刚采摘的木姜子中含油量有4%~7%,干果中的油含量大约为1%~3%[30]。因此EELC 比木姜子精油提取量大且工艺较为简单。
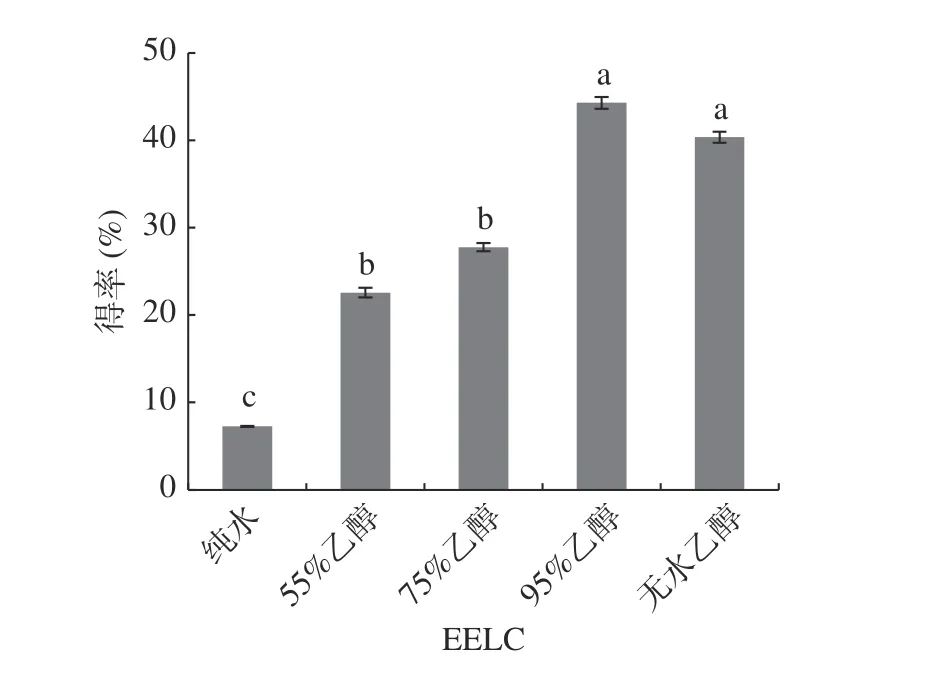
图1 不同浓度乙醇EELC 得率Fig.1 Yield of EELC with different concentrations of ethanol

图2 云南木姜子醇提物对金黄色葡萄球菌和大肠杆菌抑菌效果Fig.2 Antibacterial effect of alcohol extract of EELC on Staphylococcus aureus and Escherichia coli
2.2 不同浓度乙醇EELC 对S.aureus、E.coil 抑菌活性
采用KB 纸片法研究不同浓度乙醇EELC 抑菌活性对S.aureus、E.coil抑菌活性,结果见表1,与对照组相比纯水提取物对S.aureus、E.coil均无抑制作用。其他四种不同提取溶剂提取物均有明显抑菌效果,但抑菌圈大小并不相同,其中55% EELC 对S.aureus抑制效果最好,其抑菌圈为18.25±0.26 mm;75% EELC 对E.coil抑菌效果最好,抑菌圈为17.81±0.71 mm。

表1 EELC 对 2 种受试菌的抑菌圈结果(醇提物浓度20 mg/ml)Table 1 Inhibition zone of EELC on two tested bacteria (ethanol extract concentration 20 mg/ml)
2.3 不同乙醇浓度EELC 对S.aureus、E.coil 最小抑菌浓度(MIC)
如表2、3 所示,与未处理组相比可以看出,纯水提取物对S.aureus和E.coil均无抑制作用,55%、75%、95%、无水乙醇提取物对S.aureus、E.coil均有不同程度抑菌效果。其中55% EELC 对S.aureus抑制作用最佳,其最小抑菌浓度(MIC)为19 μg/mL;75% EELC 对E.coil抑制作用最佳,其最小抑菌浓度(MIC)为819 μg/mL。且EELC 浓度越高,抑菌效果越强。结果表明云南木姜子的主要抑菌成分溶于乙醇,在水中的溶解度很小。木姜子精油中主体抑菌成分为柠檬醛难溶于水,易溶于有机溶剂乙醇[11];据研究5%木姜子精油在含有S.aureus和枯草芽孢杆菌的培养基中有抑菌圈生成,而在含有E.coil的培养基中未出现抑菌圈[30],同样55% EELC 对S.aureus抑菌作用浓度低于75% EELC 对E.coil的抑菌作用浓度,因此推测EELC 中主体抑菌成分可能与精油类似。由于S.aureus和E.coil为不同性质的两种菌,细胞结构并不相同,因此55%、75% EELC 抑菌主体成分是否一致,还需进一步鉴定探究。

表2 EELC 对金黄色葡萄球菌最小抑菌浓度MICTable 2 Minimal inhibitory concentration MIC of EELC against S. aureus
结合提取率、抑菌圈和MIC 实验结果综合分析,后续试验以55%、75% EELC 为试验材料分别对S.aureus 与E.coil进行抑菌稳定性试验。

表3 EELC 对大肠杆菌最小抑菌浓度MICTable 3 Minimal inhibitory concentration MIC of EELC against E.coil
2.4 EELC 抑菌稳定性研究
2.4.1 温度对EELC 抑菌活性的影响 以S.aureus与E.coil的OD600值为指标来判断EELC 的抑菌活性,吸光度值越低,其抑菌活性越强[28],结果如图3所示,55% EELC 对S.aureus实验组与未处理组相比较,20~60 ℃处理30 min,其抑菌活性相对稳定;在40 ℃处理时OD600为0.1108,抑制效果最好,因此选取该温度进行热处理时间抑菌稳定性试验。80~100 ℃处理30 min,抑菌活性下降较为明显,但与对照组相比,其他组均具有显著的抑菌活性(P<0.05)。表明55% EELC 具有较好的热稳定性。

图3 不同温度EELC 对金黄色葡萄球菌抑菌活性的影响Fig.3 Effect of EELC at different temperatures on the antibacterial activity of S. aureus
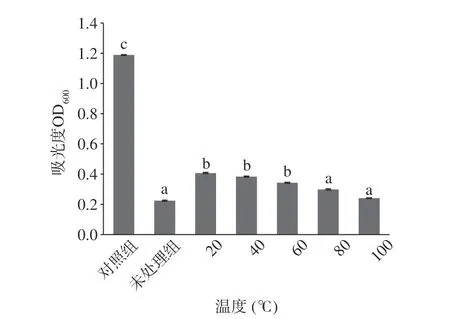
图4 不同温度EELC 对大肠杆菌抑菌活性的影响Fig.4 Effect of EELC at different temperatures on the antibacterial activity of E.coil
不同温度处理75% EELC 对E.coil抑菌活性结果如图2 所示,与未处理组对比,在100 ℃处理时抑菌活性保持最高,因此选取该温度进行热处理时间抑菌稳定性试验。但与未处理组相比,75% EELC 经不同温度处理后,与未处理组相比其抑菌活性没有显著差异(P>0.05),表明75% EELC 具有较好的热稳定性。
结合OD600与抑菌活性保持率可以看出,55%EELC 对S.aureus与75% EELC 对E.coil在相同温度处理条件下,展现出不同程度抑制效果,但综合来看均具有良好的热稳定性,100 ℃下处理30 min 均保持较好的抑菌活性。木姜子属的植物种类众多,但成分都比较类似,果实中往往富含挥发油、生物碱、黄酮类、γ-丁内酯类和萜类化合物,尤其是单萜和倍半萜是该属植物中丰富的生物活性成分[31]。单萜的沸点比倍半萜低,并且单萜和倍半萜随分子量和双键的增加,功能基的增多,熔点和沸点相应增高,在高温下不易分解[32],分析55%、75% EELC 具有良好的热稳定性与这些物质有关,具体原因有待进一步研究。
2.4.2 热处理时间对EELC 抑菌活性的影响55%、75% EELC 分别在40 和100℃处理1~5 h 抑菌活性结果如图5~图6 所示,与对照组相比,在不同时间处理下,55% EELC 对S.aureus、75% EELC 对E.coil的抑菌活性具有显著差异(P<0.05);与未处理组相比抑菌活性会有所降低,但没有显著差异(P>0.05)。试验结果表明,S.aureus、E.coil随着时间处理的增长OD600大小有所变化,但是变化幅度较小,抑菌效果相对稳定。2.4.1 中提到木姜子属含量高的活性物质熔沸点较高[31-32],在适应温度中较稳定。因此,可能是处理时间并未使55%、75% EELC抑菌成分受到影响,其仍然对微生物生长还具有抑制作用。
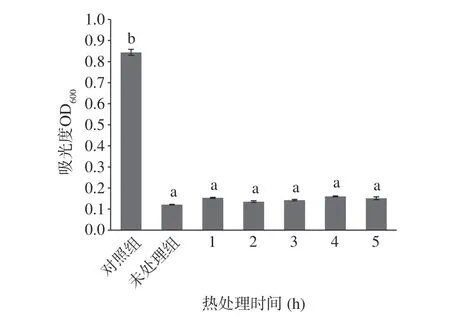
图5 不同热处理时间EELC 对金黄色葡萄球菌抑菌活性的影响Fig.5 Effect of EELC at different heat treatment times on the antibacterial activity of S. aureus

图6 不同热处理时间EELC 对大肠杆菌抑菌活性的影响Fig.6 Effect of EELC at different heat treatment times on the antibacterial activity of E.coil
2.4.3 pH 对EELC 抑菌活性的影响 如图6 所示,随着pH 的升高或者降低,与未处理组相比,55%EELC pH 为4 时抑菌活性差异显著(P<0.05),pH 为6~10 时抑菌活性没有显著差异(P>0.05)。如图7 所示,75% EELC 经pH 4~8 处理后,与未处理组相比,抑菌活性有所下降,但与对照组相比,其抑菌活性差异显著(P<0.05),具有明显的抑菌效果;pH 为10时与未处理组相比,抑菌活性没有显著差异(P>0.05)。

图7 不同pH EELC 对金黄色葡萄球菌抑菌活性的影响Fig.7 Effect of EELC at different pH on the antibacterial activity of S.aureus
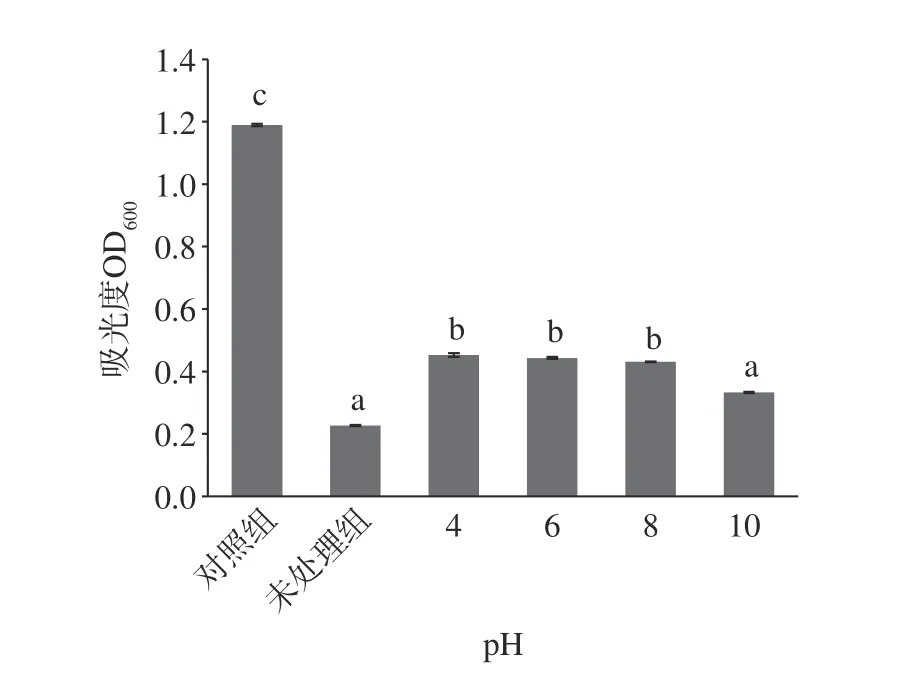
图8 不同pH EELC 对大肠杆菌抑菌活性的影响Fig.8 Effect of EELC at different pH on the antibacterial activity of E.coil
综上所述,酸性条件下更能影响55%、75%乙醇EELC 抑制受试菌的生长,pH 为10 时其抑菌活性保持率较其他处理组高;可以看出两者均在强碱条件下抑菌活性更好,研究表明木姜子挥发油具有良好的抑菌活性,且其α-柠檬醛和β-柠檬醛的含量接近70%,说明木姜子挥发油虽然化学成分复杂,但含量高的成分不多,主要成分为柠檬醛[31]。柠檬醛在碱性条件下能树脂化,但不改变其性质,在强酸性作用下能环化生成用于配制油漆稀释剂的对异丙基甲苯[33]。由此55%、75% EELC 可能也含有柠檬醛,因此在酸性条件下抑菌活性有所下降是其抑菌成分受到H+的破坏,结构发生改变,从而影响其抑菌性能。但55%、75% EELC 在pH 改变的条件下,与对照组相比,抑菌活性显著(P<0.05),说明两者具有良好酸碱稳定性。
2.4.4 紫外线照射对EELC 抑菌活性的影响 55%乙醇EELC 经30W 紫外线处理10~60 min 后,抑菌活性相对稳定,结果如图9 所示,实验组与未处理组比较其抑菌活性没有显著差异(P>0.05)。结合图10,75%乙醇EELC 经紫外线处理30~60 min 后抑菌活性会有所下降,但与对照组对比,抑菌活性差异具有统计学意义(P<0.05),对E.coil仍有抑制效果。说明55%、75%乙醇EELC 中的活性物质能够对抗紫外线的破坏,保证其在自然环境中也能发挥较好的抑菌活性。
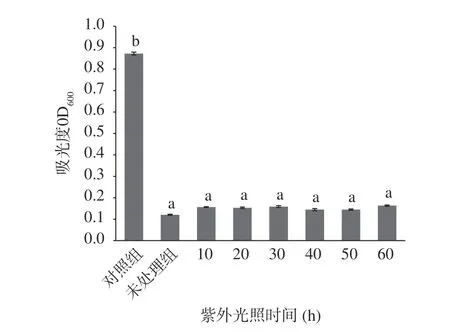
图9 紫外线处理EELC 对金黄色葡萄球菌抑菌活性的影响Fig.9 Effect of UV-treated EELC on the antibacterial activity of S. aureus
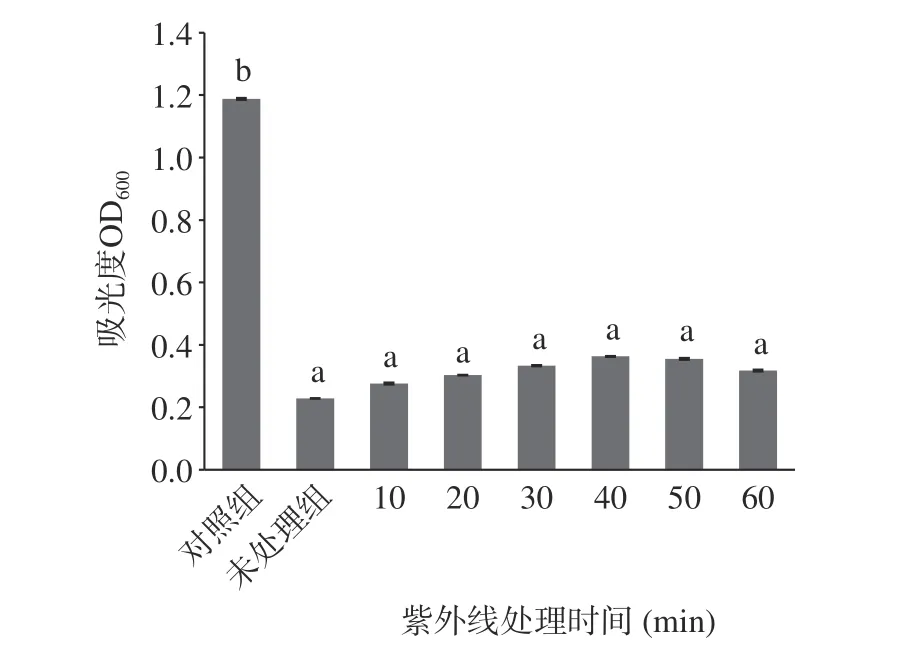
图10 紫外线处理EELC 对大肠杆菌抑菌活性的影响Fig.10 Effect of UV-treated EELC on the antibacterial activity of E.coil
3 结论
木姜子在云南有丰富的资源可利用,大多数作为调味品,群众基础好,但云南木姜子的利用还处于初步阶段,基本上都没有对其进行精细加工应用。木姜子已被证明富含抑菌、抗氧化的活性物质,但未能将其运用到食品保鲜、防腐方面。因此,本研究通过采用不同浓度乙醇进行提取制备不同浓度乙醇EELC,以S.aureus、E.coil为指示菌,探讨不同浓度乙醇EELC 是否具有抗菌作用及抗菌稳定性。结果显示,EELC 提取率较木姜子精油高且提取工艺简单,更加便于应用;纯水提取物无抑菌活性,说明云南木姜子抑菌活性物质主要溶于乙醇,并且55%、75%EELC 分别对S.aureus、E.coil具有良好的抑制作用且作用浓度较低,其MIC 分别为19、819 μg/mL;抑菌稳定性实验表明,两者分别对S.aureus、E.coil在经过不同温度、热处理时间、pH、紫外线照射时间处理下,与对照组相比,抑菌活性均具有显著差异(P<0.05),总体上,55%、75% EELC 表现出了良好的体外抑菌活性和稳定性。
本研究为云南木姜子抑菌活性物质的分离纯化、抑菌机理的研究了提供了数据支撑。在后续研究中,课题组将进一步探讨其抑菌机理和安全性评价,进一步开发两者在食品防腐和保鲜中的应用,为云南木姜子资源综合利用奠定理论基础。
