酵母菌乳酸菌共发酵对脐橙饮品品质的影响
2023-08-13周雪瑞张潆月曾朝懿
叶 洪,周雪瑞,王 素,张潆月,孙 月,曾朝懿,张 庆,唐 洁
(西华大学食品与生物工程学院,四川成都 610036)
脐橙(Navel orange)属蔷薇亚纲无患子目芸香科柑橘属,是柑橘品种中最优良的甜橙种类,含有多种常量和微量元素、维生素、氨基酸、膳食纤维等营养物质[1]。经常食用脐橙具有解油腻、分解脂肪、醒酒、促进肠道蠕动、清肠通便、增进食欲等功效[2]。
目前,脐橙饮品主要是单一酵母菌或酵母菌与非酿酒酵母菌发酵,研究主要集中在果酒[3]、果醋[4]以及发酵工艺的优化,针对脐橙饮品中酵母菌与乳酸菌共发酵特性的研究较少。酿酒酵母菌[5]和植物乳杆菌[6]共发酵是一个生物混合体系,体系中微生物之间大多具有生长代谢协调作用[7]。有相关研究报道,乳酸菌和酵母菌共发酵不但能够相互促进生长,而且可以获得某些纯种发酵不易得到的产物,这些物质赋予了饮品独特的风味和口感[8-10]。Sun 等[11]研究了酵母菌LAIVIN RC212 与乳酸菌PL18 共同接种对樱桃酒化学和感官特性的影响,不仅使共发酵的挥发性物质更多,而且缩短了发酵时间;陈毅坚等[12]利用乳酸菌RSJ-1 与酵母菌JMJ-1 发酵新型乳制品,使苯乙醇和3-甲基丁醇等风味物质含量大大增加;马丽娟等[13]利用植物乳杆菌(Lactobacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)发酵菠萝汁,发现该饮品既保留了菠萝原有的营养物质和特有香气,还赋予一定的发酵风味。金晓帆[14]利用酵母菌DV10 与植物乳杆菌(Saccharomyces cerevisiae)发酵芒果浆,使得醇类、酯类以及总酚含量增加,抗氧化能力更强。
本文以脐橙汁为原料,利用实验室保藏的酵母菌和乳酸菌菌株进行共菌发酵实验,以单一菌株发酵为对照,探究发酵过程中脐橙饮品的活菌数、酒精度、还原糖、总酚、抗氧化性、挥发性香气物质变化特性,为酿酒酵母和植物乳杆菌共发酵脐橙饮品的开发提供理论参考依据。
1 材料与方法
1.1 材料与仪器
脐橙 四川金堂脐橙果园,直径约75~80 mm,无公害;酵母菌(酿酒酵母SC-125)、乳酸菌(植物乳杆菌B-5) 均由西华大学古法发酵(酿造)生物技术研究所保藏;乳酸细菌培养基(MRS)、马铃薯葡萄糖琼脂培养基(YPD) 青岛高科园海博生物技术有限公司;1,1-二苯-2-库基肼(DPPH 试剂) 成都市科隆化学品有限公司;3,5-二硝基水杨酸 福晨(天津)化学试剂有限公司;仲辛醇 成都市科隆化学品有限公司;以上试剂均为分析纯。
FA1104 型电子天平 上海舜宇恒平有限公司;BPH-9082 型电热恒温培养箱 上海一恒科技有限公司;INFINITEF200 型酶标仪 上海闪谱生物科技有限公司;GCMS-QP2020NX 型气相色谱-质谱联用仪 岛津公司;5804R 型冷冻离心机 Eppendorf 公司;PEN3 型电子鼻 德国AIRSENSE 公司;G154DWS型全自动高压灭菌锅 致微(厦门)仪器有限公司。
1.2 实验方法
1.2.1 脐橙饮品发酵试验 将脐橙鲜果的皮壳和核去掉,用榨汁机将果肉榨汁制备成果浆状,以3000 r/min 离心30 min,120 目分样筛过滤后取上清液置于250 mL 发酵容器中,于60 ℃巴氏灭菌15 min。通过预实验,确定最佳接种量和种子液浓度,同时将酿酒酵母菌SC-125、植物乳杆菌B-5 活化(酿酒酵母菌种子液浓度为106CFU/mL,植物乳杆菌种子液浓度为108CFU/mL)按2%的比例添加,30 ℃恒温静置发酵,设置三个平行,使用阿贝折光仪检测发酵状态,直至可溶性固形物稳定,主发酵结束。期间每隔12 h 进行取样,在超净台收集脐橙发酵上清液,将其-50 ℃冷冻保存。
1.2.2 菌落计数方法 用PDA 琼脂平板计数法和MRS 琼脂平板计数法分别测定酿酒酵母SC-125 和植物乳杆菌B-5 协同发酵脐橙汁在不同发酵阶段的活细胞数。同时分别以两种菌株单独发酵脐橙为对照。活细胞数以每毫升菌落形成单位(CFU/mL)表示。
1.2.3 脐橙饮品理化指标的测定 可溶性固形物:手持糖度仪测定;pH:pH 计测定;均参照GB/T 15038-2006 的方法[15];还原糖含量:参照高文军等[16]的DNS 法;总酚:福林酚法[17],以没食酸计。
1.2.4 酒精度的测定 酒精度含量的测定参照Fulgencio 等[18]通过外标法利用气相色谱测定白酒酒精度,其标准曲线方程为y=5255.3x-769.1,R2=0.998。
色谱条件:初始温度45 ℃,保持5 min,以3 ℃·min-1升温至60 ℃,保持3 min,以20 ℃·min-1升温至200 ℃,保持5 min。色谱柱为Rtx-Wax 毛细管柱(30 m×0.25 mm,0.25 μm),载气为高纯度氦气,载气流速1.0 mL·min-1;进样口温度: 200 ℃。
1.2.5 脐橙饮品抗氧化能力测定
1.2.5.1 DPPH 自由基清除率 取1 mL 待测脐橙饮品溶液和1 mL 0.5 mmol·L-1的DPPH 溶液,摇匀避光静置30 min,于517 nm 处测定其吸光度值A1,同时用蒸馏水做空白对照,无水乙醇做阳性对照[19]。DPPH 自由基清除率计算公式如式(1):
式中:A0为蒸馏水代替脐橙饮品溶液的吸光度;A1为加入脐橙饮品溶液的吸光度;A2为无水乙醇代替DPPH 溶液的吸光度。
1.2.5.2 羟基自由基清除率 参考Hui 等[20]的方法,精确吸取9 mmol·L-1硫酸亚铁1 mL,加入1 mL 9 mmol·L-1水杨酸乙醇溶液,然后加入酒样1 mL,最后加入8.8 mmol·L-1的H2O21 mL,摇匀后在37 ℃的恒温水浴锅中反应30 min,在波长510 nm下测定吸光度A1,同时用甲醇做空白对照,蒸馏水代替H2O2做阳性对照。羟基自由基清除率计算公式如式(2):
式中:A0为甲醇代替脐橙饮品溶液的吸光度;A1为加入脐橙饮品溶液的吸光度;A2为蒸馏水代替H2O2溶液的吸光度。
1.2.6 挥发性成分的分析
1.2.6.1 样品预处理 参照文献[21-22]的方法,基于HS-SPME/GC-MS 对挥发性物质的分析,采用内标法进行半定量分析,内标选用浓度为0.4175 mg·L-1的仲辛醇。取3.8 mL 发酵样品加入0.2 mL 稀释的仲辛醇(用超纯水稀释1×105倍),置于顶空瓶中,加入1 g NaCl,加盖密封,放入60 ℃恒温水浴中平衡20 min,将老固相微萃取器插在样品瓶上,吸附20 min 后拔出,插入气相色谱仪进样口,于220 ℃解吸3 min,进行GC-MS 检测分析。
1.2.6.2 GC-MS 检测条件 a.气相色谱条件:色谱柱为DB-Wax(30 mm×0.25 mm×0.25 μm),进样温度为240 ℃;程序升温:初始温度40 ℃保持2 min;以6 ℃·min-1升至240 ℃保持4 min;载气为氦气,线速为1.0 mL·min-1,不分流。
b.质谱条件:电离方式为电子电离(electron ionization,EI)源,电子能量为70 eV,灯丝流量为0.20 mA,离子源温度为200 ℃,接口温度为250 ℃。
1.2.7 电子鼻香气成分的测定 电子鼻可对特定香气成分进行响应,然后可以通过模式识别算法来执行区分和分类[23]。为了研究脐橙汁发酵过程中风味的变化,分析发酵中的风味变化,采用顶空吸气法[24]检测,比较气味的差异性,并使用Origin 2018 进行主成分分析对其风味特征进行比较,表1 为电子鼻的10 个传感器性能。
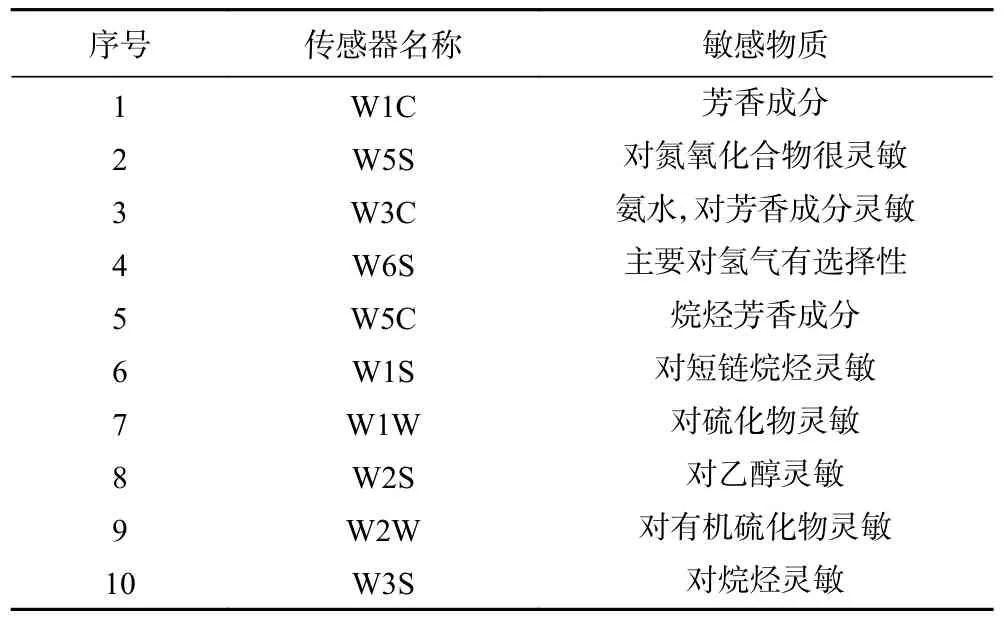
表1 电子鼻的10 个传感器的性能Table 1 Ten sensors performance of the e-nose
1.3 数据处理
试验数据采用SPSS 20.0 进行显著性分析,柱状图折线图采用 Origin 2018 进行绘制,每组试验三个平行,所有结果用平均值±标准差表示。
2 结果与分析
2.1 脐橙发酵过程中活菌数和pH 的变化
在脐橙发酵初期,酵母菌SC-125 和植物乳杆菌B-5 都能很好的代谢脐橙中的有机质,表现出了较好的生长能力。如图1A 所示,在共发酵前期,酵母菌SC-125 迅速增加达约8.0 CFU·mL-1,这是由于脐橙汁中的还原糖为酵母菌提供了营养物质。尽管随着发酵时间的延长,共发酵酵母菌SC-125 活菌数在降低,但共发酵中的植物乳杆菌B-5 活菌数保持相对的稳定,其利用酵母代谢产物和还原糖等营养物质代谢产生了乳酸、氨基酸等[25],使饮品中的可滴定酸含量升高,导致pH 下降(如图1B 所示)。葡萄酒pH 的最佳活性是2.5~3.8,三种不同菌种发酵饮品的pH 均在此范围,而且都有下降趋势,pH 的大小会影响最终产品中高级醇的含量,从而影响饮品的风味。
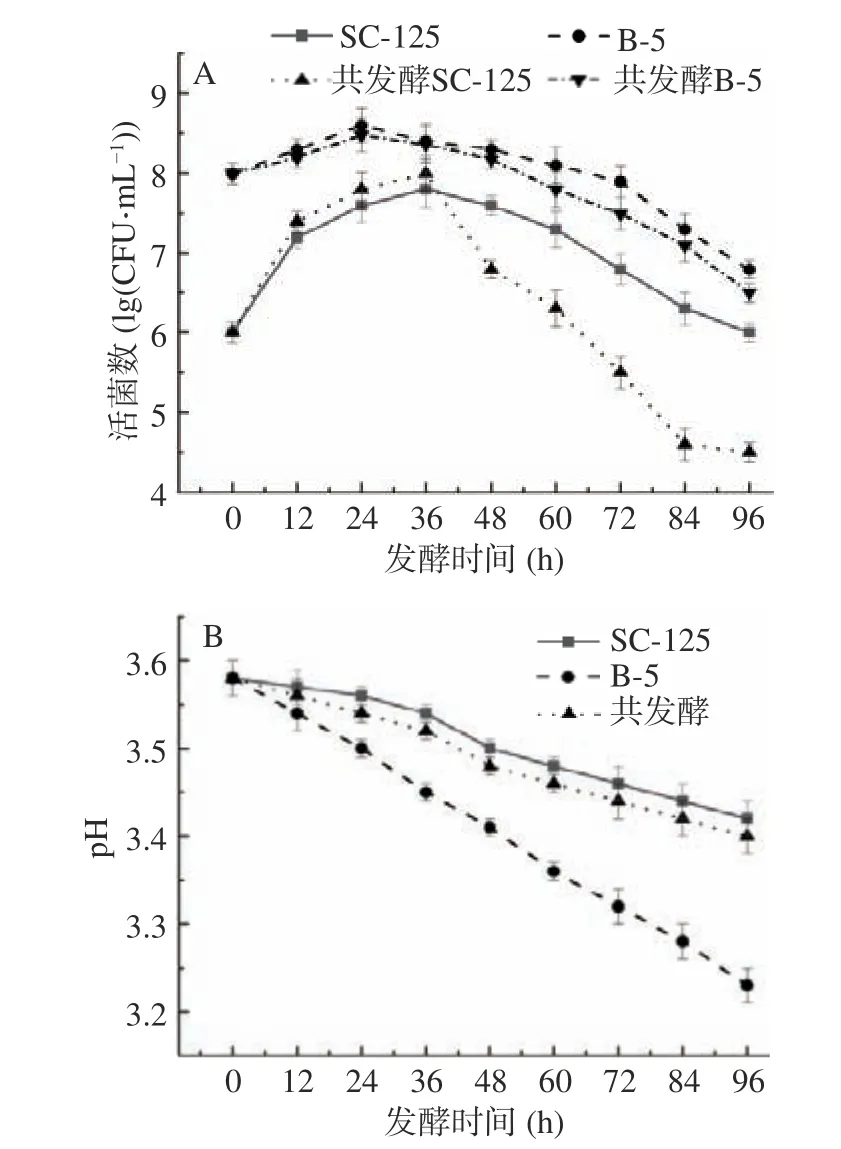
图1 脐橙发酵过程中活菌数(A)和pH(B)的变化趋势Fig.1 Variation trend of viable count (A) and pH (B) during navel orange fermentation
2.2 脐橙发酵过程中酒精度和还原糖含量的变化
还原糖的利用表明了酵母进行酒精发酵和底物转化的能力[26],而微生物对糖的耐受性和利用率也成为发酵终点判断的重要指标之一。如图2 所示,在发酵前期,酿酒酵母SC-125 单独发酵和共培养的还原糖含量从70.31 g·L-1迅速下降,分别达到3.4 和3.2 g/L,符合葡萄酒还原糖的标准[15],即4 g/L 以下;脐橙饮品酒精度持续升高,0~96 h,酿酒酵母SC-125 单独发酵的酒精度比共发酵的酒精度高,酒精度都在60 h 时达到最高峰,说明植物乳杆菌B-5 同型乳酸发酵利用还原糖生长繁殖,与酿酒酵母SC-125 共发酵中能起到一定的降低酒精度的作用。整个发酵过程中,共发酵酒精度在0~6%左右,发酵终点酒精度为5.2%,与葡萄酒低醇标准6%以下相符。
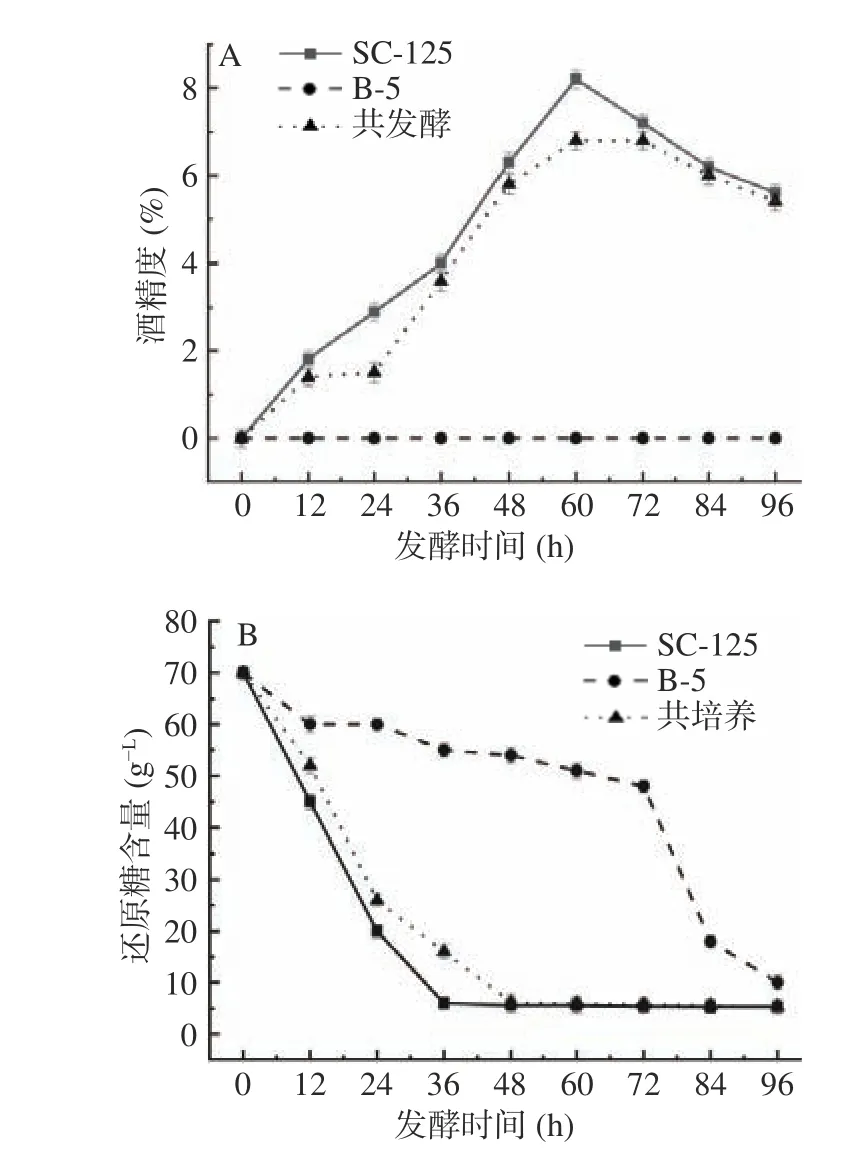
图2 脐橙发酵过程中酒精度和还原糖含量的变化Fig.2 Changes in alcohol content and reducing sugar content during navel orange fermentation
2.3 脐橙发酵过程中总酚含量的变化和脐橙饮品抗氧化能力分析
由于酵母细胞会对酚类物质产生吸附作用,随着发酵液环境的变化,又会产生解吸作用[27],从图3A 可知,对照组酿酒酵母SC-125 单独发酵过程中,总酚含量差异波动较大,而随着植物乳杆菌B-5 的添加,共发酵总酚含量最高,共发酵总酚含量从338.78 mg·L-1上升到355.5 mg·L-1,相比对照组酵母SC-125 总酚提高了7.73%。共发酵对DPPH 自由基的清除率和羟基自由基清除率最高,这与总酚含量的变化是一致的,共发酵脐橙饮品的抗氧化能力与总酚含量呈正相关关系,这与王东伟等[28]的研究是一致的。如图3B 所示,对照组酿酒酵母SC-125、对照组植物乳杆菌B-5 以及共发酵对DPPH 自由基的清除率分别由脐橙汁的62.67%提高到75.54%、72.45%、78.82%,对羟基自由基的清除率分别由初始的68.77%提高到74.71%、71.82%、77.08%。共发酵对DPPH 自由基的清除率和羟基自由基清除率最高,。证明菌株的协同作用发酵有利于抗氧化活性的增加,且共发酵的抗氧化能力效果最佳。
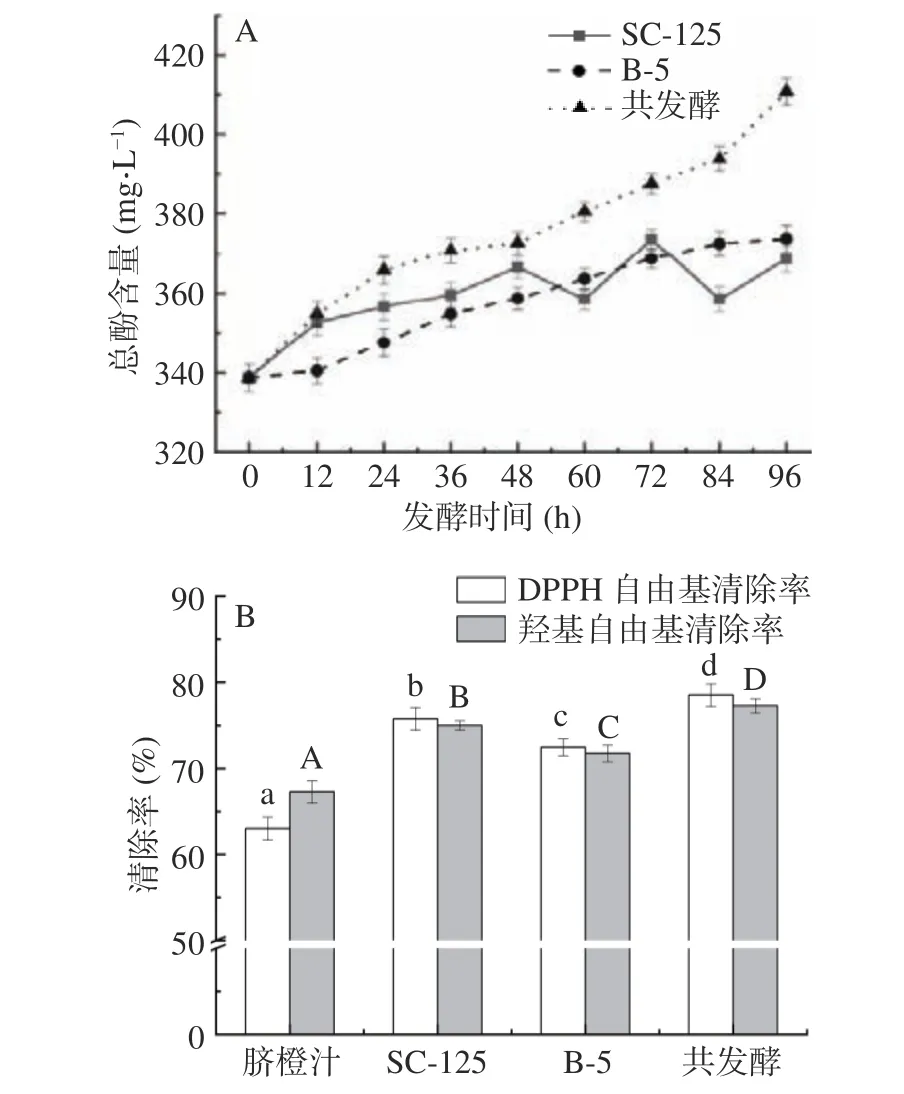
图3 脐橙发酵过程中总酚含量(A)的变化和自由基清除率(B)Fig.3 Changes of total phenolic content (A) and free radical scavenging rate (B) during navel orange fermentation
2.4 脐橙发酵饮品挥发性物质及电子鼻主成分分析
通过对发酵结束后的样品进行HS-SPME/GCMS 进行分析,得到如图4 及表2 的结果。酿酒酵母SC-125 单菌发酵共有41 种挥发性成分,含有16 种酯类、16 种醇类、4 种酸类、4 种醛酮类、1 种其他类;植物乳杆菌B-5 单菌发酵共检测出38 种,含有15 种酯类、15 种醇类、3 种酸类、4 种醛酮类、1 种其他类;共发酵共检测出53 种挥发性成分,包括23 种酯类、19 种醇类、4 种酸类、5 种醛酮类、2 种其他类。相比于酿酒酵母SC-125 和植物乳杆菌B-5,共发酵后有更多的风味物质,还产生特有的挥发性成分,如甲酸异丙酯、十一酸乙酯、乙酸异丁酯、丁酸甲酯、四氢芳樟醇、1-十四醇、2-戊醇、十一醛、2-硝基丙烷,这些物质赋予脐橙饮品醚香、梨子、苹果、干酪、玫瑰和木香橙皮等香气特征,这与之前的研究类似,即酵母菌与乳酸菌共发酵会产生更多的挥发性物质[30]。

图4 脐橙饮品挥发性成分总离子流色谱图Fig.4 Total ion chromatogram of volatile components in navel orange beverage
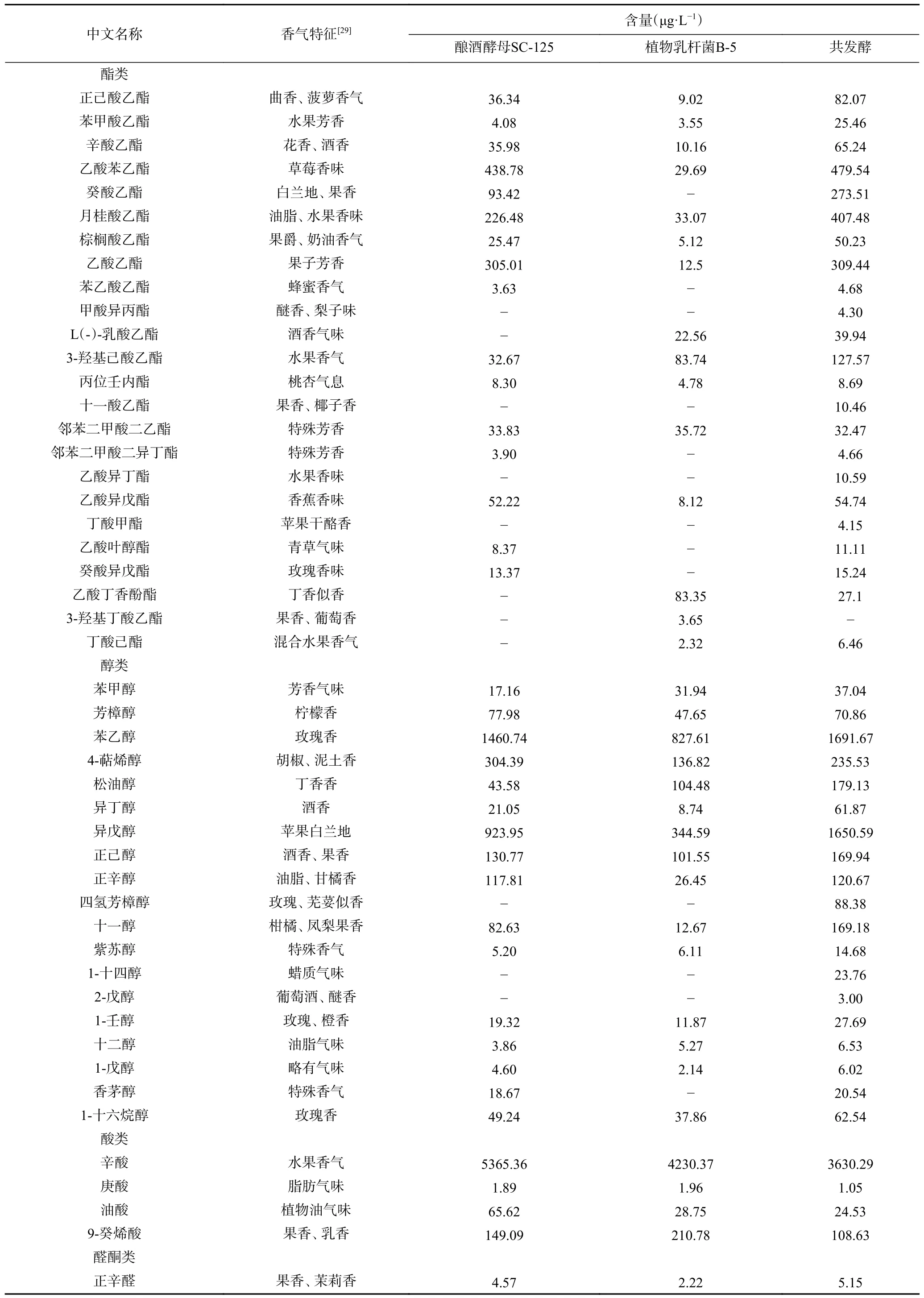
表2 三种发酵方式的脐橙饮品挥发性物质的含量Table 2 Content of volatile substances in three kinds of fermented navel orange drinks

续表2
酯类化合物对果酒的主体香型具有重要的作用,是构成果酒香气的重要物质[31]。共发酵酯类物质含量和种类高于酵母菌SC-125 和植物乳杆菌B-5,其中酵母菌SC-125 的酯类物质种类及含量高于植物乳杆菌B-5,主要产生的香气物质有乙酸苯乙酯、月桂酸乙酯、乙酸乙酯、癸酸乙酯、辛酸乙酯和3-羟基己酸乙酯,共发酵使这些物质的含量分别提高到479.54、407.48、309.44、273.51、65.24 、127.57 μg/L。乙酸苯乙酯[32]呈草莓香味,月桂酸乙酯呈油脂水果味,乙酸乙酯具有果子的芳香,癸酸乙酯具有白兰地和果香,辛酸乙酯具有花香和酒香,增加了脐橙饮品的复杂性。
醇类物质是果酒中的主要香气成分,主要通过糖代谢分解产生或是果酒中氨基酸转化形成[33]。对比三种发酵方式,醇类物质在种类和含量上均有不同,其中在共发酵中种类更多,含量最高,主要的醇类物质如:苯乙醇、4-萜烯醇[34]、异戊醇和正己醇。苯乙醇具有温和淡雅的玫瑰花气味,4-萜烯醇呈胡椒香和较淡的泥土香,异戊醇有苹果白兰地香气,正己醇微带酒香和果香。张毅坚等[12]的研究表明酵母菌与植物乳杆菌共培养增加了更多的醇类物质,使发酵制品具有更好的风味。
酸类物质是酵母代谢产生的次级物质,在本研究中,酸类物质主要有辛酸、庚酸、油酸和9-癸烯酸,共发酵的酸类物质含量比单菌发酵含量更少,这可能是共发酵中的酸与醇发生反应产生更多酯类物质[35]。
醛酮类和其他类物质在本试验中含量占比较少,如正辛醛、3-羟基-2-丁酮和2-甲基吡嗪,正辛醛呈果香、茉莉香气,3-羟基-2-丁酮呈奶油香气,2-甲基吡嗪有牛肉加热时的香味和果仁香味,这些物质与酯类、醇类和酸类物质相互协同,赋予了饮品更多的风味。
2.5 通过电子鼻比较脐橙饮品香气成分
由图5 可知,第一主成分区分贡献率为83.9%,第二主成分区分贡献率为8.2%,两个主成分区分贡献率和为92.1%,大于90%,表明两个主成分已经基本代表了样品的主要信息特征[36],而且风味相互独立,整体区分度较好,其中W5S、W1S、W2S 贡献较大,他们分别对氮氧化合物、短链烷烃、乙醇灵敏。PCA 显示脐橙发酵饮品与脐橙原汁区分明显,共发酵与单菌发酵的脐橙饮品在第一主成分和第二主成分上虽然有交叉,但是雷达图可以明显看出,共发酵10 个传感器得分均高于脐橙原汁和单菌,尤其在W5S、W1S、W2S 三个传感器的得分更高,因此判断共发酵饮品香气物质相较于脐橙原汁以及单菌发酵饮品更加丰富。
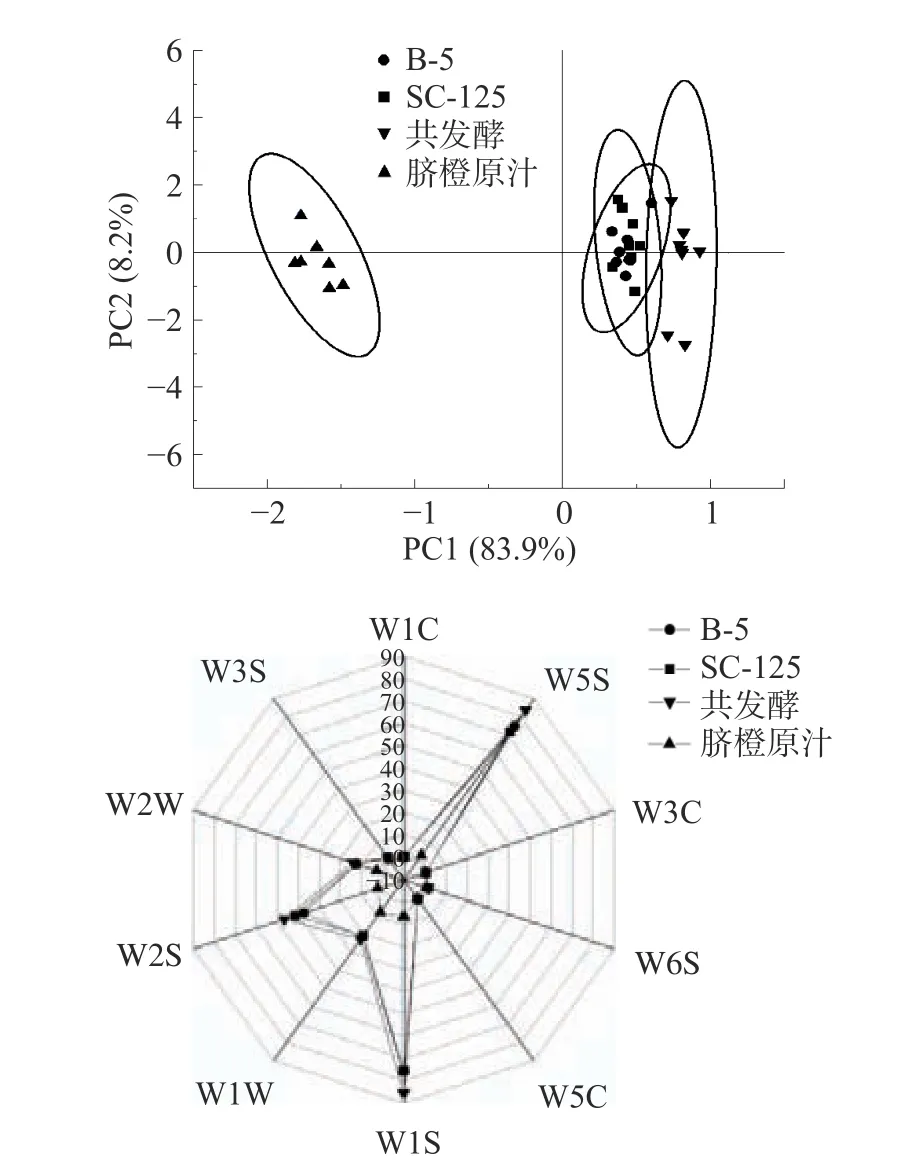
图5 脐橙原汁与不同发酵饮品的PCA 图和雷达图Fig.5 PCA and radar plots of navel orange juice and different fermented beverage
3 结论
本研究以金堂脐橙为发酵原料,首次利用酿酒酵母和植物乳杆菌发酵脐橙饮品,并比较了酿酒酵母SC-125 和植物乳杆菌B-5 单独发酵以及共发酵脐橙过程中各项指标的变化规律,结果表明:在共发酵前期酿酒酵母SC-125 迅速繁殖,还原糖含量下降;酒精度持续上升后下降最终达到为5.33%,低于酿酒酵母SC-125 单独发酵;其抗氧化能力强,共挥发性成分的种类更加丰富,特有成分赋予了共发酵的脐橙饮品椰子、坚果和醚香等香气;结合主成分分析,共发酵饮品对氮氧化合物、短链烷烃、乙醇更加灵敏。总体来说,酿酒酵母与植物乳杆菌协同发酵制备脐橙饮品口感酸甜适中,香气浓郁,为脐橙风味饮品提供了理论依据和技术参考。后续还可以针对脐橙饮品的发酵工艺进行优化,进一步探讨不同菌种接种量及其接种顺序等因素对脐橙饮品品质的影响。
