1 株光合细菌的分离鉴定、培养基优化及脱氮特性研究
2023-08-13和子涵武婧玉贾一然张晓彤张建新
靳 鹏,和子涵,武婧玉,贾一然,张晓彤,张建新
(河南师范大学水产学院,河南 新乡 453007)
工厂化水产养殖是我国水产养殖发展的一个趋势[1]。改革开放以来,中国的水产养殖业发展迅猛,养殖产量已连续30 a 位列世界第一[2]。为了提高产量,水产动物大多采用高密度的养殖模式[3],而这也导致水环境污染方面的问题越来越严重[4-5]。水环境中的氨氮(NH3-N)随饵料进入水生生物体后,会影响生物体内的酶水解作用及膜的稳定性,引起水生生物呼吸不畅、抗病能力下降等诸多问题[6];亚硝酸氮()也会对水生生物产生一定的毒性及致癌作用,影响水生生物正常的生长发育。因此,在水产养殖业中,如何能富有成效地调节水质环境是一个十分严峻的问题[7]。在调节水质方面,微生物处理法因其操作简单、维护成本低和污染物去除效率高而受到广泛关注[8-10]。
光合细菌(PSB)作为常见的水质改良剂[11],其分布非常广泛,一般在江海、湖泊、沼泽地、水塘和泥土中都有生长[12-13],具有无毒、无害、无残留等特点[14]。光合细菌不仅可以有效降低水体中NH3-N、等有害物质,还能调节水质环境[15-16],在生物环境修复、生物能源生产和农业等领域有着广泛的应用[17]。此外,光合细菌本身又是一种富含大量营养物质、价值较高的微生物,可被用作养殖鱼类的食物[13]。光合细菌应用于水产养殖废水处理,有利于提升水质改良效果[18-19]、鱼的免疫力和存活率、水产养殖业的生产效益,在水产养殖系统中的废物清除中发挥着重要作用[20]。
目前,市场上售卖的光合细菌良莠不齐,菌液浓度不高,影响了光合细菌在水产养殖业的使用,主要原因是菌种纯度不高,产品质量不稳定。鉴于此,有必要对光合细菌发酵培养基进行优化,提升光合细菌菌液浓度,促进光合细菌对水产养殖水环境的改良和养殖鱼体的健康生长。试验以分离出的光合细菌为对象,优化光合细菌发酵培养基配方,并探究其产酶特性以及降NH3-N、能力,旨在为光合细菌大规模工业化生产及在水产养殖应用提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 主要试剂 提DNA 试剂盒购自北京艾德莱生物科技有限公司;Taq酶购自郑州久是生物技术有限公司;通用引物购自深圳华大基因科技有限公司;NaOH、NH4Cl、NaNO2购自天津市德恩化学试剂有限公司;HgI2、C10H7NHCH2NH2·2HCl 购自上海阿拉丁有限公司;KI购自天津市津北精细化工有限公司;KNaC4H6O6、NH2SO2C6H4NH2购自天津市大茂化学试剂厂;羧甲基纤维素钠购自天津市恒兴化学试剂有限公司;刚果红、碘购自天津市科密欧化学试剂有限公司。
1.1.2 主要仪器 双人单面净化工作台(郑州金友宁仪器有限公司,SW-CJ-2FD)、紫外可见分光光度计(岛津仪器苏州有限公司,UV-2600)、蒸汽灭菌器(KAGOSHIMA SEISAKUSYO,KG-SK-700)、光照培养箱(上海一恒有限公司,MGC-P)、pH 计(奥豪斯仪器苏州有限公司,ST300)、白炽灯(60 W)、聚乙烯塑料瓶若干(600 mL、300 mL规格)。
1.1.3 培养基 富集培养基:CH3COONa 3.0 g∕L、NH4Cl 1.0 g∕L、酵母浸粉1.0 g∕L、乙醇1.5 mL∕L、NaCl 2.0 g∕L、K2HPO40.2 g∕L、MgSO40.2 g∕L、NaHCO31.0 g∕L,调pH值为7.0。
分离培养基:CH3COONa 3.0 g∕L、CH3CH2COONa 0.3 g∕L、NaCl 1.0 g∕L、MgSO40.2 g∕L、(NH4)2SO40.3 g∕L、KH2PO40.5 g∕L、K2HPO40.3 g∕L、CaCl250 mg∕L、酵母浸粉1.0 g∕L、谷氨酸0.2 mg∕L、MnSO42.5 mg∕L、蛋白胨10 mg∕L、FeSO45 mg∕L、琼脂18 g∕L,调pH 值为7.0。
发酵方培养基:将密集培养基中乙醇去除。
羧甲基纤维素钠培养基:KH2PO41.5 g∕L、蛋白胨5.0 g∕L、酵母膏0.5 g∕L、MgSO40.2 g∕L、NaCl 5.0 g∕L、琼脂8.0 g∕L、羧甲基纤维素钠10.0 g∕L,调pH 值为7.2。
淀粉培养基:可溶性淀粉2.0 g∕L、蛋白胨10.0 g∕L、牛肉膏5.0 g∕L、NaCl 5.0 g∕L、琼脂15.0 g∕L,调pH值为7.0。
酪素培养基:酪素8.0 g∕L、牛肉膏3.0 g∕L、琼脂15.0 g∕L,调pH值为7.0。
1.2 光合细菌分离
1.2.1 取样与富集 从河南省新乡市卫河水域中采集底泥,将样本放入烧杯中,密封带回水产工程技术研发中心实验室。将50 g 样品加入到300 mL的带塞聚乙烯塑料瓶中,之后加满灭菌的富集培养基,将聚乙烯塑料瓶置于30 ℃、2 000 lx 的光照培养箱中培养15 d,直至聚乙烯塑料瓶中的液体变为红棕色时,吸取50 mL的富集液,再次富集培养。
1.2.2 分离和纯化 采用双层平板法,取100µL富集培养液涂布于固体分离培养基上,之后再覆盖一层琼脂培养基,在30 ℃下,进行光照培养直到长出红色菌落,将分离菌株命名为WH-1,挑取单菌落再次平板划线培养,直到菌种完全纯化。
1.3 分离菌株WH-1的鉴定
1.3.1 形态学鉴定 挑取单菌落接种到分离培养基,放在恒温光照培养箱中培养5 d,待菌落变红,革兰氏染色后观察菌体形态。
1.3.2 16S rDNA 鉴定 利用艾德莱DNA 试剂盒提取WH-1 菌株的DNA,通用引物27F 和1492R 对WH-1菌株DNA进行扩增。采用25µL的PCR反应体系:菌株基因组DNA 1 µL、27F 1 µL、1492R 1µL、ddH2O 12 µL、Taq酶10 µL。PCR 反应条件:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸2 min,34 个循环;最后72 ℃末端延伸10 min。制备1%的琼脂糖凝胶,电泳后在1 500 bp出现条带,将PCR 扩增产物送去南京金斯瑞生物技术有限公司测序,进行序列比对。
1.4 培养基配方优化
1.4.1 单因素试验 对光合细菌发酵培养基进行优化,以CH3COONa、NH₄Cl、酵母浸粉、NaHCO3为单因素变量,分析比较得出各物质适合WH-1 生长的最佳质量浓度。
1.4.1.1 不同质量浓度CH3COONa 对WH-1 生长的影响 发酵培养基中各物质的质量浓度保持不变,调整CH3COONa 的质量浓度为1.0、2.0、3.0、4.0、5.0 g∕L,每种培养条件做3个重复。
1.4.1.2 不同质量浓度NH₄Cl 对WH-1 生长的影响 CH3COONa 采用初步优化后的最适质量浓度,培养基中其他物质的质量浓度保持不变,调整NH₄Cl的质量浓度为0.5、1.0、1.5、2.0、2.5 g∕L,每种培养条件做3个重复。
1.4.1.3 不同质量浓度酵母浸粉对WH-1 生长的影响 CH3COONa 和NH₄Cl 使用初步优化后的最适质量浓度,培养基中其他物质的质量浓度保持不变,调整酵母浸粉的质量浓度分别为0.5、1.0、1.5、2.0、2.5 g∕L,每种培养条件做3个重复。
1.4.1.4 不同质量浓度NaHCO3对WH-1 生长的影响 CH3COONa、NH₄Cl和酵母浸粉均使用优化后的最适质量浓度,培养基中其他物质的质量浓度保持不变,调整NaHCO3质量浓度分别为0、1.0、2.0、3.0、4.0 g∕L,每种培养条件做3个重复。
1.4.2 正交试验 菌株WH-1 的生长受到多种因素的影响,在单因素试验的结果基础上,将CH3COONa、NH₄Cl、酵母浸粉、NaHCO3等4 种物质作为对其生长有影响的因素(表1),设计了L9(34)正交试验(表2)。

表1 正交试验因素和水平Tab.1 Orthogonal test factors and levelsg∕L

表2 正交试验设计方案Tab.2 Orthogonal test design schemeg∕L
1.4.3 菌液WH-1 计数 用牙签挑取菌落进行接种,在温度30 ℃、光照强度2 000 lx 条件下,在优化后的培养基中培养5 d,待菌体变红。取WH-1菌液适量,梯度稀释后,采用流式细胞仪对WH-1 进行计数。
1.5 分离菌株WH-1产酶特性研究
制备羧甲基纤维素钠培养基,若菌株WH-1 产纤维素酶,则该菌株附近会产生显色圈,观察显色情况并记录显色圈直径。
制备淀粉培养基,若菌株WH-1 产淀粉酶,则该菌株周围产生透明圈,其余部分显蓝色,观察显色情况并记录透明圈直径。
制备酪素培养基,若菌株WH-1 产蛋白酶,则该菌株附近会形成蛋白质水解圈,观察并记录WH-1菌株周围蛋白质水解圈直径。
1.6 分离菌株WH-1降NH3-N试验
采用纳什试剂法,在波长420 nm 处,用10 mm玻璃比色皿,以无氨纯水作参比,绘制标准曲线。试验组按1%的接种量接入到含NH3-N 的液体培养基中[添加(NH4)2SO42 g∕L],每24 h 取样1 次,设置3个重复,连续取样5 d,测定NH3-N含量。
1.7 分离菌株WH-1降-N试验
采用重氮-偶氮光度法,在波长543 nm 处,用10 mm 玻璃比色皿,以纯水作参比,绘制标准曲线。试验组按1%的接种量接入到含-N 的液体培养基中(添加NaNO22 g∕L),每24 h 取样1 次,设置3个重复,连续取样5 d,测定-N含量。
1.8 数据处理与分析
采用SPSS 21.0 进行单因素方差检验,根据Duncan’s 检验法判断是否有显著差异(P<0.05);使用GraphPad Prism 9.0进行柱状图和折线图的绘制。
2 结果与分析
2.1 WH-1菌株形态学鉴定
经过5 d 的光照培养,平板上单菌落呈红色不透明状,扁平、圆形(图1);革兰氏染色呈阴性,菌体呈卵圆形(图2),无芽孢。与《伯杰细菌鉴定手册》[21]中沼泽红假单胞菌的形态、大小等特性基本相符,可初步确定分离菌株为沼泽红假单胞菌(Rhodopseudomonas palustris)。

图1 菌株WH-1菌落形态Fig.1 Colony morphology of strain WH-1

图2 菌株WH-1革兰氏染色结果Fig.2 Gram staining results of strain WH-1
2.2 WH-1菌株分子鉴定
将WH-1 菌株测序结果进行BLAST 比对,利用MEGA 11.0 软件构建系统发育树,发现分离的菌株WH-1与沼泽红假单胞菌(R.palustris,GenBank 登录号:NR 115542.1)聚在一起,相似性高达99%,结合菌株形态特征观察,鉴定WH-1 为沼泽红假单胞菌(R.palustris)(图3)。
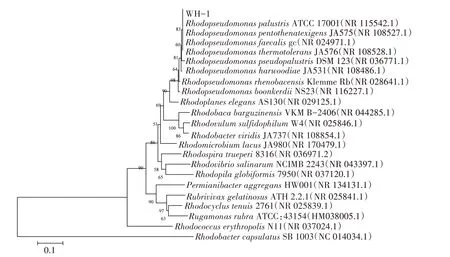
图3 WH-1菌株系统发育进化树Fig.3 Phylogenetic evolutionary tree of WH-1 strain
2.3 WH-1培养基配方的优化结果
2.3.1 单因素试验结果 以CH3COONa 为培养基组成成分变量因素,培养基其他组成成分不变。从图4可看出,CH3COONa质量浓度为5.0 g∕L时,所对应的OD 值为组内最大值,且与1.0 g∕L 和4.0 g∕L 所对应的组别之间没有显著差异(P>0.05)。考虑到发酵培养基中原材料的使用和实际经济成本,选择1.0 g∕L为培养基的最佳质量浓度。
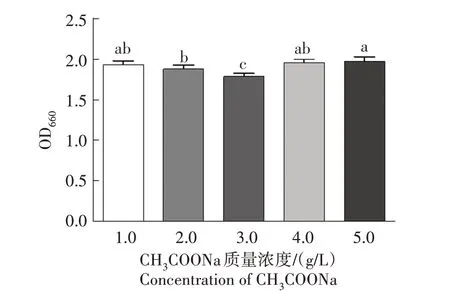
图4 CH3COONa对WH-1菌株生长的影响Fig.4 Effect of CH3COONa on the growth of WH-1 strain
以NH₄Cl 为培养基组成成分变量因素,培养基其他组成成分不变。从图5 可看出,NH₄Cl 质量浓度为0.5 g∕L 所对应的OD 值最大,且0.5 g∕L 组与其他组别之间均存在显著差异(P<0.05)。质量浓度为1.0、1.5、2.0 g∕L 三者所对应的OD 值没有显著差异(P>0.05)。当NH₄Cl 质量浓度为2.5 g∕L 时,所对应的OD 值为组内最小值,且与0.5、1.0、1.5、2.0 g∕L组别之间均有显著差异(P<0.05)。随着NH₄Cl质量浓度的增加,WH-1菌株生长浓度反而降低,原因可能是随着氮源的增加,使得培养基碳氮比降低,从而导致了WH-1 菌株生长浓度的下降。综上,选择0.5 g∕L为最佳质量浓度。
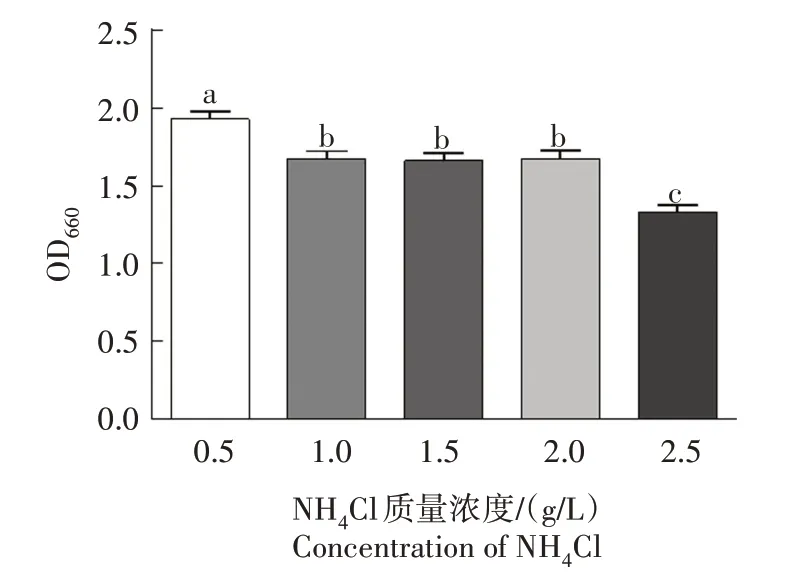
图5 NH4Cl对WH-1菌株生长的影响Fig.5 Effect of NH4Cl on the growth of WH-1 strain
以酵母浸粉为培养基组成成分变量因素,培养基其他组成成分不变。从图6 可看出,酵母浸粉质量浓度为2.5 g∕L 所对应的OD 值为组内最大值,且与其他组别之间均存在显著差异(P<0.05)。随着酵母浸粉质量浓度的增加,WH-1 菌株生长的浓度也在增加,其原因可能是酵母浸粉中存在大量的WH-1 菌株生长所需要的生长因子,酵母浸粉的增加为WH-1 菌株的生长提供了良好的营养环境,使得WH-1 菌株生长良好。综上,选择2.5 g∕L 为最佳质量浓度。

图6 酵母浸粉对WH-1菌株生长的影响Fig.6 Effect of yeast extract on the growth of WH-1 strain
以NaHCO3为培养基组成成分变量因素,培养基其他组成成分不变。从图7可看出,NaHCO3质量浓度为4.0 g∕L 所对应的OD 值为组内最大值,且与3.0 g∕L之间不存在显著差异(P>0.05)。质量浓度为0、1.0、2.0 g∕L 三者所对应的OD 值没有显著差异(P>0.05)。随着NaHCO3质量浓度的增加,对应的OD 值也缓慢增加,说明WH-1 菌液浓度在增加,其原因可能是NaHCO3的增加使得培养基中的碳源增加,当其他组成成分不变时,最终培养基中的碳氮比增加,较高的碳氮比为WH-1 菌株的生长提供了良好的营养环境条件,使得WH-1 菌株生长浓度上升。综上,考虑到发酵培养基中原材料的使用和实际经济成本,选择3.0 g∕L 为培养基的最佳质量浓度。

图7 NaHCO3对WH-1菌株生长的影响Fig.7 Effect of NaHCO3 on the growth of WH-1 strain
2.3.2 正交试验结果 由表3 可知,最佳培养基配方为A3B2C3D3。R值的大小可反映出4 种因素对WH-1的影响程度,比较表中R值可得各因素的影响主次为A>C>B>D,即CH3COONa>酵母浸粉>NH₄Cl>NaHCO3。综合单因素试验及正交试验结果,适合WH-1 生长的最佳培养基配方:CH3COONa 1.0 g∕L、NH ₄Cl 0.5 g∕L、酵母浸粉3.0 g∕L、NaCl 2.0 g∕L、K2HPO40.2 g∕L、NaHCO33.0 g∕L、MgSO40.2 g∕L。
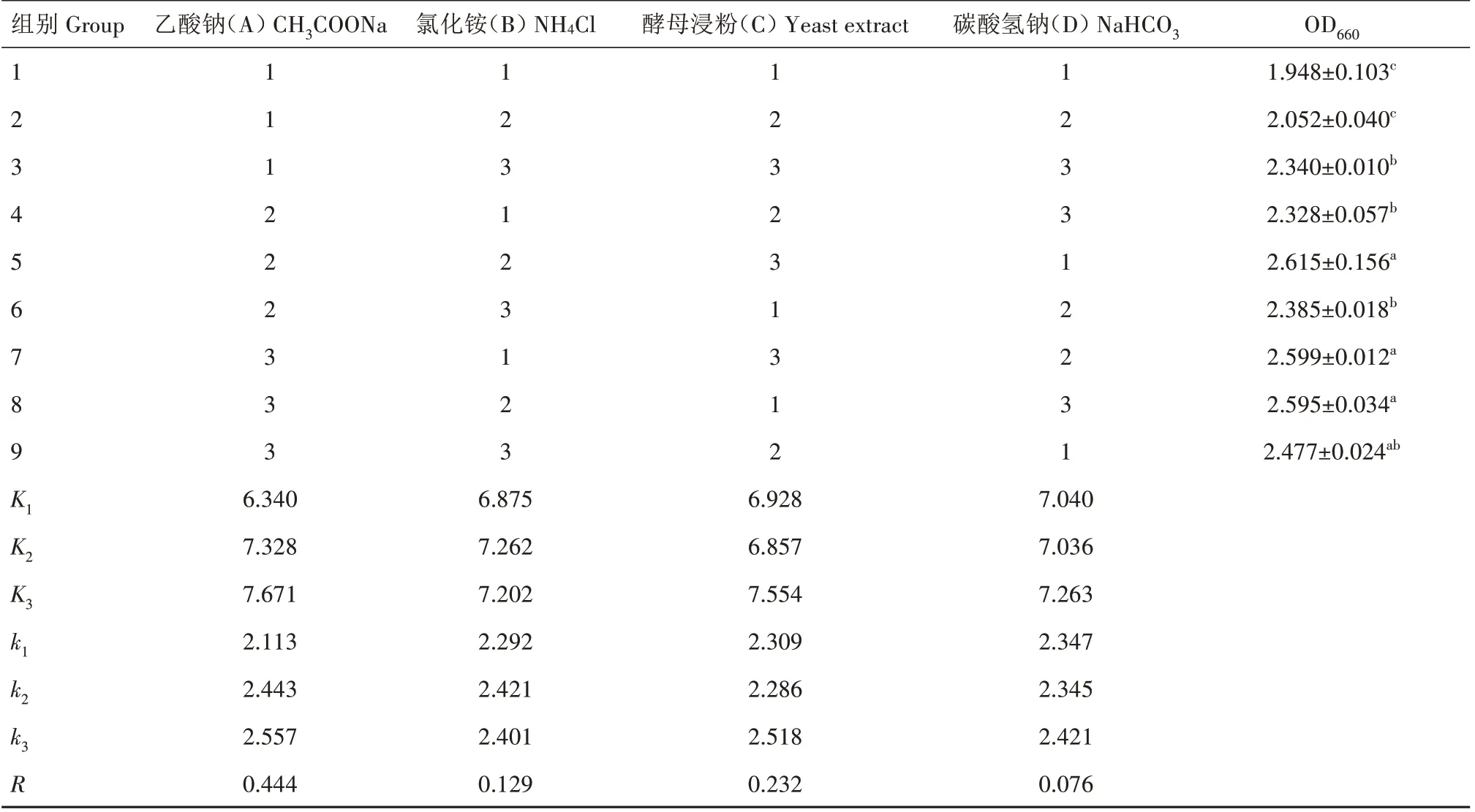
表3 正交试验结果Tab.3 Orthogonal test results
2.3.3 菌液浓度计数 经过流式细胞仪计数,相比较优化前的菌液浓度3.05×109个∕mL,优化后的WH-1 菌液浓度可以达到4.37×109个∕mL,证明WH-1发酵培养基优化效果良好。
2.4 WH-1菌株产酶特性
在羧甲基纤维素钠培养基中,0.2%刚果红水溶液染色后,可以看到明显的透明圈,说明WH-1 可以产纤维素酶(图8);在淀粉培养基中,将卢氏碘液浸于培养基表面,立即检视,可看到明显的透明圈,说明WH-1 可以产生淀粉酶(图9);在酪素培养基中,将酪素添加之后,发现没有形成蛋白质水解圈,说明WH-1 不产生蛋白酶。因此,WH-1 可以产纤维素酶和淀粉酶,但是不产蛋白酶。经显色处理后,可以明显看到该菌株周围的显色圈直径在20.0 mm 以上(表4),说明WH-1 具有良好的产纤维素酶和产淀粉酶特性,有利于降解水体中的大分子碳水化合物,进一步澄清水质。

图8 WH-1菌株产纤维素酶测定Fig.8 Detection of WH-1 strain produced cellulase
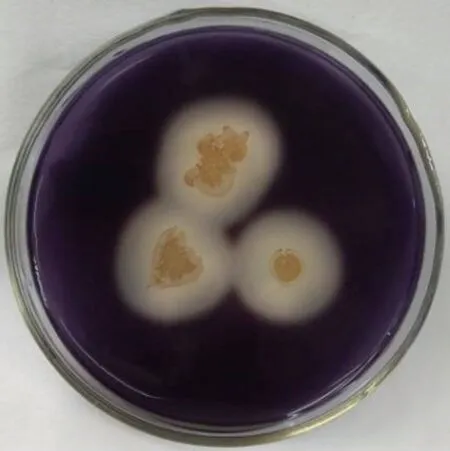
图9 WH-1菌株产淀粉酶测定Fig.9 Detection of WH-1 strain produced amylase

表4 菌株WH-1产酶的显色圈大小Tab.4 Color ring size of enzyme production by strain WH-1
2.5 WH-1菌株对NH3-N、降解特性
从图10 可以看出,WH-1 脱氮能力呈线性递增趋势。试验期间,随着天数的增加,WH-1 降解NH3-N、的能力在逐渐增强,但是相比较WH-1 对NH3-N 的降解,降解变化相对平缓,可能原因是WH-1 对NH3-N 中氮源的吸收转化能力强于对中氮源的吸收转化能力。总体上,在高质量浓度的NH3-N、环境中,培养基优化之后,WH-1 在第5 天时降解NH3-N 达到49.89%、降解达到31.15%,显示了WH-1 改良水质中良好的脱氮能力。

图10 WH-1菌株对NH3-N、降解特性Fig.10 Degradation characteristics of NH3-N and by WH-1 strain
3 结论与讨论
本研究从河南省新乡市卫河分离出1株光合细菌WH-1,经鉴定WH-1 为R.palustris。考虑到影响光合细菌生长的主要因素是培养基的营养物质的种类以及含量[22],因此,本研究选择CH3COONa、NH₄Cl、酵母浸粉、NaHCO3等4 种不同物质作为因素变量,探究4种物质不同质量浓度对光合细菌发酵培养基的影响,对发酵培养基优化后,得到WH-1生长的最佳培养基配方:CH3COONa 1.0 g∕L、NH₄Cl 0.5 g∕L、酵母浸粉3.0 g∕L、NaCl 2.0 g∕L、K2HPO40.2 g∕L、NaHCO33.0 g∕L、MgSO40.2 g∕L。测定WH-1 菌液浓度为4.37×109个∕mL,相比较优化之前的菌液浓度增长43.33%。前人对CH3COONa 培养基配方的研究中,菌液OD 值在2.0 左右,而本研究中光合细菌的OD值可达到2.615。陈秀丽等[23]对光合细菌的培养基优化之后,菌数由1.75×109cfu∕mL提高到3.19×109cfu∕mL;陈海生[24]对光合细菌的培养基优化之后,测定菌数为3.96×109cfu∕mL。可见,本研究优化后的培养基更有利于光合细菌的生长。
由于光合细菌属于兼性厌氧菌,采用双层稀释平板法进行计数,操作较为烦琐,不方便进行测量,因此,本研究对光合细菌采用流式细胞仪检测计数,相对传统的计数法,对光合细菌的计数更加高效和准确,采用新的发酵培养基,测定菌数在40 亿个∕mL以上。
本研究发现,接种WH-1 菌液于高质量浓度NH3-N 和的培养基中,5 d 后测定NH3-N 和的降解率,分别为49.89%和31.15%,NH3-N和降解量分别为105.90 mg 和123.95 mg,相比较王雨婷等[25]分离筛选出的光合细菌P-3 对NH3-N 和的降解率89.68% 和94.98%,WH-1 降解率较低。但是考虑到王雨婷等[25]的研究中NH3-N 和初始质量浓度均为50 mg∕L,而本试验NH3-N 和的初始质量浓度分别为211.27 mg∕L 和397.52 mg∕L,对比其NH3-N 和降解量44.84 mg 和47.49 mg,显然本研究中光合细菌脱氮的质量和效果反而更佳。
综上,本研究从河南省新乡市卫河分离筛选出1 株光合细菌WH-1,通过单因素试验和正交试验,优化了发酵培养基的配方,有效提高了菌液浓度,且WH-1 具有良好的产纤维素酶和产淀粉酶特性,有利于降解水体中的大分子碳水化合物,在对NH3-N和的降解试验中,表现出良好的脱氮能力,为光合细菌工业化发酵生产应用于水产养殖奠定了良好基础。
