3 种抗生素对小菜蛾肠道微生物群落的影响
2023-08-13李文红向立刚余知和李添群
李文红,郭 涛,向立刚,余知和,李添群
(1.贵州省农业科学院植物保护研究所,贵州 贵阳 550081;2.长江大学生命科学学院,湖北 荆州 434025;3.长江大学农学院,湖北 荆州 434025;4.修文县农业农村局,贵州 修文 550299)
小菜蛾(Plutella xylostella)隶属于鳞翅目菜蛾科,是一种世界性迁飞害虫,主要危害油菜、白菜和萝卜等十字花科作物,对农业生产造成了巨大的威胁[1]。化学防治因见效快、效果好,一直是小菜蛾防治的主要措施。然而,化学药剂的大量使用使得小菜蛾已对阿维菌素、高效氯氰菊酯、氯虫苯甲酰胺等95 种药剂产生了抗药性[2-3]。作为农业上的重要害虫,小菜蛾一直是国内外的重点研究对象,其种群饲养是研究的基础。当前,主要利用萝卜苗、甘蓝叶、人工饲料及半合成人工饲料饲养小菜蛾[4]。饲养过程中,小菜蛾也会受诸多病原菌侵染,因而在人工饲料中添加抗生素是饲料保鲜和减少病害侵染的主要措施。昆虫肠道作为外界环境与宿主进行物质交换的重要场所,栖息着数量庞大的微生物群落。这些肠道微生物与宿主互惠共生、相互依赖,在宿主生长繁殖、营养吸收、病害防御、代谢解毒以及抗药性产生等方面发挥着重要作用[5-7]。肠道微生物的稳定是昆虫进行正常生命活动的重要前提之一,肠道菌群一旦被打乱便可能导致其宿主的适合度降低[8]。例如,小菜蛾幼虫在四环素等5种抗生素的作用下其生长发育均受到抑制,预蛹的致畸率、死亡率均增加[9];在利福平的作用下,白蚁肠道微生物多样性降低,进而影响白蚁产卵量、体质量和寿命[10];抗生素治疗对肠道细菌的破坏可能会增加蜜蜂感染微孢子虫的可能性[11];土霉素作用可减少大蜡螟肠道微生物组中四环素抗性基因的多样性[12]。由此可见,抗生素的科学、正确使用对昆虫的饲养与防治都十分重要。然而,人工饲料中添加抗生素是否会对小菜蛾肠道微生物菌群产生影响,目前尚缺乏了解。为此,将常见的3种抗生素(氨苄青霉素、硫酸链霉素和利福平)浸泡甘蓝叶后饲喂小菜蛾,利用高通量测序技术对其肠道真菌、细菌群落组成及结构进行研究,以期更好地阐明抗生素对小菜蛾肠道微生物的作用。
1 材料和方法
1.1 材料
供试小菜蛾为贵州省农业科学院植物保护研究所昆虫研究室饲养的未接触药剂的单一敏感品系。甘蓝采自贵州省农业科学院田间试验地,种植期间未使用任何药剂。
氨苄青霉素(96%,# A6920)、硫酸链霉素(85%,#S8290)、利福平(95%,#R8011)均采购自北京索莱宝科技有限公司。氨苄青霉素和硫酸链霉素先用无菌蒸馏水配制成2 000 mg∕L 的母液,然后再用无菌水分别稀释至相应浓度。氨苄青霉素质量浓度为5 mg∕L、10 mg∕L,硫酸链霉素质量浓度为100 mg∕L、200 mg∕L。利福平先用甲醇配制成6 000 mg∕L 母液,然后再用无菌水分别稀释至3 mg∕L 和6 mg∕L。
1.2 方法
1.2.1 抗生素剂量设置 前期研究发现,蒙氏肠球菌为小菜蛾肠道优势细菌[13],室内平板试验测定发现,0.5 mg∕L 氨苄青霉素、20 mg∕L 硫酸链霉素、0.3 mg∕L 利福平即可完全抑制蒙氏肠球菌的生长。本试验采用浸叶法测定抗生素对小菜蛾肠道微生物的影响,设置3种抗生素的质量浓度分别为:氨苄青霉素5 mg∕L(HP05)、10 mg∕L(HP100),硫酸链霉素100 mg∕L(HS100)、200 mg∕L(HS200),利福平3 mg∕L(HR03)、6 mg∕L(HR06);以无菌水处理为对照。
1.2.2 小菜蛾幼虫饲养及肠道样品收集 将新鲜甘蓝叶分别置于不同质量浓度的抗生素中浸泡30 s,取出后晾干至表面无水痕,随后分别放入饲养盒中,接入300头发育状况一致的二龄小菜蛾幼虫,以饲喂无菌水浸泡的甘蓝叶为对照(CK)。饲喂24 h 后,分别从对照组和6 个处理组中各挑取200头生长状态一致的幼虫进行肠道组织的收集。先用75%乙醇浸泡虫体30 s,随后无菌蒸馏水漂洗3次,然后将幼虫挑至无菌吸水纸上,待体表水分吸干后,解剖收集肠道样品。
1.2.3 基因组DNA 提取、PCR 及扩增子测序 采用基因组DNA 提取试剂盒(Omega Bio-Tek,D5625-01)提取小菜蛾幼虫肠道微生物总DNA,使用超微量分光光度计(Thermo Fisher Scientifc,NanoDrop 2000)检测其质量与浓度。以抽提的DNA 为模板,分别采用通用引物515F∕806R 扩增肠道细菌群落16S rRNA 基因V4 区,ITS1∕ITS2 扩增真菌群落转录间隔区ITS1 区。PCR 反应体系及条件参考前人的方法[14-15]。扩增产物经检测、纯化后送至北京诺禾致源科技股份有限公司,基于PacBio sequel Ⅱ平台进行3代扩增子测序。
1.3 数据分析
使用FLASH(Version 1.2.7)软件对双端序列合并剪接,通过QIIME(Version 1.9.1)软件设定条件进行质量过滤控制以获得高质量序列,采用UCHIME算法检测并去除嵌合体序列,最终得到有效数据。使用UPARSE(Version 7.0.1001)软件,根据相似度≥97%对序列进行OTU 聚类,筛选每个OTU 的代表性序列以进行下一步注释。对于每个具有代表性的序列,基于Mothur算法并采用UNITE和Silva数据库对分类信息进行注释。利用R 语言工具绘制物种Venn分析图、群落柱状图等。
样品微生物群落Alpha 多样性指数(Shannon、Simpson、Chao1、Observed OTUs、Pielou 和Goods coverage)使用QIIME(Version 1.7.0)计算,使用Qiime feature-table rarefy 按最小样本序列数进行样本序列抽平标准化处理,并用R 软件(Version 2.15.3)显示。主成分分析(PCA)使用R 软件中的factoiner 软件包和ggplot2软件包来减小原始变量的尺寸,并由R 软件中的WGCNA 包、stat 包和ggplot2包显示。
2 结果与分析
2.1 测序深度分析
稀释性曲线是用于验证测序数据量是否足以反映样品中物种多样性及丰富程度的重要指标之一[16]。由图1可见,7组样品中真菌群落可观察到的OTU 数在测序数据量为10 000 条时达到平台期,细菌群落在测序数据量为25 000 条时达到平台期,说明此次测序数据深度已经足够,能够反映样品中大多数的真菌、细菌多样性信息,进一步测序对新OTU的产生贡献不大。

图1 物种稀释性曲线Fig.1 Species dilution curves
2.2 数据质控
测序原始数据拼接、质控后的信息如表1所示,每组样品中真菌群落高质量序列数在37 700~80 531 条,碱基数在9 693 967~19 194 865 nt,序列平均长度211~257 bp,平均GC 含量为46.22%~52.25%,测序错误率小于0.01(Q20)和0.001(Q30)的碱基数分别占总碱基数的92.72%~99.20%和86.90%~97.02%,有效序列百分比在46.56%~94.82%。其中对照组中有效序列百分比和测序错误率明显低于处理组,但序列平均长度明显高于处理组。每组样品中细菌群落高质量序列数在70 049~76 254 条,碱基数在26 811 923~32 570 182 nt,序列平均长度为383~428 bp,平均GC 含量为46.87%~55.15%,测序错误率小于0.01 和0.001 的碱基数分别占总碱基数的96.99%~97.78% 和90.98%~92.76%,有效序列百分比在80.84%~91.68%。所有样本测序原始序列均已上传至NCBI SRA 数据库(登录号:PRJNA898667)。

表1 各样本序列数据质控信息Tab.1 Quality control information of each sample sequences data
2.3 小菜蛾肠道真菌与细菌群落组成
子 囊 菌 门(Ascomycota)、担 子 菌 门(Basidiomycota)和毛霉门(Mucoromycota)为小菜蛾肠道的优势真菌门(图2A)。对照组小菜蛾肠道中子囊菌门相对丰度为45.3%,经3 种抗生素处理后相对丰度均不同程度地增加,其中10 mg∕L 氨苄青霉素处理的小菜蛾肠道中子囊菌门相对丰度增加至88.7%,增幅最大;6 mg∕L 利福平处理的小菜蛾肠道子囊菌门相对丰度为49.1%,增幅最小。小菜蛾肠道中担子菌门相对丰度为14.6%(CK),在10 mg∕L氨苄青霉素、100 mg∕L 硫酸链霉素作用下分别降低至6.8%、8.0%,而在5 mg∕L 氨苄青霉素、200 mg∕L 硫酸链霉素、3 mg∕L 和6 mg∕L 利福平作用下相对丰度增加。毛霉门在对照组中的相对丰度为2.6%,经5 mg∕L 氨苄青霉素和100 mg∕L 硫酸链霉素作用后相对丰度分别增加至5.8%和26.1%,而在其他处理中的相对丰度降低。

图2 小菜蛾肠道真菌和细菌门水平群落物种组成Fig.2 Gut fungal and bacterial communities composition of P.xylostella at phylum level
厚 壁 菌 门(Firmicutes)、变 形 菌 门(Proteobacteria)和拟杆菌门(Bacteroidota)为小菜蛾肠道的优势细菌门(图2B)。对照组中厚壁菌门相对丰度为80.6%,经3 种抗生素处理后均不同程度地降低,其中100 mg∕L、200 mg∕L 硫酸链霉素以及3 mg∕L 利福平作用效果较为显著,其在3 组中相对丰度分别为34.35%、33.7%和26.4%。小菜蛾肠道中变形菌门(CK 17.5%)除经100 mg∕L 硫酸链霉素处理后(6.5%)降低外,在经其他质量浓度抗生素处理后相对丰度均增加,在10 mg∕L 氨苄青霉素、200 mg∕L 硫酸链霉素和3 mg∕L 利福平处理下增幅较显著,相对丰度分别为46.1%、56.7%和72.3%。对照组中拟杆菌门相对丰度为1.1%,经10 mg∕L 氨苄青霉素、100 mg∕L 和200 mg∕L 硫酸链霉素处理后其相对丰度分别增加至4.1%、12.0%和8.0%。
青霉属(Penicillium)为小菜蛾肠道中的优势真菌属,其在对照组中的相对丰度为37.5%,经不同抗生素处理后相对丰度均有提升,在10 mg∕L 氨苄青霉素作用下相对丰度最高,为86.9%(图3A)。线黑粉酵母属(Filobasidium)在对照组中相对丰度为5.6%,经10 mg∕L 氨苄青霉素和100 mg∕L 硫酸链霉素处理后相对丰度分别降低至4.9%和1.0%,而在其他浓度抗生素作用下相对丰度均升高,在200 mg∕L硫酸链霉素和6 mg∕L 利福平处理中相对丰度均大于35%。毛霉属(Mucor)在对照组中相对丰度为2.6%,经5 mg∕L 氨苄青霉素和100 mg∕L 硫酸链霉素处理后其相对丰度分别增加至5.5%和26.1%,在其余处理组中的相对丰度均降低,10 mg∕L 氨苄青霉素处理组降幅最多,仅为0.2%。枝孢属(Cladosporium)在对照组中的相对丰度为1.3%,除在3 mg∕L 利福平处理下相对丰度(0.6%)降低外,在其余处理组中相对丰度均升高,100 mg∕L 硫酸链霉素、6 mg∕L 利福平处理下相对丰度增幅最明显,分别为6.6%、7.1%。汉纳酵母属(Hannaella)在100 mg∕L 硫酸链霉素(5.9%)、200 mg∕L 硫酸链霉素(2.8%)和6 mg∕L 利福平(2.5%)处理组中的相对丰度均高于对照组(2.2%)。
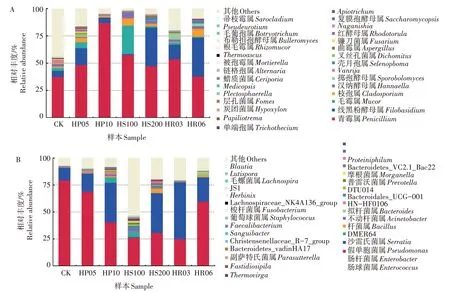
图3 小菜蛾肠道真菌和细菌属水平群落物种组成Fig.3 Gut fungal and bacterial communities composition of P.xylostella at genus level
肠球菌属(Enterococcus)和肠杆菌属(Enterobacter)为小菜蛾肠道中的优势细菌属,在对照组中的相对丰度分别为79.3%和11.8%(图3B)。经抗生素处理后,肠球菌属相对丰度均降低,其在氨苄青霉素5 mg∕L、10 mg∕L,硫酸链霉素100 mg∕L、200 mg∕L,利福平3 mg∕L、6 mg∕L 处理组中的相对丰度分别为68.8%、40.4%,26.4%、30.6%,24.7%、59.6%。肠杆菌属除在100 mg∕L 硫酸链霉素作用下相对丰度(0.5%)降低外,在5 mg∕L 氨苄青霉素(16.8%)、10 mg∕L 氨苄青霉素(36.9%)、200 mg∕L 硫酸链霉素(36.9%)、3 mg∕L 利福平(53.0%)和6 mg∕L利福平(22.4%)处理组中的相对丰度均增加,其中以3 mg∕L 利福平处理组增幅最显著。假单胞菌属(Pseudomonas)在10 mg∕L 氨苄青霉素和100 mg∕L 硫酸链霉素作用后相对丰度由对照组的0.06%分别增加至5.0%和4.9%。沙雷氏菌属(Serratia)在对照组中的相对丰度仅为0.3%,经200 mg∕L 硫酸链霉素处理后相对丰度增加至4.1%。除上述菌属外,其余菌属在处理组与对照组中的相对丰度变化不显著。
花瓣图结果(图4)表明,对照组与抗生素处理组中共有的真菌和细菌OTU 数目均为14。其中共有的14 个真菌OTU 分别属于星盘青霉(Penicilliumastrolabium)、Filobasidium、毛霉属、未分类真菌、极细枝孢霉(Cladosporium tenuissimum)、Hannaella oryzae、掷孢酵母属(Sporobolomyces)、黄曲霉(Aspergillus flavus)、Naganishia、巴氏红酵母(Rhodotorula babjevae)、Papiliotrema flavescens、P.polonicum、布勒担孢酵母属(Bulleromyces)和Holtermanniella takashimae。共有的14 个细菌扩增子分别属于沙雷氏菌属(2个)、未分类细菌(2 个)、肠杆菌属(2 个)、肠球菌属、肠杆菌科(Enterobacteriaceae)、假单胞菌属、亨盖特梭菌科(Hungateiclostridiaceae)(2个)、Anaerovoracaceae、透明颤菌属(Vitreoscilla)和Lutispora。
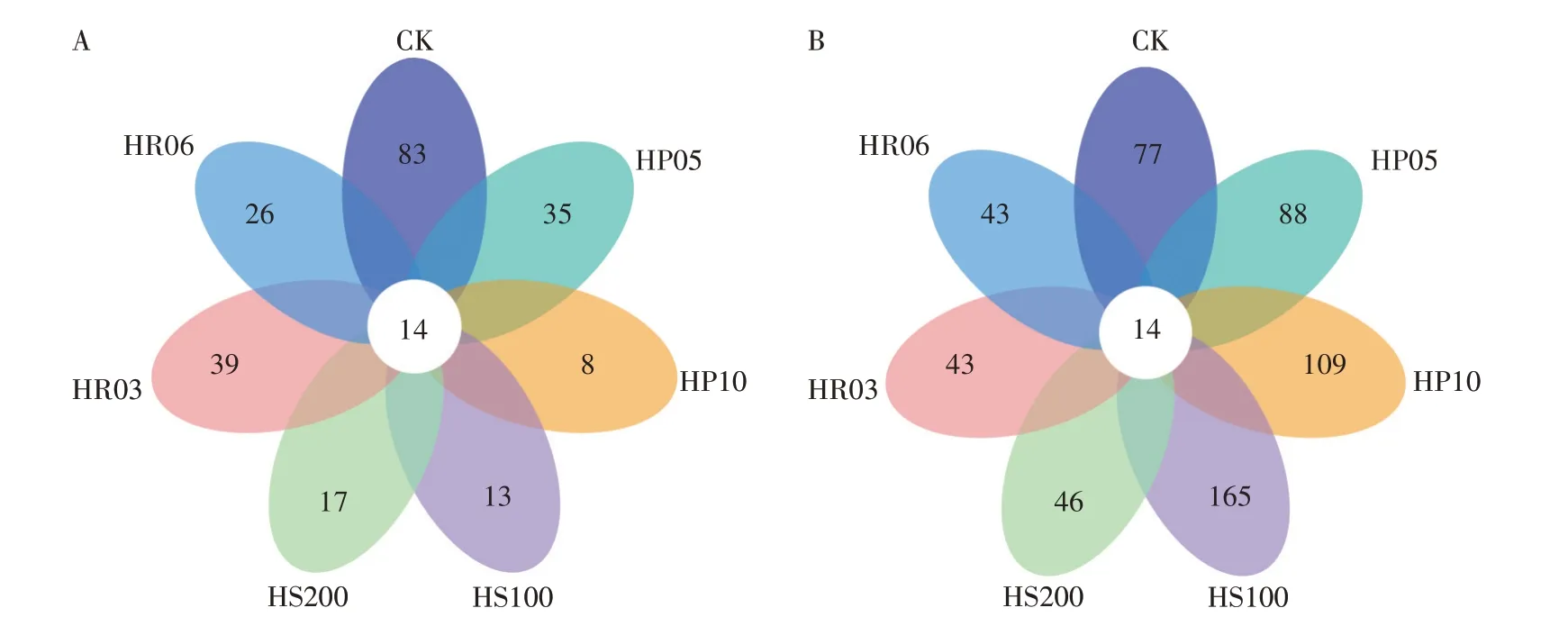
图4 样本独有、共有物种组成Fig.4 Sample unique,shared species composition
2.4 小菜蛾肠道微生物群落Alpha多样性
Alpha 多样性指数中,Chao1 指数用于表示样品微生物群落丰富度;Goods coverage 指数用于表示样品测序的深度;Observed OTUs 表示样本中实际观察到的物种数;Pielou 指数用于表示微生物群落均匀度;Shannon、Simpson指数用于表示样品微生物群落多样性。Alpha 多样性指数分析结果表明,各组的样品覆盖度(Goods coverage)指数均达到1,表明测序深度足够、结果合理。
小菜蛾肠道真菌群落中,各处理组的群落丰富度、均匀度和多样性较对照组均有不同程度降低,其下降程度由大到小依次为10 mg∕L 氨苄青霉素处理组、100 mg∕L硫酸链霉素处理组、200 mg∕L硫酸链霉素处理组、6 mg∕L利福平处理组、3 mg∕L利福平处理组和5 mg∕L 氨苄青霉素处理组(表2)。未经抗生素处理组中小菜蛾肠道真菌群落Shannon、Simpson指数分别为3.52、0.81,Chao1 指数、Observed OTUs均为135,Pielou 指数为0.50;10 mg∕L 氨苄青霉素处理组中各多样性指数下降最显著,Shannon、Simpson指数分别为1.11、0.28,Chao1 指数、Observed OTUs均为38,Pielou指数为0.21。
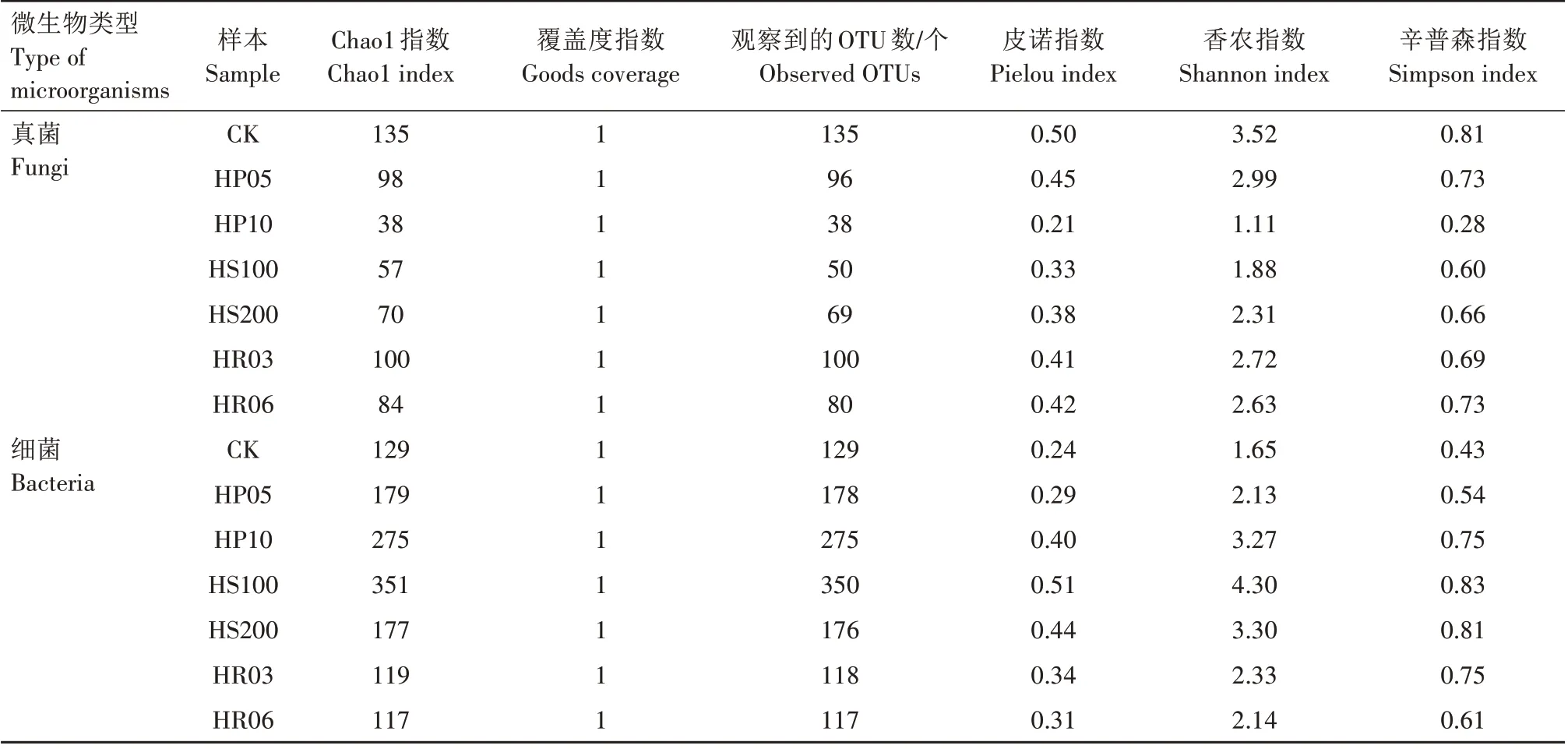
表2 小菜蛾肠道微生物群落Alpha多样性分析Tab.2 Alpha diversity analysis of the gut microbial community of P.xylostella
小菜蛾肠道细菌群落多样性分析中,与对照组相比,氨苄青霉素和硫酸链霉素处理组的群落丰富度增加,而利福平处理组降低,3种抗生素处理组的群落均匀度与多样性均增加,其中100 mg∕L 硫酸链霉素处理组增幅最大,其次是200 mg∕L 硫酸链霉素组、10 mg∕L 氨苄青霉素组、3 mg∕L 利福平组、6 mg∕L利福平组、5 mg∕L 氨苄青霉素组(表2)。对照组中小菜蛾肠道细菌群落Shannon、Simpson 指数分别为1.65、0.43,Chao1 指数、Observed OTUs 均为129,Pielou 指数为0.24;100 mg∕L 硫酸链霉素处理组的小菜蛾肠道细菌群落丰富度、均匀度与多样性增幅最大,Chao1、Shannon、Simpson 和Pielou 指数分别为351、4.30、0.83和0.51。
2.5 小菜蛾肠道微生物群落主成分分析
PCA 分析是一种简化数据集的分析技术,通过分解方差将样品差异反映在二维坐标图上[17]。PCA分析表明,小菜蛾肠道真菌群落(图5A)的第一主成分及第二主成分贡献率为34.27%、18.98%,累积贡献率为53.25%。10 mg∕L 氨苄青霉素、100 mg∕L 和200 mg∕L 硫酸链霉素、6 mg∕L 利福平4 个处理组样品(HP10、HS100、HS200、HR06)距离较近,表明其真菌群落组成相似;而对照组(CK)和5 mg∕L氨苄青霉素(HP05)处理组、3 mg∕L 利福平(HR03)处理组3组样品之间以及与其余4组样品间距离较远,表明其真菌群落组成存在较大差异。
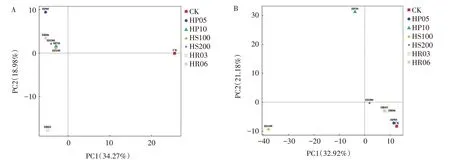
图5 小菜蛾肠道微生物群落主成分分析Fig.5 Principal component analysis of the gut microbial community of P.xylostella
小菜蛾肠道细菌群落(图5B)的第一主成分、第二主成分贡献率分别为32.92%、21.18%,累积贡献率为54.10%。对照组(CK)与5 mg∕L 氨苄青霉素、200 mg∕L 硫酸链霉素、3 mg∕L 利福平、6 mg∕L 利福平4 个处理组样品(HP05、HS200、HR03、HR06)距离较近,表明其细菌群落组成相似;而10 mg∕L 氨苄青霉素处理组(HP10)样品和100 mg∕L 硫酸链霉素处理组(HS100)样品之间以及与其余5 个样品间距离较远,表明其细菌群落组成差异较大。
3 结论与讨论
肠道微生物群落组成复杂、功能多样,稳定健康的肠道菌群结构可以提高宿主对环境的适应性,保证正常的生命活动,提高宿主的存活率[18-19]。本研究基于高通量测序技术解析了小菜蛾肠道微生物响应3 种抗生素胁迫的变化规律,从微观层面揭示了抗生素对小菜蛾肠道微生物的影响。
本研究发现,3 种抗生素对小菜蛾肠道微生物的群落结构组成及丰度均存在影响,不同浓度、不同抗生素处理对肠道微生物的影响有所差别。小菜蛾肠道细菌主要分布于厚壁菌门、变形菌门和拟杆菌门,优势菌属有肠球菌属和肠杆菌属,这与前人报道一致[13,20-21];真菌主要分布于子囊菌门、担子菌门和毛霉门,优势菌属有青霉属。3 种抗生素处理后小菜蛾肠道厚壁菌门、肠球菌属相对丰度均降低,子囊菌门、青霉属相对丰度均增加,变形菌门和肠杆菌属在100 mg∕L 硫酸链霉素作用下相对丰度均降低,其余处理组相对丰度增加。肠道微生物直接或间接对宿主发挥着重要的作用,如参与消化、吸收利用营养物质、解毒、提高宿主免疫活性等[21]。青霉菌是一种重要的木质纤维素降解菌,其存在于昆虫肠道中可帮助宿主消化植物组织,为宿主的生长发育和繁殖提供营养物质[22-23]。肠杆菌可参与碳的代谢,能帮助宿主降解碳水化合物,有利于宿主对食物的消化,此外肠杆菌还具有固氮能力[24-26]。相关文献表明,肠球菌可增加小菜蛾对毒死蜱的抗性[27]。毛霉属、枝孢属、假单胞菌属、沙雷氏菌属虽不是小菜蛾肠道中的绝对优势菌群,但在对照和处理组中也占有一定比例。毛霉菌能产生高活力蛋白酶,广泛存在于空气、土壤等环境中[28];枝孢菌属广泛存在于土壤、海洋及植物体内,能合成与宿主相同或相似的化合物以及其他类型化合物[29];假单胞杆菌参与为寄主提供能量的过程,与宿主免疫相关;沙雷氏菌可在小菜蛾的营养获取中起作用。
本研究中对照组小菜蛾肠道微生物中最优势细菌门为厚壁菌门(80.6%),其次为变形菌门(17.5%),这与前人报道的最优势菌门为变形菌门有所差异[21,30],但与LI 等[13]研究结果一致。肠道微生物很大程度上来自食物及外界环境,因此,环境以及食物上携带的微生物显著影响肠道菌群。LIANG等[31]发现,在饲喂莴苣叶的家蚕幼虫中,莴苣叶饲喂的家蚕幼虫肠道中含有大量的不动杆菌和硫酸盐还原菌,而在正常家蚕幼虫肠道内几乎不存在这些细菌。吴晓露等[32]研究也发现,以人工饲料为食的小菜蛾品系肠道细菌主要由厚壁菌门组成,而转寄主植物后,肠道的优势菌门是变形菌门或拟杆菌门。MIKAELYAN 等[33]研究表明,食物是高等白蚁(Nasutitermes takasagoensis)肠道细菌群落结构的主要决定因素。STRANO 等[34]对松异舟蛾(Thaumetopoea pityocampa)的研究也说明,食物是影响其肠道微生物的重要因素,且变形菌门的丰度可能与食物相关联。BRODERICK 等[35]对鳞翅目昆虫舞毒蛾(Lymantria dispar)的研究结果显示,取食同一种食物的舞毒蛾的肠道微生物组成高度相似,而取食不同食物(白杨、落叶松、白栎或柳树)的舞毒蛾,其肠道微生物组成存在很大差异。
经3 种抗生素处理后,小菜蛾肠道真菌群落的群落丰富度、均匀度和多样性较对照组均有不同程度降低。小菜蛾肠道细菌群落中,氨苄青霉素和硫酸链霉素处理组的群落丰富度较对照组升高,利福平处理组较对照组降低,而群落均匀度与多样性表现为抗生素处理组均较对照组升高。结合PCA 分析的结果来看,各组间细菌群落对比各有差异,复杂程度高;而对照组与处理组的真菌群落样本距离较远,物种组成差异较大。结合Alpha 多样性指数的分析,推测肠道真菌群落受抗生素等因素影响的程度更大,相比肠道细菌,真菌的丰度和多样性较低且组成不稳定,这与SUHR 等[36]、周本翔等[37]的结论有共同之处。一般而言,抗生素主要靶标为细菌而非真菌,本研究中经抗生素处理后小菜蛾肠道真菌群落的受影响程度大于细菌群落的可能原因,一是肠道细菌群落基数高于真菌群落,因此细菌群落的抗胁迫能力强于真菌群落;二是不同的微生物菌群由于结构和功能差异导致其对同一环境的适应能力各异,真菌群落可能对抗生素处理后宿主生理状态的改变更为敏感。
小菜蛾肠道微生物结构和多样性经3种抗生素处理后均有显著变化,这可能是由于抗生素处理导致小菜蛾肠道生理环境改变,优势、非优势菌群数量发生增减。肠道微生物的主要作用是协助宿主代谢、增强宿主的免疫能力和适应性,促进其机体健康。而作为共生关系的二者,宿主的生理状态也会影响肠道微生物的改变。如CHEN 等[38]研究了同属鳞翅目昆虫的斜纹夜蛾(Spodoptera littoralis),发现其卵期微生物主要由泛菌属、不动杆菌属和罗尔斯通菌属组成,幼虫期和蛹期优势菌属为肠球菌属,而羽化后成虫期肠道微生物主要由肠球菌属、泛菌属和克雷伯氏杆菌属组成;并且,早期幼虫微生物组更富含与细胞运动和碳水化合物代谢有关的基因,而在晚期幼虫中,与氨基酸、辅因子和维生素代谢相关的基因增加;微生物群落的种种差异反映了其在各生命阶段不同的功能作用,突出了宿主发育过程中对其肠道微生物群的控制。唐旸[30]的研究也表明,小菜蛾肠道微生物在物种组成上总体相对稳定,但物种丰度上却存在动态变化,其中卵、幼虫期、蛹期和成虫期均表现出明显的与发育相关联的种群特异性,并随着小菜蛾的生长发育,其肠道微生物多样性会伴随着变化以适应相应的生理改变和功能需要。
小菜蛾肠道内有丰富的微生物群落,其组成复杂、功能多样,对小菜蛾的适应性有重要作用。本研究检测了3种抗生素处理后小菜蛾肠道微生物群落结构的变化,为小菜蛾肠道微生物功能研究提供了借鉴,同时也为氨苄青霉素、硫酸链霉素和利福平3 种抗生素与小菜蛾的互作研究提供了参考,对后续使用抗生素防控小菜蛾的实践推广提供了理论依据。
